-
生物固氮是指自然界中的一些微生物将大气中的不能被植物利用的氮气还原成可利用的氨的过程。豆目Fabales树种与根瘤菌在长期进化过程中形成的共生固氮体系是生物固氮中效率最高的体系,所固定的氮素约占生物固氮总量的65%,它可以导致植物的氮素营养和土壤中化合态氮大量增加[1-2],对于自然界氮素的生物循环和农林生产都有十分重要的作用。花榈木Ormosia henryi属豆目Fabales蝶形花科Papilionaceae红豆树属Ormosia,主产于中国亚热带地区,其材质优良,是制作高档家具、工艺雕刻和特种装饰品的珍贵用材树种[3]。段如雁等[4]通过对花榈木结瘤调查发现,当年生花榈木幼苗根瘤较少,幼苗生长细弱,其固氮效率很低。未结瘤的当年生幼苗上山造林成活率低,只有到第2年时才有部分结瘤,且结瘤幼苗在生长上、生理生化特征上都优于未结瘤幼苗。因此,通过人工接种优良菌株,建立一个高效的花榈木-根瘤菌共生体系是提高苗木品质的重要措施。通过研究花榈木与根瘤菌之间的最佳匹配关系,推广花榈木根瘤菌的接种技术,使花榈木获得最佳生长效果,不仅可以提高花榈木苗木品质和造林成活率,还可以丰富豆目树木根瘤菌在整个根瘤菌应用研究领域的内容。目前,中国对花榈木的根瘤菌研究较少,除笔者[4]进行过初步研究外,韩素芬等[5]对花榈木的根瘤形态、结瘤数量进行过研究,李东等[6]对花榈木根瘤菌的16S rDNA序列进行过分析。尚未涉及到人工接种根瘤菌对花榈木幼苗生理和生长效应的研究。本研究拟通过对花榈木幼苗接种不同根瘤菌试验,测定接种不同菌株后花榈木幼苗的光合生理指标以及苗高、地径、生物量、根系等生长指标变化,以揭示不同根瘤菌株对花榈木幼苗的促生效应,初步筛选出高效促生的优良根瘤菌种,为今后花榈木育苗中人工接种根瘤菌, 培育优质壮苗提供理论依据。
HTML
-
花榈木种子采自贵州省石阡县同一母株,千粒重为(390.6 ± 0.4) g,净度为94.6%。移栽基质为经过121 ℃高温高压灭菌0.5 h的蛭石,育苗容器为直径20 cm高度15 cm的塑料盆,使用前用质量分数为0.5%高锰酸钾溶液进行消毒。
供试菌株是从贵州、浙江、安徽、福建、江西等省采集的花榈木根瘤分离,经加有刚果红的酵母甘露醇琼脂(YMA)平板上划线,28 ℃恒温培养,并通过16S rDNA序列分析及回接验证筛选出20株纯化菌株(表 1)。
编号 采集地 近源菌 相似性/% 登录号 1 贵州荔波 Rhizobium sp. SCAUS07 99.00 KF836032.1 2 贵州荔波 Rhizobium sp. S41 100.00 CP016433.1 3 贵州平塘 Rhizobium sp. strain YE2-4 98.00 KT992333.1 4 贵州罗甸 R. nepotum strain MLS-6-6 99.00 KT997460.1 5 贵州石阡 Rhizobium sp. L120T 99.00 KM894194.1 6 贵州石阡 R. pusense strain BJ 99.00 KF297587.1 7 贵州石阡 Rhizobium sp. JCM 28644 99.00 LC133675.1 8 贵州麻江 R. nepotum strain Rrad-006 99.00 KX260959.1 9 贵州麻江 R. lusitanum strain P3-13 99.00 HQ830495.1 10 贵州孟关 R. tropici strain SY61 99.00 KP687381.1 11 贵州黎平 Rhizobium sp. RITF 1462 98.00 JQ697681.1 12 贵州黎平 Rhizobium sp. CCBAU 83718 99.00 EU145992.1 13 贵州天柱 R. lusitanum strain R-51027 99.00 LN995682.1 14 浙江临安 R. lusitanum strain P3-13 98.00 HQ830495.1 15 浙江临安 Rhizobium sp. JCM 28634 99.00 LC133665.1 16 浙江永康 Rhizobium sp. L120T 99.00 KM894194.1 17 浙江永康 Rhizobium sp. LMB-1 99.00 KM891589.1 18 福建建瓯 R. multihospitium strain CCBAU 83375 99.00 EF035065.2 19 福建南平 R. lusitanum strain ITM L4111 99.00 KC568140.1 20 江西庐山 R. tropici strain B28 99.00 JX010975.1 Table 1. Twenty strains by return verifying and 16S rDNA sequence analysis
-
选取饱满的花榈木种子,先用质量分数为0.1%升汞溶液浸泡10 min进行表面消毒,然后浸泡于80 ℃的热水中,并让其自然冷却。种子吸胀后,置于无菌发芽盒中,在25 ℃培养箱内催芽。待芽苗长至1~2 cm时,将芽苗移栽到装有蛭石的塑料花盆中。移栽花榈木芽苗5株·盆-1,共移栽芽苗126盆,置于塑料大棚中培养,待花榈木长出真叶后,接种不同的根瘤菌菌液,设置重复3个·处理-1,每个重复设10株苗,共21个处理(含不接种根瘤菌的对照ck)。
供试菌株在YMA斜面上活化后,接入YMA液体培养基中,28 ℃下摇床培养3 d至对数期,用分光光度计检测菌液吸光度D(600)为0.7时即可接种。接种菌液10 mL·株-1,接种方式为直接将菌液浇灌在苗木根部,隔15 d浇1次无氮营养液,不施加其他肥料,隔30 d追浇1次根瘤菌菌液,到2016年7月抽查到苗木结瘤为止。
于2016年5月下旬,花榈木幼苗接种根瘤菌3 d后开始测量苗高、地径,以后测量1次·月-1,直到11月底试验结束。接种后2个月抽查苗木结瘤情况,苗木结瘤后于8月中旬晴天测定花榈木幼苗光合生理指标以及叶绿素荧光等指标。试验结束后,统计各处理的结瘤数和根瘤质量,从各处理中选取标准株5株测定生物量以及根系状况。
-
用卷尺测苗高(精度0.1 cm),游标卡尺测地径(精度0.01 mm)。生物量测定方法:选取5株标准株,将苗木洗净擦干后放到105 ℃烘箱中杀青15 min,再用70 ℃烘(17±1) h,在干燥器中冷却后用1/1 000电子天平称取地上部分和地下部分干质量,单株生物量=地上部分干质量+地下部分干质量。
-
先将选取的花榈木标准株冲洗干净,用吸水纸吸干,把待测根系用根系扫描分析系统(WinRHIZO)进行根系指标的分析。
-
于8月中旬的晴天上午9:00-11:00,各处理选择3株标准株的功能叶片,用LI-6400便携式光合仪测定光合速率、蒸腾速率等光合指标。测定时使用红蓝光源叶室,光照强度设置为1 000 μmol·m-2·s-1,二氧化碳摩尔分数设为400 μmol·mol-1,测定时保持叶片自然生长角度不变,对测定的数据取平均值。叶绿素荧光参数测定:使用Junior-PAM叶绿素荧光仪测定叶绿素荧光参数,主要包括最大光化学量子产量(Fv/Fm),PSⅡ潜在活性(Fv/Fo),实际光合量子产量(YⅡ),光化学猝灭(qP),非光化学猝灭(qN)。进行实验前将Junior-pam连接好。将叶片暗适应30 min后放到磁性叶夹上进行实验,在测量Fv/Fm前确保实时荧光(Ft)小于600,饱和脉冲、远红光强度和持续时间选用默认设置,光化光强度设置为1 150 μmol·m-2·s-1,点击诱导曲线程序按扭进行自动测量。
-
试验数据采用Excel 2010和SPSS 22.0统计分析软件进行分析处理。采用Duncan法进行多重比较。利用隶属函数法对各个指标进行综合评价[7]。
1.1. 试验材料
1.2. 研究方法
1.3. 指标测定方法
1.3.1. 苗高、地径及生物量测定
1.3.2. 根系指标的测定
1.3.3. 光合参数的测定
1.4. 数据统计方法
-
单株结瘤数和根瘤质量是评价瘤菌结瘤效率的重要指标。由表 2可得:与对照相比,接种根瘤菌后,花榈木幼苗结瘤率显著(P<0.05)增加,结瘤率均为90.0%以上。其中7号处理单株根瘤数最多,15号和17号次之,分别是ck的102.9,100.0和95.3倍,3号处理单株根瘤数最少,为ck的24.3倍。不同菌株处理后苗木单株根瘤质量与根瘤数变化趋势一致。
处理 结瘤率/% 单株根瘤数/个 单株根瘤质量/mg 1 96.67 2.93 ± 0.43 117.87 ± 12.74 2 93.33 1.90 ± 0.15 76.20 ± 3.78 3 90.00 1.70 + 0.32 67.57 ± 13.65 4 96.67 3.27 ± 0.52 130.57 ± 9.78 5 96.67 2.87 ± 0.44 114.50 ± 6.65 6 100.00 3.40 ± 0.10 135.43 ± 8.57 7 100.00 7.20 ± 0.79 287.47 ± 35.75 8 93.33 2.17 ± 0.12 86.23 ± 3.70 9 100.00 4.47 ± 0.11 178.70 ± 17.68 10 93.33 1.97 ± 0.03 79.03 ± 12.33 11 93.33 1.87 ± 0.08 74.97 ± 3.65 12 100.00 4.90 ± 0.36 196.27 ± 5.66 13 100.00 3.90 ± 0.25 156.00 ± 36.22 14 96.67 3.17 ± 0.20 126.23 ± 24.57 15 100.00 7.00 ± 0.48 280.63 ± 26.89 16 100.00 6.50 ± 0.64 259.50 ± 26.45 17 100.00 6.67 ± 0.38 266.17 ± 35.50 18 100.00 6.40 ± 0.37 256.17 ± 16.42 19 96.67 3.17 ± 0.16 127.00 ± 24.64 20 96.67 2.80 ± 0.32 111.90 ± 21.78 ck 3.33 0.07 ± 0.00 1.76 ± 0.00 Table 2. Effects of inoculated different rhizobium strains on nodule number and nodule weight per plant of Ormosia henryi seedlings
-
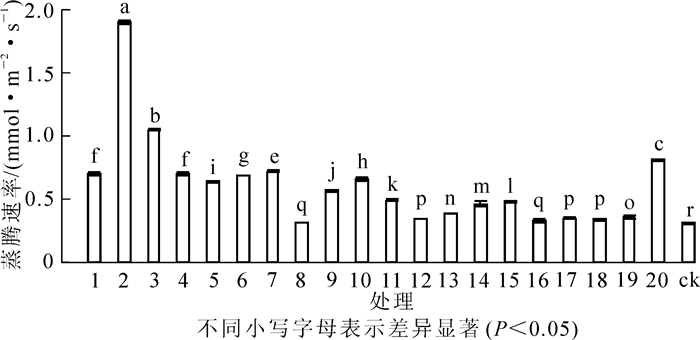
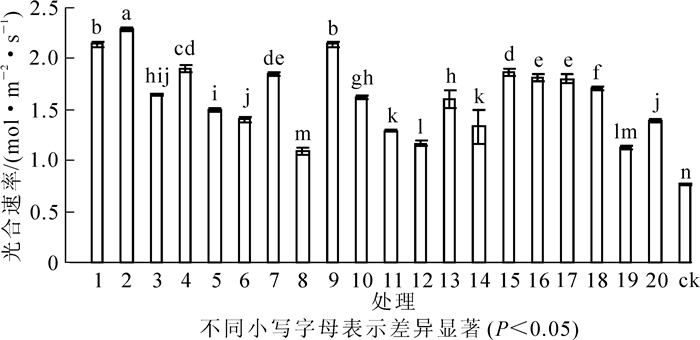
光合速率的大小直接决定着植物光合能力的强弱。试验结果(图 1)显示:接种根瘤菌可以提高花榈木幼苗的光合速率。接种不同根瘤菌的花榈木幼苗光合速率差异显著(P<0.05)。与ck相比,所有接种根瘤菌处理的花榈木幼苗叶片的光合速率都高于ck,增幅为41.6%~197.4%。接种2号、1号、9号菌株的花榈木光合速率较高,分别比ck提高197.4%,177.9%,177.9%,说明这几个菌株更有利于花榈木光合能力的提高。

Figure 1. Effects of inoculated different rhizobium strains on photosynthetic rate of Ormosia henryi seedlings
图 2表明:接种不同菌株对花榈木幼苗蒸腾速率的影响差异显著(P<0.05)。各菌株处理的蒸腾速率变化范围为0.32~1.90 mmol·m-2·s-1。蒸腾速率最高为2号菌株,是ck的6.1倍;最低为10号菌株,比ck高3.2%。蒸腾速率大于1.00 mmol·m-2·s-1的处理有2号和3号菌株,表明这些菌株接种后有利于促进花榈木幼苗蒸腾作用的进行。
-
表 3表明:接种不同根瘤菌的花榈木幼苗叶绿素荧光参数差异均达到显著水平(P<0.05)。接种根瘤菌各处理实际光化学量子产量YⅡ均高于ck,增幅为4.8%~95.2%,其中,接种20号菌株YⅡ最大,是ck的2.0倍,表明其PSⅡ反应中心有部分关闭情况下的实际原初光能捕获效率最高。qP为光化学猝灭,反映的是PSⅡ天线色素吸收的光能用于光化学电子传递的份额。接种根瘤菌各处理qP均高于ck,增幅为7.7%~51.9%,其中,接种3号菌株qP最大、8号次之,分别比对照高出51.9%和44.2%。非光化学猝灭(qN)反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分。qN表现为ck最大,接种20号菌株次之,5号菌株qN最小,分别是ck的75.0%和12.0%。Fv/Fm反映PSⅡ反应中心内禀光能转化效率,Fv/Fo表示PSⅡ的潜在活性,2个指标变化趋势基本一致,均表现为ck最小,接种20号菌株最大,分别是ck的2.1倍和4.8倍。
处理 实际光合量子产量YⅡ 光化学猝灭qP 非光化学猝灭qN 最大光合量子产量Fv/Fm PSⅡ潜在活性Fv/Fo 1 0.25 ± 0.03 defgh 0.59 ± 0.04 bcd 0.58 ± 0.09 abc 0.54 ± 0.02 abcde 1.16 ± 0.12 cdefg 2 0.25 ± 0.01 defgh 0.57 ± 0.01 bcd 0.62 ± 0.02 ab 0.55 ± 0.03 abcde 1.25 ± 0.13 cdef 3 0.24 ± 0.07 efgh 0.79 ± 0.22 a 0.45 ± 0.17 abcde 0.42 ± 0.16 efghi 0.76 ± 0.46 fgh 4 0.28 ± 0.00 bcdefg 0.73 ± 0.06 abc 0.18 ± 0.08 efgh 0.43 ± 0.03 defghi 0.77 ± 0.14 fgh 5 0.24 ± 0.03 efgh 0.73 ± 0.13 abc 0.11 ± 0.03 h 0.36 ± 0.07 ghi 0.58 ± 0.20 h 6 0.22 ± 0.01 h 0.72 ± 0.05 abc 0.17 ± 0.18 fgh 0.33 ± 0.06 hi 0.51 ± 0.15 h 7 0.24 ± 0.03 efgh 0.69 ± 0.10 abcd 0.16 ± 0.03 fgh 0.39 ± 0.01 fghi 0.64 ± 0.06 gh 8 0.24 ± 0.03 fgh 0.75 ± 0.14 ab 0.14 ± 0.10 gh 0.37 ± 0.11 ghi 0.62 ± 0.29 h 9 0.26 ± 0.02 cdefgh 0.59 ± 0.27 bcd 0.13 ± 0.06 gh 0.35 ± 0.13 ghi 0.60 ± 0.37 h 10 0.30 ± 0.05 bcde 0.57 ± 0.00 bcd 0.43 ± 0.07 abcdef 0.61 ± 0.08 ab 1.65 ± 0.46 bc 11 0.26 ± 0.02 cdefgh 0.68 ± 0.09 abcd 0.39 ± 0.10 bcdefg 0.48 ± 0.11 bcdefgh 1.00 ± 0.37 efgh 12 0.31 ± 0.01 bcde 0.60 ± 0.02 bcd 0.47 ± 0.22 abcd 0.60 ± 0.05 abc 1.52 ± 0.33 bcde 13 0.23 ± 0.02 fgh 0.56 ± 0.01 cd 0.62 ± 0.04 ab 0.53 ± 0.03 abcdef 1.16 ± 0.17 cdefg 14 0.30 ± 0.00 bcde 0.58 ± 0.05 bcd 0.29 ± 0.07 defgh 0.58 ± 0.05 abc 1.40 ± 0.25 cde 15 0.31 ± 0.01 bcd 0.68 ± 0.03 abcd 0.56 ± 0.14 abcd 0.58 ± 0.03 abc 1.38 ± 0.23 cde 16 0.34 ± 0.03 b 0.65 ± 0.02 abcd 0.32 ± 0.23 cdefgh 0.59 ± 0.04 abc 1.46 ± 0.27 bcde 17 0.23 ± 0.01 fgh 0.63 ± 0.09 abcd 0.31 ± 0.00 cdefgh 0.45 ± 0.06 cdefghi 0.84 ± 0.20 fgh 18 0.30 ± 0.05 bcde 0.73 ± 0.07 abc 0.32 ± 0.07 cdefgh 0.49 ± 0.10 bcdefg 1.04 ± 0.39 defgh 19 0.26 ± 0.05 cdefg 0.66 ± 0.06 abcd 0.43 ± 0.05 abcdef 0.65 ± 0.06 a 1.95 ± 0.06 ab 20 0.41 ± 0.07 a 0.58 ± 0.04 bcd 0.69 ± 0.20 a 0.68 ± 0.09 a 2.38 ± 0.08 a ck 0.21 ± 0.02 h 0.52 ± 0.04 d 0.92 ± 0.26 a 0.31 ± 0.12 i 0.50 ± 0.29 h 说明:同列数据后不同字母表示差异显著(P<0.05) Table 3. Effects of inoculated different rhizobium strains on chlorophyll fluorescence of Ormosia henryi seedlings
-
从表 4可以看出:接种根瘤菌对花榈木幼苗根系生长有明显的促进作用,各处理间花榈木幼苗总根表面积、根平均直径、根尖数之间差异显著(P<0.05)。与ck相比,接种17号菌株的花榈木幼苗总根表面积最大,随后依次为7号、15号、16号菌株,但三者与接种17号菌株处理间差异不显著(P>0.05)。接种5号菌株总根表面积最小,仅是ck的1.4倍。1~5号菌株处理均与ck差异不显著(P>0.05)。接种7号、12号、11号菌株对根平均直径的提高作用较大,分别比ck高193.3%,171.1%和171.1%,1~6号菌株对花榈木根平均直径的影响较小,增幅均小于50%且与ck差异不显著(P>0.05)。6号菌株对花榈木幼苗根尖数的生长促进作用最大,比ck提高92.1%,与其他处理差异显著(P<0.05)。接种7号、4号、18号、9号、15号、17号、12号、20号、16号、13号菌株的花榈木幼苗的根尖数增幅为37.4%~53.3%,其中7号、4号、18号增幅较大,分别为53.3%,50.0%和45.8%。
处理 总根表面积/cm2 根平均直径/mm 根尖数/个 1 13.72 ± 7.03 ij 0.48 ± 0.06 d 263 ± 42 bcde 2 16.73 ± 4.39 ij 0.50 ± 0.04 d 245 ± 43 cde 3 18.31 ± 3.77 ij 0.48 ± 0.02 d 282 ± 49 bcd 4 17.12 ± 4.72 ij 0.51 ± 0.05 d 321 ± 36 b 5 13.71 ± 3.92 ij 0.52 ± 0.07 d 266 ± 19 bcde 6 31.61 ± 6.82 hi 0.61 ± 0.04 d 411 ± 5 a 7 95.37 ± 10.87 a 1.32 ± 0.03 a 328 ± 39 b 8 51.28 ± 11.20 fg 1.01 ± 0.05 c 286 ± 20 bc 9 67.97 ± 9.96 cdef 0.99 ± 0.04 c 303 ± 21 bc 10 58.87 ± 13.55 def 1.02 ± 0.03 c 278 ± 26 bcd 11 37.95 ± 19.59 gh 1.22 ± 0.09 ab 215 ± 22 e 12 76.38 ± 14.62 bcd 1.22 ± 0.15 ab 297 ± 43 bc 13 67.83 ± 12.17 cdef 1.06 ± 0.12 bc 294 ± 20 bc 14 55.53 ± 9.53 efg 1.10 ± 0.22 bc 239 ± 53 cde 15 84.32 ± 7.52 abc 1.00 ± 0.09 cbc 299 ± 35 bc 16 82.29 ± 17.00 abc 1.13 ± 0.12 bc 294 ± 43 bc 17 96.61 ± 13.82 a 1.12 ± 0.02 bc 299 ± 18 bc 18 72.13 ± 12.56 bcde 1.10 ± 0.06 bc 312 ± 29 b 19 57.70 ± 10.62 def 1.03 ± 0.18 c 274 ± 24 bcde 20 51.43 ± 5.99 fg 1.09 ± 0.06 bc 295 ± 19 bc ck 10.00 ± 6.23 j 0.45 ± 0.02 d 214 ± 14 e 说明:同列数据后不同字母表示差异显著(P<0.05) Table 4. Effects of inoculated different rhizobium strains on roots growth of Ormosia henryi seedlings
-
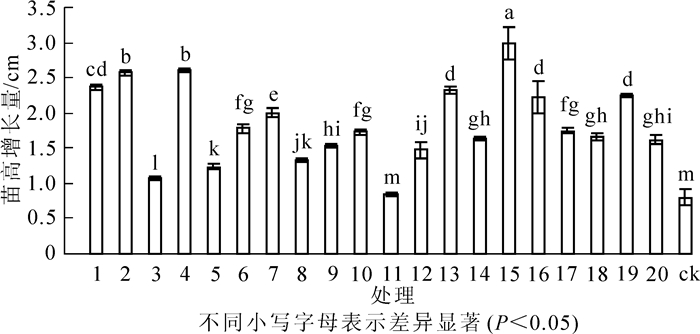
从图 3可以看出:人工接种根瘤菌有助于促进花榈木高生长。与ck相比,接种根瘤菌的花榈木幼苗高生长增幅为6.3%~273.8%,差异显著(P<0.05)。其中,苗高增长量增幅为200%以上的菌株号为15号、4号、2号;增幅为100%~200%的菌株号为1号、13号、19号、16号、7号、6号、17号、10号、18号、14号、20号;增幅为10%~99%的菌株号为9号、12号、8号、5号、3号;11号菌株对花榈木幼苗高生长的影响最小,仅比ck高6.3%,与ck差异不显著(P>0.05)。
-
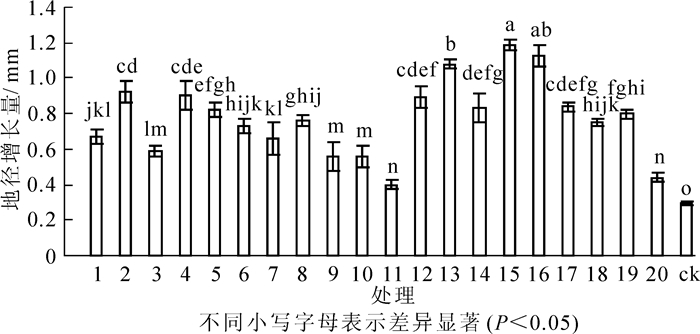
接种根瘤菌对花榈木幼苗地径生长有明显促进作用(图 4)。方差分析表明:不同处理间花榈木幼苗地径差异显著(P<0.05)。接种根瘤菌的花榈木幼苗地径增长量比ck提高37.9%~310.3%,其中增幅为200%以上的菌株号为15号、16号、13号、2号、4号、12号;增幅为100%~200%的菌株号为17号、14号、5号、19号、8号、18号、6号、1号、7号、3号;增幅小于100%的菌株号为9号、20号、20号、11号;11号处理地径增长量最低,仅比ck高37.9%。
-
图 5表明:接种根瘤菌的花榈木幼苗单株生物量均高于ck,增幅为10.7%~128.6%。方差分析表明:接种不同根瘤菌的花榈木幼苗单株生物量之间差异显著(P<0.05)。其中,接种13号、15号菌株单株生物量最大,比ck高了128.6%;接种6号、18号、19号、12号、16号、5号、7号、17号、1号、4号菌株花榈木幼苗单株生物量增幅均高于100%;单株生物量增幅为50%~100%的菌株处理为9号、20号、14号、11号、8号、10号;单株生物量增幅低于50%菌株号为2号、3号菌株。
-
对各指标进行相关性分析,去除相关性较强的指标,余下地径增长量、生物量、总根表面积、根尖数、实际光合量子产量、光化学猝灭、光合速率、总根瘤质量作为隶属函数综合评价指标。评价结果表明(表 5):对花榈木幼苗生长生理促进效应最为显著的前5个菌株号为15号、16号、18号、7号、4号,可初步作为促进花榈木生长的优良菌株。
处理 地径增长量 生物量 总根表面积 根尖数 实际光合量子产量 光化学猝灭 光合速率 总根瘤质量 综合值 排序 15 1.00 1.00 1.00 0.43 0.50 0.59 0.56 0.98 6.06 1 16 0.93 0.73 0.97 0.41 0.65 0.48 0.53 0.90 5.60 2 7 0.51 0.43 0.84 0.50 0.45 0.78 0.48 1.00 4.99 3 18 0.41 0.51 1.15 0.58 0.15 0.63 0.55 0.89 4.87 4 17 0.68 0.78 0.10 0.54 0.35 0.78 0.58 0.93 4.74 5 4 0.61 0.49 1.17 0.43 0.10 0.41 0.53 0.45 4.19 6 12 0.88 0.75 0.78 0.41 0.10 0.15 0.43 0.68 4.18 7 13 0.67 0.41 0.89 0.42 0.50 0.30 0.21 0.54 3.94 8 6 0.49 0.46 0.29 1.00 0.05 0.74 0.32 0.47 3.82 9 9 0.57 0.63 0.64 0.30 0.25 0.52 0.18 0.62 3.71 10 19 0.30 0.32 0.78 0.45 0.25 0.26 0.70 0.44 3.50 11 20 0.17 0.31 0.56 0.41 1.00 0.22 0.32 0.39 3.38 12 8 0.52 0.32 0.56 0.37 0.15 0.85 0.16 0.30 3.23 13 14 0.70 0.78 0.09 0.16 0.20 0.19 0.78 0.44 3.34 14 2 0.60 0.45 0.61 0.13 0.45 0.22 0.29 0.26 3.01 15 10 0.30 0.39 0.66 0.32 0.45 0.19 0.44 0.27 3.02 16 1 0.33 0.18 0.11 0.35 0.15 1.00 0.45 0.41 2.98 17 5 0.59 0.31 0.05 0.26 0.15 0.78 0.37 0.40 2.91 18 3 0.42 0.63 0.05 0.25 0.20 0.26 0.70 0.23 2.74 19 11 0.12 0.05 0.38 0.01 0.25 0.59 0.27 0.26 1.93 20 ck 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 21 Table 5. Comprehensive evaluation of quality for Ormosia henryi seedlings with different rhizobium strains
2.1. 对花榈木幼苗结瘤数和鲜瘤质量的影响
2.2. 对花榈木幼苗光合速率、蒸腾速率的影响
2.3. 对花榈木幼苗叶绿素荧光的影响
2.4. 对根系生长状况的影响
2.5. 对花榈木幼苗苗高的影响
2.6. 对花榈木幼苗地径的影响
2.7. 对花榈木幼苗生物量的影响
2.8. 接种不同根瘤菌效应的综合评价
-
豆目植物接种根瘤菌后光合能力显著提高[8-12],其主要原因是:①与根瘤菌共生形成根瘤进行生物固氮,固定的氮素转化成氨基酸或酞胺后,运往植物的地上及其他部位,为地上部的生长提供合成物质,增加了叶面积,提高了整个植株的碳固定水平。②氮素供给提高了叶片中叶绿素的含量,影响天线色素的光吸收和光传递。③氮素供给促进类囊体中的电子传递体和烟酰胺腺嘌呤二核苷磷酸(NADP+)以及细胞基质中的二氧化碳同化酶(主要是1, 5-二磷酸核酮糖羧酶Rubisco)等物质的合成[13],从而提高植物的光合能力。本研究中,花榈木幼苗接种根瘤菌后,叶片光合速率都有不同程度提高,且接种不同菌株后花榈木幼苗的光合速率存在显著的差别,表明不同根瘤菌与花榈木共生固氮效率亦有所不同,这与前人的研究结果一致[14-15]。
叶绿素荧光参数也是体现植物光合作用潜力的重要指标,通过对花榈木叶片叶绿素荧光参数的测量可以更深入了解与电子传递有关的光合器官能力[9]。接菌处理后,花榈木叶片的叶绿素荧光参数与对照相比,除qN外其余参数都有不同程度的提高,表明接种根瘤菌后,氮素营养得到补充,花榈木幼苗的PSⅡ反应中心开放度提高,更多的光能用于驱动电子传递,PSⅡ的光量子效率潜能提高,对花榈木光合作用更为有利。本研究中无论接种哪个菌株,qN都比对照低,其原因可能是未接菌处理不能通过生物固氮为幼苗提供氮素营养,属于低氮胁迫状态,因此PSⅡ天线色素吸收的光能更多部分不能用于光合电子传递,只能以热形式耗散掉。
根系是植物吸收水分和养分的主要器官,接种根瘤菌促进了根系生长和根系对养分及水分的吸收利用。郝凤等[16]研究结果表明:接种中华根瘤菌Sinorhizobium meliloti和不接菌相比,紫花苜蓿Medicago sativa的根长、根表面积、根平均直径和根体积均表现为接菌比不接菌要好,本研究亦得到类似的研究结果。另一方面,地上部分所产生的光合产物向地下部分运输,为根系的生长提供能量和碳架,生长点便成为很强的光合产物竞争部位,间接体现在根尖数的增加上。根尖数增加越高的处理,其光合产物供给能力越强。接种根瘤菌从地上部分提高光合能力,地下部分改善水分、养分的吸收,最终体现为苗高、地径和生物量的增加。
花榈木与根瘤菌的共生作用,是在长期的进化中相互作用、互相选择的结果,也是与环境相适应的结果。本研究表明:在相同的条件下,花榈木幼苗分别接种20株不同的根瘤菌菌株,虽然都可与花榈木共生结瘤固氮,但并未获得同样的接种效果,说明根瘤菌和寄主之间的共生匹配关系存在差异。只有选择合适的菌株,在共生固氮中综合考虑宿主菌株和环境的相互关系,才有利于充分发挥共生固氮的作用,促进苗木的生长。本研究所采集的根瘤菌来自不同的区域,各自有其适生环境,虽然寄主都是花榈木,但不同区域的的花榈木还存在基因型上的差异,因而在相同条件下接种产生的效果不一致。因此,筛选最佳花榈木与根瘤菌共生固氮体系,不仅要适地适菌,还要做到适苗适菌。此外,本研究对象为1年生花榈木苗木,且育苗基质并非土壤,根瘤菌与花榈木苗木的共生环境比较单一,因此,所筛选的促生菌株对于多年生花榈木是否具有的促进效应,以及所筛选的优良菌株在土壤基质中是否有相同的促生效应,有待进一步验证。










 DownLoad:
DownLoad: