-
大豆Glycine max富含蛋白质、多糖、不饱和脂肪酸、异黄酮,具有丰富的营养价值[1]。中国西南地区“寡日、高湿、小温差”的特殊生态环境,致使大豆抗逆性差、极易发生田间霉变、品质劣变严重,危害食品安全,这成为阻碍南方大豆发展的重要瓶颈[2];选育田间霉变抗性品种是突破该瓶颈问题的有效途径之一。前期研究表明:轮枝镰刀菌Fusarium verticillioides为大豆田间霉变的主要致病菌[3],不同大豆种质资源的种荚对轮枝镰刀菌的感病性存在显著差异[4]。禾谷镰刀菌F. graminearum会抑制小麦Triticum sestivum光合作用相关基因导致其光合作用下降[5];尖孢镰刀菌F. oxysporum会破坏枸杞Lycium sp.叶片的光合机构,使得感病品种的叶绿体色素降解,净光合速率、蒸腾速率以及叶绿素荧光参数急剧下降[6]。叶绿素荧光动力学技术在测定植物光合过程中光系统对光能的吸收、分配等方面具有独特作用,能直观显示植物受胁迫时的变化过程,可检测由病毒、细菌、真菌感染引起的生理变化;其在黄瓜Cucumis sativus[7]、小麦[8]、水稻Oryza sativa[9]等多种植物上得到了较快的普及和广泛应用[10]。本研究以豆荚抗性不同的3个典型大豆种质为试验材料,监测轮枝镰刀菌接种在豆荚后叶绿素荧光参数变化情况,旨在寻找评价大豆种荚田间霉变抗性的指标,为抗性大豆新品种的选育奠定基础。
HTML
-
试验于2018年在四川农业大学教学科研园区(四川雅安)进行。供试材料为3种不同抗性大豆种质,包括高抗大豆‘QWT15-2’、中抗大豆‘E1’和易感大豆‘E314’。供试的轮枝镰刀菌由农业部西南作物生理生态与耕作学重点实验室提供。
大豆于6月15日播种,生长至鼓粒期(R6)时取样;采集长势一致的健康、饱满豆荚,用冰盒带回实验室,以无菌水冲洗干净备用。每个种荚用无菌注射器破损3处表皮,向损伤部位接种5 μL菌悬液(106 cuf·mL−1),对照组用等量的无菌水处理。随后,将豆荚置于铺有湿润滤纸的无菌培养皿中,10皿·品种−1,接种种荚3~6个·皿−1。于接种后1、2、3、4、5 d监测种荚的叶绿素荧光参数。
-
种荚经暗适应20 min后,采用CF Imager叶绿素荧光成像系统(英国Technologica公司)测定其初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)、PSⅡ最大光化学量子产量(Fv/Fm)、非光化学猝灭系数(QNP,qN)、PSⅡ实际光化学量子产量(ΦPSⅡ)、光电子传递速率(RET)等叶绿素荧光参数,并对荧光参数进行成像分析。采用Microsoft Excel 2010软件整理数据、作图,SPSS 23.0软件统计分析。
1.1. 试验材料与处理
1.2. 叶绿素荧光成像分析
-
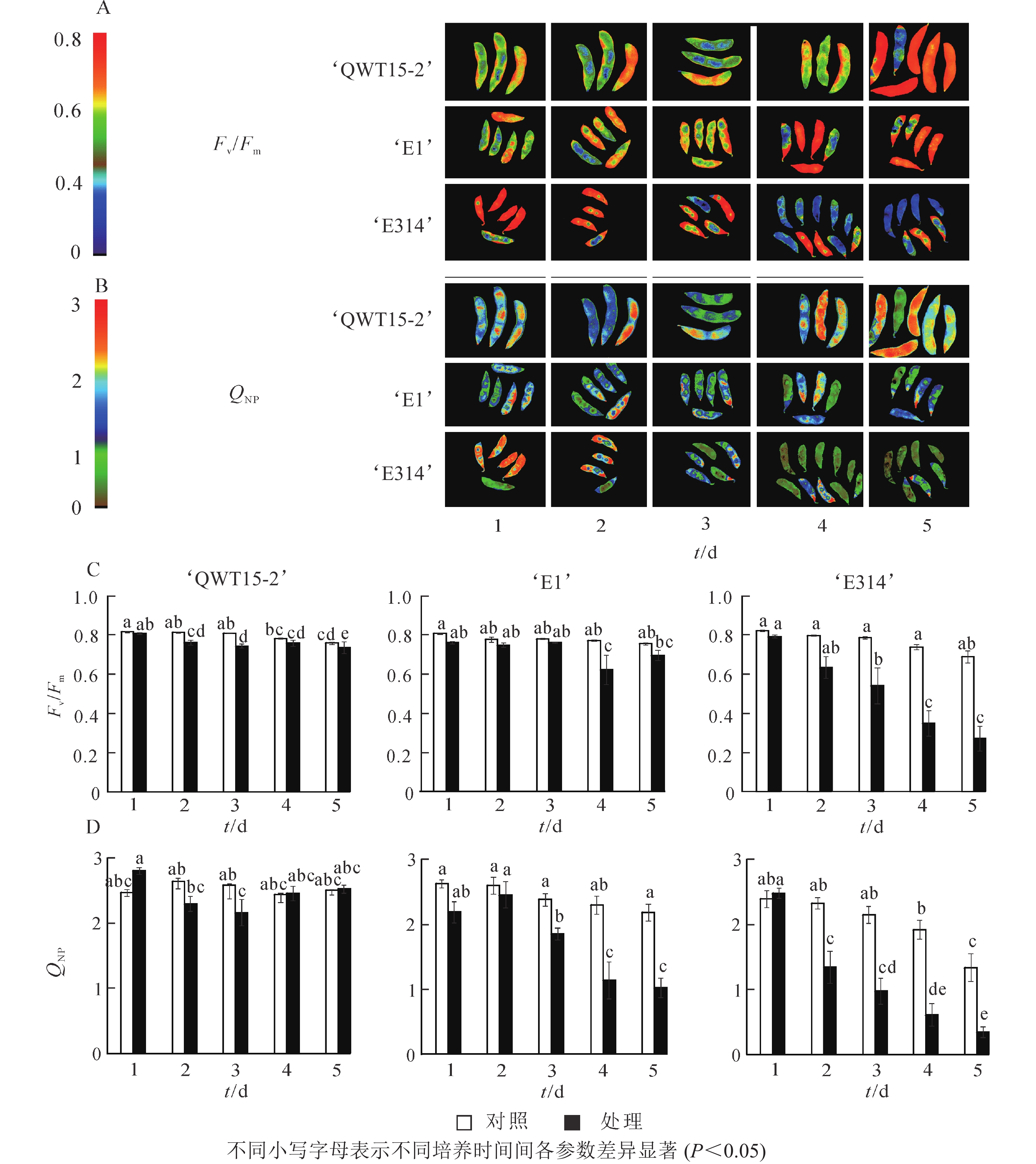
对不同抗性大豆种荚接种霉菌1~5 d内的叶绿素荧光参数进行时序性监测。由图1A~B可知:高抗大豆‘QWT15-2’在接菌培养的5 d内,未发现明显的病斑产生;中抗大豆‘E1’和感病大豆‘E314’则在接菌1 d后即出现了小块病斑,并随着接种培养时间的延长,病斑处颜色和区域增加越加明显,荧光强度显著降低。Fv/Fm和QNP的成像变化与豆荚的受害呈现出明显的相关性。在图1C~D中,高抗大豆‘QWT15-2’在接种5 d后,与对照相比,Fv/Fm具有明显的应答响应,荧光强度虽成显著降低,但仍可以达到0.73,而中抗和敏感的‘E1’和‘E314’病斑处,Fv/Fm图像分别在接种后4和1 d呈现深蓝色,且Fv/Fm荧光强度明显降低,与受侵染处组织受到破坏的程度表现出一致性,QNP的荧光成像和参数与之呈现出类似的变化特征。总体表现为种荚霉变病级越高,病斑处区域则越大,Fv/Fm和QNP越低,变化幅度越大;高抗种荚的Fv/Fm和QNP高于中抗和敏感品种,但变化幅度小于中抗和敏感品种。
-
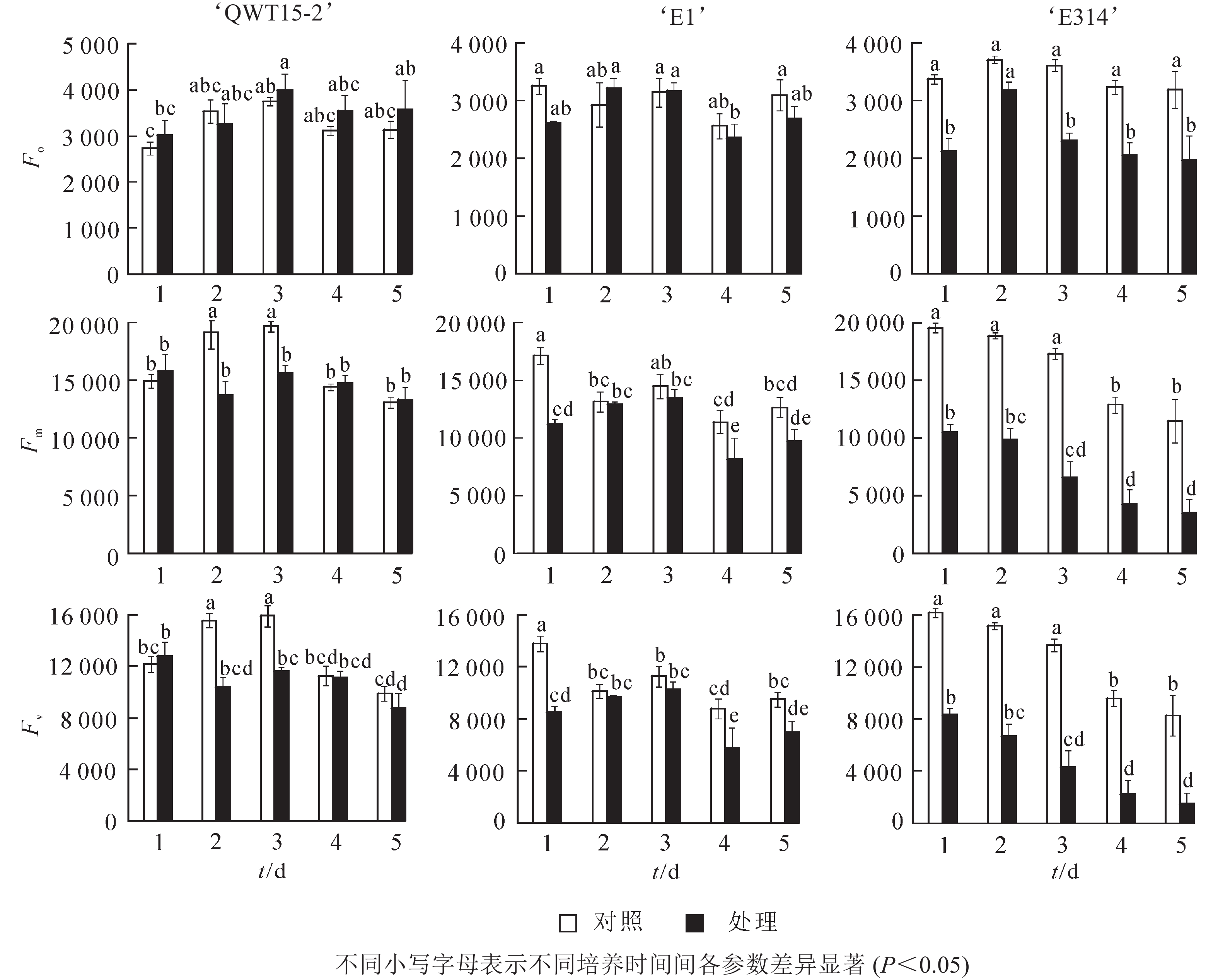
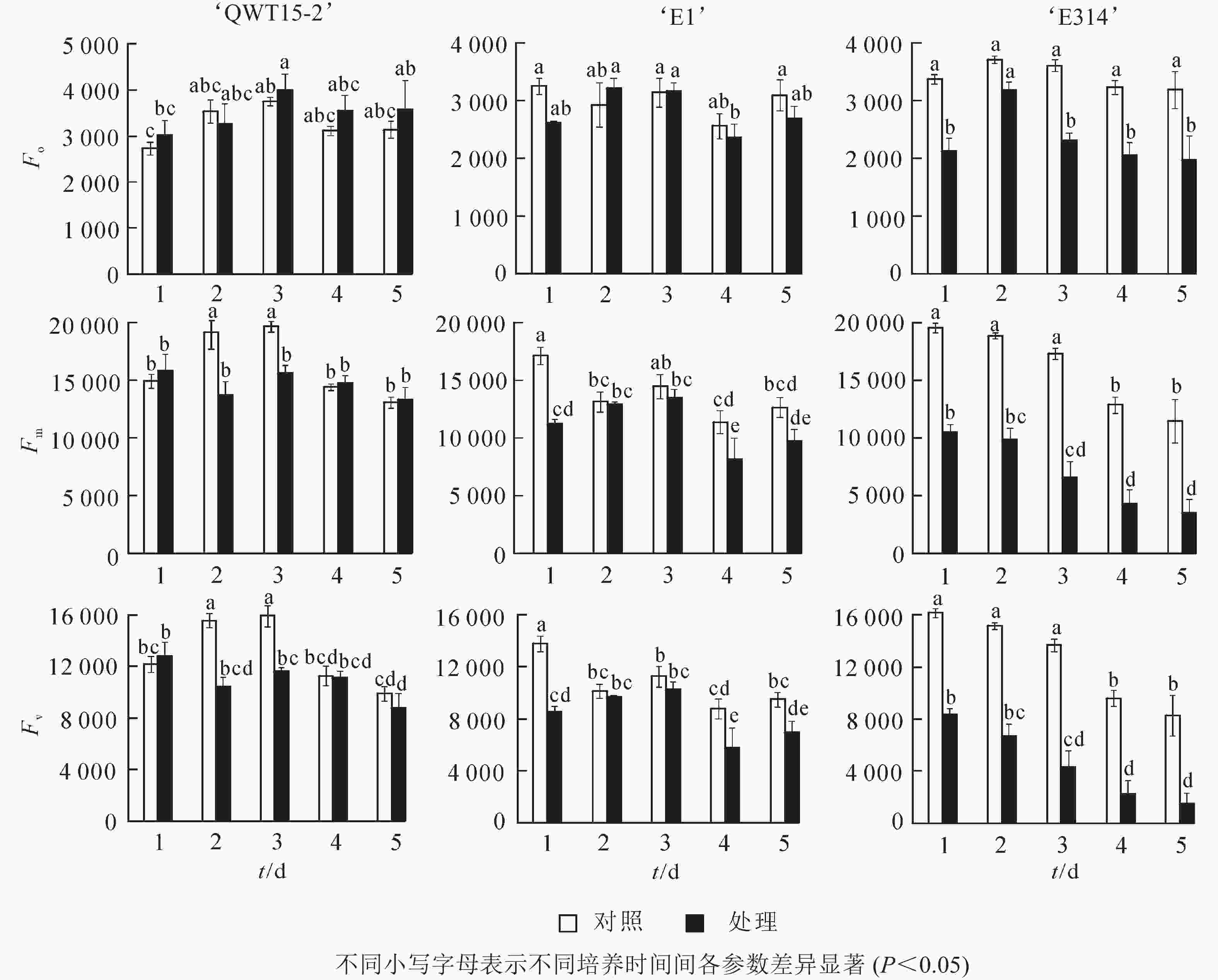
大豆种荚接种轮枝镰刀菌后,其初始叶绿素荧光参数发生变化,不同抗性豆荚的变化存在差异(图2)。与对照相比,在接菌培养的5 d内,易感大豆‘E314’的初始荧光参数变化最为剧烈,Fo、Fm及Fv均呈降低趋势,且在培养的5 d内,各参数的平均降低幅度分别为32%、58%、66%;中抗大豆‘E1’的初始荧光参数变化较为缓和,Fo、Fm及Fv也主要呈降低趋势,其各参数的平均降低幅度分别为6%、19%、22%;而高抗大豆‘QWT15-2’的3个初始荧光参数变化幅度仅为7%、8%、13%。这表明种荚受轮枝镰刀菌侵染后,高抗材料初始荧光变化幅度最小,中抗材料其次,敏感材料最大;且随着侵染时间延长,种荚霉变程度加剧,Fm和Fv具有明显的应答响应。
-
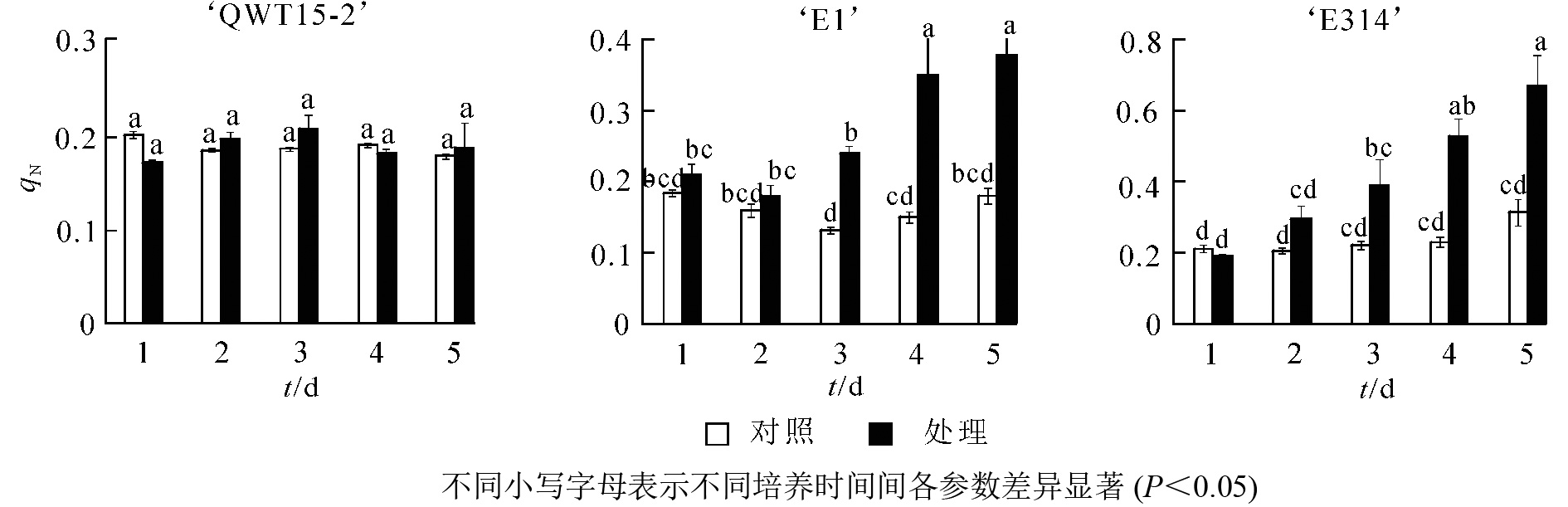
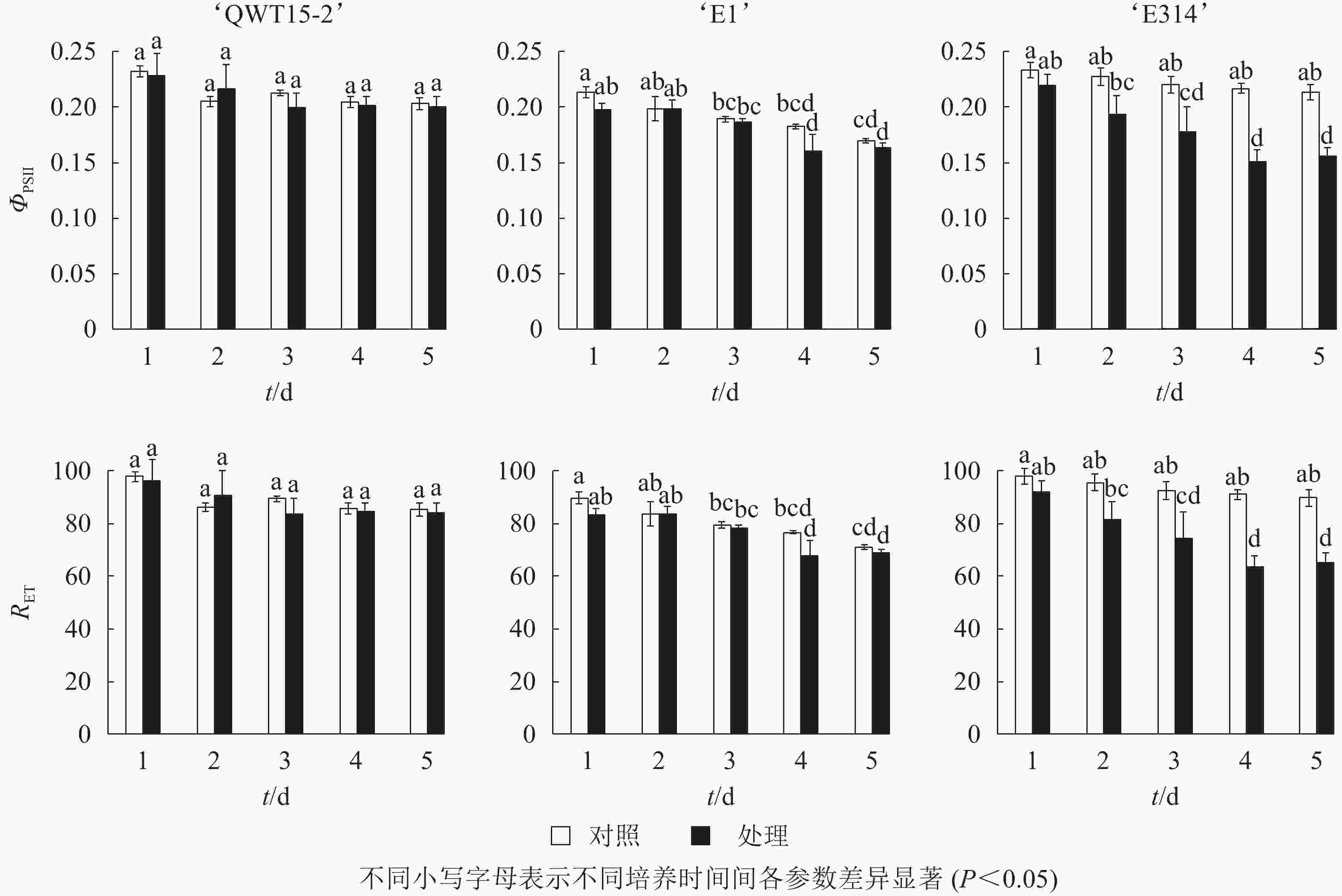
接种轮枝镰刀菌的5 d内,不同抗性大豆种荚的非光化学猝灭系数qN随接种时间变化如图3所示。与对照相比,随着接种时间的延长,‘QWT15-2’的qN几乎没有变化;‘E1’和‘E314’种荚qN不断增高,且变化幅度明显大于‘QWT15-2’。‘E1’种荚qN在接种3 d后呈极显著变化;而‘E314’种荚qN变化时间更为提前,在接种2 d后呈显著变化;‘QWT15-2’在整个接种过程中变化都不显著,表明荧光参数qN在响应时间和变化幅度上,对霉菌侵染应答敏感。
-
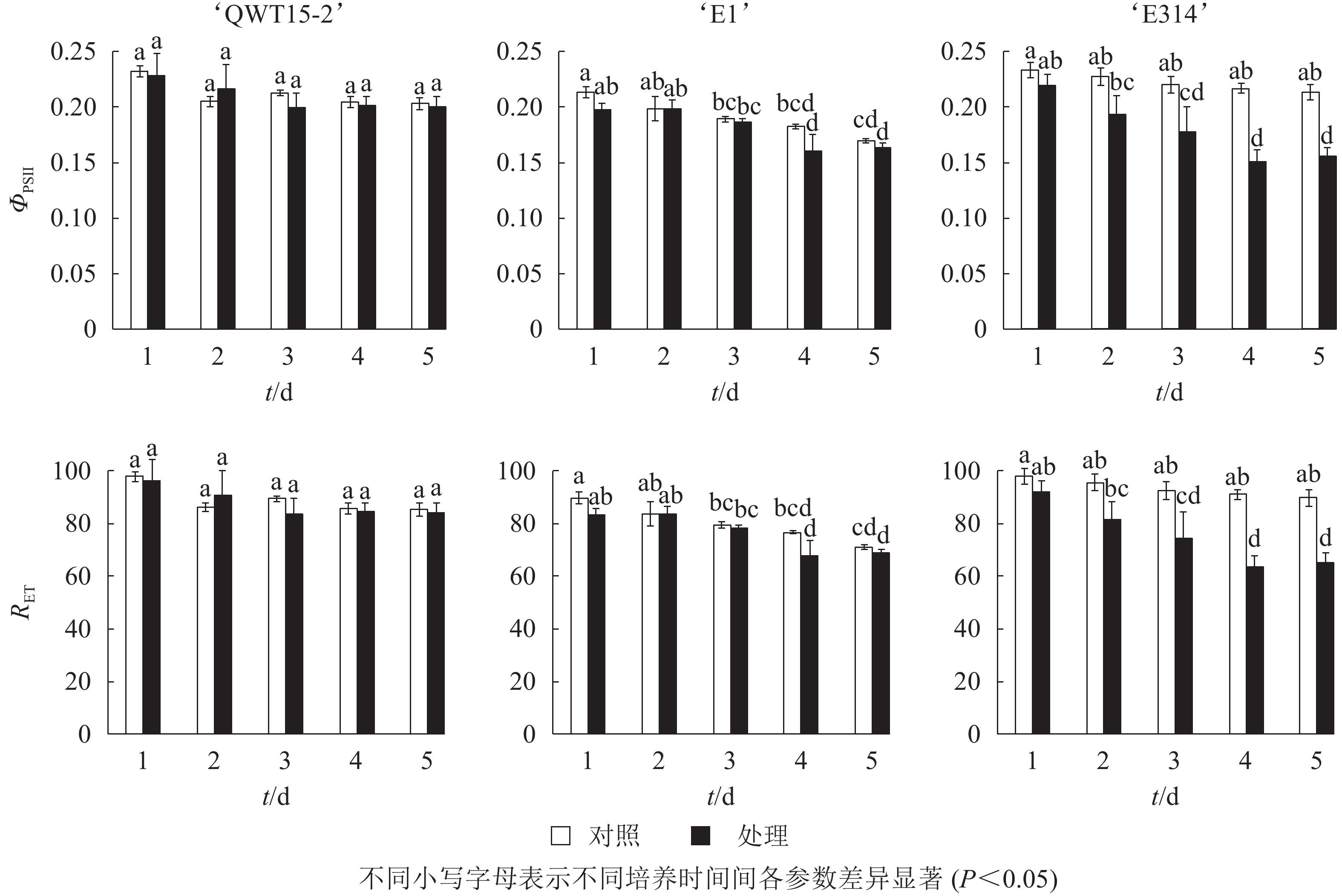
对接种豆荚的光化学效率与电子传递效率进行了时序性监测。由图4可知:在接种的5 d内,与对照相比,3个不同抗性大豆豆荚的光化学效率ΦPSⅡ与电子传递速率RET均呈下降趋势,但仅在易感材料‘E314’中响应剧烈。
2.1. 种荚接种轮枝镰刀菌后的荧光成像及参数分析
2.2. 接种过程中的种荚初始荧光参数变化
2.3. 接种过程中种荚的非光化学猝灭系数
2.4. 接种过程中的种荚光化学效率与电子传递效率
-
叶绿素荧光成像技术是植物光合生理的无损伤探针,近年来在植物抗逆生理机制和植物病害检测方面得到了广泛应用。对水稻[9]、小麦[11]、山葡萄Vitis amurensis[12]等植物的病害研究发现,各种病害均会降低植物Fv/Fm,抑制PSⅡ活性。杨峰等[13]运用荧光成像技术发现,根腐病导致大豆叶片PSⅡ反应中心受到影响,使得Fv/Fm、QNP和ΦPSⅡ下降;何金祥等[14]在烟草Nicotiana tabacum中发现花叶病毒感染叶片时,PSⅡ的光捕获效率和光化学反应效率降低,光合电子传递和碳同化受到抑制,Fv/Fm、QNP和ΦPSⅡ显著低于健康叶片。表明在生物胁迫检测中,叶绿素荧光参数Fv/Fm、QNP和ΦPSⅡ等对生物胁迫具有较好的灵敏度,能实现对染病植株与健康植株的早期识别,也能定量分析植株的染病程度。
在本研究中,种荚接种轮枝镰刀菌后,其荧光参数与对照差异明显,高抗大豆‘QWT15-2’参数变化幅度最小,其次是中抗大豆‘E1’,易感大豆‘E314’最大。接种后Fo、Fm及Fv呈降低趋势,Fo为光照下最小荧光,主要与PSⅡ天线色素内的最初激子密度及叶绿素含量有关[15],由于种荚组织被病原菌破坏,叶绿素含量急剧降低,导致Fo明显降低;Fm和Fv分别反映了PSⅡ的电子传递情况和电子传递受体QA的还原情况[16],与对照相比,接菌后‘E1’和‘E314’的PSⅡ活性下降,电子传递速率RET降低。表明霉菌侵染大豆种荚后,会损坏其光合机构,导致电子传递受阻,使得种荚初始荧光降低,而‘QWTT15-2’维持了较为健康的组织形态,初始荧光参数表现稳定。在初始荧光中,Fm和Fv在中抗大豆‘E1’和易感大豆‘E314’较早应答病菌侵染,随着侵染时间延长,种荚霉变程度加剧,Fm和Fv具有明显的应答响应。
最大光化学效率Fv/Fm及光化学效率ΦPSII的降低也表明种荚受霉菌侵染后,种荚健康组织逐渐受损,其PSⅡ反应中心的原初光能捕获效率降低,导致实际的光化学效率ΦPSII降低,其中Fv/Fm在3个不同抗性材料中应答最为明显。非光化学猝灭系数qN和QNP反映了PSⅡ天线色素吸收的光能不能用于光合电子传递的部分和植物热耗散的能力[17],种荚在霉菌侵染条件下,‘E1’和‘E314’种荚的健康组织逐步霉变,病变处光能未被光合吸收利用,使得天线色素吸收的多余光能以热能形式耗散掉。在整个接种过程中,‘QWT15-2’种荚qN和QNP变化都不显著,而‘E1’和‘E314’种荚qN和QNP分别在接种3和2 d后呈显著变化,表明qN和QNP在响应时间和变化幅度上,对霉菌侵染应答敏感。
因而在上述实验过程中,高抗大豆‘QWT15-2’在接种病原菌后,种荚各荧光参数变化均不大,仅Fv/Fm变化明显;中抗大豆‘E1’中,荧光参数下降幅度更为明显,多个参数在霉变严重的4~5 d达到显著水平,以Fm、Fv、qN和QNP的应答更为明显;而易感大豆‘E314’种荚在霉菌侵染2 d时,其光系统活性即发生显著变化,所有荧光参数均发生了极显著响应。
-
轮枝镰刀菌侵染大豆种荚后,不同抗性大豆种荚的荧光参数响应迅速。霉菌造成种荚光合机构损伤,叶绿素降解,热耗散能力降低,阻碍了光合电子传递,导致光合速率下降;随着离体培养时间的延长,病原菌扩散加快、霉变程度加剧,健康种荚组织逐渐被霉菌破坏,使得种荚Fo、Fm、Fv、Fv/Fm、QNP、ΦPSⅡ、RET下降;其中,霉菌侵染不同抗性大豆1 d后,Fv/Fm即有明显响应,均呈现下降趋势,可作为筛选抗性大豆种质的首要评价指标;Fm、Fv、qN和QNP在中抗和易感品种中也具有显著响应,可作为次要评价指标。南方大豆田间霉变严重,基于叶绿素荧光成像技术实现对豆荚霉变的早期监测预报具有重要作用,后续工作将扩大检测群体,进一步验证荧光参数的应用效果,为抗病新品种选育奠定基础。








 DownLoad:
DownLoad: