-
杉木Cunninghamia lanceolata是中国南方最主要的用材树种, 主要分布在南方16个省(区)。第8次全国森林资源清查结果表明:中国人工林面积达6 933万hm2, 占全国森林面积的33.3%, 其中杉木林面积达1 096万hm2, 面积约占中国人工林总面积的16%[1]。随着杉木人工林种植面积扩大, 由于营林措施不合理(多代连栽、纯林化等)再加上杉木林自毒作用[2], 使得在杉木林的整个生长发育过程中, 林地养分被大量消耗, 土壤微生物数量逐年减少, 生化活性和氧化代谢功能下降, 致使杉木人工林出现生产力下降和地力衰退的现象[3-5], 严重影响其原有的生态和经济效益。这些问题已成为林业工作者持续关注的重点[6-7]。研究者们针对不同代、不同发育阶段杉木林的土壤理化性质、生物特性变化及其影响因素做了大量研究[4, 8], 其中, 许多研究者指出林下土壤中微生物的多样性能够显著提高土壤质量进而影响杉木的产量与质量[9]。大量对杉木人工林林分密度的研究也表明, 林分密度通过对照入地面光照的控制, 影响林下植物物种多样性及土壤水分, 进而影响微生物多样性[10-12]。密度是人工林经营最重要的可控因子之一, 合理的林分密度对微生物多样性尤为重要[13]。土壤微生物在维持生态系统整体服务功能方面具有重要作用, 土壤养分循环、净化环境以及陆地生态系统的稳定调节等都离不开土壤微生物[14]。与土壤理化性质相比, 土壤微生物对外界环境的变化更为敏感。因此, 土壤微生物性质常被用作表征土壤质量的灵敏性指标, 而土壤微生物多样性是土壤微生物学研究中应用最广泛的指标之一[15]。Biolog-ECO微平板法是被广大研究者用来研究土壤微生物群落功能多样性的一种简单、快速的方法。该方法通过酶标仪快速检测每个孔的吸光度来计算微生物碳代谢情况[16]。该方法不仅可以区分不同密度杉木人工林土壤微生物群落的主要碳源类型, 明确不同密度杉木人工林土壤微生物对不同碳源类型利用强度, 还可以比较土壤微生物群落对不同密度的响应, 为杉木人工林的密度选择、生长发育及可持续发展提供基础数据。本研究通过对5种不同密度杉木人工林土壤微生物碳代谢多样性的研究, 探索杉木人工林土壤微生物对林分密度及土壤养分的响应, 为杉木人工林可持续发展提供理论依据。
HTML
-
研究区位于江西省新余市分宜县(27°30′~27°45′N, 114°30′~114°45′E), 该地区属于低山丘陵地貌。属亚热带季风气候, 全年平均气温17.2 ℃, 年均降水量1 600.0 mm, 年均无霜期270.0 d。雨量充沛, 阳光充足, 气候温和, 无霜期长。母岩以千枚岩为主, 土壤为黄、红壤, 地带性植被为常绿阔叶林。本研究选择地形地貌、海拔、母岩、土壤类型等相同的1980年造杉木人工林实验样地(表 1)进行, 研究地造林密度不同且造林后没有任何人为干扰, 杉木人工林林分结构简单, 乔木以杉木为主。林下灌木层物种主要以杜茎山Maesa japonica、草珊瑚Sarcandra glabra、菝葜Smilax china、珍珠莲Ficus sarmentosa、青冈栎Cyclobalanopsis glauca、大青Clerodendrum cyrtophyllum、细枝柃Eurya loquaiana、毛冬青Ilex pubescens、鸡骨柴Elsholtzia fruticosa为主, 林下草本层物种主要以双盖蕨Diplazium、边缘鳞盖蕨Microlepia marginata、黑足鳞毛蕨Dryopteris fuscipes、团叶陵齿蕨Lindsaea orbiculata、莎草Cyperus rotundus、淡竹叶Lophatherum gracile、薹草Carex spp.、荩草Arthraxon hispidus为主。
样地号 种植密度/(株·hm-2) 株行距/(m×m) 郁闭度 存活密度/(株·hm-2) 树高/m 胸径/cm A 1 667 3.0×2.0 0.79±0.01 a 80.66±2.70 a 13.00±0.54 a 20.93±0.80 a B 3 333 2.0×1.5 0.81±0.01 b 77.44±2.40 a 12.30±0.30 b 18.76±0.75 b C 5 000 2.0×1.0 0.82±0.01 c 73.31±1.70 b 11.71±0.26 b 16.63±0.50 c D 6 667 1.5×1.0 0.85±0.01 cd 69.33±1.60 c 10.95±0.28 c 14.79±0.59d E 10 000 1.0×1.0 0.93±0.01 d 57.80±1.92 d 10.46±0.53 d 14.05±0.85 d 说明:同列数值后不同小写字母表示不同林分密度间林木生长状况差异显著(P<0.05) Table 1. Basic condition of plots
-
2018年10月, 选择1980年造5种不同密度(1 667、3 333、5 000、6 667、10 000株·hm-2)杉木人工林实验样地, 样地海拔高度为190~210 m, 坡向均为南坡, 坡度约15°~20°。每块样地造林面积1 000 m2(33 m × 33 m), 并在相应样地下方按照同样造林密度设置2组重复样地, 造林前3 a进行抚育, 后基本无人工干扰, 为长期自然发展形成。在每块1 000 m2样地中间位置选取20 m × 20 m样方, 在样方内采用S形取样法采集5点0~20 cm土壤样品混合, 去除凋落物并分为2份, 一份装入土袋带回实验室风干过筛, 做土壤理化性质, 另一份装入无菌密封袋并放入恒温箱, 及时运回实验室放入4 ℃冰箱, 24 h内进行样品处理及Biolog分析。每块样地用钢制环刀(直径5 cm, 容积100 cm3)取3个原状土, 带回实验室做土壤物理性质分析。
-
土壤容重采用环刀法[17]; 土壤pH值采用电位法, 用水浸提测定(水土质量比2.5:1.0);土壤有机质采用重铬酸钾氧化外加热法; 全氮用硫酸铜、硫酸钾、硫酸消煮, 凯氏定氮法测量; 全磷、全钾采用硝酸、盐酸、氢氟酸微波消解, 流动分析仪法(Spectro Analytical Instruments, Spectro Arcos ICP, Kleve, 德国)测量; 有效磷采用氟化铵和盐酸浸提, 流动分析仪测量; 速效钾采用乙酸铵浸提, 流动分析仪测量; 碱解氮采用扩散法[18]。
-
采用含有31种碳源的Biolog-ECO分析土壤微生物群落的代谢特征。采用CLASSEN等[19]的方法制备生态板接种液。首先称取相当于30 g烘干土的鲜土加入到盛有270 mL质量分数为0.85%的氯化钠溶液的三角瓶中180转·min-1震荡30 min, 取3 mL上清液加入到27 mL氯化钠溶液, 混匀后再取3 mL上清液加入到27 mL氯化钠溶液, 土壤溶液最终稀释至10-3。向ECO板的各孔中加入150 μL的稀释液。将接种好的微孔板放在28 ℃的恒温培养箱中。分别于24、48、72、96、120、144、168、192 h在MicroLogTM Version 4.20.05微孔板读数仪(Biolog Inc, 美国)上进行测定, 读取波长分别为590 nm(颜色+浊度)和750 nm(浊度)的数值。采用所有测定数据计算平均颜色变化率(AWCD), 采用96 h测定数据计算土壤微生物群落的功能多样性, 用丰富度指数(R)、Shannon-Wiener指数(H′)、Pielou指数(J)、Simpson指数(D)、McIntosh指数(U)表示[20-23]。运用R i386 3.3.1软件, 对样地林分状况、土壤理化性质、AWCD值和微生物碳代谢多样性指数进行单因素方差分析, 并利用邓肯氏检验将相同指标在不同密度下的差异性用小写字母进行标注(P<0.05);对96 h各土样AWCD值进行主成分分析, 确定微生物主要利用的碳源类型; 对土壤理化性质与微生物碳代谢多样性指数进行相关性分析。运用Excel处理相关数据, GraphPad PRISMⓇ软件绘图。
1.1. 区域概况
1.2. 研究方法
1.2.1. 样品采集及样地介绍
1.2.2. 土壤理化性质的测定
1.2.3. Biolog-ECO技术及微生物多样性计算方法
-
通过资料查询及对样方内林木状况调查, 得知随着种植密度的增加, 林地郁闭度逐渐增加, 杉木存活率、树高、胸径逐渐减小, 且这些变化在多数林分密度间差异显著(P<0.05)。这是由杉木的种间竞争决定的, 种植密度越大, 对水肥气热等条件需求越高, 越影响单株生长状况。
不同密度杉木人工林土壤的理化性质各不相同(表 2)。土壤有机质、全氮、全磷在林分密度适中时质量分数较高, 而pH、全钾、有效磷、速效钾则是在林分密度较低或较高时质量分数较高, 碱解氮则无明显规律。表明不同的养分指标对林分密度具有不同方向的响应。单因素方差分析显示:不同密度的土壤理化性质差异显著(P<0.05), 尤其是全磷、碱解氮、有效磷, 在各林分密度间均差异显著(P<0.05)。
样地号 pH 容重/(g·cm-3) 有机质/(g·kg-1) 全氮/(g·kg-1) 全磷/(g·kg-1) 全钾/(g·kg-1) 碱解氮/(mg·kg-1) 有效磷/(mg·kg-1) 速效钾/(mg·kg-1) A 4.41 1.37±0.15 b 28.82±0.91 b 1.86±0.05 b 0.13±0.01 e 24.81±0.53 a 49.12±0.24 c 1.38±0.01 a 62.67±0.51 a B 4.25 1.29±0.10 c 29.26±0.05 a 1.90±0.11 a 0.28±0.00 c 22.30±0.51 be 63.20±0.52 b 1.35±0.01 b 58.75±0.52 b C 4.26 1.43±0.00 a 21.98±0.01 c 1.68±0.04 c 0.20±0.00 d 21.61±0.50 c 38.96±0.56 d 1.26±0.01 d 49.91±0.55 c D 4.31 1.41±0.10 a 28.54±0.50 ab 1.86±0.11 ab 0.34±0.00 b 24.14±0.54 a 66.62± 0.50 a 1.23±0.01 e 40.35±0.51 d E 4.44 1.36±0.03 b 21.96±0.27 c 1.45±0.01 d 0.42±0.00 a 22.88±0.55 b 19.08±0.56 e 1.29±0.01 c 59.22±0.53 b 说明:同列不同数值后小写字母表示不同林分密度间土壤性质差异显著(P<0.05) Table 2. Physical and chemical properties of soil
-
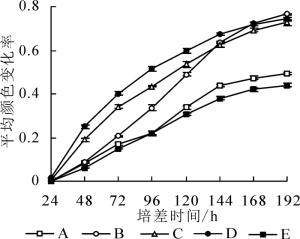
Biolog生态板板孔平均颜色变化率(AWCD)反映了土壤微生物利用单一碳源的能力, 是土壤微生物活性及群落功能多样性的重要指标[24], 计算不同植被类型土壤AWCD值的3次重复平均值, 绘制AWCD值随时间动态变化曲线(图 1)。结果显示:随着时间的增加, AWCD值不断增加, 表明土壤微生物对31种碳源的综合利用随时间逐渐增加。从图 1可以看出:AWCD值变化曲线在144 h时有明显的变化, 培养24~144 h时间内, AWCD值上升较快, 表明微生物对碳源的利用速率较快。144 h后, AWCD值上升速率明显降低且趋于平缓, 微生物对碳源的利用逐渐达到平衡甚至减弱。培养24~144 h时间内, 5个样地杉木人工林土壤微生物对31种碳源的综合利用程度从大到小依次为样地D、样地C、样地B、样地A、样地E。从土壤微生物对碳源的综合利用情况可以看出:林分密度适中时, 微生物利用碳源的能力较强, 且利用程度显著(P<0.05)大于高密度和低密度林分。
-
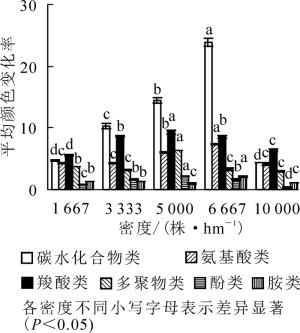
ECO板上的31种碳源可以根据其化学基团的性质, 分为6大类, 即碳水化合物类、羧酸类、氨基酸类、多聚物类、酚酸类和胺类。选取培养时间为96 h的数据分析不同群落土壤微生物对这6类碳源的利用情况。结果如图 2:各密度不同类碳源间差异多达到显著水平(P<0.05);在样地B、样地C、样地D的3种密度下, 微生物对糖类利用最多, 羧酸类其次; 在样地A和样地E这2种密度下, 微生物对羧酸类利用最多, 糖类其次; 除糖类和羧酸类外, 在杉木人工林中其他碳源被微生物群落利用程度从大到小依次为氨基酸类、多聚物类、酚类(胺类); 5种不同密度杉木人工林下土壤微生物对6类不同碳源的综合利用程度程度从大到小依次为样地D、样地C、样地B、样地A和样地E, 与图 1各孔平均颜色变化率相同; 5种不同密度下微生物对不同碳源的利用程度从大到小依次为碳水化合物类、羧酸类、氨基酸类、多聚物类、酚类、胺类。
-
微生物多样性指数可用来表征微生物对31种碳源综合利用程度。根据96 h的AWCD值计算得到不同密度杉木人工林土壤微生物群落的丰富度指数、Shannon-Wiener指数、McIntosh指数、Simpson指数和Pielou指数(表 3)。丰富度指数代表微生物群落对碳源利用数目的多少, 样地C的丰富度指数最高, 对碳源利用的数目最多, 其次为样地B, 样地E对碳源利用的数目最少。Shannon-Wiener指数反映微生物群落物种变化度和差异度, 样地D的微生物群落变化度和差异度最大, 密度在样地D以下的杉木人工林微生物群落变化度随密度减小而减小, 样地E的微生物群落变化度和差异度最小。McIntosh指数反映对碳源利用种类数的不同, 并能区分不同利用程度, 其规律与Shannon-Wiener指数基本一致。Simpson指数反映土壤微生物种最常见物种, 数据表明密度为样地A和样地E中的微生物物种最常见。Pielou指数反映了全部微生物种群个体数目的分配状况, 数据表明其规律与Shannon-Wiener指数、McIntosh指数基本一致。综合微生物多样性指数, 在培养时间为96 h时, 微生物对31种碳源综合利用程度从大到小依次为样地D、样地C、样地B、样地A、样地E, 即林分密度在1 667~6 667株·hm-2以内时, 微生物对31种碳源综合利用随林分密度的增大而增大, 在6 667~10 000株·hm-2以内时, 可能随林分密度的增大而减小, 至10 000株·hm-2时, 微生物对31种碳源的利用已小于林分密度为1 667株·hm-2。
群落编号 丰富度指数 Shannon-Wiener指数 McIntosh指数 Simpson指数 Pielou指数 A 20.26±l.83 c l.48±0.02 c 3.l3±0.03 c 0.96±0.0l a 0.43±0.00 d B 24.l6±2.29 a 2.ll±0.03 b 4.47±0.03 b 0.93±0.0l ab 0.6l±0.0l c C 25.l8±2.84 a 2.54±0.02 a 6.00±0.05 ab 0.89±0.0l b 0.74±0.0l b D 22.60±2.63 b 2.92±0.02 a 6.55±0.04 a 0.86±0.0l c 0.85±0.02 a E l8.49±l.26 c l.43±0.0l c 3.09±0.02 c 0.96±0.02 a 0.42±0.0l d 说明:同列不同字母表示同一指数在不同林分密度间差异显著(P<0.05) Table 3. Diversity indices for soil microbial communities of different C. lanceolata plantations
-
对不同密度杉木人工林生态板培养96 h的AWCD值表征的微生物利用单一碳源特性进行主成分分。根据主成分提取原则[25], 提取与土壤微生物碳源利用功能多样性相关的2个主成分累计贡献率达到87.90%。其中第1主成分的方差贡献率为71.53%, 第2主成分的方差贡献率为16.37%, 因其他主成分的方差贡献率较小, 故只分析第1主成分和第2主成分(图 3)。由各孔AWCD值贡献率得分, 第1主成分得分为正的共有17种, 得分最高的为α-D-乳糖(α-D-lactose), 其中碳水化合物类6种, 氨基酸类4种, 羧酸类2种, 多聚物2种, 胺类2种, 酚类1种。第2主成分得分为正的共有21种, 其中碳水化合物类3种, 氨基酸类4种, 羧酸类7种, 多聚物4种, 胺类2种, 酚类1种。由此说明:对杉木人工林土壤微生物利用的碳源贡献率种类最多的是碳水化合物类, 其次是氨基酸类。
-
不同密度下杉木人工林理化性质与微生物多样性相关性(表 4)显示:土壤容重、有机质、全磷和全钾质量分数与表示微生物多样性的各指数均无相关性; 土壤全氮仅与微生物丰富度指数显著正相关(P<0.05);土壤碱解氮质量分数与表示微生物多样性的所有指数都有显著(P<0.05)或极显著(P<0.01)相关性; 土壤有效磷和速效钾质量分数与Shannon-Wiener指数、McIntosh指数、Simpson指数、Pielou指数显著(P<0.05)或极显著相关(P<0.01), 但其相关性与碱解氮相关性相反。综上所述, 在本研究的杉木林中, 土壤碳与微生物多样性相关性弱, 而土壤氮磷钾与微生物多样性存在相关性, 特别是速效养分与微生物多样性相关性显著(P<0.01)。
项目 丰富度指数 Shannon-Wiener指数 McIntosh指数 Simpson指数 Pielou指数 容重 -0.158 0.284 0.353 -0.337 0.273 有机质 0.458 0.327 0.261 -0.258 0.322 全氮 0.666* 0.468 0.419 -0.390 0.468 全磷 -0.261 0.143 0.142 -0.172 0.148 全钾 -0.406 -0.06F -0.077 -0.004 -0.079 碱解氮 0.742** 0.694** 0.642* -0.612* 0.690** 有效磷 -0.112 -0.640* -0.670* 0.581* -0.620* 速效钾 -0.417 -0.926** -0.938** 0.925** -0.921** 说明:*表示在005水平(双侧)上显著相关, **表示在0.01水平(双侧)上显著相关 Table 4. Correlation between physicochemical properties and microbial diversity
2.1. 样地概况及土壤性质差异
2.2. 不同密度杉木人工林土壤微生物利用总碳源动力学特征
2.3. 不同密度杉木人工林土壤微生物群落对各类碳源的利用
2.4. 不同密度杉木人工林土壤微生物多样性指数
2.5. 土壤微生物利用碳源的主成分分析
2.6. 不同密度杉木人工林土壤理化性质与微生物多样性相关性分析
-
土壤微生物碳代谢水平一定程度上反映森林整体生长情况。微生物代谢活性越高, 能力越强, 反映地上植物生长状况越好。土壤微生物对于土壤养分的分解和转化意义重大, 一方面对土壤有机物质起分解作用, 使有机物质转化成有效养分, 另一方面, 对土壤中的无机营养元素起固持和保蓄作用。微生物量越大, 土壤保肥作用越强, 并使土壤养分趋于积累[26-27]。土壤理化性质及生物学特性直接受到林内水、热、光及林木根系对土壤养分的吸收利用的影响, 而这些因素和林分密度密切相关, 因此, 寻找合适的林分密度, 对森林生态的可持续发展十分重要。对不同密度杉木人工林土壤微生物碳代谢进行比较的过程中发现, 38年生杉木林现存密度为3 333、5 000和6 667株·hm-2时, 微生物碳代谢能力较强, 土壤水热条件好, 适合杉木林土壤微生物发挥作用。杉木林密度为1 667株·hm-2时, 林地郁闭度低, 透光性较高, 影响林下土壤水分的保存, 从而使微生物的代谢功能降低。种植密度为10 000株·hm-2时, 由于郁闭度的增高, 林地的透光量的减少, 会导致林下植被多样性及林下温度降低, 从而降低了林下凋落物种类和数量及微生物的代谢速率, 同样导致微生物的代谢作用降低。对比各密度林下土壤养分含量, 得知杉木密度为5 000和6 667株·hm-2时, 对土壤养分的消耗增大, 表现为土壤养分含量的降低及微生物碳代谢的后劲不足, 不利于杉木人工林的可持续发展。因此, 本研究中该地区38年生杉木人工林在种植密度为3 333株·hm-2时最好, 此时林地杉木的存活数量约为2 600株·hm-2, 这一结果可以为杉木公益林的长期可持续发展提供建议。
-
由不同密度杉木人工林土壤微生物群落对各类碳源的利用得出:不同密度杉木人工林土壤微生物对不同种类碳源的利用程度不同。在林分密度适中时, 土壤微生物对糖类的利用最高, 而林分密度过大或过小时, 土壤微生物对羧酸类的利用大于糖类。杉木人工林对6种碳源的利用量从大到小依次为糖类、羧酸类、氨基酸类、多聚物类、酚类(胺类), 而主成分分析则显示糖类对第1主成分贡献最大, 其次为氨基酸类。结果表明:糖类、氨基酸类、羧酸类为杉木林下微生物主要利用的碳源, 且杉木人工林土壤微生物利用最大的碳源为α-D-乳糖, 表明α-D-乳糖在杉木人工林物质组成和能量转换中不可或缺。这一结果可为不同密度杉木林施肥方法提供思路, 在种植不同密度杉木林时, 应根据其需要的营养物质施用合适的肥料, 以保障林木快速生长。
-
土壤微生物量库的微小变化都会影响到养分的循环和有效性, 而土壤理化性质与土壤微生物多存在密切的正相关关系[28], 但不同生态系统土壤理化性质与微生物多样性的关系缺乏可比性[29-31], 在这方面的研究应更加广泛和深入。本研究中的土壤理化性质与代表微生物多样性的各指数和AWCD值均为种植密度3 333株·hm-2的最大, 6 666株·hm-2次之, 5 000株·hm-2最小, 表明杉木人工林土壤理化性质与微生物存在正相关关系, 但由于本研究所选择的样地为近自然状态不同密度杉木林, 受密度等影响, 样地环境因子比较复杂, 因此土壤某些理化性质与微生物多样性的相关性并不明显。由不同密度杉木人工林土壤理化性质与微生物多样性指数的相关性看出, 速效养分质量分数, 特别是碱解氮, 与微生物多样性相关性显著(P<0.05), 是影响微生物发挥作用的重要因素[32-33]。有研究表明:碱解氮是影响土壤微生物量碳积累的最重要养分因子, 全氮和碱解氮是影响微生物量氮、微生物呼吸强度和微生物熵的重要养分因子[34-35]。靳正忠等[36]也认为:全氮和碱解氮是影响微生物量的主导因子。这些结论与本研究结果一致。
3.1. 土壤微生物碳代谢对林分密度的响应
3.2. 杉木人工林土壤微生物主要利用碳源类型
3.3. 土壤理化性质与微生物多样性的关系
-
不同密度杉木人工林土壤微生物存在差异, 林分密度在2 600~4 600株·hm-2时, 反映土壤微生物代谢功能多样性的平均颜色变化率(AWCD)差异并不显著。该密度范围下土壤微生物碳代谢活性最高, 最适合有机质的分解及养分的转化与积累。不同密度杉木人工林土壤微生物对6种碳源的利用量不同, 密度在2 600~4 600株·hm-2时, 土壤微生物利用的主要碳源为糖类, 其次为羧酸类和氨基酸类, 但密度小于或超出这一范围时, 土壤微生物对羧酸类的利用将大于对对糖类的利用。主成分分析结果显示:α-D-乳糖对土壤微生物的利用贡献最大, 是杉木人工林中利用最多的物质。相关性分析结果显示:全氮和碱解氮与微生物多样性相关性显著(P<0.05), 且速效养分与微生物多样性的相关性比全量更加显著(P<0.05)。综合考虑微生物碳代谢多样性与土壤理化性质, 认为符合杉木人工林可持续发展战略的理想林分密度为2 600株·hm-2。











 DownLoad:
DownLoad:

