-
从有性生殖角度来看,植物的生物学特性与传粉条件相适应;而有效的传粉是以鲜花粉的活力、可靠的传播媒介和可授期的花朵柱头为前提的[1]。花粉持续活力的时间与柱头可授期共同对植物的传粉受精和植株发育起重要作用,特别在异花授粉和远缘杂交方面的影响程度更高[2],了解花粉培养、储藏及活力测定的方法是提高植物杂交育种效率的前提条件[3]。黄薇Heimia myrtifolia为千屈菜科Lythraceae黄薇属Heimia灌木,原产南美洲和非洲的热带、亚热带地区,人类的迁移致使南亚、东亚地区有零星分布,在中国上海、广西、浙江等地均有引种,用于园林观赏及河道美化等方面。对黄薇的研究主要集中在生物应用方面[4-5],目前未见黄薇在杂交育种方面的报道。本研究采用花粉离体萌发法研究不同温度、蔗糖质量浓度和硼酸(H3BO4)质量浓度对黄薇花粉萌发及花粉管生长的影响;用联苯胺-过氧化氢法测定柱头可授性,研究不同质量浓度萘乙酸(NAA)、赤霉素(GA3)、6-苄基腺嘌呤(6-BA)对黄薇柱头可授性的影响,并对黄薇花粉与柱头进行电镜扫描观察,为黄薇杂交育种亲本选配提供依据。
HTML
-
黄薇花单生叶腋,花瓣5~6,倒广卵形,长3~4 mm,金黄色;花萼钟形,裂片间有角状附属物;花、果期7月[6]。于2014年8月由杭州植物园引进,经过扦插繁殖成批量小苗种植于浙江农林大学东湖校区平山植物苗圃。植株生长良好,可正常开花结实。试验分别在2015年7月10-25日,2016年7月12日至8月25日进行。
-
在7:00-8:00采集黄薇未散粉的花药置于干燥箱内干燥2 h,常温下自然散粉后过80目分子筛收集花粉。
-
采用琼脂培养基萌发法检测花粉萌发率,培养基于121 ℃高温灭菌20 min,冷却至常温后备用。硼酸(H3BO4)处理:以100.0 g·L-1蔗糖,8.0 g·L-1琼脂为基本培养基,分别添加0、0.5、1.0、1.5、2.0、2.5 g·L-1的硼酸,在30 ℃下进行培养;蔗糖处理:以1.0 g·L-1的硼酸,8.0 g·L-1琼脂为基本培养基,分别添加0、50.0、100.0、150.0、200.0、250.0 g·L-1的蔗糖,30 ℃下培养;温度处理:培养基为150.0 g·L-1蔗糖+ 20.0 mg·L-1 H3BO4 + 20.0 mg·L-1 CaCl2 + 100.0 g·L-1 PEG 4000,设置10、15、20、25、30、35、40 ℃共7个温度梯度,3种处理均将培养基滴加在凹形载玻片上,采集的花粉用毛笔均匀撒在培养基上,放置于铺有湿润滤纸的培养皿中,盖上保鲜膜,置于光照培养箱内,光照强度2 000 lx,培养6 h。
-
柱头采集和处理参考KHO等[7]的方法,提前选取即将开放、松蕾情况相同、长势良好的花朵,标记挂牌,次日清晨6:00摘取黄薇鲜花,用镊子去除花瓣和雄蕊,取出柱头,分别装入含6-BA、GA3、NAA等3种植物生长调节剂溶液的5 mL离心管中。6-BA的质量浓度设为1.0、5.0、10.0、15.0、20.0 mg·L-1;GA3的质量浓度设为100.0、200.0、400.0、600.0 mg·L-1,NAA的质量浓度设为1.0、5.0、10.0、15.0、20.0 mg·L-1,以蒸馏水浸泡为参照,4 ℃保存12 h后,柱头在4.0 mol·L-1氢氧化钠(NaOH)溶液中常温处理6 h,经蒸馏水洗净后用质量浓度为0.1%水溶性苯胺蓝染色1 h。摘取开花1、2、4、6、8、12、24 h的黄薇花朵,用镊子取出柱头,用福尔马林-乙醇-醋酸混合固定液(FAA)固定24 h,其余染色步骤如上。
-
花粉萌发后在ZEISS Imager A2荧光显微镜下观察花粉萌发状况,观察不同视角花粉个数大于50,重复5次,拍照并记录,花粉萌发率=(萌发花粉/花粉总数)×100%。用联苯胺-过氧化氢法测定柱头可授性[8]。将处理后的柱头放入4.0 mol·L-1NaOH溶液中常温处理6 h,浸入盛有联苯胺-过氧化氢反应液(1%联苯胺:3%过氧化氢:水为4:11:22,体积比)染色1 h,随后取出并移置载玻片上,滴加体积分数为50%中性甘油,盖片压片,用ZEISS Imager A2荧光显微镜进行观察[9];反应液呈蓝色并伴有少量的气泡,表明柱头具有可授性;反应液无变化,则柱头无可授性[10]。每处理重复5次,并拍照。
-
黄薇花粉和柱头经过硅胶干燥,雌蕊经FAA固定24 h以上,乙醇溶液梯度脱水。临界点干燥后,固定于样品台上,离子溅射仪镀金,在S-3700N Hitachi扫描电镜下观察拍照。选取5个花粉或柱头,重复3次。利用Image-Pro plus 6.0,Photoshop CS6,SPSS 19.0分析处理图像及数据。
1.1. 材料
1.2. 方法
1.2.1. 花粉采集
1.2.2. 花粉萌发培养基配制及培养
1.2.3. 柱头采集及处理
1.2.4. 花粉萌发和柱头可授性检测
1.2.5. 花粉和柱头的扫描电镜观察
-
由表 1可见:花粉萌发率及花粉管长度在10~15 ℃呈上升趋势,15~35 ℃时花粉萌发率达25%~30%,花粉管长度处于上升趋势,在30~35 ℃时花粉萌发率和花粉管长度达最高值。温度为40 ℃时花粉萌发率和花粉管长度显著下降,且花粉萌发率降至最低,干瘪花粉粒数量增多,花粉粒脱水严重。可见,温度对黄薇花粉萌发率影响较为显著,适宜的温度为35 ℃。
温度/℃ 花粉萌发率/% 花粉管长度/μm 10 16.60 ± 3.57 bc 74.13 ± 5.01 e 15 25.80 ± 5.76 b 123.27 ± 6.77 d 20 29.40 ± 2.30 a 152.33 ± 3.22 cd 25 28.20 ± 4.55 a 167.75 ± 5.93 bc 30 29.60 ± 6.43 a 199.58 ± 7.94 b 35 29.80 ± 3.03 a 245.73 ± 18.19 a 40 10.40 ± 2.70 c 144.07 ± 6.24 cd 说明:数据均为平均值±标准误;同列不同字母表示0.05水平差异显著 Table 1. Effect of temperature on pollen germination and pollen tube growth of H. myrtifolia
-
由表 2可见:硼酸质量浓度对黄薇花粉萌发率与花粉管生长影响差异显著。硼酸质量浓度为0~0.5 g·L-1时,花粉萌发率和花粉管生长随着硼酸质量浓度提高而呈上升趋势,花粉萌发率在0.5 g·L-1时达最高值为39.60%,相较对照(24.20%)高出15.40%;硼酸质量浓度为0.5~2.5 g·L-1时,花粉萌发率和花粉管生长,随着硼酸质量浓度提高呈下降趋势,高于1.0 g·L-1时,对黄薇花粉萌发和花粉管生长具有明显抑制作用,2.5 g·L-1时,花粉萌发率与花粉管长度均降至最低,花粉萌发率比对照降低了13.80%,花粉管长度相比对照减少了102.67 μm。因此,当硼酸质量浓度为0.5~1.0 g·L-1时,对黄薇花粉萌发和花粉管生长具有明显促进作用。
硼酸浓度/(g·L-1) 花粉萌发率/% 花粉管长度/μm 0(ck) 24.20 ± 2.71 b 132.08 ± 10.38 bc 0.5 39.60 ± 3.64 a 281.44 ± 8.93 a 1.0 27.00 ± 2.47 b 170.20 ± 21.48 b 1.5 19.80 ± 1.07 bc 105.45 ± 14.06 cd 2.0 10.60 ± 1.43 c 64.65 ± 8.74 de 2.5 10.40 ± 2.20 c 29.41 ± 1.14 e 说明:数据均为平均值±标准误;同列不同字母表示0.05水平差异显著 Table 2. Effect of boric acid on pollen germination and pollen tube growth of H. myrtifolia
-
由表 3可见:不同质量浓度蔗糖对黄薇花粉萌发与花粉管生长的影响差异显著。蔗糖质量浓度为50.0 g·L-1时,花粉萌发率和花粉管长达最大值,花粉萌发率相比对照高出40.60%,花粉管长度相比对照长308.86 μm。黄薇花粉萌发及生长随着蔗糖质量浓度上升呈下降趋势,在250.0 g·L-1降至最低,花粉萌发率比对照低0.40%,花粉管长仅为5.38 μm。因此,有效促进黄薇花粉萌发及花粉管生长的蔗糖质量浓度为50.0~150.0 g·L-1,最佳蔗糖质量浓度为50.0 g·L-1。
蔗糖质量浓度/(g·L-1) 花粉萌发率/% 花粉管长度/μm 0(ck) 1.60 ± 0.51 b 22.34 ± 7.35 d 50.0 42.20 ± 2.75 a 331.20 ± 18.60 a 100.0 27.65 ± 7.81 a 217.17 ± 22.92 b 150.0 29.00 ± 4.44 a 86.47 ± 2.76 c 200.0 9.60 ± 2.40 b 33.98 ± 1.06 d 250.0 1.20 ± 1.20 b 5.38 ± 5.38 d 说明:数据均为平均值±标准误;同列不同字母表示0.05水平差异显著 Table 3. Effect of sucrose on pollen germination and pollen tube growth of H. myrtifolia
-
由图 1可见:柱头平面为椭圆形,中部明显凹陷,辐射对称,表面密布不规则突起,柱头直径为425.78~546.93 μm,表面突起高度为24.42~29.13 μm;花粉以多粒形式存在,赤道面观为椭圆形,两端钝尖,近极面和远极面相同,三裂圆形,花粉表面平滑,密布细孔,极轴长为23.15~26.74 μm,赤道轴长为18.02~20.03 μm,花粉较小。
-
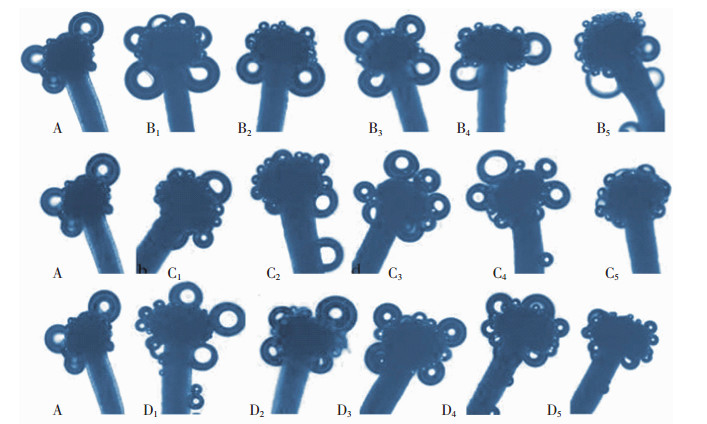
由图 2显示:对照柱头气泡明显低于6-BA浸泡处理后的柱头;不同质量浓度6-BA浸泡12 h后,柱头周边气泡数量增多,当6-BA质量浓度为20.0 mg·L-1时,柱头气泡数量明显增多,此时柱头的可授性最好。100.0~400.0 mg·L-1 GA3处理的柱头相较于对照气泡增多,柱头可授性明显提高;当质量浓度达到600.0~800.0 mg·L-1 时,柱头气泡减少,甚至停止反应,气泡消失。200.0~400.0 mg·L-1GA3利于增强柱头的可授性。NAA浸泡处理后的柱头气泡数随着质量浓度增加呈现先升后降的趋势,NAA质量浓度为1.0 mg·L-1时柱头反应最为剧烈,气泡最多;1.0~10.0 mg·L-1范围内,柱头可授性增强;当NAA质量浓度大于10.0 mg·L-1时柱头反应减弱,可授性降低,20.0 mg·L-1 时,柱头反应较低。
-
由图 3可见:在自然条件下,黄薇在6:00左右花瓣展开,柱头已经直立且伸出,顶端呈嫩绿色;11:00-12:30柱头开始产生黏液,开花6 h时柱头上已粘染大量花粉:开花24 h时柱头弯曲变褐色,柱头黏性消失;开花48 h时柱头彻底萎蔫,花瓣干枯掉落。开花1~8 h柱头可授性逐渐增强,在开花6~8 h时柱头可授性达到最强,随后下降,开花24 h的柱头基本不产生气泡。
2.1. 黄薇花粉萌发率观察
2.1.1. 温度对黄薇花粉萌发的影响
2.1.2. 硼酸质量浓度对黄薇花粉萌发的影响
2.1.3. 蔗糖质量浓度对黄薇花粉萌发的影响
2.2. 柱头与花粉的扫描电镜观察
2.3. 柱头荧光显微镜观察
2.3.1. 植物生长调节剂对黄薇柱头可授性的影响
2.3.2. 自然条件下黄薇柱头可授性的动态变化
-
花粉保持活力时间的长短,同时受到遗传基因和环境因素的影响[11],温度过高或过低,均会对花粉萌发生长产生影响。本研究表明:黄薇花粉在15~35 ℃条件下,花粉萌发及生长良好,10与40 ℃时花粉萌发及生长受到抑制,这与桃Prunus persica[12]和玉米Zea mays[13]中观察到的现象一致。多重因素对花粉的离体萌发产生影响,其中蔗糖和硼酸是花粉萌发的重要因素。本研究表明:促进黄薇花粉萌发生长硼酸适宜质量浓度为0.5~1.0 mg·L-1,蔗糖适宜质量浓度为50.0~150.0 mg·L-1,这与四季报春Primula obconica花粉一致[14]。柱头可授期是植物花正常成熟的重要时期,对花传粉率及受精过程起着重要的作用[15-16],不同植物的柱头可授期长短差异较大,即使种内不同品种的植物柱头可授期也有较大差异。通过外源植物生长调节剂可有效提高柱头可授性或促进柱头增长。本研究表明:黄薇柱头在开花48 h时柱头彻底萎蔫,花瓣干枯掉落,失去可授性。通过6-BA、GA3和NAA等3种植物生长调节剂处理能够有效提高黄薇柱头可授性,20.0 mg·L-16-BA,200.0~400.0 mg·L-1GA3及10.0 mg·L-1NAA处理都可显著提高黄薇柱头可授性。在杂交育种中花粉的结构、大小对杂交授粉受精成功与否有着重要关系,花粉粒与柱头的结构性差异会直接造成杂交不亲和问题[17-18]。本研究表明:黄薇花粉的赤道轴、极轴长均小于30 μm,属于小型花粉,如与其他属植物进行远缘杂交时,应选择黄薇作为父本,并且尽量选取花型较小,柱头较短的植物与黄薇进行杂交,从而提高杂交成功率。













 DownLoad:
DownLoad: