-
植物繁育系统是指直接影响后代遗传组成的所有有性特征,包括花部特征、开放式样、花各性器官寿命长短,自交亲和程度与交配系统等[1]。作为植物重要的繁殖器官,花内部器官发育和外部形态特征与植物的传粉效率、交配方式密不可分。因此,系统研究植物的花部特征和繁育系统有助于理解其繁殖过程限制因子的生态效应,对生物多样性保育具有重要价值[2]。
长柱紫茎Stewartia rostrata为山茶科Theaceae紫茎属Stewartia的落叶灌木或小乔木,主要分布于浙江西北部、安徽南部及西部、江西北部及湖南东部,地理分布较为狭窄。花白繁茂,花瓣多带有形状、颜色不一的红斑,树干造型多样;集中开花,观赏价值极高,在园林绿地应用潜力巨大。近年来,由于人类干扰频繁和自然环境恶化,长柱紫茎的野外生存受到极大的威胁,迫切需要开展保育生物学系列研究。实地调查发现:尽管盛花期花量极大,但长柱紫茎群落下层幼苗稀少,天然更新不良,与同属的濒危植物紫茎Stewartia sinensis衰退型种群结构类似[3−4]。紫茎属木本植物幼苗幼树稀少,其原因可能涉及群落环境(如植物间竞争排斥关系、植物与传粉昆虫关系)与非生物环境(如阴雨天气的出现)的限制作用、种子发芽受阻、花部特征与繁育系统影响传粉过程造成种子发育质量不良等。已有研究表明[5]:紫茎的种子发芽率无论是实验室还是圃地最高仅为10%,甚至为0。长柱紫茎和紫茎在同属中亲缘关系最为接近,形态特征、生物学特性有许多相近之处,推测此2个种的繁育过程受阻有相似之处。
目前,紫茎属已有研究集中于群落结构[4]、繁殖技术[5]、种子发芽[6]、植物种分类[7]及系统发育[8]等方面,未发现有关紫茎属特别是长柱紫茎花部特征、传粉过程的限制因素、繁育系统所属类型等的报道。繁育系统类型是否对长柱紫茎结实率和种子败育产生影响,其衰退型种群结构是否与其繁育系统类型有关,生境自然条件变化是否影响传粉昆虫的行为,从而影响繁殖成功率;这些都是当前亟待深入研究的科学问题。为此,本研究以长柱紫茎为材料,通过观察(测)长柱紫茎花部特征和昆虫访花特性、测定花粉活力和柱头可授性、测算杂交指数和花粉胚珠比等,深入揭示其繁殖过程限制因素的影响,为紫茎属种群更新、人工扩繁及园林推广应用提供科学依据,为紫茎属的濒危植物致濒机制研究提供思路。
-
研究地浙江农林大学东湖校区(30°15′28″N,119°43′35″E)海拔101.3 m,属于中亚热带季风气候,四季分明,年平均气温为16.1 ℃,全年降水量为1 628.6 mm,年降水日为154 d,无霜期为236 d。研究地周边地带性植被为亚热带常绿阔叶林。选择3 a生长柱紫茎为材料,株高为2.5~3.0 m。研究时间为2021年4—6月。
-
于花蕾期随机选取30朵花挂牌标记,每天16:00观察直至单花开放;开花当天及开花第2天8:00—18:00连续观察,每隔2 h定点观测1次并拍照,之后每天观测1次。观察花的开花动态,记录单花结构、花朵大小和形状、雄雌蕊位置形态变化、花瓣颜色、苞片颜色、萼片颜色、花药开裂时间等,直至花部萎蔫[9]。
-
于盛花期,在15株植株上随机选取30朵发育良好的花,测定花部结构参数,记录花冠直径、苞片长宽、花瓣长宽、萼片长宽、子房直径及长度等数据。
-
随机采集当天开放花朵的花粉,设置5种蔗糖质量浓度(0、5、10、15、20 g·L−1)处理,于25 ℃下培养6 h后观察并统计花粉萌发率。
-
随机采集当天开放花朵的花粉,分别采用2,3,5-氯化三苯基四氮唑(TTC)染色法、碘-碘化钾(I2-KI)染色法,筛选最适蔗糖质量浓度培养6 h后测定花粉活力,以加热致死的花粉作对照,每个处理3次重复。在光学显微镜下随机选取3个视野统计着色花粉数,每个视野花粉数不少于100粒[10]。
-
选取开放前1 d至开放后第3天的花朵,每个阶段选取10朵,测定最适蔗糖质量浓度培养下的花粉活力,以加热致死的花粉为对照。在光学显微镜下观察统计花粉萌发率,每视野内花粉数不少于100粒。
-
随机选取开放前1 d至开放后7 d的花朵,将柱头放在凹面载玻片上,完全浸泡于质量分数3%的过氧化氢(H2O2)溶液中,30 min后在体式显微镜下观察,若有气泡产生则表明柱头有活性,反之则无[11]。
-
随机选取不同植株的20朵即将开放的花蕾,记录每朵花的雄蕊数。随机选取1个花药,用解剖针将花药捣碎,蒸馏水定容至1 mL,吸取1 µL液体在光学显微镜下统计花粉数量;每朵花选取3个花药,重复3次,取平均数乘雄蕊数再乘1 000得出单花花粉量。解剖相对应的子房,统计胚珠数[12]。根据CRUDEN[13]标准,计算花粉胚珠比(单花花粉总数/单花胚珠数,P/O);并由此判断长柱紫茎繁育系统类型。
-
按照DAFNI[14]标准,通过杂交指数(OCI)评判繁育系统类型。用游标卡尺测定花冠直径;观察记录花药开裂时间与柱头可授期,雌雄蕊是否同时成熟;记录花药与柱头之间的相对空间关系。
-
随机选择5株长柱紫茎,于晴天9:00—17:00连续观察访花昆虫。每株长柱紫茎选择10朵花,每2 h观察1次,每天观察5次,记录访花昆虫的种类和访花时间[15]。
-
长柱紫茎居群花期为5月初至5月中下旬,约17 d (2021年5月1—17日),单花花期2 d。5月1日该居群的第1朵花开放,5月8日单日开花最多,占总开花数的15%,达到盛花期,5月13日进入末花期。
长柱紫茎单花开放过程分为花蕾期(苞片、萼片包裹花蕾)、初展期(花药、柱头显露)、盛放期(花瓣平展)、凋落期(花瓣枯萎)及坐果期(子房膨大结实) 5个过程(图1)。具体的,①花蕾期(图1A和B),苞片、萼片呈绿色,紧紧包裹花蕾。临近开放时,绿色的苞片和萼片从基部向边缘转为紫红色,同时向外伸展,逐渐显现出花苞。花苞顶部受光影响,呈现红斑。②初展期(图1C),单花花瓣展开,花药和柱头显露,弯曲的花丝慢慢伸展高出柱头。③盛放期(图1D),花瓣完全平展,雄蕊高于柱头伸展,柱头反向弯曲,呈5裂。④凋落期(图1E和F),花瓣枯萎、脱落,开放24~32 h后,花药逐渐由橘黄色变为淡棕色,花冠极易掉落,柱头萎蔫,萼片和苞片逐渐收缩,花朵直径变小。⑤坐果期(图1G和H),子房膨大,萼片和苞片再逐渐展开,由红色转为绿色,果实由绿色转为棕色,逐渐木质化。
-
长柱紫茎的平均单花直径为(50.2±11.7) mm (表1),花瓣5枚,白色,边缘裂状,有1~3枚花瓣带红斑(图1K);每花具1对叶状苞片(图1J-1),披针叶形,开花时基部由绿色转为紫红色;萼片5枚(图1J-2);雄蕊50~84枚,长17~19 mm,花丝黄色呈线形,基部连合成短管,花丝的连合处不及花丝长度的1/3(图1J-4),花药橘黄色,干后变为淡棕色;雌蕊1枚,长14~16 mm,柱头呈5裂(图1J-5),花朵盛开时花丝高于柱头;子房5室,每室4枚胚珠,稀2~3枚,中轴胎座。
表 1 长柱紫茎的花部形态特征
Table 1. Flower characteristics of S. rostrata
花器官 平均值±标准误 花器官 平均值±标准误 花器官 平均值±标准误 花梗长/mm 5.2±1.4 萼片宽/mm 8.8±2.2 带斑的花瓣宽/mm 19.6±2.9 花冠直径/mm 50.2±11.7 花瓣数/枚 5±0 雄蕊数/枚 64.9±11.8 苞片数/片 2±0 花瓣长/mm 28.5±3.7 雄蕊长/mm 17.5±1.5 苞片长/mm 15.5±4.2 花瓣宽/mm 20.0±3.1 胚珠数/枚 18.6±2.4 苞片宽/mm 9.4±2.4 花斑长/mm 8.9±2.8 雌蕊长度/mm 14.2±1.1 萼片数/枚 5±0 花斑宽/mm 8.2±2.7 子房直径/mm 5.0±0.7 萼片长/mm 15.2±3.3 带斑的花瓣长/mm 20.2±5.7 子房长/mm 3.7±0.5 -
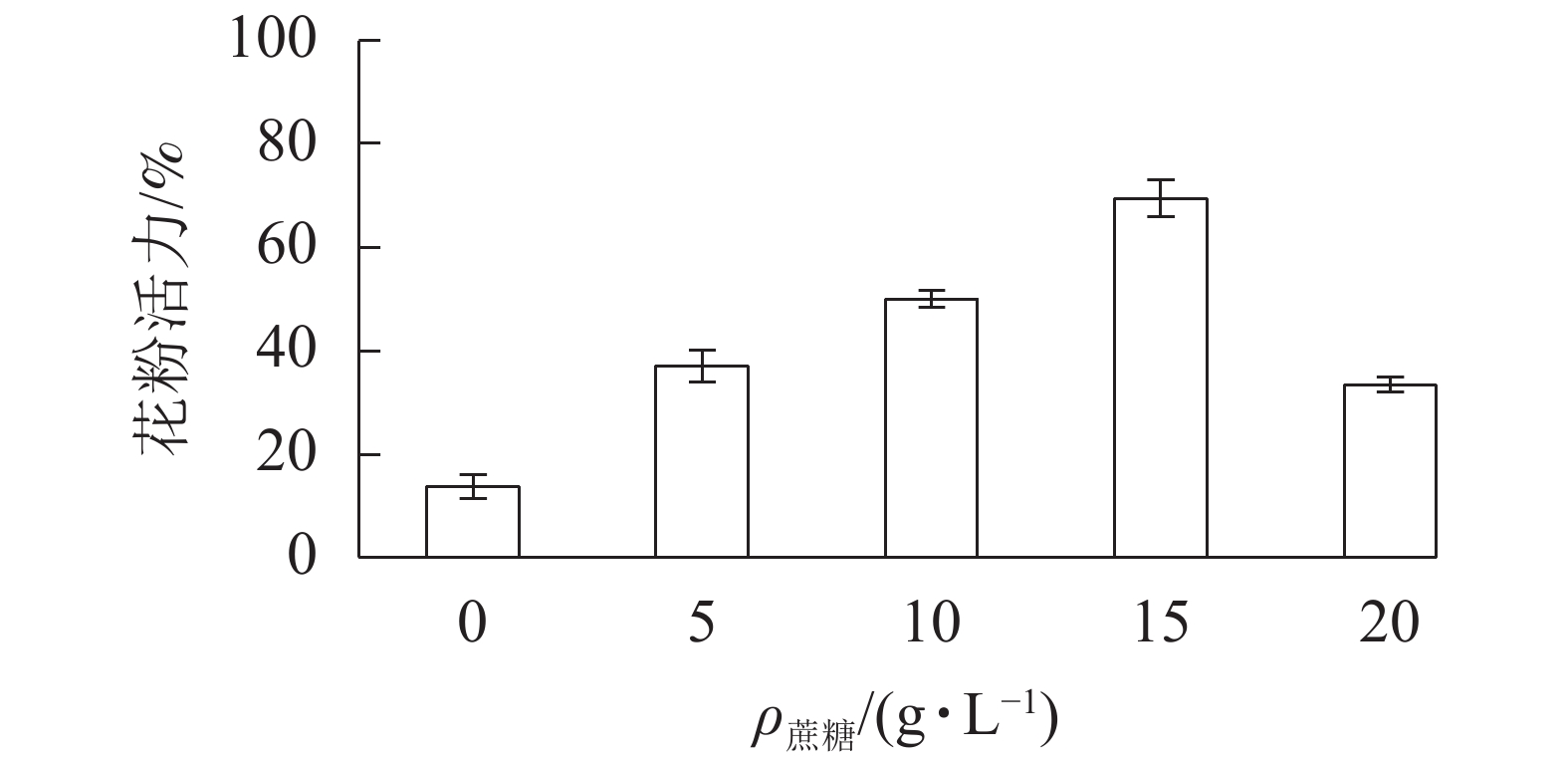
在无蔗糖培养基下,长柱紫茎花粉萌发率仅为13.7%;随着培养基蔗糖质量浓度的增加,花粉萌发率增大,在15 g·L−1出现峰值,为69.3%。当蔗糖质量浓度为20 g·L−1时,花粉萌发率降至33.3%。因此,15 g·L−1的蔗糖培养基为最适培养基(图2)。
-
采用I2-KI染色,活力较强的花粉会呈现蓝黑色,但在操作时,易混入杂质,视野中观察到的蓝黑色不够明显,不利于计数。采用TTC染色,有活力的花粉会呈现红色;但观察到大部分花粉未变红,说明TTC染色不利于测定长柱紫茎的花粉活力。因此,TTC染色法和I2-KI染色法均不适合长柱紫茎花粉活力的测定。实际研究中,与TTC染色法和I2-KI染色法相比,花粉离体培养下,花粉会萌发较长的花粉管,更有利于观察。
-
采用15g·L−1的蔗糖培养基培养花粉,由图3可知:开放前1 d,花粉萌发率较高,为49.3%,开花当天花粉活力最高,为65.0%。之后花粉活力逐渐下降,到第3天,已降至11.7%。
-
由图4可知:开放前1 d长柱紫茎花药尚未开裂,柱头合拢,呈白色,可授性弱。开放1~2 d,柱头逐渐张开,具有较强可授性,之后可授性逐渐增强。到第3天柱头开始萎蔫,由白色转变为棕黄色,可授性强。在开放的第4天,柱头完全展开,向外反卷呈5裂,呈棕黄色、萎蔫皱巴的状态,此时花粉活性最强。之后,柱头可授性逐渐下降,到第7天,柱头基本失去可授性。
-
根据统计结果,长柱紫茎花粉数为(1 618 666.7±254 775.4)粒,胚珠数为(18.6±2.4)枚,花粉/胚珠比(P/O)为2 108.0~195 525.0,平均为87 025.1。依照CRUDEN的标准,判断长柱紫茎的繁育系统属于专性异交。
-
依照DAFNI的评判标准,测算长柱紫茎的杂交指数。长柱紫茎成熟花朵的花冠直径平均为50.24 mm,大于6 mm,记为3。雌雄蕊在成熟时间上一致,记为0;在花蕾期,长柱紫茎的柱头高于雄蕊,当花朵完全盛开时,雄蕊高于雌蕊,柱头和花药存在空间分离,记为1。因此,OCI结果为4,说明长柱紫茎的繁育类型属于以异交为主,需要传粉者,部分自交亲和。
-
长柱紫茎上观察到的访花昆虫有熊蜂Bombus sp.、中华蜜蜂Apis cerana、黑带食蚜蝇Episyrphus balteatus、叶甲Chrysomelidae和日本弓背蚁Camponotus japonicus等,有效传粉者主要为熊蜂,其他种类出现频率低或进行无效传粉(图5)。长柱紫茎的开花高峰为7:00—11:00,昆虫的访花时间也集中在这段时间。黑带食蚜蝇在同一朵花上同一部位停留超过20 s,舔食花蜜,但数量较少,传粉作用不佳(图5A)。熊蜂单次访花时间为2~5 s,访花频率很高,在较短时间内频繁地在多朵花间逗留。访花时喜欢头部向下,整个身体钻入花冠筒,身上的绒毛黏附花粉量大,与柱头接触面积大,可有效传粉(图5B)。中华蜜蜂与熊蜂行为相似,但出现频率不及熊蜂,且体积小,能够黏附到的花粉少(图5C)。叶甲外壳光滑,花粉难以黏附。偶见1只在花冠上停留较长时间,与柱头未进行有效接触,传粉贡献小(图5D)。日本弓背蚁的足部和腹部会黏附花粉,徘徊逗留,偶尔实现有效传粉(图5E)。
-
花部特征包含花部构成(结构、颜色、气味等)和开放式样(开花数目、大小及类型等),因此可以从花部特征、开放式样解析植物与传粉者的生态依存关系。植物为了与传粉者的行为习惯相适应而使其花部形态结构、颜色等逐步进化[16]。对于蜂类,白色和黄色是可见花色。长柱紫茎花冠白色,平均直径达(50.2±11.7) mm,花丝黄色,颜色耀眼,同时平展的花冠为传粉昆虫提供停靠点,符合蜂媒花特征,此类花部特征与四川牡丹Paeonia decomposita一致[17]。同一物种内不同个体或居群间花色差异即花色多态性,传粉者的偏好因为花色差异造成访花频率的差异[18]。长柱紫茎的白色花瓣上常出现红色,推测是为适应单一的传粉媒介而进化出的特征,以便增加对其他类昆虫的吸引力,从而提高传粉效率[19]。
在强大的选择压力下,很多植物形成了“大量、集中开放”的开花模式,有利于吸引访花昆虫在短时间大量、密集表达访花行为,从而增加传粉机会[20]。长柱紫茎花期为5—6月,属于浙江的梅雨季节,阴雨天气极大地减少了传粉昆虫的活动。长柱紫茎集中开花,持续开花时间短,日均开花数量多,有利于提高繁殖成功率。此开花式样呈现的特征与山茶科Theaceae濒危植物金花茶Camellia nitidissima的研究结果一致[21]。长柱紫茎的有效传粉者主要为熊蜂,在阴雨天气熊蜂频繁地在同一植株上访花,且开花植株又少,原生境植株间相距较远,不利于花粉在植株间传播,结果增加同株异花授粉的可能性,降低接受花粉的质量,从而影响长柱紫茎的结实率。
-
参照CRUDEN[13]所述标准,长柱紫茎的繁育系统为专性异交。长柱紫茎P/O极高,达87 025.1,意味着长柱紫茎更加趋向于远交;但根据DAFNI[14]的标准,长柱紫茎OCI为4,判断其繁育系统为异交为主,部分自交亲和,需要传粉者。长柱紫茎开花后雄蕊逐渐伸长,最后花药高于柱头,且花蕾期有花药散粉现象,因此长柱紫茎的花部特征增加了自花授粉的可能性。在自然界中,绝大部分被子植物倾向于自交与异交结合的混合交配模式,只有极少数利用单一交配模式完成授粉[22]。综合得出:长柱紫茎的繁育系统属于倾向于异交的混合交配系统,当其异株(异花)授粉受阻时,可表现为自交亲和,自交是长柱紫茎适应长期阴雨环境的繁殖保障策略,此种混合交配系统与流苏树Chionanthus retusus相似[23]。
有效的传粉过程包含大量有活力的花粉、可授期的柱头及有效传粉媒介[24]三大要素。长柱紫茎平均雄蕊数为(64.9±11.8)枚,单花平均花粉量多达(1 618 666.7±254 775.4)粒,为传粉昆虫提供丰厚的报酬,且花粉黏附力强,易被传粉昆虫携带,为异交授粉提供了充足的物质保障,故花粉数量不是其繁殖受限的原因。柱头可授期长,达7 d,在第3和第4天达到最强活力,为实施人工授粉的最佳时期。柱头5裂增加传粉表面积和柱头可授期长为异花授粉提供了基本保障,有利于提高传粉效率和结实率,此现象与陈雄伟等[25]观测紫背天葵Begonia fimbristipula的结果一致。当天开花的花朵保持最强活力(65.0%),随着开花时间增加,花粉活力显著下降,到第2天仅38.3%,第3天降至11.7%。观察发现长柱紫茎大多数花朵寿命很短,开花损失率高,花粉强活力和较强柱头可授性仅1 d的相遇期,严重影响花朵的传粉效率。无论授粉与否,长柱紫茎在开花24~32 h后,花冠和雄蕊都存在易脱落的现象,脱落后花粉迅速失活,大大减少了受精的可能性[26]。推测已授粉花朵脱落可能与营养资源限制有关,减少繁殖成本[27];未授粉花朵可能通过短寿命减小花展示程度,从而减少同株异花传粉的概率[28]。
P/O是衡量植物对雄性资源分配量的指标[29],高P/O值可能是对传粉效率低造成柱头接受的花粉量少、质量低的补偿[30],多样化的传粉媒介有利于提高授粉成功率。长柱紫茎授粉受限可能与传粉者的种类、数量有关。长柱紫茎的主要传粉昆虫熊蜂,飞行距离远,访花频率高,多朵花之间穿梭,携带花粉量大,有效地进行异花传粉,但其他昆虫传粉效率较低,有效传粉媒介单一。长柱紫茎花粉离开花朵后迅速失活,不利于传粉昆虫远距离完成植株之间的传粉,因此居群间的基因不能充分交流[31]。
-
综上所述,长柱紫茎花冠白色和花丝黄色,与蜂类传粉特性相适应,为典型蜂媒花;传粉受阴雨天气影响,集中开花模式是对恶劣天气的有效适应,但传粉昆虫单一。开花24~32 h,花冠和雄蕊都极易脱落从而导致花粉迅速失活。以上因素限制了长柱紫茎的繁殖。集中开花模式、花粉量大、柱头5裂及可授期长等花部特征是长柱紫茎维持繁殖成功的基本保障。长柱紫茎繁育系统属于以异交为主,需要传粉者,当其授粉受阻时,可表现为自交亲和,自交是长柱紫茎适应长期阴雨天气的繁殖策略。
Floral syndrome and breeding system of Stewartia rostrata
-
摘要:
目的 研究长柱紫茎Stewartia rostrata的花部特征和繁育系统,为紫茎属Stewartia种群更新、人工扩繁及园林推广应用提供科学依据。 方法 以3年生长柱紫茎为材料,观察(测)长柱紫茎的花部特征和昆虫访花特性,测定花粉活力和柱头可授性,测算杂交指数和花粉胚珠比,分析其传粉生物学及繁育系统特征。 结果 ①长柱紫茎居群花期为5月初至5月中下旬,约17 d,单花花期约2 d。②花粉活力开放当天最强,单花开花24~32 h,花冠和雄蕊易脱落,脱落后花粉极易失去活力。③开花前柱头已具有可授性,可授期达7 d,花粉强活力与柱头强可授性具1~2 d的相遇期。④花蕾期柱头高于花药,开花后花药高于柱头;无论开花前后,雄蕊与雌蕊均具有一定的空间分离。⑤长柱紫茎杂交指数为4,花粉胚珠比为2 108.0~195 525.0,繁育系统以异交为主,需要传粉者,部分自交亲和。⑥传粉昆虫以熊蜂Bombus sp.为主。 结论 长柱紫茎花粉寿命短,传粉昆虫单一,传粉易受阴雨天气影响,繁殖过程有较大限制;集中开花模式、花粉量大、柱头5裂及可授期长等花部特征是保障繁殖成功的基本表现。图5表1参31 Abstract:Objective The objective is to study the floral syndrome and breeding system of Stewartia rostrata, so as to provide a scientific basis for its population renewal, artificial reproduction and garden popularization and application. Method Taking 3-year-old S. rostrata as material, the characteristics of pollination biology and breeding system were observed and analyzed by observing the floral syndrome and insect visiting characteristics, measuring the pollen viability and stigma acceptability, and calculating the hybridization index (OCI) and pollen-ovule ratio (P/O). Result (1) The flowering period of the population was about 17 days from early May to mid and late May, and the single flowering period was about 2 days. (2) The pollen vitality reached the highest on the day of opening, and the single flower bloomed for 24−32 h , the corolla and stamens were easy to fall off, and the pollen was easy to lose vitality after falling off. (3) The stigma was receptive before flowering, lasting for 7 days. The strong pollen vitality and stigma receptivity had a meeting period of 1−2 days. (4) Stigma was higher than anther in bud stage, and anther was higher than stigma after flowering. Both before and after flowering, stamens and pistils had a certain spatial separation. (5) The OCl of S. rostrata was 4 and P/O was 2 108.0−195 525.0. The breeding system was mainly outcrossing and some self compatibility was required for pollination. (6) Bombus sp. was the main pollinator. Conclusion S. rostrata has short pollen life, single pollinating insect, and pollination is easily affected by cloudy and rainy weather, so the reproductive process is greatly limited. The floral syndromes such as centralized flowering mode, large amount of pollen, 5-lobed stigma and long receptive period are the basic manifestations of reproductive success. [Ch, 5 fig. 1 tab. 31 ref.] -
Key words:
- Stewartia rostrata /
- breeding system /
- floral syndrome /
- pollen vitality /
- stigma receptivity
-
表 1 长柱紫茎的花部形态特征
Table 1. Flower characteristics of S. rostrata
花器官 平均值±标准误 花器官 平均值±标准误 花器官 平均值±标准误 花梗长/mm 5.2±1.4 萼片宽/mm 8.8±2.2 带斑的花瓣宽/mm 19.6±2.9 花冠直径/mm 50.2±11.7 花瓣数/枚 5±0 雄蕊数/枚 64.9±11.8 苞片数/片 2±0 花瓣长/mm 28.5±3.7 雄蕊长/mm 17.5±1.5 苞片长/mm 15.5±4.2 花瓣宽/mm 20.0±3.1 胚珠数/枚 18.6±2.4 苞片宽/mm 9.4±2.4 花斑长/mm 8.9±2.8 雌蕊长度/mm 14.2±1.1 萼片数/枚 5±0 花斑宽/mm 8.2±2.7 子房直径/mm 5.0±0.7 萼片长/mm 15.2±3.3 带斑的花瓣长/mm 20.2±5.7 子房长/mm 3.7±0.5 -
[1] 何亚平, 刘建全. 植物繁育系统研究的最新进展和评述[J]. 植物生态学报, 2003, 27(2): 151 − 163. HE Yaping, LIU Jianquan. A review on recent advances in the studies of plant breeding system [J]. Acta Phytoecol Sin, 2003, 27(2): 151 − 163. [2] 王洁, 杨志玲, 杨旭. 濒危植物繁育系统研究进展[J]. 西北农林科技大学学报(自然科学版), 2011, 39(9): 207 − 213. WANG Jie, YANG Zhiling, YANG Xu. Advances in the studies of endangered plants’ breeding system [J]. J Northwest A&F Univ Nat Sci Ed, 2011, 39(9): 207 − 213. [3] 傅立国. 中国植物红皮书[M]. 北京: 科学出版社, 1992. FU Liguo. China Plant Red Data Book [M]. Beijing: Science Press, 1992. [4] 钱海源, 唐战胜, 余建平, 等. 浙江古田山珍稀植物紫茎群落的组成与结构特征[J]. 贵州农业科学, 2019, 47(1): 152 − 157. QIAN Haiyuan, TANG Zhansheng, YU Jianping, et al. Commuity composition and structual feature of Stewartia sinensis, a rare and endangered plant species, in Gutian Mountain, Zhejiang [J]. Guizhou Agric Sci, 2019, 47(1): 152 − 157. [5] 左艺芳. 紫茎繁殖技术体系的研究[D]. 合肥: 安徽农业大学, 2007. ZUO Yifang. Studied the Propagated System of Stewartia sinensis [D]. Hefei: Anhui Agricultural University, 2007. [6] 吴泽群. 珍稀濒危植物紫茎Stewartia sinensis的种子生理特性和光合生理特性研究[D]. 杭州: 浙江农林大学, 2019. WU Zequan. Study on the Seed Physiological Characteristics and Photosynthetic Physiological Characteristics of Rare and Endangered Species Stewartia sinensis [D]. Hangzhou: Zhejiang A&F University, 2019. [7] 李捷. 山茶科紫茎属和舟柄茶属的系统学研究[J]. 植物分类学报, 1996, 34(1): 48 − 67. LI Jie. A systematic study on the genera Stewartia and Hartia (Theaceae) [J]. Acta Phytotaxonomica Sin, 1996, 34(1): 48 − 67. [8] 李密密. 山茶科及紫茎属的系统发育和生物地理研究[D]. 杭州: 浙江大学, 2011. LI Mimi. Phylogenetic and Biogeographic Studies of Theaceae with a Special Reference to Stewartia [D]. Hangzhou: Zhejiang University, 2011. [9] 万海霞, 邓洪平, 何平, 等. 濒危植物丰都车前的繁育系统与传粉生物学研究[J]. 生态学报, 2018, 38(11): 4018 − 4026. WAN Haixia, DENG Hongping, HE Ping, et al. Breeding system and pollination biology of endangered Plantago fengdouensis [J]. Acta Ecol Sin, 2018, 38(11): 4018 − 4026. [10] 孙忆, 李玺, 丁苏芹, 等. 小苍兰开花特性与繁育系统研究[J]. 园艺学报, 2018, 45(2): 299 − 308. SUN Yi, LI Xi, DING Suqin, et al. Studies on flowering characteristics and breeding system of Freesia hybrida [J]. Acta Hortic Sin, 2018, 45(2): 299 − 308. [11] 李帅杰, 蔡秀珍. 湖南报春苣苔的花部特征及其繁育系统研究[J]. 园艺学报, 2020, 47(3): 492 − 502. LI Shuaijie, CAI Xiuzhen. Studies on floral syndrome and breeding system of Primulina hunanensis [J]. Acta Hortic Sin, 2020, 47(3): 492 − 502. [12] 孙慧芳, 魏岩, 闫紫烟, 等. 紫花地丁花形态的季节转化对繁育系统及结实的影响[J]. 草业学报, 2020, 29(12): 198 − 204. SUN Huifang, WEI Yan, YAN Zhiyan, et al. Effect of seasonal transformation of flower morphology on reproduction of Viola philippica [J]. Acta Pratac Sin, 2020, 29(12): 198 − 204. [13] CRUDEN R W. Pollen-ovule ratios: a conservative indicator of breeding system in flowering plants [J]. Evolution, 1977, 31(1): 32 − 46. [14] DAFNI A. Pollination Ecology: a Practical Approach [M]. New York: Oxford University Press, 1992: 55 − 63. [15] 罗峰, 金晓玲, 李瑞雪, 等. 桂南木莲繁育系统及其传粉适应性[J]. 东北林业大学学报, 2018, 46(3): 45 − 49, 53. LUO Feng, JIN Xiaoling, LI Ruixue, et al. Breeding systems and adaptation of flowers in Manglietia chingi [J]. J Northeast For Univ, 2018, 46(3): 45 − 49, 53. [16] BARRIONUEVO C N, BENITEZ-VIEYRA S, SAZATORNIL F. Floral biology of Salvia stachydifolia, a species visited by bees and birds: connecting sexual phases, nectar dynamics and breeding system to visitors’ behaviour [J]. J Plant Ecol, 2021, 14(4): 580 − 590. [17] 杨勇, 骆劲涛, 张必芳, 等. 四川牡丹的花部特征和繁育系统研究[J]. 植物资源与环境学报, 2015, 24(4): 97 − 104. YANG Yong, LUO Jintao, ZHANG Bifang, et al. Studies on floral characteristics and breeding system of Paeonia decomposita [J]. J Plant Resour Environ, 2015, 24(4): 97 − 104. [18] 汤晓辛, 黄双全. 花色多样性与变异的研究进展[J]. 植物分类与资源学报, 2012, 34(3): 239 − 247. TANG Xiaoxin, HUANG Shuangquan. Research progress on diversity and variation in flower color [J]. Plant Diversity Resour, 2012, 34(3): 239 − 247. [19] LIAO Wanjin, HARDER L D. Consequences of multiple inflorescences and clonality for pollinator behavior and plant mating [J]. Am Nat, 2014, 184(5): 580 − 592. [20] 杨旭, 杨志玲, 王洁, 等. 濒危植物凹叶厚朴的花部综合特征和繁育系统[J]. 生态学杂志, 2012, 31(3): 551 − 556. YANG Xu, YANG Zhiling, WANG Jie, et al. Floral syndrome and breeding system of endangered species Magnolia officinalis subsp. biloba [J]. Chin J Ecol, 2012, 31(3): 551 − 556. [21] 柴胜丰, 韦霄, 蒋运生, 等. 濒危植物金花茶开花物候和生殖构件特征[J]. 热带亚热带植物学报, 2009, 17(1): 5 − 11. CHAI Shengfeng, WEI Xiao, JIANG Yunsheng, et al. The flowering phenology and characteristics of reproductive modules of endangered plant Camellia nitissima [J]. J Trop Subtrop Bot, 2009, 17(1): 5 − 11. [22] ZHANG Huihui, WU Huaiyan, ZHOU Qi, et al. Flowering characteristics and reproductive biology of Nymphaea hybrid, a precious water lily [J/OL]. Sci Hortic Vol, 2021, 287: 110268[2021-08-10]. doi: 10.1016/j.scienta.2021.110268. [23] 何艳霞, 孔令茜, 陈鹏臻, 等. 雄全异株流苏树的花部特征及繁育系统研究[J]. 生态学报, 2017, 37(24): 8467 − 8476. HE Yanxia, KONG Lingqian, CHEN Pengzhen, et al. Floral syndrome and reproductive strategy of an androdioecious species, Chionanthus retusus (Oleaceae) [J]. Acta Ecol Sin, 2017, 37(24): 8467 − 8476. [24] 黄双全, 郭友好. 传粉生物学的研究进展[J]. 科学通报, 2000, 45(16): 1441 − 1447. HUANG Shuangquan, GOU Youhao. New advances in pollination biology and the studies in China [J]. Chin Sci Bull, 2000, 45(16): 1441 − 1447. [25] 陈雄伟, 邵玲, 梁广坚, 等. 紫背天葵花部特征与繁育系统的研究[J]. 园艺学报, 2013, 40(2): 363 − 372. CHEN Xiongwei, SHAO Ling, LIANG Guangjian, et al. A study on floral syndrome and breeding system of Begonia fimbristipula Hance [J]. Acta Hortic Sin, 2013, 40(2): 363 − 372. [26] RATHCKE B J. Floral longevity and reproductive assurance: seasonal patterns and an experiment test with Kalmia latifolia (Ericaceae) [J]. Am J Bot, 2003, 90(9): 1328 − 1332. [27] 王玉贤, 侯盟, 谢言言, 等. 青藏高原高寒草甸植物花寿命与花吸引特征的关系及其对雌性繁殖成功的影响[J]. 植物生态学报, 2020, 44(9): 905 − 915. WANG Yuxian, HOU Meng, XIE Yanyan, et al. Relationships of flower longevity with attractiveness traits and their effects on female fitness of alpine meadow plants on the Qinghai-Xizang Plateau [J]. Chin J Plant Ecol, 2020, 44(9): 905 − 915. [28] 张志强, 李庆军. 花寿命的进化生态学意义[J]. 植物生态学报, 2009, 33(3): 598 − 606. ZHANG Zhiqiang, LI Qingjun. Review of evolutionary ecology of floral longevity [J]. Chin J Plant Ecol, 2009, 33(3): 598 − 606. [29] 李志成, 李进, 吕海英, 等. 艾比湖沙拐枣的花部特征与繁育系统[J]. 园艺学报, 2015, 42(5): 939 − 949. LI Zhicheng, LI Jin, LÜ Haiying, et al. Floral syndrome and breeding systems of Calligonum ebi-nuricum [J]. Acta Hortic Sin, 2015, 42(5): 939 − 949. [30] BERNARDELLO G, AGUILAR R, ANDERSON G J. The reproductive biology of Sophora fernandeziana (Leguminosae), a vulnerable endemic species from Isla Robinson Crusoe [J]. Am J Bot, 2004, 91(2): 198 − 206. [31] 苏志尧, 吴大荣, 陈北光. 广东山茶科稀有濒危植物的区系特点和保护评价[J]. 华南农业大学学报, 2000, 21(2): 34 − 37. SU Zhiyao, WU Darong, CHEN Beiguang. Floristic and conservational analysis of Guangdong’s rare and endangered theaceous plants [J]. J South China Agric Univ, 2000, 21(2): 34 − 37. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210563







 下载:
下载: