-
单叶铁线莲Clematis henryi为多年生常绿木质藤本,为毛茛科Ranunculaceae铁线莲属Clematis植物。铁线莲属植物种类丰富,全世界约300种,中国分布108种。该属植物多为藤本,兼具药用以及观赏价值,栽培品种多样,在西方园林中应用广泛,素有“藤本皇后”之美誉[1−2]。中国拥有丰富的铁线莲属植物资源,但绝大多数仍处于野生状态[3]。单叶铁线莲花为白色或淡黄色,聚伞花序,花量大,具芳香,花期为12月至翌年2月,有效填补了现有铁线莲品种冬季少花的空白,具有极大的开发利用潜力[4]。
光照对植物的生长和发育具有重要的作用,除了影响光合作用之外,也影响植物体内激素的产生和形态建成、生理特征、新陈代谢和基因表达调控等[5−6]。城市园林中的小环境光照强度变化多样,光照过强会灼伤植株叶片,破坏光系统,过低则降低植物的光合效率,影响植物生长和观赏效果[7]。研究表明:遮光条件下植株具有形态可塑性,植物可以通过调节体内保护酶活性和次生代谢物含量适应遮光环境,夏季适度遮光能够明显提高光合作用[8−9]。选择适宜的光照环境,对园林植物健康生长,以及生态价值、观赏价值的充分发挥起到决定性作用。现有铁线莲品种多为春秋季开花的喜阳类型,单叶铁线莲作为冬季开花且具有良好耐阴性的植株种类,可以满足林下栽培、室内观赏等多种景观需求,将有效扩大铁线莲品种的栽培应用范围。因单叶铁线莲药用价值高,前人对其研究多集中在药材性状、资源调查、药理作用等方面[10],而关于单叶铁线莲的园林应用和遮光对其生理特性影响的研究尚未见报道。本研究对不同遮光强度下单叶铁线莲幼苗的生长发育及生理特性进行研究,探讨其对不同遮光强度响应的生理机制,为单叶铁线莲在园林中的栽培应用提供依据。
-
研究在浙江农林大学东湖校区铁线莲种质资源圃中(30°13′19.2″N,119°22′33.6″E)进行。该区属亚热带湿润型季风气候,雨量充足且四季分明,年平均气温为13.0~21.0 ℃,年均降水量为1 427.0 mm,年均日照时数为1 939.0 h,无霜期为23.0 d。2022年3月2日选取60株长势良好、生长一致的3年生单叶铁线莲扦插植株移栽于上口径16.0 cm、下口径12.0 cm、高13.5 cm的容器中,单株定植,栽培基质[V(珍珠岩)∶V(泥炭土)=1∶1]一致。容器苗置于大棚内(遮光强度为73%),常规栽培及管理。研究区5、6、7月日均最高气温分别为26.0、33.0、36.0 ℃;正午最高光强分别为1 300 、1 550 、1 800 μmol·m−2·s−1。
-
2022年5月20日,从上述移栽的植株中选取生长健康,且长势一致的40株用于后续研究。共设5个遮光处理,遮光率分别为80% (T1)、60% (T2)、50% (T3)、40% (T4)和0 (ck),每个处理8株,植株间距为25 cm,防止相互遮挡,期间常规栽培管理。15 d后开始进行形态和光合生理指标的测定。
-
2022年6月5日开始,分别于遮光后的15 d (6月5日)、30 d (6月20日)和60 d (7月20日)共3次测量并记录每组单叶铁线莲的分蘖数、节数以及节间距,并取平均值,拍照记录叶片变化。7月30日,各处理分别取3株带回实验室,冲去根部泥土,60 ℃烘干至恒量,测定生物量。
-
2022年6月5日开始,每15 d测定1次,分别于遮光后的15 d (6月5日)、30 d (6月20日)、45 d (7月5日)和60 d (7月20日)共测定4次。可溶性蛋白(SP)采用考马斯亮蓝法测定[11];丙二醛(MDA)采用硫代巴比妥酸显色法测定[11];叶绿素采用乙醇浸提-分光光度法测定[11]。
-
采样时间同1.3.2。超氧化物歧化酶(SOD)活性采用南京建成科技有限公司的试剂盒测定,以每克组织在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位;过氧化物酶(POD)活性采用愈创木酚法测定[11];过氧化氢酶(CAT)活性采用苏州格锐思生物科技有限公司的试剂盒测定,以25 ℃下每克组织每分钟催化分解1 μmol过氧化氢为1个酶活单位。
-
所有数据均采用Excel 2010和Origin 2022进行整理和作图,利用SPSS 26.0进行方差分析和相关性分析。文中数据均为平均值±标准差。
-
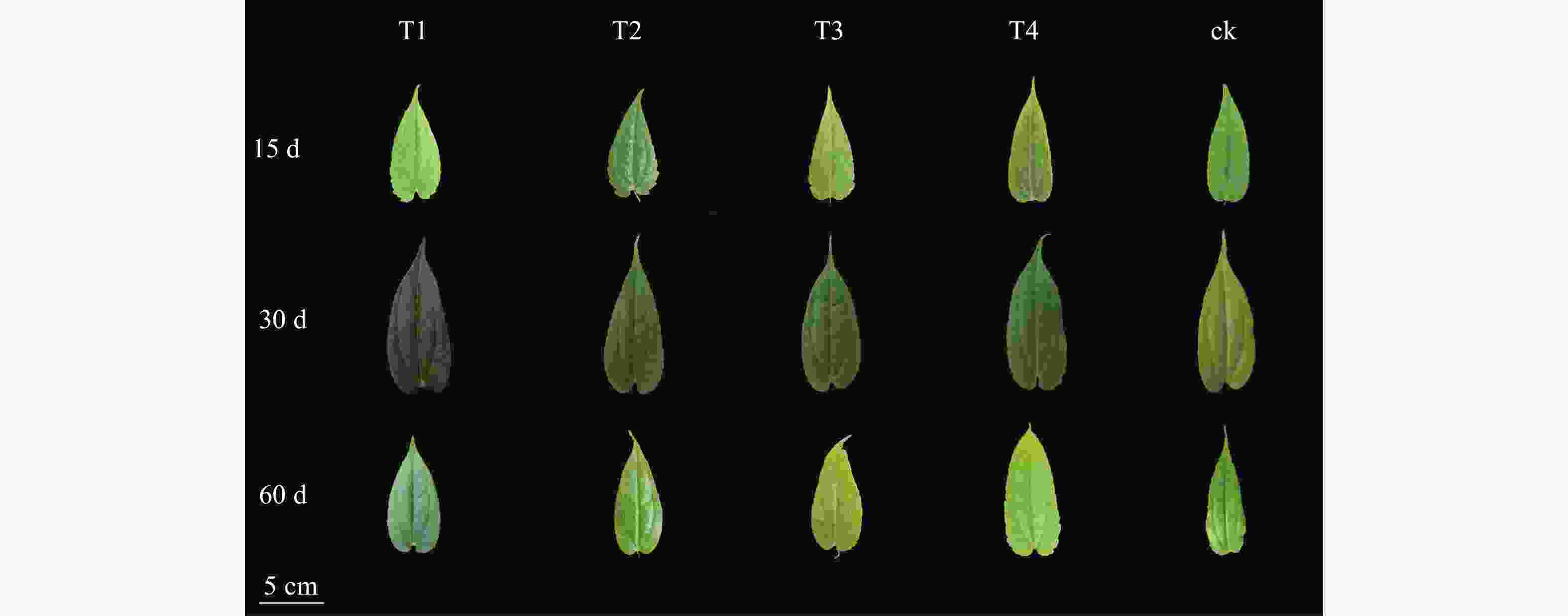
遮光处理30 d后单叶铁线莲叶片颜色均比对照颜色深,其中T1为浓绿色;处理60 d后,T3、T4处理组叶片发黄,对照叶片边缘及叶尖出现明显的皱缩和焦枯现象(图1)。表明遮光处理有利于叶片生长,高光强叠加高温会降低叶绿素的合成甚至使叶片受到损害。
方差分析(表1)显示:与对照相比,T1处理的分蘖数、节数总体平均增加了63.0%、24.3%,60 d时,T1、T2、T3处理的节间距分别高于对照29.8%、10.7%、36. 6%。随着时间的延长,植株分蘖数、节数和节间距均有增长,30 d时增幅最大,整体呈先快后慢的增长趋势。此外,不同遮光处理之间的植株生长也存在一定差异,如60 d时,T4处理的分蘖数最多(3.6个),T1处理的节数最多(13.6个),T3处理的节间距最大(17.9 cm)。可见,促进分蘖数、节数和节间距增加的最适宜光强存在差异。生物量测定结果显示:T2、T3处理的生物量显著高于其他处理(P<0.05),分别比对照高58.2%和61.7%(表2),表明50%~60%的遮光促进植株生长,高温、强光不利于植株干物质积累。
处理 分蘖数/个 节数/个 节间距/cm 15 d 30 d 60 d 15 d 30 d 60 d 15 d 30 d 60 d T1 2.10±0.10 a 3.00±0.10 a 3.20±0.16 AB 10.20±0.10 AB 13.00±0.10 A 13.60±0.16 a 16.00±0.10 A 16.80±0.10 A 17.00±0.16 B T2 1.75±0.04 a 2.50±0.85 ab 2.70±0.20 AB 8.20±0.04 B 10.00±0.85 B 12.10±0.20 ab 14.00±0.04 B 14.30±0.30 B 14.50±0.20 C T3 2.00±0.13 a 3.40±0.30 a 3.50±0.20 AB 10.20±0.13 AB 12.00±0.30 AB 12.30±0.20 ab 17.00±0.13 A 17.50±0.30 A 17.90±0.20 A T4 2.10±0.07 a 3.50±0.05 a 3.60±0.10 AB 10.30±0.07 AB 12.50±0.05 AB 13.00±0.10 a 13.00±0.07 B 14.00±0.05 BC 14.20±0.10 C ck 1.75±0.20 a 2.00±0.15 b 2.10±0.01 B 12.50±0.20 A 13.00±0.15 AB 13.00±0.01 a 13.00±0.20 B 13.10±0.15 C 13.10±0.01 D 说明:不同大写字母表示同一时间不同处理间差异极显著(P<0.01);不同小写字母表示同一时间不同处理间差异显著(P<0.05)。 Table 1. Effect of shading on tillers, number of nodes, and internode spacing of C. henryi
处理 生物量/g T1 35.0±3.1 b T2 40.5±2.0 a T3 41.4±1.7 a T4 33.2±2.4 b ck 25.6±1.3 c 说明:不同小写字母表示不同处理间差异显著(P<0.05)。 Table 2. Effects of shading on biomass of C. henryi
-
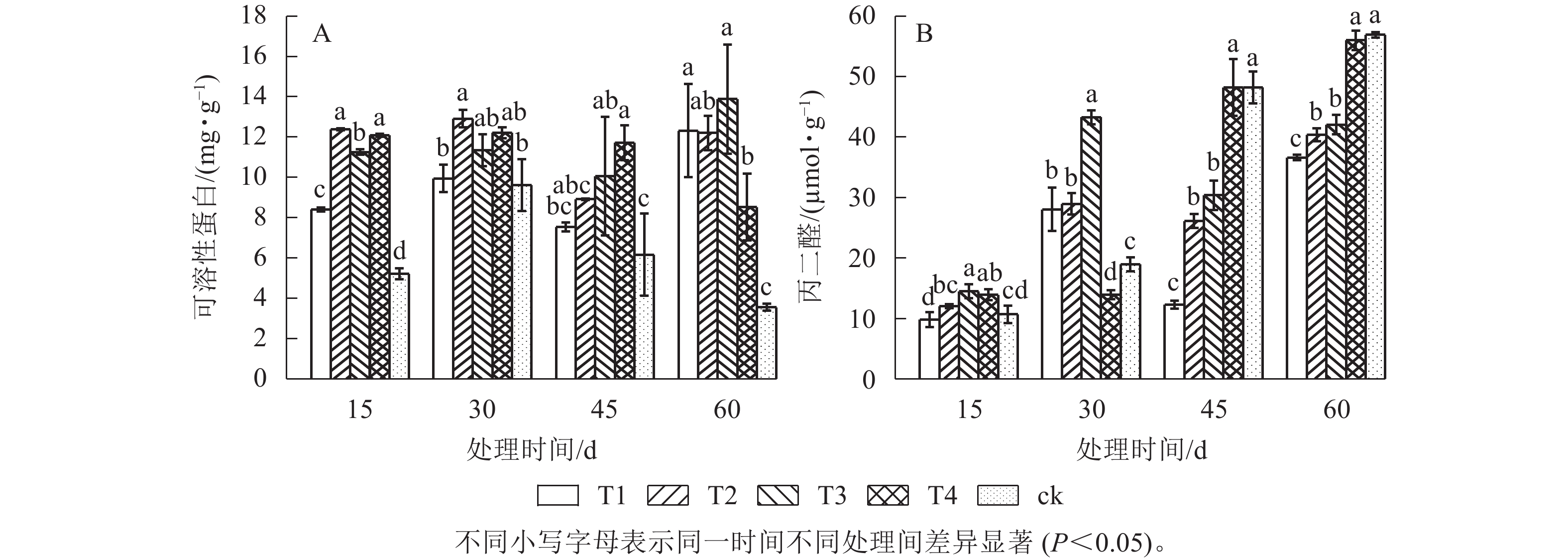
由图2可知:对照处理的可溶性蛋白(SP)最低,45和60 d时,T1处理的MDA质量摩尔浓度显著低于其他处理(P<0.05),遮光处理促进蛋白质合成的同时减少MDA的产生。随着处理时间的延长,除对照和T4处理外,SP质量分数呈升—降—升的变化趋势,对照处理的MDA质量摩尔浓度持续升高,60 d时达最大值(56.4 μmol·g−1),表明高温高光强胁迫下植物对于能量的固定能力下降,引发较强细胞膜脂过氧化作用。T3处理60 d时的SP质量分数高于30 d,而MDA质量摩尔浓度却分别低于T4、ck处理25.0%、26.6%,即适宜遮光度更有利于有机物积累,减少膜脂过氧化分解产物生成,膜系统更稳定。
从表3可见:遮光处理15 d时,T1处理的叶绿素a/b最高(4.37)。60 d时遮光组的各指标均高于对照,高温、强光胁迫降低了单叶铁线莲合成叶绿素的能力。除15 d以外,T1处理的叶绿素a、叶绿素b、叶绿素a+b均最高,并显著高于对照(P<0.05)。说明单叶铁线莲可以通过提高叶绿素质量浓度适应遮光环境,更大限度地捕捉光能。
处理
时间/d叶绿素a/(mg·L−1) 叶绿素b/(mg·L−1) T1 T2 T3 T4 ck T1 T2 T3 T4 ck 15 0.44±0.06 B 0.79±0.29 A 0.43±0.13 B 0.73±0.14 AB 0.67±0.06 AB 0.11±0.05 a 0.26±0.16 a 0.11±0.04 a 0.18±0.05 a 0.15±0.03 a 30 0.60±0.12 A 0.42±0.13 AB 0.62±0.00 A 0.34±0.11 B 0.29±0.09 B 0.23±0.03 A 0.13±0.06 BC 0.20±0.01 AB 0.07±0.06 C 0.07±0.05 C 45 1.54±0.16 A 0.66±0.09 B 0.29±0.04 D 0.48±0.06 C 0.24±0.02 C 0.73±0.08 A 0.38±0.04 B 0.24±0.02 CD 0.30±0.02 BC 0.22±0.01 D 60 0.62±0.10 A 0.42±0.05 B 0.28±0.01 C 0.42±0.03 B 0.15±0.03 D 0.23±0.03 A 0.13±0.02 B 0.14±0.08 AB 0.14±0.02 AB 0.13±0.02 B 处理
时间/d叶绿素a+b/(mg·L−1) 叶绿素a/b T1 T2 T3 T4 ck T1 T2 T3 T4 ck 15 0.55±0.10 B 1.05±0.35 A 0.54±0.16 B 0.91±0.17 AB 0.82±0.03 AB 4.37±1.30 a 3.82±1.93 a 3.98±0.87 a 4.17±1.08 a 4.68±1.15 a 30 0.83±0.15 A 0.56±0.18 AB 0.81±0.01 A 0.42±0.16 B 0.36±0.14 B 2.64±0.28 a 3.35±0.80 a 3.11±0.09 a 6.95±4.51 a 5.93±3.95 a 45 2.28±0.25 A 1.03±0.12 B 0.53±0.05 CD 0.78±0.07 BC 0.47±0.03 D 2.10±0.02 A 1.74±0.08 B 1.24±0.07 D 1.55±0.11 C 1.11±0.05 D 60 0.85±0.13 A 0.55±0.06 B 0.42±0.07 BC 0.56±0.03 B 0.28±0.06 C 2.74±0.06 A 3.73±0.25 A 4.24±2.46 A 3.05±0.36 A 1.24±0.17 B 说明:不同大写字母表示同一时间不同处理间差异极显著(P<0.01);不同小写字母表示同一时间不同处理间差异显著(P<0.05)。 Table 3. Comparison of different shading treatments on leaf chlorophyll content
-
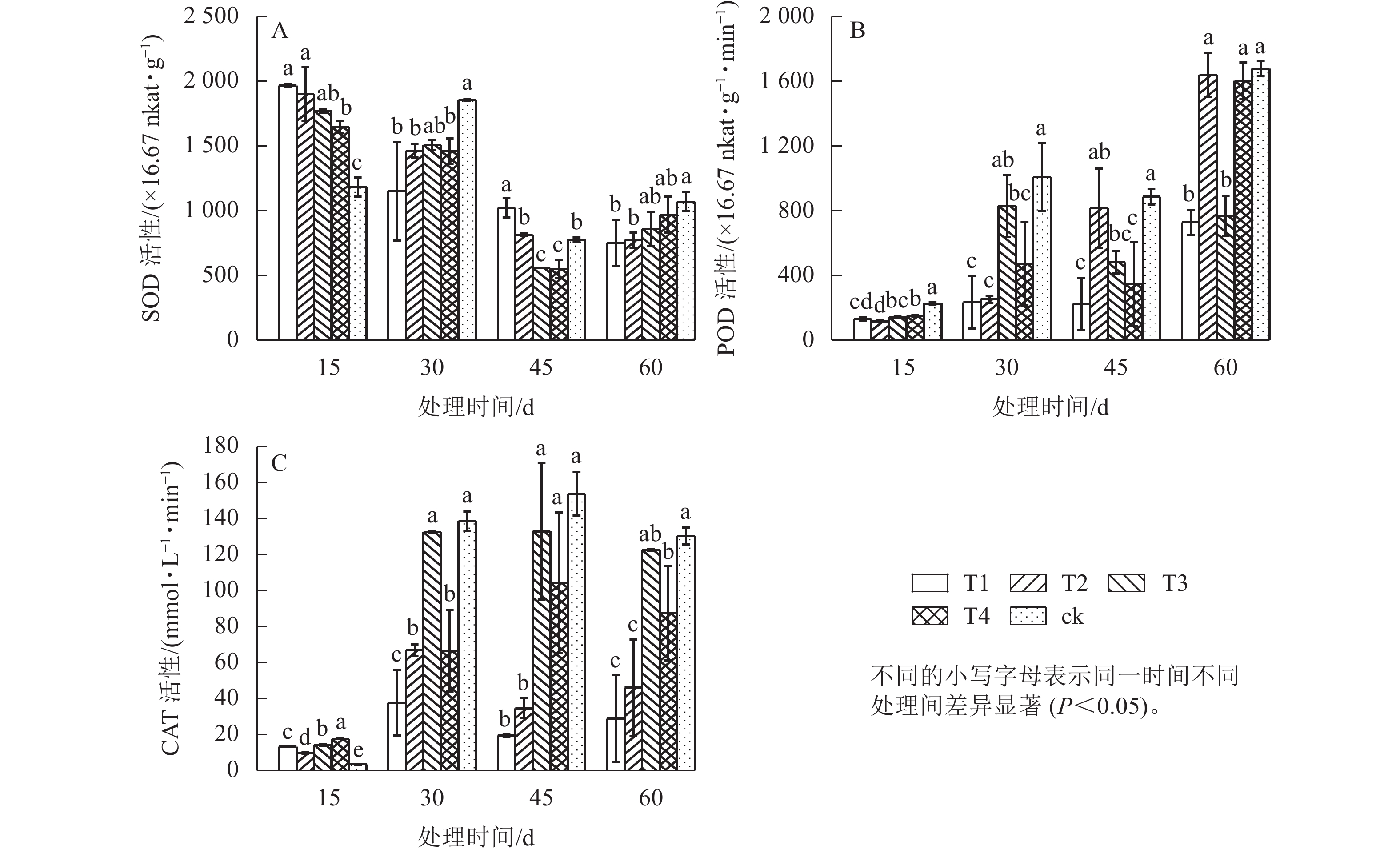
图3显示:遮光时间对POD、CAT和SOD活性均有影响,其中POD和CAT活性随时间推移整体上升,SOD则不断下降,表明7月高温和强光胁迫叠加下,氧离子和氢氧根离子的积累超出了SOD的清除能力,POD和CAT被不断激活,成为保护细胞活力的主要力量,并起主要作用来抵抗植物体内的氧化物。除15 d之外,POD和CAT活性随着遮光强度由强到弱,均呈升—降—升的变化趋势,表明不同遮光环境下2种酶协同发挥作用,共同维持细胞膜稳定。45 d时T1处理的POD活性较低,T4处理的CAT活性分别显著高于T1、T2处理(P<0.05),说明短期高温高光强胁迫下,遮光强度较高时POD保持较低活性,即可抵御逆境带来的损害,遮光强度较低时CAT活性升高以维持细胞内部稳定。
-
相关性分析(表4)表明:CAT、SOD和POD活性均与MDA呈显著(P<0.05)或极显著(P<0.01)正相关,说明弱光或高温高光强环境使植物体内积累过量MDA,此时植株通过提高抗氧化酶活性来清除逆境下产生的有害物质。MDA与节间距、生物量均呈极显著负相关(P<0.01),而可溶性蛋白与节间距、生物量呈极显著正相关(P<0.01),膜脂过氧化产物对植物造成损伤,不利于植物形态发育以及干物质的积累。
指标 生物量 分蘖数 节数 节间距 叶绿素
总量可溶性
蛋白MDA CAT POD SOD 生物量 1 分蘖数 0.152 1 节数 −0.142 0.542* 1 节间距 0.585* 0.421 0.300 1 叶绿素总量 0.303 0.733** 0.579* 0.420 1 可溶性蛋白 0.854** 0.423 0.102 0.718** 0.531* 1 MDA −0.684** −0.302 −0.234 −0.707** −0.623* −0.789** 1 CAT −0.325 −0.594* −0.375 −0.143 −0.794** −0.468 0.604* 1 POD −0.403 −0.461 −0.453 −0.952** −0.454 −0.613* 0.689** 0.203 1 SOD −0.631* −0.442 −0.012 −0.444 −0.535* −0.744** 0.684** 0.692** 0.425 1 说明:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。 Table 4. Correlation analysis of morphological and physiological indexes under different shading treatments
-
单叶铁线莲的分蘖数、节数和节间距分别于不同遮光强度下达到最高值,但与金线莲Anoectochilus roxburghii[12]和绢毛匍匐委陵菜Potentilla reptans[8]生长过程中不同器官生长发育适宜的光照强度并不一致。表明光因子对植株可塑性具有一定的影响,弱光刺激植株株节的纵向生长,以获得更多的光能[13],适度遮光有效保持叶色浓绿,强光胁迫使叶片发黄、皱缩。研究表明:遮光下桫椤Alsophila spinulosa幼苗叶绿素显著增加,全光照下出现日灼现象[14]。本研究中单叶铁线莲在50%~60%的遮光下生物量最高,这与香榧Torreya grandis ‘Merrillii’在不同遮光水平下的研究结果一致[15],表明中度遮光有利于耐阴植物的生物量积累,保持较好的生命活力。耐阴种类齿叶铁线莲C. serratifolia和褐毛铁线莲C. fusca[16]的光补偿点为8~24 μmol·m−2·s−1,自然分布环境多在落叶和常绿阔叶混交林下,这与单叶铁线莲生境相似。邵伟丽等[4]研究发现:单叶铁线莲比毛叶铁线莲C. lanuginosa、毛萼铁线莲C. hancockiana等6个野生种耐阴性更强,建议在选择遮光的小环境中栽培,本研究也得到类似结果。此外,单叶铁线莲园林应用过程中应保持适度遮光,促进分蘖数、节数、节间距的增加和叶绿素的形成和积累,使叶色浓绿,提升垂直绿化景观效果,遮光强度设置还要综合考虑光照强度对其不同器官生长发育的影响,保障观赏效果。
-
MDA作为膜脂过氧化产物,反映膜脂过氧化及膜受伤害的程度,可溶性蛋白含有多种参与植物体内代谢的酶类,是维持正常渗透势的重要渗透调节物质。本研究中短期(30 d)轻度遮光(T4)和不遮光(ck)处理植株的MDA质量摩尔浓度均显著低于其他处理,可能是短期弱光胁迫导致植株体内膜脂过氧化产物积累,低光强下紫心甘薯Ipomoea batatas [17]也得到类似结果。遮光组可溶性蛋白质量分数均显著高于对照,表明低光强有利于单叶铁线莲积累光合产物,这与金莲花Trollius chinensis[18]和地黄Rehmannia glutinosa[19]的研究结果相似。7月强光高温胁迫叠加,各处理组MDA质量摩尔浓度升高,可溶性蛋白质量分数降低,活性氧产生速度超过抗氧化物清除能力,细胞质膜通透性变大,细胞质外渗,导致植物生理代谢紊乱,植物体通过消耗可溶性蛋白来维持细胞膨压和降低渗透势,降低损害[20]。同时,遮光条件下植株MDA质量摩尔浓度减少,这与北江荛花Wikstroemia monnula[21]在遮光条件下的研究结果一致,表明遮光处理有效减缓了植株受到的伤害。
叶绿素直接影响叶肉细胞光合作用的强弱,是植物适应和利用环境因子的重要指标[22]。处理30 d时,遮光组叶绿素总量均高于对照,单叶铁线莲通过增加叶绿素质量浓度来提高光合效率,这与香果树Emmenopterys henryi[23]在遮光处理下叶绿素质量浓度的变化一致。T1、T2和T3处理在6月的叶绿素a/b低于对照,且随着时间的推移逐渐降低,说明其通过增加叶绿素b或者降低叶绿素a,提高了叶片对短波蓝紫光的吸收,又有利于维持光系统Ⅰ (PSⅠ)与光系统Ⅱ (PSⅡ)之间的能量平衡,从而提高自身对遮光环境的适应性[24],这与黄波罗Phellodendron amurense[25]在遮光下叶片叶绿素质量浓度变化的研究结论相似。叶绿素a+b的增加以及叶绿素a/b的降低均是植物对弱光环境适应以及耐阴性强的表现[26]。单叶铁线莲耐阴性较强,适度遮光可以促进叶绿素积累,使叶色保持浓绿,同时可以缓解夏季外界强光造成的损害。
-
逆境条件下植物体内产生大量自由基会危害植物细胞膜系统,严重时会导致细胞死亡[9]。与此对应,植物细胞会构建一套保护酶系统,减少活性氧和自由基对细胞的损害。研究初期,遮光组的SOD和POD活性显著高于对照,说明在较低光强下单叶铁线莲通过维持这2种酶的较高活性来清除活性氧,这与遮光处理下赤皮青冈Quercus gilva的酶活性变化相同[9]。伴随7月高温的出现,轻度遮光(T3、T4)和对照植株的SOD活性增长显著,这与铁线莲品种[27]面对高温胁迫时SOD活性变化规律一致;同时重度遮光(T1、T2)处理的SOD活性降幅较小,表明遮光度增加对植株起到了有效保护作用。植物体清除胁迫过程中细胞内产生的H2O2需依赖CAT和POD的共同作用[28],单叶铁线莲POD和CAT活性在7月持续增长,表明其通过协同机制来消除过剩光能带来的危害,这与铁线莲品种应对热胁迫的生理机制类似[29]。此外,POD活性增幅高于CAT也表明前者在协同作用中占主导地位,这与四季桂Osmanthus fragrans ‘Semperflorens’[30]叶片酶活性对光照的响应相似。
-
单叶铁线莲耐阴性好,40%~50%的遮光度可显著促进新枝和新叶的生长,园林应用中可在林下、建筑物北侧及室内窗台区域栽培,单叶铁线莲的开发利用将有效扩展观赏铁线莲的应用场景。夏季高温和强光叠加对单叶铁线莲植株生长的胁迫加剧,植物体通过POD和CAT等保护酶的协同作用缓解过剩光能对细胞的伤害。栽培过程中应选择不低于60%的遮光环境,保障植株的健康生长。
Effects of shading treatment on growth and physiological characteristics of Clematis henryi
doi: 10.11833/j.issn.2095-0756.20230508
- Received Date: 2023-10-18
- Accepted Date: 2024-03-22
- Rev Recd Date: 2024-01-17
- Available Online: 2024-05-22
- Publish Date: 2024-05-22
-
Key words:
- Clematis henryi /
- shading treatment /
- protect enzyme activity /
- chlorophyll /
- physiological index
Abstract:
| Citation: | CHEN Zihang, TAO Li, CHOU Tianze, et al. Effects of shading treatment on growth and physiological characteristics of Clematis henryi[J]. Journal of Zhejiang A&F University, 2024, 41(3): 615-623. DOI: 10.11833/j.issn.2095-0756.20230508 |












 DownLoad:
DownLoad: