-
水稻Oryza sativa是世界上重要的禾本科Gramineae粮食作物之一。据估计,到2030年,禾本科作物的产量至少需要提高40%才能满足人口增长所带来的粮食需求[1]。生长发育良好的水稻根系不仅使植株适应不利的生长环境,而且还能提高植株对水分和营养的利用率[2],从而保证结实率和产量。水稻的种子根只在植株发育初期起作用,随后的整个生育期主要通过发育更为完善和发达的侧根和冠根维持生长发育。因此,发掘和鉴定调控水稻侧根和根冠生长发育的蛋白对水稻根系遗传发育及分子调控机制研究显得尤为重要。目前,在水稻根系发育研究中已获得了一些突变体表型及其调控侧根和冠根发育的关键基因,这些基因的功能缺失突变能特异地影响根系的生长发育和形态建成[3-5]。水稻侧根通过中柱鞘和内皮层细胞不断分裂而形成[6]。已有研究表明:真核生物中含锌指结构域蛋白能特异结合DNA,RNA和蛋白质,从而参与调控真核生物细胞的发育和凋亡过程及相关信号传导途径[7-8]。拟南芥Arabidopsis thaliana C1-1i亚族中GIS,GIS2,ZFP8和ZFP5蛋白受赤霉素和细胞分裂素诱导,参与调控表皮毛的生长发育及相关信号传导途径[9-12];而C1-2i亚族中的Zat6被证实参与调控种子根的生长发育和磷酸盐的吸收[13]。最近,水稻中已鉴定出189个含C2H2型锌指结构蛋白,其中至少26个蛋白响应不同的生物胁迫和非生物胁迫[14]。这些研究结果预示着含锌指结构域的蛋白在水稻生长发育过程中起着重要的调节作用。在前期研究中,我们已鉴定到1个水稻调控侧根生长发育的C2HC型锌指结构蛋白。本研究拟利用酵母双杂交技术筛选鉴定与该蛋白互作的调控蛋白,以期为水稻根系生长发育分子机制的解析奠定工作基础。
-
根据酵母表达载体pGBKT7多克隆位点及水稻锌指结构蛋白基因(OsZFP)表达序列设计引物,正向:5′-CGGAATTCATGGCAAGGGAACCAAGTCC-3′(下划线为EcoRⅠ酶切位点),反向:5′-ACGCGTCGACCTAAAATGCCTGGCTCCTAA-3′(下划线为SalⅠ酶切位点)。以本实验室保存的水稻品种‘日本晴’‘Nipponbare’幼苗为试验材料,对幼苗cDNA进行聚合酶链式反应(PCR)扩增,反应体系和扩增程序参照文献[15]稍作修改。目的基因经双酶切回收后连接至酵母表达载体pGBKT7并转化大肠埃希菌Escherichia coli DH5α,重组酵母表达载体pGBKT7+OsZFP双酶切验证后进行单克隆测序。
-
按YeastmakerTM Yeast Transformation System 2小量法转化酵母表达载体pGBKT7和酵母钓饵表达载体pGBKT7+OsZFP至50 μL酵母菌株Y2H感受态细胞,分别稀释转化菌液至1/10和1/100,取100 μL酵母表达载体pGBKT7转化液涂布于SD/-Trp;同时,取100 μL酵母钓饵表达载体pGBKT7+OsZFP转化液涂布于SD/-Trp(SDO),SD/-Trp/X-α-Gal(SDO/X)和SD/-Trp/X-α-Gal/AbA(SDO/X/A)固体培养基,30 ℃培养3~5 d,对比pGBKT7和pGBKT7+OsCYP2两者转化后酵母单克隆大小,观察统计结果,检测钓饵载体是否对酵母菌株有毒性及是否对报告基因存在自激活现象。
-
按YeastmakerTM Yeast Transformation System 2共转化水稻幼苗cDNA文库和酵母钓饵表达载体pGBKT7+OsZFP至600 μL酵母菌株Y2H感受态细胞,所有转化菌液全部涂布于SD/-Leu/-Trp/X-α-Gal/AbA(DDO/X/A)固体培养基,30 ℃培养3~5 d,挑选蓝色单克隆接种至SD/-Leu/-Trp/-His/Ade/X-α-Gal/AbA(QDO/X/A)固体培养基,30 ℃培养3~5 d,将蓝色克隆菌株划线至SD/-Leu/-Trp//X-α-Gal(DDO/X)固体培养基,重复2~3次,分离阳性互作蛋白。
-
挑取上述DDO/X固体培养基中分离出来的蓝色单克隆,用酵母质粒提取试剂盒(easy yeast plasmid isolation kit)提取钓饵与互作蛋白表达质粒,转化大肠杆菌DH5α感受态细胞,涂布于含有氨苄青霉素的LB固体培养基,37 ℃过夜培养,挑选单克隆提取质粒,送生物公司测序。将分离的互作蛋白表达质粒,与pGBKT7或pGBKT7+OsZFP分别共转化酵母菌株Y2H,取100 μL转化菌液涂布于DDO/X和QDO/X/A固体培养基中,30 ℃培养3 d,回复验证阳性互作蛋白。
-
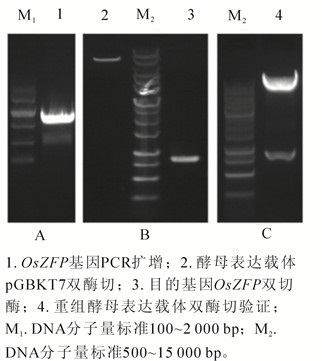
PCR扩增OsZFP基因获得大小为828 bp的目的片段(图 1A),与预期条带相符;利用EcoRⅠ和SalⅠ酶切位点酶切酵母表达载体pGBKT7及目的基因OsZFP(图 1B),T4连接酶连接后转化大肠埃希菌DH5α,提取重组表达载体后进行双酶切验证(图 1C),阳性克隆送生物公司测序验证。
-
酵母表达载体pGBKT7和钓饵载体pGBKT7+OsZFP转化酵母菌株Y2H感受态细胞,分别涂布于SDO,SDO/X和SDO/X/A固体培养基,30 ℃培养3~5 d。结果显示:SDO培养基中,含有pGBKT7与pGBKT7+OsZFP载体的酵母菌株单克隆大小相近(图 2A和2B),表明含有OsZFP基因的钓饵表达载体对酵母菌株的生长没有毒性作用;同时,含有pGBKT7+OsZFP载体的酵母菌株在SDO/X固体培养基中呈白色(图 2C),且在SDO/X/A固体培养基中不能生长(图 2D),表明pGBKT7+OsZFP载体在酵母菌株Y2H中无自激活现象,适合互作蛋白的文库筛选。
-
将pGBKT7+OsZFP载体与水稻cDNA文库共转化酵母菌株Y2H感受态细胞,涂布于DDO/X/A固体培养基进行筛选;挑选候选阳性单克隆进一步接种至QDO/X/A固体培养基进行筛选。将候选阳性单克隆(83号和87号)转接至DDO/X固体培养基2~3次,筛选分离出蓝色(箭头所示)阳性单克隆(图 3)。
-
利用酵母质粒提取试剂盒提取DDO/X固体培养基中蓝色单克隆表达质粒。将分离互作蛋白表达载体pGADT7+83(AD-83)和pGADT7+87(AD-87)分别与pGBKT7(BD)或pGBKT7+OsZFP(BD-ZFP)共转化酵母菌株Y2H,涂布于DDO/X和QDO/X/A固体培养基进行筛选。结果显示,BD-ZFP/AD-83和87以及BD/AD-83和87共转化后,酵母Y2H均能在DDO/X固体培养基中生长;但是只有BD-ZFP/AD-87共转化后酵母Y2H能在QDO/X/A固体培养基中生长且呈蓝色(图 4),表明87号筛选蛋白可能为阳性互作蛋白。进一步对87号互作蛋白的文库表达载体进行测序和同源性比对,鉴定为含有T-complex polypeptide 1(TCP-1)结构域的分子伴侣蛋白第7个亚基(LOC4341893),命名为chaperonin containing TCP-1 eta subunit(CCT-eta);该基因mRNA全长为2 123 bp,编码560个氨基酸。
-
锌指结构蛋白是一类含有指状结构域的基因表达调控蛋白,依据蛋白结构中半胱氨酸和组氨酸残基的数目和顺序可以将锌指结构分为C2H2,C2HC和C2C2等类型。在真核生物中,C2H2型锌指结构蛋白的类型最多,研究也较为深入。水稻基因组中存在189个编码含有QALGGH保守结构域的C2H2型锌指结构转录因子,其中有18个基因是调控水稻穗发育,12个是种子特异表达基因[16];另外,含有C2H2型锌指结构的水稻蛋白ZFP36被证实参与脱落酸诱导的抗氧化防御机制[17]。这些结果都表明:锌指结构蛋白广泛参与调控水稻的生长发育及生理生化途径。
本研究以调控水稻侧根生长发育的CCHC型锌指结构蛋白为钓饵,通过酵母双杂交技术从水稻cDNA文库中筛选获得2个互作蛋白;酵母双杂交一对一回复验证显示BD/AD-87共转化酵母在QDO培养基中不能生长,但BD-ZFP/AD-87能在QDO培养基中生长且呈蓝色(图 4),表明87号蛋白为阳性互作蛋白。另外,BD/AD-83在QDO培养基中呈白色,但BD-ZFP/AD-83共转化酵母在QDO培养基上不能生长,因此,83号筛选蛋白为假阳性。
含有TCP-1结构域的分子伴侣蛋白已被证实在真核生物细胞中参与蛋白的折叠与复性[18]。该蛋白至少由8个不同功能亚基组成,各个亚基同源性仅为30%;同时,各个蛋白亚基也含有相对保守的结构域,可能与ATP酶活性相关[19]。本研究筛选到的编码CCT蛋白的第7个亚基与C2HC型锌指结构蛋白存在互作,推测它可能参与锌指结构蛋白的折叠与形成,从而调控水稻根系的生长发育,其相关生物学功能需要通过反向遗传学进一步研究。
Screening and identification of a protein for controlling lateral root development in Oryza sativa
-
摘要: CCHC型锌指结构蛋白OsZFP参与调控水稻Oryza sativa侧根的生长发育,但其相关互作蛋白及调控机制未知。以水稻‘日本晴’‘Nipponbare’为试验材料,克隆了OsZFP基因,利用EcoRⅠ和SalⅠ酶切位点构建酵母双杂交钓饵表达载体pGBKT7+OsZFP,验证该表达载体对酵母菌株Y2H无毒性及报告基因自激活现象;采用酵母双杂交技术,从已构建的水稻cDNA文库中筛选到1个阳性互作蛋白,经美国国家生物技术信息中心数据库(NCBI)同源性比对,鉴定为含有T-complex polypeptide 1(TCP-1)结构域的分子伴侣蛋白第7个亚基(Os06g0687700),命名为chaperonin containing TCP-1 eta subunit(CCT-eta),进而通过酵母一对一回复验证该互作蛋白。基于CCT-eta亚基与OsZFP蛋白互作,推测分子伴侣蛋白亚基CCT-eta可能参与调控水稻侧根的生长发育。Abstract: OsZFP, a CCHC-type zinc finger protein, has reportedly participated in lateral root development in rice. To determine the molecular mechanism and its interacting proteins in a regulated network, the OsZFP gene from Oryza sativa. 'Nipponbare' was cloned, and then a yeast bait vector, pGBKT7 + OsZFP, was constructed by EcoRⅠ and SalⅠ for cDNA library screening of rice. Results showed no toxicity or autoactivation with transformation of the Y2H strain containing the pGBKT7 + OsZFP bait vector. In a yeast two-hybrid assay, a positive interacted protein was obtained and confirmed from the cDNA library. Sequencing and homologous alignment from the National Center for Biotechnology Information (NCBI) showed that the interacting protein (named chaperonin containing a T-complex polypeptide 1 (TCP-1) eta subunit, CCT-eta) was the eta subunit of the chaperone which contained a TCP-1 domain. Based on the interaction between OsZFP and the CCT-eta subunit, it was speculated that the CCT-eta subunit of the chaperone protein may be involved in controlling lateral root development in rice.
-
Key words:
- botany /
- Oryza sativa /
- regulated protein /
- vector construction /
- yeast two-hybrid /
- protein interaction
-
-
[1] KHUSH G S. What it will take to feed 5.0 billion rice consumers in 2030[J]. Plant Mol Biol, 2005, 59(1):1-6. [2] KING J, GAY A, SYLVESTER-BRADLEY R, et al. Modelling cereal root systems for water and nitrogen capture:towards an economic optimum[J]. Annu Bot, 2003, 91(3):383-390. [3] ZHAO Yu, HU Yongfeng, DAI Mingqiu, et al. The WUSCHEL-related homeobox gene WOX11 is required to activate shoot-borne crown root development in rice[J]. Plant Cell, 2009, 21(3):736-748. [4] ZHU Zhenxing, LIU Yu, LIU Shaojun, et al. A gain-of-function mutation in OsIAA11 affects lateral root development in rice[J]. Mol Plant, 2012, 5(1):154-161. [5] KANG Bo, ZHANG Zhongchen, WANG Lingling, et al. OsCYP2, a chaperone involved in degradation of auxin-responsive proteins, plays crucial roles in rice lateral root initiation[J]. Plant J, 2013, 74(1):86-97. [6] COUDERT Y, PÉRIN C, COURTOIS B, et al. Genetic control of root development in rice, the model cereal[J]. Trends Plant Sci, 2010, 15(4):219-226. [7] LUCHI S. Three classes of C2H2 zinc finger proteins[J]. Cell Mol Life Sci, 2001, 58(4):625-635. [8] CIFTCIYILMAZ S, MILLTER R. The zinc finger network of plants[J]. Cell Mol Life Sci, 2008, 65(7/8):1150-1160. [9] GAN Yinbo, KUMIMOYO R, LIU Chang, et al. GLABROUS INFLORESCENCE STEMS modulates the regulation by gibberellins of epidermal differentiation and shoot maturation in Arabidopsis[J]. Plant Cell, 2006, 18(6):1383-1395. [10] GAN Yinbo, LIU Chang, YU Hao, et al. Integration of cytokinin and gibberellin signalling by Arabidopsis transcription factors GIS, ZFP8 and GIS2 in the regulation of epidermal cell fate[J]. Development, 2007, 134(11):2073-2081. [11] ZHOU Zhongjing, AN Lijun, SUN Lili, et al. Zinc finger protein 5 is required for the control of trichome initiation by acting upstream of ainc finger protein 8 in Arabidopsis[J]. Plant Physiol, 2011, 157(2):673-682. [12] AN Lijun, ZHOU Zhongjing, SUN Lili, et al. A zinc finger protein gene ZFP5 integrates phytohormone signaling to control root hair development in Arabidopsis[J]. Plant J, 2012, 72(3):474-490. [13] DEVAIAH B N, NAGARAJAN V K, RAGHOTHAMA K G. Phosphate homeostasis and root development in Arabidopsis are synchronized by the zinc finger transcription factor ZAT6[J]. Plant Physiol, 2007, 145(1):147-159. [14] AGARWAL P, ARORA R, RAY S, et al. Genome-wide identification of C2H2 zinc-finger gene family in rice and their phylogeny and expression analysis[J]. Plant Mol Biol, 2007, 65(4):467-485. [15] LIU Hongbo, GUO Xiang, NAEEM M S, et al. Transgenic Brassica napus L. lines carrying a two gene construct demonstrate enhanced resistance against Plutella xylostella and Sclerotinia sclerotiorum[J]. Plant Cell Tiss Org Cult, 2011, 106(1):143-151. [16] AGARWAL P, ARORA R, RAY S, et al. Genome-wide identification of C2H2 zinc-finger gene family in rice and their phylogeny and expression analysis[J]. Plant Mol Biol, 2007, 65(4):467-485. [17] ZHANG Hong, LIU Yanpei, WEN Feng, et al. A novel rice C2H2-type zinc finger protein, ZFP36, is a key player involved in abscisic acid-induced antioxidant defence and oxidative stress tolerance in rice[J]. J Exp Bot, 2014, 65(20):5795-5809. [18] ZEBOL J R, HEWITT N M, MORETTI P A, et al. The CCT/TriC chaperonin is required for maturation of sphingosine kinase 1[J]. Int J Biochem Cell Biol, 2009, 41(4):822-827. [19] KUBOTA B H, HYNES G, WILLISON K. The chaperonin containing t-complex polypeptide 1(TCP-1) multisubunit machinery assisting in protein folding and assembly in the eukaryotic cytosol[J]. Eur J Biochem, 1995, 230(1):3-16. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2017.06.008







 下载:
下载: