-
《全国土壤污染状况调查公报》显示,中国耕地土壤污染点位超标率高达19.4%,重金属污染点位超标率为15.5%,其中镉的点位超标率为7.0%,居首位[1]。镉是一种毒性很强的人体非必需元素,极易被作物吸收进入食物链,从而危害人体健康[2]。如何阻遏环境中的镉进入食物链,已成为当前土壤及生态环境领域的研究热点之一[3]。目前,微生物修复技术成为镉污染治理的研究方向之一[4]。蒋成斌[5]筛选到2种耐镉细菌:腐败希瓦菌Shewanella putrefaciens和假单胞菌Pseudomonas sp.,在LB(Luria-Bertani)固体和液体培养上耐受重金属镉离子(Cd2+)浓度分别达到150和40 mmol·L−1。张欣等[6]在模拟镉轻度污染(1 mg·kg−1)试验中通过施入微生物菌剂(枯草芽孢杆菌Bacillus subtilis、光合细菌和乳酸菌)后使菠菜Spinacia oleracea镉含量平均下降14.5%。王微等[7]和何小三等[8]利用硅藻土制备的铜绿假单胞菌Pseudomonas aeruginosa菌剂能够显著促进镉胁迫苗期水稻Oryza sativa的生长,抑制镉在根、茎鞘、叶片中的迁移与积累。汪敦飞等[9]研究指出:耐镉铜绿假单胞菌及其菌剂能显著提高镉胁迫水稻苗期的根系活力,增强水稻叶片抗氧化酶系统的活力,提高水稻叶片抗氧化物的含量,从而有效缓解水稻镉胁迫效应。假单胞菌为革兰氏阴性菌,环境适应能力强,世代周期短,具有根际促生能力,已被广泛用作生防菌[10-11]。本课题组前期从水稻根际土壤筛选了1株耐镉的假单胞菌TCd-1,能在高达900 mg·L−1 Cd2+下生长,在100 mg·L−1镉处理下,菌株体内吸收的镉质量分数为9.04 mg·g−1,镉富集系数达到90.4,具有较强镉富集能力,因此有应用于镉污染的修复潜力[12]。但该菌株的培养条件有待优化。响应面分析法是一种综合试验设计和数学建模的方法,既能有效减少试验次数又能考察各个因素之间的交互作用[13-14],在优化试验设计中,被人们广泛使用[15]。胡瑞萍等[16]利用响应面法优化了枯草芽孢杆菌 Bacillus subtilis NHS1菌株培养基组分,使芽孢含量比优化前提高1.5倍。印杨等[17]利用响应面法优化了生防菌株(巨大芽孢杆菌Megaterium bacillus RB10)的发酵培养条件参数,证实了Box-Behnken设计的有效性和模型的准确可靠[17]。袁辉林[18]以植物促生菌SZ7-1为研究对象,在5 L自动发酵罐中采用单因素试验设计及响应曲面法进行扩大培养,结果表明:优化后的培养条件更利于菌株的生长,且活菌数是优化前的1.62倍。刘江红等[19]通过响应面法优化了芽孢杆菌Bacillus S2的培养条件,使最优乳化指数(E24)提高为81.20%。巩志金等[20]利用响应面法优化了铜绿假单胞菌产鼠李糖脂的发酵培养基,结果使其产量提高了14.43%。本研究基于响应面法通过单因素筛选试验、Plackett-Burman试验、Box-Behnken 试验和响应面分析法,对TCd-1菌株培养条件进行优化,以期为菌株潜在价值的开发利用和菌剂制备提供技术支持。
-
供试菌株为耐镉的假单胞菌Pseudomonas sp. TCd-1(专利号CN 103952333A)[21],甘油保存于−80 ℃冰箱。菌株活化时取出塑料冻存管,立即置于30~40 ℃恒温水浴锅中匀速摇动进行快速复苏,待冻存管内结冰全部溶解后,开启冻存管,将内容物转移至种子液培养基内培养。
种子液培养条件:采用牛肉膏蛋白胨培养基(牛肉膏3.0 g,蛋白胨10.0 g,氯化钠 5.0 g,琼脂 15.0~20.0 g,1.0 L蒸馏水,pH 7.2~7.4)。菌株长出后选取直径约为3 mm的菌落进行平板划线法过夜培养,再从2次培养的固体培养基上挑取1环菌落至100 mL的三角瓶,150 r·min−1,37 ℃,恒温培养18 h,制成菌株种子液。发酵培养条件:牛肉膏蛋白胨液体培养基100 mL,质量分数为0.5%氯化钠,1.0%种子液,150 r·min−1,37 ℃恒温培养24 h。
-
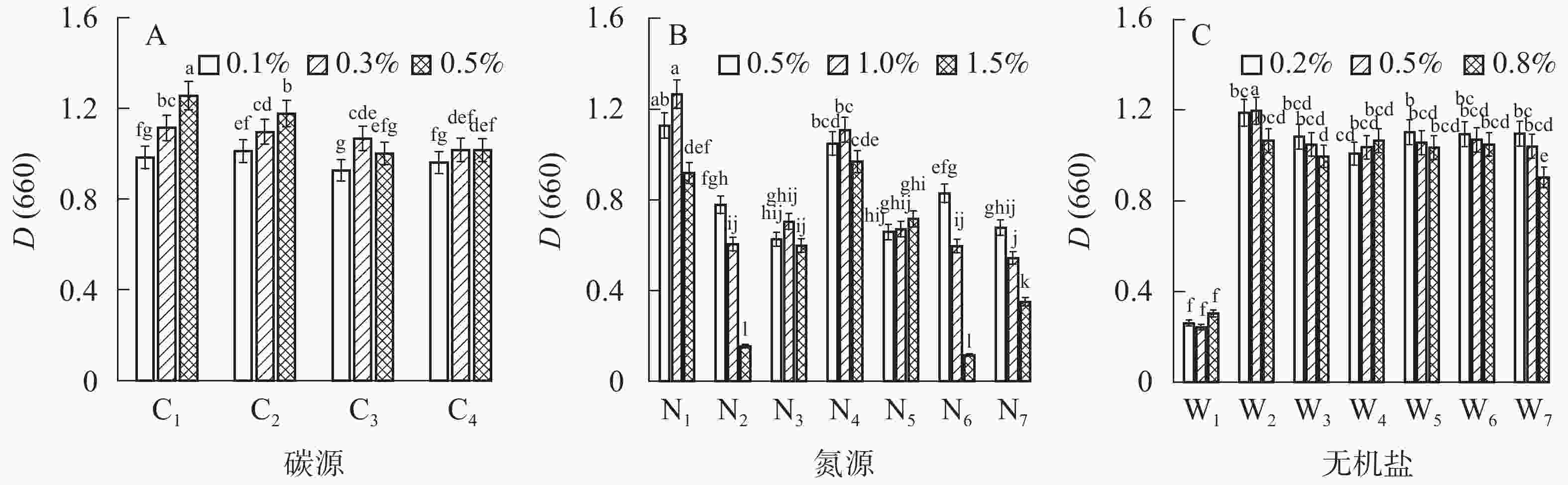
在发酵培养条件下,选择不同氮源:N1为酵母粉,N2为硫酸铵[(NH4)2SO4],N3为硝酸铵(NH4NO3),N4为蛋白胨,N5为硝酸钾(KNO3),N6为氯化铵(NH4Cl),N7为硝酸纳(NaNO3),设置质量分数为0.5%、1.0%、1.5% 3个水平;不同碳源:C1为牛肉膏,C2为可溶性淀粉,C3为葡萄糖,C4为蔗糖,设置质量分数为0.1%、0.3%、0.5% 3个水平;不同无机盐:W1为氯化钙(CaCl2),W2为氯化镁(MgCl2),W3为氯化钠(NaCl),W4为氯化钾(KCl),W5为磷酸氢二钠(Na2HPO4),W6为硫酸钠(Na2SO4),W7为磷酸二氢钠(NaH2PO4),设置质量分数为0.2%、0.5%、0.8% 3个水平。以菌株最大吸收波长660 nm下的吸光度D(660)作为评价指标,筛选最适的碳源、氮源、无机盐及其质量分数。
-
根据单因素试验得到的最适碳源(牛肉膏)、氮源(酵母粉)、无机盐(MgCl2),进行Plackett-Burman试验。试验设计如表1。试验次数 n=12,各因素水平设置为高低2个水平,高水平(1)取值为低水平(−1)的1.25倍,其中 D、H、K为空白试验,用于误差估计。考察牛肉膏(A)、酵母粉(B)、MgCl2(C)、培养温度(E)、初始pH(F)、接菌量(G)、培养时间(I)和转速(J) 8个因素对菌株生长的影响,确定影响菌株生长的关键因素。
表 1 Plackett-Burman试验设计因素和水平
Table 1. Factors and levels of Plackett-Burman design
因素 水平 因素 水平 因素 水平 −1 1 −1 1 −1 1 A 牛肉膏/% 4.0 5.0 E 温度/% 30.0 37.50 I 培养时间/h 20 24 B 酵母粉/% 0.8 1.0 F 初始pH 6.0 7.50 J 转速/(r·min−1) 160 200 C MgCl2/% 4.0 5.0 G 接菌量/% 1.0 1.250 K 空白3 D 空白1 H 空白2 -
根据Plackett-Burman试验筛选得到的显著影响菌株生长的关键因素(酵母粉、温度、初始pH),确定最陡爬坡试验的步长和方向,获得最佳的响应区域。
以最陡爬坡试验得到最佳响应区域(2号试验)作为Box-Behnken试验设计的中心点,各因素取3个水平,以(−1,0,1)表示,设计包括了5个中心点(0,0,0),即酵母粉0.9%、温度35 ℃、pH 7,共17个组合的响应面试验。各处理3次重复。
表 4 最陡爬坡试验
Table 4. Factors and levels of steepest ascent design
试验
号B 酵
母粉/%E 温
度/℃F 初
始pH编码 吸光度 1 0.8 40 8.0 (−1,1,1) 1.079±0.058 c 2 0.9 35 7.0 (0,0,0) 1.720±0.006 a 3 1.0 30 6.0 (1,−1,−1) 1.681±0.015 b 说明:不同小写字母表示差异显著(P<0.05) -
根据Box-Behnken试验结果,进行方差分析,并拟合线性回归方程,检验拟合防方程的符合程度;利用拟合方程获得最佳培养条件,并在最佳培养条件下进行验证试验。
-
数据处理和作图使用Excel 2016进行,统计分析使用Design Experts 10和IBM SPSS 22。试验结果以平均值±标准差表示,采用Duncan法进行数据差异显著性检验(P=0.05)。
-
结果表明:碳源种类及其质量分数显著影响菌株的生长(图1A),菌液吸光度随牛肉膏、可溶性淀粉质量分数的提高而增大,而葡萄糖和蔗糖质量分数对菌液吸光度的影响较小。各处理中以0.5%牛肉膏培养的吸光度(1.257)最高,显著高于其他各处理(P<0.05),比可溶性淀粉的最大值高10.8%,比葡萄糖和蔗糖的最大值分别提高了17.7%和23.6% (图1A)。不同氮源及其质量分数显著(P<0.05)影响菌株的生长(图1B),有机氮源(酵母粉、蛋白胨)更利于菌株生长,各处理中以1.0%酵母粉处理的吸光度(1.266)最高,比1.0%蛋白胨高14.2%,比硫酸铵、硝酸铵、硝酸钾、氯化铵和硝酸钠处理的最大吸光度分别高出62.7%、79.8%、76.8%、52.7%、87.0%。不同无机盐显著(P<0.05)影响菌株的生长(图1C)。培养基含0.5%镁离子时的菌液吸光度(1.197)最高,而钙离子最不利于菌株生长;培养基含0.5%的氯化钠、氯化钾、磷酸氢二钠、硫酸钠、磷酸二氢钠与含0.8%的氯化镁、氯化钾、磷酸二氢钠间无显著性差异。可见,选择0.5%牛肉膏、1.0%酵母粉及0.5% MgCl2作为基础培养基是最合适的。
-
Plackett-Burman试验结果显示:菌株生长在不同处理间存在显著差异(表2),以8号、9号、10号吸光度高,且之间无显著性差异。9号吸光度 (1.802)最高,比最低5号(0.981)的值高83.7%。
表 2 Plackett-Burman 试验结果
Table 2. Results of Plackett-Burman design
试验号 A 牛肉膏 B 酵母粉 C 氯化镁 D 空白1 E 温度 F pH G 接菌量 H 空白2 I 时间 J 转速 K 空白3 吸光度 1 1 1 −1 1 1 1 −1 −1 −1 1 −1 1.235±0.078 f 2 −1 1 1 −1 1 1 1 −1 1 −1 −1 1.358±0.030 e 3 1 −1 1 1 −1 1 1 1 −1 −1 −1 1.563±0.058 b 4 −1 1 −1 1 1 −1 1 1 −1 −1 1 1.397±0.021 de 5 −1 −1 1 −1 1 1 −1 1 −1 1 1 0.981±0.042 h 6 −1 −1 −1 1 −1 1 1 −1 1 1 1 1.440±0.028 cd 7 1 −1 −1 −1 1 −1 1 1 1 1 −1 1.121±0.026 g 8 1 1 −1 −1 −1 1 −1 1 1 −1 1 1.756±0.010 a 9 1 1 1 −1 −1 −1 1 −1 −1 1 1 1.802±0.003 a 10 −1 1 1 1 −1 −1 −1 1 1 1 −1 1.783±0.012 a 11 1 −1 1 1 1 −1 −1 −1 1 −1 1 1.195±0.096 fg 12 −1 −1 −1 −1 −1 −1 −1 −1 −1 −1 −1 1.492±0.041 bc 说明:不同小写字母表示差异显著(P<0.05) 进一步的因子分析(表3)结果表明:在设定的试验条件下,显著影响菌株生长的因子为酵母粉(B)、温度(E)和pH (F),显著性程度从大到小依次为温度、酵母粉、pH。确定这3个因素为影响菌株生长的关键因素,进行最陡爬坡试验。
表 3 Plackett-Burman试验显著性分析结果
Table 3. Results of Plackett-Burman design
来源 均方和 自由度 均方 F P 显著性 效应系数 显著性排序 效应正负 模型 0.780 00 8 0.098 00 70.01 0.002 5 ** 1.430 A 牛肉膏 0.004 07 1 0.004 07 2.91 0.186 5 0.018 7 + B 酵母粉 0.200 00 1 0.200 00 141.15 0.001 3 ** 0.130 2 + C 氯化镁 0.004 84 1 0.004 84 3.46 0.159 8 0.020 5 + E 温度 0.540 00 1 0.540 00 387.22 0.000 3 ** −0.210 1 − F pH 0.017 00 1 0.017 00 12.45 0.038 7 * −0.038 3 − G 接菌量 0.004 76 1 0.004 76 3.40 0.162 2 −0.020 6 + I 时间 0.000 03 1 0.000 03 0.022 0.892 7 0.002 8 + J 转速 0.013 00 1 0.013 00 9.49 0.054 1 −0.033 4 − 说明:*表示差异显著(P<0.05),**表示差异极显著(P<0.01) -
参照表3因子的正负效应可知:因素B、因素E、因素F各具有不同正、负效应系数,即酵母粉(B)具有正效应(+),依次增大;温度(E)具有负效应(−),依次减小;pH (F)具有负效应(−),依次减小。
最陡爬坡试验结果(表4)显示:随着酵母粉质量分数逐渐增大,温度和pH逐渐减小,菌株吸光度呈现先升高后下降的变化趋势。2号的吸光度达到最高水平(1.720),比1号和3号分别高出2.3%和59.4%,以此确定为因子的最大相应值响应区域,即酵母粉质量分数为0.9%,温度为35 ℃,pH 7的组合可作为Box-Behnken试验设计的中心点(0,0,0)。
-
Box-Behnken试验结果表明:不同试验组合间存在显著差异(表5)。14 号吸光度(1.785)最高,比2号(0.922)高93.6%,即14号(0,0,0):酵母粉质量分数为0.9%,温度为35 ℃,pH 7条件下的吸光度高于2号(0,1,1):酵母粉质量分数为0.8%,温度为40 ℃,pH=7条件下的吸光度。
表 5 Box-Behnken试验设计
Table 5. Results of Box-Behnken design
试验序号 B 酵母粉/% E 温度/℃ F 初始pH 吸光度 试验序号 B 酵母粉/% E 温度/℃ F 初始pH 吸光度 1 0 0 0 1.505±0.007 g 10 1 −1 0 1.770±0.023 ab 2 0 1 1 0.922±0.014 j 11 −1 0 −1 1.634±0.021 f 3 1 0 1 1.655±0.035 ef 12 1 0 −1 1.670±0.007 ef 4 −1 −1 0 1.056±0.027 h 13 0 0 0 1.749±0.024 ef 5 0 0 0 1.661±0.018 ef 14 0 0 0 1.785±0.007 a 6 0 −1 −1 0.941±0.042 ig 15 −1 1 0 1.754±0.010 abc 7 −1 0 1 1.524±0.013 g 16 0 0 0 1.733±0.003 bc 8 0 1 −1 0.967±0.060 i 17 0 −1 1 1.727±0.009 cd 9 1 1 0 1.690±0.010 de 说明:不同小写字母表示差异显著(P<0.05) -
回归模型的方差分析结果表明:模型多元相关性系数为0.9958 (表6),表明仅有0.042 0%的变异不能由此模型解释;回归模型P<0.01,表明模型是极显著的。模型失拟项的显著性水平P=0.146>0.05,表明模型失拟不显著。方差分析结果显示,Box-Behnken设计的模型显著性水平P<0.000 1,表明所采用的拟合模型达到极显著水平,具有统计学意义。由表6可知,3个因素的影响程度从大到小次序为温度(E)、酵母粉(B)、pH(F);B、E、F、E2 对响应值Y(吸光度)的影响达到极显著水平,EF显著影响Y值。此外,回归方程的相关系数R2=0.9958,变异系数为2.08%,说明该回归方程拟合度高,变异几率低,适用于该菌株试验条件下各影响因素的统计分析。该响应面拟合方程为:Y=1.750 0+0.050 0B−0.307 0E−0.033 3F−4.000 0E−0.030 0BE−0.011 0BF−0.040 7EF−0.023 6B2−0.441 0E2−0.034 9F2。依据单因素和Plackett-Burman试验的结果选择设定的酵母粉(B)、温度(E)和pH(F)的取值范围,利用响应面拟合方程得到3个关键因素的拟合值:酵母粉为1.0%,pH为6.3,温度为33 ℃。该拟合值条件下模型的预测吸光度最大,为1.856。
表 6 Box-Behnken试验回归模型方差分析
Table 6. Variance analysis of regression model of Box-Behnken test
来源 均方和 自由度 均方 F 显著性 来源 均方和 自由度 均方 F 显著性 模型 1.638 00 9 0.182 00 182.747 ** B2 0.002 36 1 0.002 36 2.371 B 0.020 00 1 0.020 00 20.091 ** E2 0.820 50 1 0.820 00 824.161 ** E 0.756 00 1 0.756 00 759.257 ** F2 0.005 14 1 0.005 14 5.159 F 0.008 90 1 0.008 91 8.951 ** 残差 0.006 97 7 0.001 00 BE 0. 000 06 1 0.000 06 0.064 失拟项 0.004 91 3 0.001 64 3.179 不显著 BF 0.000 48 1 0.000 48 0.486 纯误差 0.002 06 4 0.000 52 EF 0.006 64 1 0.006 64 6.672 * 总和 1.644 00 16 说明:变异系数为2.08%,相关系数为0.995 8,校正决定系数为0.9903,预测系数为0.950 3。*表示显著差异(P<0.05),**表示极显 著差异(P<0.01) -
综合单因素筛选试验、Plackett-Burman及 Box-Behnken试验模型的拟合值,得到菌株最佳培养条件为:牛肉膏质量分数为0.5%,酵母粉1.0%,氯化镁 0.5%,pH 6.3,温度33 ℃,接菌量1.25%,转速160 r·min−1,培养时间24 h。利用最佳培养条件,进行重复试验验证,得到菌液的吸光度为1.801±0.015,与模型预测的最大值(1.856)相接近,接近程度97.03%,表明模型准确可信,能真实评价各因素及其交互作用对菌株生长的不同影响。同时,与未优化前培养条件下菌株吸光度(1.078±0.021)相比,优化后该值提高了67.07%,达到预期目的。
-
Plackett-Burman 是一种基于非完全平衡块原理的近饱和的两水平试验设计方法。通过N次试验最多可以考察N−1个因素,用最少试验次数可以从众多因素中快速有效地筛选出最为重要的几个主效因子,每个因素取低和高2个水平,高水平取低水平的1.25倍[22-23]。
在本试验中,Plackett-Burman试验从多个因素[牛肉膏(A)、酵母粉(B)、氯化镁(C)、培养温度(E)、初始pH(F)、接菌量(G)、培养时间(I)和转速(J)]中快速筛选出具有显著影响的因素为:酵母粉、pH和温度。其中酵母粉之所以能显著影响菌株生长,在于它能提供优质氮源满足细菌繁殖所必需,而且天然酵母粉主要由多种酵母菌自然繁殖而成,是一种纯天然、无污染的健康营养源[24]。有机氮源比无机氮源含有更丰富的氨基酸、维生素及生长因子等营养物质,其中氨基酸可以直接参与微生物体内的转氨或脱氨作用(图1),更适用于菌株生长。温度是诸多因素中显著影响因素之一,因为可能随着温度升高,菌体生长速度及营养消耗的速率也随之加快,明显缩短进入生长稳定期的时间;从酶本身特性来看,酶具有高效催化性,能够降低生化反应的活化能,但酶本身作用条件较温和,对温度比较敏感,很容易因温度过高而丧失活性[25]。温度也会影响细胞膜的流动性,进而影响膜内外物质(水分、有机物、各种离子等)的交换和吸收。pH 显著影响菌株生长速率可能在于其对菌株生长需要的酶、各种生物大分子的稳定性造成破坏等,导致失去生物活性;pH也会影响到培养基中金属离子的存在形式,造成其不易或者不被吸收;pH同样会影响微生物细胞膜所带电荷状态,进而改变细胞膜的通透性,最终直接或间接影响微生物对所需营养物质的吸收和代谢产物的排出。
-
响应面分析是利用统计学和数学模型的方法对需要优化的多因素系统进行建模和分析[13-15],Box-Behnken试验设计是其中拟合模型之一,目前常被用于生物发酵过程培养基和培养条件的优化。该方法不仅可以建立连续变量的曲面模型和拟合方程,还可以对影响微生物生长和发酵过程的各种因子及其交互作用进行评价,确定最佳水平范围,通过最少的试验组数获得更为精确有效的结论,极大地节约资源和降低成本,使其效应最大化[26]。
细菌生长和培养是一个动态发酵过程,受外部发酵环境以及内部培养基成分的共同影响。此次试验以牛肉膏蛋白胨培养基为基础,通过单因素试验、Plackett-Burman试验、最陡爬坡试验、Box-Behnken试验确定菌株培养基组分和外部培养条件,系统优化了重金属镉耐性假单胞菌TCd-1培养体系,为后续进一步深入研究其菌剂制备及应用于重金属镉污染土壤的修复效应奠定了基础。
Optimization of culture conditions of Cd-tolerant strain Pseudomonas TCd-1 based on response surface methodology
-
摘要:
目的 利用响应面法优化耐镉菌株假单胞菌Pseudomonas TCd-1的培养条件。 方法 以基础发酵培养条件为对照,菌株吸光度D(660)作为评价指标,利用单因素试验确定培养基组分的最佳碳源、氮源和无机盐种类,通过Plackett-Burman试验设计评价牛肉膏、酵母粉、氯化镁、培养温度、初始pH、接菌量、培养时间和转速8个因素对菌株生长的影响,进而确定显著影响因素,然后进行最陡爬坡试验获得显著影响因素的最优组合,结合Box-Behnken试验设计和响应面分析,优化假单胞菌TCd-1的培养条件。 结果 菌株培养基组分的最佳碳源、氮源和无机盐分别为牛肉膏、酵母粉和氯化镁;影响菌株生长的显著性因素为酵母粉、培养温度、初始pH;基于响应面法优化后的培养条件为:牛肉膏质量分数为0.5%,酵母粉1.0%,氯化镁0.5%,pH 6.3,温度33 ℃,接菌量1.25%,转速160 r·min−1,培养时间24 h。 结论 根据最佳条件, 进行重复试验得到优化后的菌液吸光度D(660)比对照提高了67.07%,与模型预测值相一致,表明优化后的条件显著促进了菌株的生长,达到预期目的。图1表6参26 -
关键词:
- 假单胞菌 /
- 镉 /
- Plackett-Burman设计 /
- 优化培养 /
- 响应面法
Abstract:Objective This study aims to optimize the culture conditions of Cd-tolerant Pseudomonas TCd-1 based on response surface methodology. Method Taking the basic fermentation conditions as the control, and the absorbance D(660) value of the strain as the evaluation index, the single factor test was carried out to determine the best carbon source, nitrogen source, and inorganic salt species of the culture medium components. The Plackett-Burman test design was used to evaluate the influence of 8 factors on the growth of the strain, including beef extract, yeast powder, magnesium chloride, culture temperature, initial pH, inoculation quantity, culture time, and rotation speed. The best combination of significant factors was obtained by the steepest climbing test. The culture conditions of TCd-1 were optimized by combining the box Behnken design test and response surface analysis. Result The best carbon source, nitrogen source, and inorganic salt of the strain culture medium components were beef extract, yeast powder, and magnesium chloride. The significant factors affecting the growth of the strain were yeast powder, culture temperature, and initial pH. The optimized culture conditions based on response surface methodology included beef extract 0.5%, yeast powder 1.0%, magnesium chloride 0.5%, pH 6.3, temperature 33 ℃, inoculation rate 1.25%, rotation speed 160 r·min−1, and culture time 24 h. Conclusion According to the optimal conditions, the D(660) value of the optimized bacterial solution is 67.07% higher than that of the control after repeated experiments, which is consistent with the predicted value of the model, indicating that the optimized conditions could significantly promote the growth of the strain and achieve the desired goal.[Ch, 1 fig. 6 tab. 26 ref.] -
Key words:
- Pseudomonas sp. /
- Cd /
- Plackett-Burman design /
- optimized culture /
- response surface methodology
-
表 1 Plackett-Burman试验设计因素和水平
Table 1. Factors and levels of Plackett-Burman design
因素 水平 因素 水平 因素 水平 −1 1 −1 1 −1 1 A 牛肉膏/% 4.0 5.0 E 温度/% 30.0 37.50 I 培养时间/h 20 24 B 酵母粉/% 0.8 1.0 F 初始pH 6.0 7.50 J 转速/(r·min−1) 160 200 C MgCl2/% 4.0 5.0 G 接菌量/% 1.0 1.250 K 空白3 D 空白1 H 空白2 表 4 最陡爬坡试验
Table 4. Factors and levels of steepest ascent design
试验
号B 酵
母粉/%E 温
度/℃F 初
始pH编码 吸光度 1 0.8 40 8.0 (−1,1,1) 1.079±0.058 c 2 0.9 35 7.0 (0,0,0) 1.720±0.006 a 3 1.0 30 6.0 (1,−1,−1) 1.681±0.015 b 说明:不同小写字母表示差异显著(P<0.05) 表 2 Plackett-Burman 试验结果
Table 2. Results of Plackett-Burman design
试验号 A 牛肉膏 B 酵母粉 C 氯化镁 D 空白1 E 温度 F pH G 接菌量 H 空白2 I 时间 J 转速 K 空白3 吸光度 1 1 1 −1 1 1 1 −1 −1 −1 1 −1 1.235±0.078 f 2 −1 1 1 −1 1 1 1 −1 1 −1 −1 1.358±0.030 e 3 1 −1 1 1 −1 1 1 1 −1 −1 −1 1.563±0.058 b 4 −1 1 −1 1 1 −1 1 1 −1 −1 1 1.397±0.021 de 5 −1 −1 1 −1 1 1 −1 1 −1 1 1 0.981±0.042 h 6 −1 −1 −1 1 −1 1 1 −1 1 1 1 1.440±0.028 cd 7 1 −1 −1 −1 1 −1 1 1 1 1 −1 1.121±0.026 g 8 1 1 −1 −1 −1 1 −1 1 1 −1 1 1.756±0.010 a 9 1 1 1 −1 −1 −1 1 −1 −1 1 1 1.802±0.003 a 10 −1 1 1 1 −1 −1 −1 1 1 1 −1 1.783±0.012 a 11 1 −1 1 1 1 −1 −1 −1 1 −1 1 1.195±0.096 fg 12 −1 −1 −1 −1 −1 −1 −1 −1 −1 −1 −1 1.492±0.041 bc 说明:不同小写字母表示差异显著(P<0.05) 表 3 Plackett-Burman试验显著性分析结果
Table 3. Results of Plackett-Burman design
来源 均方和 自由度 均方 F P 显著性 效应系数 显著性排序 效应正负 模型 0.780 00 8 0.098 00 70.01 0.002 5 ** 1.430 A 牛肉膏 0.004 07 1 0.004 07 2.91 0.186 5 0.018 7 + B 酵母粉 0.200 00 1 0.200 00 141.15 0.001 3 ** 0.130 2 + C 氯化镁 0.004 84 1 0.004 84 3.46 0.159 8 0.020 5 + E 温度 0.540 00 1 0.540 00 387.22 0.000 3 ** −0.210 1 − F pH 0.017 00 1 0.017 00 12.45 0.038 7 * −0.038 3 − G 接菌量 0.004 76 1 0.004 76 3.40 0.162 2 −0.020 6 + I 时间 0.000 03 1 0.000 03 0.022 0.892 7 0.002 8 + J 转速 0.013 00 1 0.013 00 9.49 0.054 1 −0.033 4 − 说明:*表示差异显著(P<0.05),**表示差异极显著(P<0.01) 表 5 Box-Behnken试验设计
Table 5. Results of Box-Behnken design
试验序号 B 酵母粉/% E 温度/℃ F 初始pH 吸光度 试验序号 B 酵母粉/% E 温度/℃ F 初始pH 吸光度 1 0 0 0 1.505±0.007 g 10 1 −1 0 1.770±0.023 ab 2 0 1 1 0.922±0.014 j 11 −1 0 −1 1.634±0.021 f 3 1 0 1 1.655±0.035 ef 12 1 0 −1 1.670±0.007 ef 4 −1 −1 0 1.056±0.027 h 13 0 0 0 1.749±0.024 ef 5 0 0 0 1.661±0.018 ef 14 0 0 0 1.785±0.007 a 6 0 −1 −1 0.941±0.042 ig 15 −1 1 0 1.754±0.010 abc 7 −1 0 1 1.524±0.013 g 16 0 0 0 1.733±0.003 bc 8 0 1 −1 0.967±0.060 i 17 0 −1 1 1.727±0.009 cd 9 1 1 0 1.690±0.010 de 说明:不同小写字母表示差异显著(P<0.05) 表 6 Box-Behnken试验回归模型方差分析
Table 6. Variance analysis of regression model of Box-Behnken test
来源 均方和 自由度 均方 F 显著性 来源 均方和 自由度 均方 F 显著性 模型 1.638 00 9 0.182 00 182.747 ** B2 0.002 36 1 0.002 36 2.371 B 0.020 00 1 0.020 00 20.091 ** E2 0.820 50 1 0.820 00 824.161 ** E 0.756 00 1 0.756 00 759.257 ** F2 0.005 14 1 0.005 14 5.159 F 0.008 90 1 0.008 91 8.951 ** 残差 0.006 97 7 0.001 00 BE 0. 000 06 1 0.000 06 0.064 失拟项 0.004 91 3 0.001 64 3.179 不显著 BF 0.000 48 1 0.000 48 0.486 纯误差 0.002 06 4 0.000 52 EF 0.006 64 1 0.006 64 6.672 * 总和 1.644 00 16 说明:变异系数为2.08%,相关系数为0.995 8,校正决定系数为0.9903,预测系数为0.950 3。*表示显著差异(P<0.05),**表示极显 著差异(P<0.01) -
[1] 环境保护部和国土资源部. 全国土壤污染状况调查公报[EB/OL]. 2014-04-17[2020-03-31]. http://www.mee.gov.cn/gkml/sthjbgw/qt/201404/t20140417_270670.htm. [2] 牛之欣, 孙丽娜, 孙铁珩. 重金属污染土壤的植物-微生物联合修复研究进展[J]. 生态学杂志, 2009, 28(11): 2366 − 2373. NIU Zhixing, SUN Lina, SUN Teiheng. Plant-microorganism combined remediation of heavy metals-contaminated soils: its research progress [J]. Chin J Ecol, 2009, 28(11): 2366 − 2373. [3] 孟龙, 黄涂海, 陈謇, 等. 镉污染农田土壤安全利用策略及其思考[J]. 浙江大学学报(农业与生命科学版), 2019, 45(3): 263 − 271. MENG Long, HUANG Tuhai, CHEN Jian, et al. Safe utilization of farmland soil with cadmium pollution: strategies and deliberations [J]. J Zhejiang Univ Agric Life Sci, 2019, 45(3): 263 − 271. [4] 钱春香, 王明明, 许燕波. 土壤重金属污染现状及微生物修复技术研究进展[J]. 东南大学学报(自然科学版), 2013, 43(3): 669 − 674. QIAN Chunxiang, WANG Mingming, XU Yanbo. Current situation of soil contamination by heavy metals and research progress in bio-remediation technique [J]. J Southeast Univ Nat Sci Ed, 2013, 43(3): 669 − 674. [5] 蒋成斌. 重金属Cd2+高耐受和富集细菌的筛选与分析[D]. 成都: 西南交通大学, 2007. JIANG Chengbin. Selection and Analysis of Bacteria Higher Tolerance and Enrichment to Cd2+[D]. Chengdu: Southwest Jiaotong University, 2007. [6] 张欣, 范仲学, 郭笃发, 等. 3种微生物制剂对轻度镉污染土壤中菠菜生长的影响[J]. 天津农业科学, 2011, 17(1): 81 − 83, 87. ZHANG Xin, FAN Zhongxue, GUO Dufa, et al. Effects of microorganisms on the growth of spinach under Cd stress [J]. Tianjin Agric Sci, 2011, 17(1): 81 − 83, 87. [7] 王微, 李圆萍, 谢惠玲, 等. 铜绿假单胞菌菌剂载体的筛选[J]. 福建农林大学学报(自然科学版), 2016, 45(3): 325 − 330. WANG Wei, LI Yuanping, XIE Huiling, et al. Screening of carrier for Pseudomonas aeruginosa bacterial agent [J]. J Fujian Agric For Univ Nat Sci Ed, 2016, 45(3): 325 − 330. [8] 何小三, 王微, 肖清铁, 等. 铜绿假单胞菌对镉胁迫水稻苗期生长与镉积累的影响[J]. 中国生态农业学报, 2018, 26(6): 884 − 891. HE Xiaosan, WANG Wei, XIAO Qingtie, et al. Effects of Pseudomonas aeruginosa on the growth and cadmium accumulation in rice (Oryza sativa L.) seedling under Cd stress [J]. Chin J Eco-Agric, 2018, 26(6): 884 − 891. [9] 汪敦飞, 郑新宇, 肖清铁, 等. 铜绿假单胞菌对镉胁迫苗期水稻根系活力及叶片生理特性的影响[J]. 应用生态学报, 2019, 30(8): 2767 − 2774. WANG Dunfei, ZHENG Xinyu, XIAO Qingtie, et al. Effects of Pseudomonas aeruginosa on root activity and leaf physiological characteristics in rice (Oryza sativa L.) seedling under cadmium stress [J]. Chin J Appl Ecol, 2019, 30(8): 2767 − 2774. [10] BRAUD A, JÉZÉQUEL K, BAZOT S, et al. Enhanced phytoextraction of an agricultural Cr-and Pb-contaminated soil by bioaugmentation with siderophore-producing bacteria [J]. Chemosphere, 2008, 74(2): 280 − 286. [11] RANE M R, SARODE P D, CHAUDHARI B L, et al. Exploring antagonistic metabolites of established biocontrol agent of marine origin [J]. Appl Biochem Biotechnol, 2008, 151(2): 665 − 675. [12] 周丽英, 叶仁杰, 林淑婷, 等. 水稻根际耐镉细菌的筛选与鉴定[J]. 中国生态农业学报, 2012, 20(5): 597 − 603. ZHOU Liying, YE Renjie, LIN Shuting, et al. Screening and identification of cadmium-tolerant bacteria from rhizosphere soils under rice [J]. Chin J Eco-Agric, 2012, 20(5): 597 − 603. [13] 王永菲, 王成国. 响应面法的理论与应用[J]. 中央民族大学学报(自然科学版版), 2005, 14(3): 236 − 240. WANG Yongfei, WANG Chengguo. The application of response surface methodology [J]. J CUN Nat Sci Ed, 2005, 14(3): 236 − 240. [14] 李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用[J]. 实验室研究与探索, 2015, 34(8): 41 − 45. LI Li, ZHANG Sai, HE Qiang, et al. Application of response surface methodology in experiment design and optimization [J]. Res Explor Lab, 2015, 34(8): 41 − 45. [15] 郝学财, 余晓斌, 刘志钰, 等. 响应面方法在优化微生物培养基中的应用[J]. 食品研究与开发, 2006, 27(1): 38 − 41. HAO Xuecai, YU Xiaobin, LIU Zhiyu, et al. The application of response surface methodology in optimization of microbial media [J]. Food Res Dev, 2006, 27(1): 38 − 41. [16] 胡瑞萍, 丁贤, 李来好, 等. 响应面法优化枯草芽孢杆菌NHS1产芽孢发酵培养[J]. 生态学杂志, 2018, 37(2): 605 − 612. HU Ruiping, DING Xian, LI Laihao, et al. Optimization of fermentation medium composition by response surface methodology for the spore production of Bacillus subtilis [J]. Chin J Ecol, 2018, 37(2): 605 − 612. [17] 印杨, 伊艳杰, 李瑞芳, 等. 响应面法优化巨大芽孢杆菌RB10的发酵培养条件[J]. 生物技术, 2013, 23(2): 84 − 88. YIN Yang, YI Yanjie, LI Ruifang, et al. Optimization of fermentation conditions of Megaterium bacillus RB10 by response surface methodology [J]. Biotechnology, 2013, 23(2): 84 − 88. [18] 袁辉林. 植物促生菌培养优化及作用机理研究[D]. 北京: 中国林业科学研究院, 2011. YUAN Huilin. Plant Growth Promoting Rhizobacreria Cultication Optimization and Mechanism Research[D]. Beijing: Chinese Academy of Forestry, 2011. [19] 刘江红, 任静薇, 贾云鹏, 等. 响应面法优化S2菌株的培养条件[J]. 湖南大学学报(自然科学版), 2015, 42(6): 96 − 100. LIU Jianghong, REN Jingwei, JIA Yunpeng, et al. Optimization of culture conditions of S2 strain by response surface method [J]. J Hunan Univ Nat Sci, 2015, 42(6): 96 − 100. [20] 巩志金, 刘胜格, 梁鑫鑫, 等. 响应面法优化铜绿假单胞菌产鼠李糖脂发酵培养基的研究[J]. 中国酿造, 2017, 36(9): 127 − 131. GONG Zhijin, LIU Shengge, LIANG Xinxin, et al. Optimization of fermentation medium components for rhamnolipid production by Pseudomonas aeruginosa with response surface methodology [J]. China Brew, 2017, 36(9): 127 − 131. [21] 林瑞余, 肖清铁, 周丽英, 等. 1种镉耐性细菌及其抑制水稻吸收重金属镉的方法: CN103952333A [P]. 2014-07-30. [22] 李永红, 刘波, 赵宗保, 等. 圆红冬孢酵母菌发酵产油脂培养基及发酵条件的优化研究[J]. 生物工程学报, 2006, 22(4): 650 − 656. LI Yonghong, LIU Bo, ZHAO Zongbao, et al. Optimized culture medium and fermentation conditions forlipid production by Rhodosporidium toruloides [J]. Chin J Biotechnol, 2006, 22(4): 650 − 656. [23] 代志凯, 张翠, 阮征. 试验设计和优化及其在发酵培养基优化中的应用[J]. 微生物学通报, 2010, 37(6): 894 − 903. DAI Zhikai, ZHANG Cui, RUAN Zheng. The application of experimental design and optimization techniques in optimization of microbial medium [J]. Microbiol China, 2010, 37(6): 894 − 903. [24] 李志斌. 天然酵母中种面团及其制作方法: CN104757043A [P]. 2015-07-08. [25] 李芳, 刘波, 黄素芳. 温度对淡紫拟青霉NH-PL-03菌株培养特性及毒力的影响[J]. 中国生态农业学报, 2007, 15(4): 130 − 133. LI Fang, LIU Bo, HUANG Sufang. Effect of temperature on Paecilomyces lilacinus culture characteristics and its toxicity to Ditylenchus destructor [J]. Chin J Eco-Agric, 2007, 15(4): 130 − 133. [26] GOUVEIA E R, BAPTISTA-NETO A, Jr BADINO A C. Optimisation of medium composition for clavulanic acid production by Streptomyces clavuligerus [J]. Biotechnol Let, 2001, 23: 157 − 161. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20190587






 下载:
下载:


