-
喜树碱(camptothecin, CPT)是一种细胞毒性喹啉类生物碱,1966年由WALL等[1]首次从喜树Camptotheca acuminata中分离得到。作为植物源农药的喜树碱是一种昆虫不育剂[2],并且对昆虫有触杀和胃毒的作用[3];对黄瓜白粉病Sphaerotheca fuliginea、番茄灰霉病Botrytis cinerea等也有较好的防治效果[4]。因此,喜树碱在农业病虫害防治方面有较大的应用开发潜力。马比木Nothapodytes pittosporoides是茶茱萸科Icacinaceae假柴龙树属Nothapodytes灌木,又名海桐马比木、公黄珠子、追风伞[5]。主产于贵州、湖南、湖北、四川等地,入药能除湿、祛风、理气,主治湿痹、浮肿、疝气[6-7]。在马比木植株中,其根、茎、枝、叶、果实和种子中都含有喜树碱[8-10]。随着市场对喜树碱需求量不断增加,马比木作为喜树碱药源, 具有原料成本低的优点,是国家二级保护植物喜树的最佳替代品,已成为提取喜树碱的重要原料[11-13]。目前国内关于马比木中喜树碱提取工艺的研究较少,且基本采用的均为正交设计优化。本研究以马比木为原料,以喜树碱提取率作为优化指标,采用Box-Behnken响应面法对喜树碱的提取工艺进行了研究,以期为喜树碱提取工艺的优化提供科学依据。
-
高效液相色谱仪(型号1260,Agilent);高速多功能粉碎机(800Y-304,旭曼);超声波清洗器(DS-080S,工作频率40 kHz,东森);电子分析天平(ME204E,METTLER TLLEDO)。
-
马比木(购于贵州中药材市场, 主要为枝和叶),晒干后粉碎过60目筛。
-
甲醇(上海阿拉丁生化科技股份有限公司,分析纯);甲醇(北京百灵威科技有限公司,色谱纯);乙腈(北京百灵威科技有限公司,色谱纯);水为超纯水;喜树碱对照样品(纯度≥98%,合肥博美有限公司)。
-
称取喜树碱标准样品10.50 mg,置于容量瓶中,甲醇溶解稀释、定容至50 mL,配制质量浓度为0.21 g·L−1的喜树碱对照样品溶液,摇匀,备用。
-
称取粉碎后马比木粉末5.06 g,置于锥形瓶中,加入甲醇100 mL,室温下超声30 min,0.45 μm的微孔滤膜过滤,取续滤液备用。
-
色谱柱Alltima C18(4.6 mm×250.0 mm,5 μm);流动相为乙腈∶水=25∶75(V∶V);流速1.0 mL·min−1;检测波长254 nm;柱温30 ℃;进样量20 μL。
-
取对照样品溶液1.0、3.0、5.0、7.0、9.0 mL置于10 mL容量瓶中,甲醇定容至10 mL,按照1.2.3色谱条件进行检测。以喜树碱质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
-
称取粉碎后的马比木粉末10.16 g,置于锥形瓶中,加入甲醇100 mL,温度条件30 ℃,超声30 min,0.45 μm微孔滤膜过滤,取续滤液按照1.2.3色谱条件进行检测。根据以下公式计算喜树碱提取率(R1):R1=CV/1 000M×100%。其中:C表示提取液中喜树碱质量浓度(g·L−1),V表示溶剂体积(mL),M表示药材质量(g)。
-
称取粉碎后马比木粉末10 g,置于锥形瓶中,将3个实验因素:甲醇体积分数、超声时间、液料比中2个固定不变,1个作为变量进行单因素试验,0.45 μm微孔滤膜过滤,取续滤液在1.2.3色谱条件进行检测,平行3次,取平均值。
-
在单因素实验基础上,选择超声时间30 min、甲醇体积分数80%和液料比20 mL·g−1(溶剂体积∶药材质量=100∶5)3个因素进行优化实验。以喜树碱提取率为指标,采用Box-Behnken设计优化提取条件。因素水平如表1所示。
表 1 因素水平表
Table 1. Factors and levels
水平 A. 甲醇体积
分数/%B. 超声
时间/minC. 液料比/
(mL·g−1)−1 70 20 12(60∶5) 0 80 30 20(100∶5) 1 90 40 28(140∶5) -
响应面实验数据采用Designer-Expert 8.0软件进行处理,并对数据进行差异显著性分析。
-
为准确测量马比木中喜树碱的质量浓度,建立高效液相色谱法,以喜树碱质量浓度为横坐标(x),峰面积为纵坐标(y),计算得线性回归方程为:y=9×106x+902 381,相关系数R2=0.999 2,喜树碱质量浓度的线性范围为0.021~0.189 g·L−1。
-
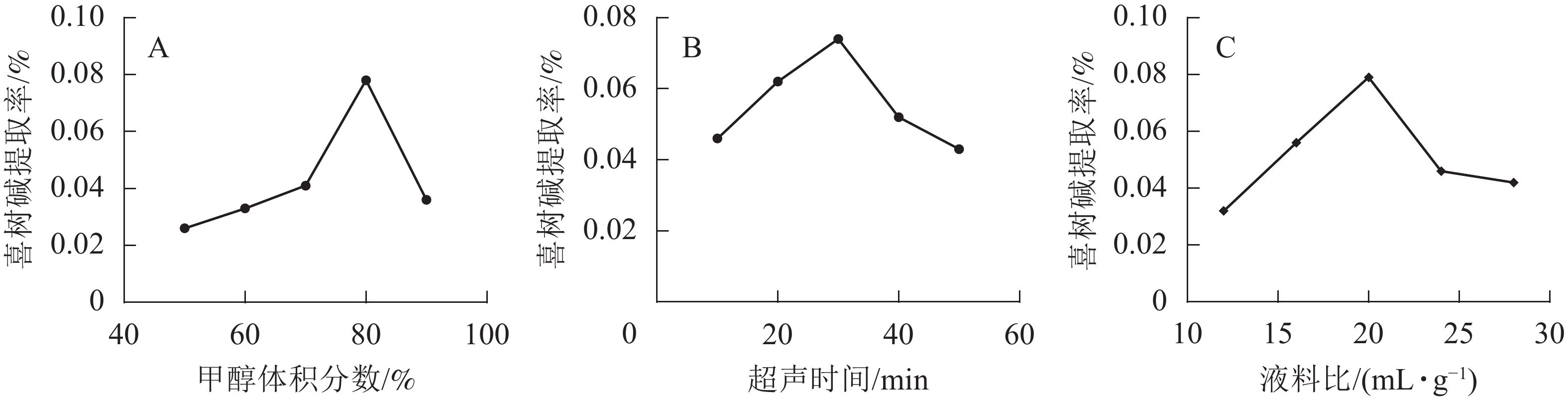
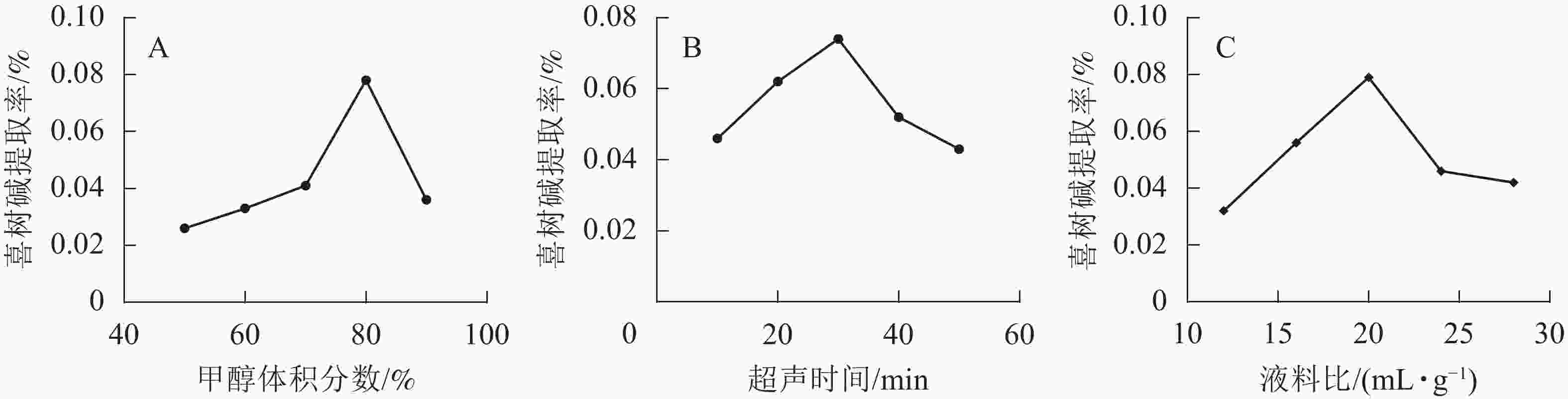
在超声时间为30 min,液料比为20 mL·g−1时,选取甲醇体积分数为50%、60%、70%、80%、90%的条件下进行提取。由图1A可知:随着甲醇体积分数的增大,喜树碱的提取率先增大后减小。当甲醇体积分数超过80%时,提取率开始减小。提高甲醇体积分数有利于喜树碱的提取,当甲醇体积分数>80%时,喜树碱提取率反而降低,可能由于随甲醇体积分数的提高,提取液极性减小,其中某些杂质的溶出增加,干扰了马比木的检测,提取率下降。当甲醇体积分数为80%时,提取率达最大值,因此选择甲醇体积分数为80%为宜。
-
在甲醇体积分数为80%,液料比为20 mL·g−1时,选取超声时间分别为10、20、30、40和50 min的条件下进行提取。由图1B可知:随超声时间的增加,喜树碱提取率先增加后减小,在超声时间为30 min时喜树碱提取率最高。这是因为随超声时间增加,喜树碱发生氧化的概率也会增大,使提取率降低,所以选择提取时间为30 min适宜。
-
在超声时间为30 min,甲醇体积分数为80%时,选取液料比分别为12、16、20、24和28 mL·g−1的条件进行提取。由图1C可知:随着液料比由小到大,喜树碱提取率先增加后减小,提取率最高的液料比为20 mL·g−1。随着溶剂的增多,马比木与溶剂之间能充分接触,有利于马比木溶解于溶剂中,当液料比超过20 mL·g−1后,已经达到饱和状态,再加就稀释了,喜树碱提取率下降,所以选择液料比20 mL·g−1较适宜。
-
依据单因素实验结果,初步选定甲醇体积分数80%、超声时间30 min和液料比20 mL·g−1为最佳提取条件,采用Box-Behnken响应面法对其进行优化,结果如表2所示。
表 2 Box-Behnken设计实验和结果
Table 2. Box-Behnken Design tests and results
实验号 A. 甲醇体积分数 B. 超声时间 C. 液料比 提取率R1/% 1 1 −1 0 0.043 2 0 0 0 0.108 3 −1 −1 0 0.062 4 0 −1 −1 0.057 5 0 0 0 0.113 6 0 1 −1 0.043 7 −1 0 −1 0.045 8 1 0 1 0.029 9 1 0 −1 0.043 10 0 1 1 0.078 11 0 −1 1 0.031 12 0 0 0 0.105 13 0 0 0 0.103 14 −1 1 0 0.056 15 0 0 0 0.106 16 −1 0 1 0.085 17 1 1 0 0.065 以喜树碱提取率为指标(R1),采用Designer-Expert 8.0软件进行二次多项式回归拟合,得到方程:R1=0.11−8.500×10−3A+6.125×10−3B+4.375×10−3C+7.000×10−3AB−0.014AC+0.015BC−0.026A2−0.024B2−0.030C2。其中:A表示甲醇体积分数,B表示超声时间,C表示液料比。多元回归模型的方差分析见表3。由ANVOA分析可知:在考察指标的二项式方程中,模型的F为24.59(P=0.000 2<0.001),说明回归模型极显著;拟合相关系数R2=0.969 3,调整系数R2Adj=0.929 9,失拟项显著(P=0.034 3<0.05)。该模型拟合程度较好,实验误差较小;信噪比较高,为12.503>4.000,说明该多元回归模型可预测马比木中喜树碱的最优提取工艺条件。
表 3 响应面回归模型ANOVA分析结果
Table 3. Response surface regression model ANOVA analysis results
方差来源 平方和 自由度 均方 F P 显著性 模型 0.013 9 1.469×10−3 24.59 0.000 2 *** A 5.780×10−4 1 5.780×10−4 9.67 0.017 1 * B 3.001×10−4 1 3.001×10−4 5.02 0.060 0 C 1.531×10−4 1 1.531×10−4 2.56 0.153 4 AB 1.960×10−4 1 1.960×10−4 3.28 0.113 0 AC 7.290×10−4 1 7.290×10−4 12.20 0.010 1 * BC 9.303×10−4 1 9.303×10−4 15.57 0.005 6 ** A2 2.874×10−3 1 2.874×10−3 48.10 0.000 2 *** B2 2.502×10−3 1 2.502×10−3 41.87 0.000 3 *** C2 3.885×10−3 1 3.885×10−3 65.02 <0.000 1 *** 残差 4.183×10−4 7 5.975×10−5 失拟项 3.603×10−4 3 1.201×10−4 8.28 0.034 3 误差 5.800×10−5 4 1.450×10−5 总和 0.014 16 说明:A. 甲醇体积分数;B. 超声时间;C. 液料比。*表示P<0.05;**表示P<0.01;***表示P<0.001 显著性检验结果表明:甲醇体积分数(A)、超声时间(B)、液料比(C)对马比木中喜树碱提取率的影响顺序依次为A、B、C。甲醇体积分数的二次项A2、超声时间的二次项B2、液料比的二次项C2对马比木中喜树碱的提取率有极显著影响(P<0.001);超声时间和液料比的交互项BC对马比木中喜树碱的提取率有极显著影响(P<0.01);甲醇体积分数A与甲醇体积分数和液料比的交互项AC对马比木中喜树碱的提取率有显著影响(P<0.05);超声时间B、液料比C、甲醇体积分数与超声时间的交互项AB对马比木中喜树碱提取率的影响不显著(P>0.05)。
相对于3个单因素的其中2个因素,采用Box-Behnken绘制三维响应面图,两两因素的交互作用对马比木中喜树碱提取率的影响见图2。由图2A可见:甲醇体积分数A的曲面较陡峭,超声时间B的曲面较平缓,说明甲醇体积分数对马比木中喜树碱提取率的影响比超声时间的影响大。由图2B可见:甲醇体积分数A的曲面较为陡峭,液料比C的曲面较为平缓,说明甲醇体积分数对马比木中喜树碱提取率的影响比液料比大。由图2C可见:超声时间B的曲面较陡,液料比C的曲面较为平缓,表明超声时间对马比木中喜树碱提取率的影响比液料比的影响大。可见,在选择的3个单因素中,甲醇体积分数A对马比木中喜树碱的提取率的影响显著,表现为其曲线较陡;在两两因素交互作用中,甲醇体积分数与液料比的交互作用(AC)对马比木中喜树碱的提取率影响显著,超声时间与液料比的交互作用(BC)对马比木中喜树碱的提取率影响显著。
-
根据模型预测,得到马比木中喜树碱提取的最优工艺为:甲醇体积分数46.4%,超声时间26.1 min,液料比21.20 mL·g−1。在此条件下进行3次平行实验,测得喜树碱提取率分别为0.080 4%、0.082 6%、0.082 1%,与模型预测值接近,平均误差3.2%,表明模型能较好地预测喜树碱实际提取率。
-
本研究以马比木为原料,以喜树碱提取率作为优化指标,在单因素实验基础上,选取甲醇体积分数、超声时间和液料比3个因素,通过Box-Behnken响应面法对17组实验进行分析,在整个区域得到回归方程,可以直观反映出各个因素对喜树碱提取率的影响。优化的最优工艺为:甲醇体积分数46.4%,超声时间26.1 min,液料比21.20 mL·g−1,喜树碱提取率为0.084 4%。3次验证实验结果显示:提取率平均误差3.2%。说明本次建立的拟合模型较为成功,可以为马比木中喜树碱的提取应用提供一定的参考。
Optimization of camptothecin extraction process from Nothapodytes pittosporoides by Box-Behnken response surface method
-
摘要:
目的 应用响应面法及超声波辅助优化马比木Nothapodytes pittosporoides中喜树碱的提取工艺。 方法 采用高效液相色谱法测定喜树碱含量,以市售马比木为研究对象,在单因素实验的基础上,选取甲醇体积分数、液料比及超声时间为影响因素,喜树碱提取率为响应值,通过Box-Behnken响应面法设计3因素3水平实验,确定最优提取工艺。 结果 最优提取工艺为甲醇体积分数46.4%,超声时间26.1 min,液料比21.20 mL·g−1,喜树碱的提取率为0.084 4%,二项式拟合相关系数R2为0.969 3,预测值与实验值偏差为3.2%。 结论 采用Box-Behnken优化马比木中喜树碱提取工艺,精确度高,预测值与实验值吻合度较高,预测性良好。图2表3参13 Abstract:Objective This study aims to optimize extraction process of camptothecin from Nothapodytes pittosporoides by response surface method and ultrasonic wave. Method The content of camptothecin was determined by high performance liquid chromatography, and N. pittosporoides wood available on the market was used as the research object. Based on the single factor experiment, methanol concentration, liquid to solid ratio and ultrasonic time were taken as the influencing factors, and the extraction rate of camptothecin as the response value. Box-Behnken response surface method was used to design the experiment with 3 factors and 3 levels, so as to determine the optimal extraction process. Result The optimal extraction process was as follows: methanol concentration 46.4%, ultrasonic time 26.1 min, liquid to solid ratio 21.20 mL·g−1, extraction rate of camptothecin 0.084 4%, binomial fitting correlation coefficient R2 0.969 3, and deviation between the predicted value and the experimental value 3.2%. Conclusion Box-Behnken can be used to optimize the extraction process of camptothecin from N. pittosporoides, with high precision and good predictability. [Ch, 2 fig. 3 tab. 13 ref.] -
表 1 因素水平表
Table 1. Factors and levels
水平 A. 甲醇体积
分数/%B. 超声
时间/minC. 液料比/
(mL·g−1)−1 70 20 12(60∶5) 0 80 30 20(100∶5) 1 90 40 28(140∶5) 表 2 Box-Behnken设计实验和结果
Table 2. Box-Behnken Design tests and results
实验号 A. 甲醇体积分数 B. 超声时间 C. 液料比 提取率R1/% 1 1 −1 0 0.043 2 0 0 0 0.108 3 −1 −1 0 0.062 4 0 −1 −1 0.057 5 0 0 0 0.113 6 0 1 −1 0.043 7 −1 0 −1 0.045 8 1 0 1 0.029 9 1 0 −1 0.043 10 0 1 1 0.078 11 0 −1 1 0.031 12 0 0 0 0.105 13 0 0 0 0.103 14 −1 1 0 0.056 15 0 0 0 0.106 16 −1 0 1 0.085 17 1 1 0 0.065 表 3 响应面回归模型ANOVA分析结果
Table 3. Response surface regression model ANOVA analysis results
方差来源 平方和 自由度 均方 F P 显著性 模型 0.013 9 1.469×10−3 24.59 0.000 2 *** A 5.780×10−4 1 5.780×10−4 9.67 0.017 1 * B 3.001×10−4 1 3.001×10−4 5.02 0.060 0 C 1.531×10−4 1 1.531×10−4 2.56 0.153 4 AB 1.960×10−4 1 1.960×10−4 3.28 0.113 0 AC 7.290×10−4 1 7.290×10−4 12.20 0.010 1 * BC 9.303×10−4 1 9.303×10−4 15.57 0.005 6 ** A2 2.874×10−3 1 2.874×10−3 48.10 0.000 2 *** B2 2.502×10−3 1 2.502×10−3 41.87 0.000 3 *** C2 3.885×10−3 1 3.885×10−3 65.02 <0.000 1 *** 残差 4.183×10−4 7 5.975×10−5 失拟项 3.603×10−4 3 1.201×10−4 8.28 0.034 3 误差 5.800×10−5 4 1.450×10−5 总和 0.014 16 说明:A. 甲醇体积分数;B. 超声时间;C. 液料比。*表示P<0.05;**表示P<0.01;***表示P<0.001 -
[1] WALL M E, WANI M C, COOK C E, et al. Plant antitumor agents, the isolation and structure of Camptothecin, a novel alkaloidal leukaemia and tumor inhibitor from Camptotheca acuminata [J]. J Am Chem Soc, 1966, 88(16): 3888 − 3890. [2] 曾庆钱, 郑海, 黄意成, 等. 喜树采后生理调控对喜树碱次生代谢的影响[J]. 广东化工, 2017, 44(16): 69 − 70. ZENG Qingqian, ZHENG Hai, HUANG Yicheng, et al. Effects of post-harvest physiological regulation on secondary metabolism of Camptothecin [J]. Guangdong Chem Ind, 2017, 44(16): 69 − 70. [3] 吴海霞, 洪仁辉, 苟志辉, 等. 喜树碱在喜树体内分布及在有害生物防治上的应用[J]. 热带林业, 2014, 42(4): 39 − 42. WU Haixia, HONG Renhui, GOU Zhihui, et al. The distribution of camptothecin in Camptotheca acuminata Decaisne and its usage in pest control [J]. Trop For, 2014, 42(4): 39 − 42. [4] 毛胜凤, 周湘, 范闻春, 等. 喜树碱对番茄灰霉病菌的毒理效应[J]. 浙江农林大学学报, 2015, 32(4): 585 − 589. MAO Shengfeng, ZHOU Xiang, FAN Wenchun, et al. Toxicological effects of camptothecin on Botrytis cinerea [J]. J Zhejiang A&F Univ, 2015, 32(4): 585 − 589. [5] 陈旭, 雷帮星, 文庭池, 等. 1株马比木植物内生真菌Trichoderma sp. 抗癌活性研究[J]. 时珍国医国药, 2017, 28(3): 522 − 525. CHEN XU, LEI Bangxing, WEN Tingchi, et al. Anticancer activity of an endophytic fungus Trichoderma sp. [J]. Lishizhen Med Mater Med Res, 2017, 28(3): 522 − 525. [6] 白永花, 宋启示. 马比木根的化学成分研究[J]. 天然产物研究与开发, 2014, 26(2): 197 − 201. BAI Yonghua, SONG Qishi. Chemical constituents from the roots of Nothapodytes pittosporoides [J]. Nat Prod Res Dev, 2014, 26(2): 197 − 201. [7] 杨艳, 王道平, 李齐激, 等. SPME-GC-MS分析马比木中挥发性成分[J]. 信阳师范学院学报(自然科学版), 2016, 29(3): 435 − 438. YANG Yan, WANG Daoping, LI Qiji, et al. Analysis natural volatile constituents of Nothapodytes pittosporoides with SPME-GC-MS [J]. J Xinyang Norm Univ Nat Sci Ed, 2016, 29(3): 435 − 438. [8] 白永花, 宋启示. 马比木根中喜树碱和9-甲氧基喜树碱的HPLC分析[J]. 药物分析杂志, 2014, 34(1): 100 − 103. BAI Yonghua, SONG Qishi. HPLC analysis of camptothecin and 9-methoxycamptothecin in the roots of Nothapodytes pittosporoides [J]. Chin J Pharm Anal, 2014, 34(1): 100 − 103. [9] 周翔, 林森, 罗娅君, 等. 喜树果和马比木中喜树碱含量的比较[J]. 食品与发酵科技, 2014, 50(2): 89 − 91. ZHOU Xiang, LIN Sen, LUO Yajun, et al. Comparison of camptothecin content in Camptotheca acuminata fruit and mappia foetida [J]. Food Ferment Technol, 2014, 50(2): 89 − 91. [10] 刘盛权, 于敬亮, 刘振德, 等. 马比木根中喜树碱提取液稳定剂的优化[J]. 中药材, 2016, 39(3): 603 − 605. LIU Shengquan, YU Jingliang, LIU Zhende, et al. Optimization of stabilizing agent of camptothecin extraction from Nothapodytes pittosporoides roots [J]. J Chin Med Mater, 2016, 39(3): 603 − 605. [11] 高渐飞, 张凡, 杨艳, 等. 马比木不同部位喜树碱含量测试分析[J]. 绿色科技, 2018(1): 1 − 5. GAO Jianfei, ZHANG Fan, YANG Yan, et al. Camptothecin contents and transfer process in different parts of Nothapodytes pittosporoides [J]. J Green Sci Technol, 2018(1): 1 − 5. [12] 罗娅君, 边清泉, 罗英, 等. 大孔树脂吸附马比木中喜树碱的工艺[J]. 中成药, 2015, 37(8): 1859 − 1862. LUO Yajun, BIAN Qingquan, LUO Ying, et al. Process for adsorbing camptothecin in macrobiporous resin [J]. Chin Tradit Pat Med, 2015, 37(8): 1859 − 1862. [13] 卞赛男, 常鹏杰, 王宁杭, 等. 氮素形态对喜树叶片生长、叶绿素荧光参数及叶绿体相关基因表达的影响[J]. 浙江农林大学学报, 2019, 36(5): 908 − 916. BIAN Sainan, CHANG Pengjie, WANG Ninghang, et al. Leaf growth, chlorophyll fluorescence characteristics, and expression of photosystem-related genes in Camptotheca acuminata with different N forms’ fertilization [J]. J Zhejiang A&F Univ, 2019, 36(5): 908 − 916. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20190533






 下载:
下载: