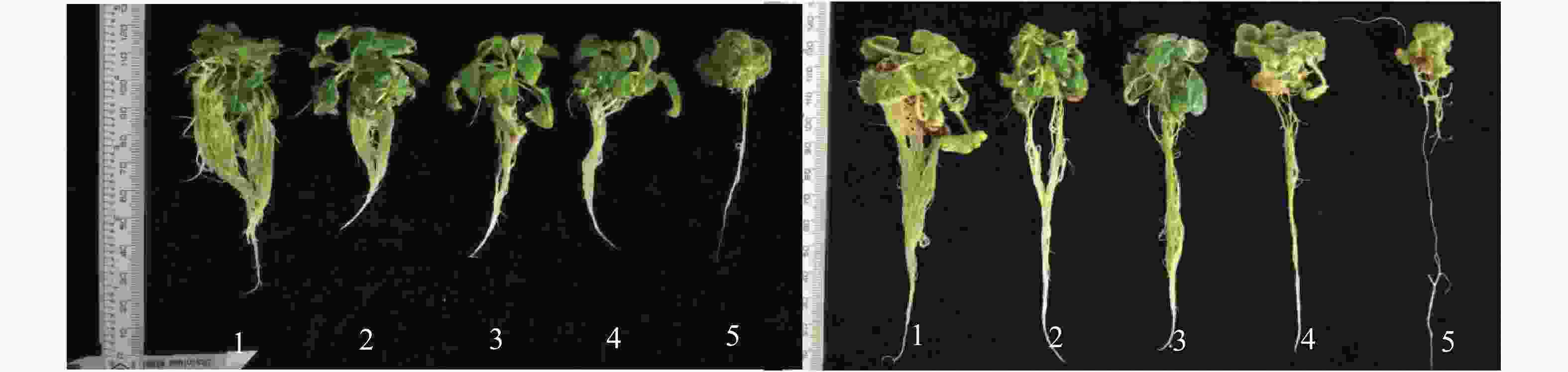
-
铝毒害是目前酸性土壤中限制植物生长及矿物质吸收而导致减产的主要因子[1-2]。一般情况下,铝以难溶性硅酸盐或氧化铝的形式存在,对植物没有毒害,但当土壤pH<5时,硅酸盐或氧化铝就在酸性条件下转变为溶解状态进入土壤中,可溶性的铝(主要是Al3+)对大多数植物都会产生毒害[3-4]。植物具体表现为根长生长受抑制,生根数量减少;细胞壁和细胞膜遭到破坏,透性增大,细胞内的可溶性物质外渗,体内酶活性受到影响等[5-6]。为了消除或者减缓伤害,植物一方面通过根系分泌有机酸来缓解胁迫[7],另一方面通过积累脯氨酸、可溶性糖等渗透调节物质,提高氧化酶系统酶活性来维持细胞正常生活状态。绣球属Hydrangea为虎耳草科Saxifragaceae植物,其花色在酸性土壤中呈蓝色,在碱性土壤中呈红色,而酸性土壤中铝离子的存在对蓝色花的形成有着重要作用,因此,探究绣球耐铝性一方面为铝污染地区植物栽培应用提供依据,另一方面在调控绣球花色时的硫酸铝施用量提供参考依据。目前,中国对铝胁迫的研究大都集中在农作物[1-3],对观赏植物研究较少,对绣球耐铝机制的研究仅集中在少数耐铝品种[8-10],缺乏对野生种的探究。野生种未经驯化移栽,可能保留了更多的耐性基因,因此,本研究以蜡莲绣球Hydrangea strigosa与莼兰绣球Hydrangea longipes 2个野生种组培苗为材料,研究绣球野生种在不同质量浓度铝胁迫下的生长及生理特性,探究其耐铝机制,为抗铝毒植物的应用和酸性土壤特殊资源的利用奠定基础。
-
蜡莲绣球和莼兰绣球组培苗由种子经过组织培养获得。蜡莲绣球种子采自甘肃省陇南市徽县嘉陵镇吴家咀山区,莼兰绣球种子采自陕西省西安市太平国家森林公园。
-
将株高约2 cm且长势一致的无菌幼苗接种于1/2MS+0.2 mg·L−1 IBA生根培养基上,蔗糖30 g·L−1,琼脂4 g·L−1,pH=4.5。用氯化铝溶液作为胁迫液,设0(ck)、25、50、100、200 mg·L−1 5个质量浓度梯度。每个处理接种10瓶,1瓶接种1株,重复3次。将试材置于温度为25 ℃,光照度为 2 000 lx,光暗比为 12 h/12 h的组培室内进行培养。
-
铝胁迫处理1个月后进行叶片生理指标的测定,随机选取5瓶,剪取植株中部成熟叶片,剪碎混合后称量,测定指标有丙二醛(MDA)质量摩尔浓度、叶绿素质量分数、脯氨酸(Pro)质量分数、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和过氧化氢酶(CAT)活性。测定方法参照李合生[11]和高俊凤[12]的方法稍有改动。铝胁迫处理2个月后,采用直接计数法对生根率进行统计,直接测量根长以及根球底面东西方向与南北方向直径,计算平均根长和根体积。
-
采用SPSS 19对数据进行方差分析,采用LSD进行多重比较,Excel进行图表绘制。
-
从图1可知:胁迫1个月后,2种绣球在氯化铝(0~100 mg·L−1)处理下的组培苗长势差别不大,200 mg·L−1处理下的组培苗叶色发黄、植株矮小,小叶数明显少于其他处理组。2个月后,蜡莲绣球0、25和50 mg·L−1处理下的组培苗长势基本一致,100 mg·L−1处理下的组培苗叶片有发黄现象,长势减弱,200 mg·L−1处理下长势最弱。莼兰绣球25、50 mg·L−1处理下的组培苗有所生长,但长势弱于对照组,100、200 mg·L−1处理下的组培苗生长不良,叶片失绿严重。当氯化铝质量浓度大于100 mg·L−1时,2种绣球都受到严重伤害,生长受阻。
-
从表1可知:在氯化铝质量浓度为0~100 mg·L−1时,蜡莲绣球生根率均达到100%,可见在0~100 mg·L−1范围内,氯化铝对蜡莲绣球生根率没有产生抑制作用。当氯化铝质量浓度为200 mg·L−1时,生根率为96.67%,与对照组差异不显著。对照组的平均根长最大,为5.61 cm,200 mg·L−1处理组平均根长最小,为3.12 cm。25 mg·L−1处理组与对照组差异不显著,其他处理组显著低于对照组(P<0.05)。根体积随着氯化铝质量浓度的增加呈现逐渐下降的趋势,且对照组与其他处理组差异达显著水平(P<0.05)。生根情况见图2。
表 1 铝胁迫对2种绣球组培苗生根指标的影响
Table 1. Effects of aluminum stress on rooting indexes of Hydrangea tissue culture seedlings
种 氯化铝/
(mg·L−1)生根率/% 平均根长/cm 根体积/cm3 蜡莲绣球 0 100.00 a 5.61±0.45 a 7.35±2.97 a 25 100.00 a 4.85±0.37 ab 2.79±0.76 b 50 100.00 a 4.22±0.32 b 1.85±0.44 b 100 100.00 a 4.27±0.39 b 0.68±0.21 b 200 96.67 a 3.12±0.53 b 0.43±0.23 b 莼兰绣球 0 100.00 a 6.07±0.41 a 3.45±0.92 a 25 100.00 a 5.36±0.21 a 1.22±0.47 b 50 100.00 a 5.60±0.10 a 0.26±0.08 b 100 100.00 a 5.63±0.29 a 0.12±0.02 b 200 93.33 b 2.26±0.36 b 0.02±0.00 b 说明:不同字母表示在0.05水平上差异显著(P<0.05) 莼兰绣球生根率在氯化铝质量浓度为0~100 mg·L−1时均为100%,200 mg·L−1处理组的生根率为93.33%,显著低于其他处理组(P<0.05),可知200 mg·L−1处理可显著抑制莼兰绣球生根。对照组的平均根长最大为6.07 cm,200 mg·L−1处理组根长最小,为2.26 cm,对照组与25、50、100 mg·L−1处理组平均根长差异性均不显著,与200 mg·L−1处理组差异达显著水平(P<0.05)。随着氯化铝质量浓度的增加,莼兰绣球根体积呈现逐渐下降的趋势,对照组与其他处理组差异达显著水平(P<0.05),说明铝胁迫对莼兰绣球的根体积产生了抑制作用。生根情况见图2。
-
植物通过光合作用进行有机物的积累,叶绿素的高低与光合作用有关。从表2可知:在氯化铝胁迫下,蜡莲绣球叶绿素a、叶绿素b、叶绿素a+b质量分数经质量浓度为50 mg·L−1氯化铝处理后有所提高,分别比对照组增加了8.97%、13.33%、9.26%。200 mg·L−1处理后的叶绿素的质量分数最低,且对照组与各铝胁迫处理间差异均不显著,表明蜡莲绣球叶绿素质量分数受铝胁迫影响不大,50 mg·L−1的处理对蜡莲绣球叶绿素合成有一定的促进作用。
表 2 铝胁迫对2种绣球组培苗叶绿素质量分数的影响
Table 2. Effect of aluminum stress on chlorophyll content of Hydrangea tissue culture seedlings
种 氯化铝/
(mg·L−1)叶绿素a/
(mg·g−1)叶绿素b/
(mg·g−1)叶绿素a+b/
(mg·g−1)蜡莲绣球 0 0.78±0.20 a 0.30±0.08 a 1.08±0.28 a 25 0.73±0.29 a 0.29±0.11 a 1.02±0.41 a 50 0.85±0.07 a 0.34±0.03 a 1.18±0.10 a 100 0.78±0.01 a 0.30±0.04 a 1.07±0.05 a 200 0.68±0.03 a 0.20±0.14 a 0.88±0.18 a 莼兰绣球 0 1.18±0.15 a 0.50±0.05 a 1.68±0.20 a 25 0.78±0.08 b 0.32±0.03 b 1.10±0.11 b 50 0.67±0.17 b 0.30±0.07 b 0.97±0.24 b 100 0.58±0.16 b 0.23±0.06 b 0.81±0.20 b 200 0.22±0.12 c 0.09±0.05 c 0.32±0.17 c 说明:不同字母表示在0.05水平上差异显著(P<0.05) 莼兰绣球叶绿素a、叶绿素b、叶绿素a+b质量分数随着氯化铝质量浓度的增加呈现下降的趋势。氯化铝胁迫处理组的叶绿素质量分数显著低于对照组(P<0.05),表明在铝胁迫下莼兰绣球叶绿素的合成受到抑制。
-
从表3可知:随着氯化铝质量浓度的增加,2种绣球叶片MDA质量摩尔浓度呈现先下降后上升的趋势。蜡莲绣球MDA质量摩尔浓度在25、50 mg·L−1氯化铝处理下,与对照组相比分别下降了13.51%、13.22%,在100、200 mg·L−1处理下,与对照相比分别提高了3.44%、7.47%。方差分析表明:蜡莲绣球对照组MDA质量摩尔浓度与铝胁迫处理组间差异性不显著。莼兰绣球MDA质量摩尔浓度在25、50 mg·L−1氯化铝处理下,与对照相比分别下降了12.13%、6.62%,在100、200 mg·L−1处理下,与对照组相比分别提高了12.13%、22.43%。莼兰绣球对照组MDA质量摩尔浓度与铝胁迫处理组间差异不显著。可知较低质量浓度的氯化铝胁迫不会对绣球膜系统造成伤害。氯化铝质量浓度大于100 mg·L−1后,植物膜系统会受到一定程度的损伤。
表 3 铝胁迫对绣球组培苗生理指标的影响
Table 3. Effects of aluminum stress on physiological indexes of Hydrangea tissue culture seedlings
种 氯化铝/
(mg·L−1)MDA/
(×10−2 μmol·g−1)Pro/
(μg·g−1)CAT活性/
(×16.67 nkat·g−1·min−1)SOD活性/
(×16.67 nkat·g−1)POD活性/
(×16.67 nkat·g−1·s−1)蜡莲绣球 0 3.40±0.54 a 30.79±1.89 a 2.96±0.57 b 372.41±2.47 a 553.25±33.27 a 25 3.01±0.55 a 30.77±2.16 a 2.97±0.58 b 371.90±7.86 a 554.74±29.89 a 50 3.02±0.25 a 32.52±3.91 a 3.59±0.68 ab 367.34±4.89 a 570.44±23.56 a 100 3.60±0.05 a 31.71±2.14 a 3.92±0.52 ab 364.44±5.86 a 593.59±16.10 a 200 3.74±0.18 a 43.13±8.98 a 5.49±1.17 a 366.51±7.64 a 655.73±86.45 a 莼兰绣球 0 2.72±0.36 a 79.05±3.04 b 4.62±1.19 a 389.24±3.21 a 417.76±39.83 c 25 2.39±0.32 a 80.06±7.65 b 5.89±2.93 a 378.19±2.70 a 562.57±34.05 b 50 2.54±0.76 a 79.22±9.04 b 7.61±1.69 a 373.34±4.89 a 586.71±53.88 b 100 3.05±0.52 a 87.25±7.34 a 13.01±5.50 a 378.67±10.30 a 595.71±11.78 b 200 3.33±0.20 a 100.46±5.16 a 14.72±3.62 a 372.10±5.77 a 798.41±26.64 a 说明:不同字母表示在0.05水平上差异显著(P<0.05) -
从表3可知:蜡莲绣球Pro质量分数在铝胁迫处理下变化与对照组相比差异不显著,在铝胁迫质量浓度为25 mg·L−1时,Pro质量分数降到最低,为30.77 μg·g−1;铝胁迫质量浓度为200 mg·L−1时,Pro质量分数最高,为43.13 μg·g−1,是对照组的1.40倍。莼兰绣球对照组的Pro质量分数最低,为79.05 μg·g−1,各铝胁迫处理组的Pro质量分数均高于对照组,对照组与25、50 mg·L−1处理组间差异性不显著,与100、200 mg·L−1处理组差异达显著水平(P<0.05)。
-
CAT的主要作用是清除过氧化氢(H2O2),CAT活性的提高有助于植物清除H2O2。从表3可知:随着氯化铝质量浓度的增加,2种绣球叶片CAT活性呈现不断上升的趋势。蜡莲绣球在200 mg·L−1处理下CAT活性值最大,为5.49×16.67 nkat·g−1·min−1,比对照组提高了85.47%,且与对照组差异显著(P<0.05)。莼兰绣球在200 mg·L−1处理下,CAT活性值最大,为14.72×16.67 nkat·g−1·min−1,对照组与铝胁迫处理组间差异性不显著。表明绣球通过提高CAT活性来清除体内过量的H2O2,且蜡莲绣球CAT活性提高幅度高于莼兰绣球。
SOD是植物体内的一种含金属酶,它能催化O2−发生歧化反应,生成氧气(O2)和H2O2,以此来保护细胞膜系统。从表3可知:经过氯化铝胁迫处理的2种绣球叶片的SOD活性值均低于对照组,但对照组与各铝胁迫处理组间差异不显著。蜡莲绣球的SOD活性在100 mg·L−1处理下降到最低,为364.44×16.67 nkat·g−1,莼兰绣球的SOD活性在200 mg·L−1处理下降到最低,为372.10×16.67 nkat·g−1。绣球的SOD活性变化比较平缓,原因可能是SOD在与O2−反应后质量分数趋于平衡。
POD是抗氧化酶系统中重要的酶类,在植物受到逆境胁迫时,POD可分解一定的H2O2,减少H2O2对细胞膜的伤害。从表3可知:随着氯化铝质量浓度的增加,2种绣球叶片POD活性呈现不断上升的趋势。蜡莲绣球在200 mg·L−1处理下,POD活性最大,为655.73×16.67 nkat·g−1·s−1,对照组与各铝胁迫处理组间差异不显著。莼兰绣球在25、50、100、200 mg·L−1处理组的POD活力比对照组分别提高了34.66%、40.44%、42.60%、91.12%,对照组与各铝胁迫处理组间差异显著(P<0.05)。表明绣球通过提高POD活力来清除体内过量的H2O2,且莼兰绣球POD活性提高幅度高于蜡莲绣球。
-
通常认为,铝对植物有毒害作用,铝胁迫会导致植物细胞膜结构和功能遭到破坏,使细胞膜透性增大,稳定性下降[13]。铝还可以与细胞内的蛋白质、脂质、糖类以及核酸等结合,破坏细胞内离子代谢平衡系统,阻碍生理生化过程的正常进行,从而抑制植物的生长[14]。但也有研究发现[15]:铝作为植物非必需元素,低浓度的铝元素可以促进植物生长,高浓度的铝元素会对植物造成伤害,而且植物的形态特征变化可直接体现出植物抗性的强弱[16-17]。本研究结果显示:铝胁迫2个月后,蜡莲绣球在低质量浓度铝处理下的组培苗长势与对照组相当,高质量浓度处理下的组培苗叶片发黄、长势减弱。莼兰绣球铝处理组长势不及对照组,氯化铝质量浓度越高长势越弱。平均根长与根体积随着铝胁迫质量浓度的增加呈现下降的趋势。陈海霞等[7]对八仙花Hydrangea macrophylla铝胁迫根系分泌有机酸的研究表明:铝毒对根尖的伤害包括抑制细胞分裂、细胞伸长和营养运输等,使根的生长受到抑制。本研究中铝胁迫对绣球地上和地下部分生长均有抑制作用,当氯化铝质量浓度大于100 mg·L−1时,抑制作用较明显。
叶绿素是植物光合作用必不可少的物质,叶绿素含量与植物对光能的捕获能力成正相关。在金属胁迫下,叶绿素合成酶活性降低导致叶绿素合成受阻,叶绿素含量降低,从而影响到植物光合作用有机物的积累[18]。本研究中,蜡莲绣球叶绿素质量分数在50 mg·L−1氯化铝处理时高于对照组,这可能是植物为了弥补铝胁迫造成叶绿素功能降低损害而大量合成叶绿素。各处理组与对照组差异不显著,说明铝胁迫对蜡莲绣球叶绿素质量分数影响较小。莼兰绣球叶绿素质量分数随着铝胁迫质量浓度的增加呈现下降的趋势,对照组与各铝胁迫处理组差异达显著水平(P<0.05),说明铝胁迫对莼兰绣球叶绿体的结构功能以及叶绿素的合成途径造成了伤害。
细胞膜是细胞与外界环境的屏障,参与生物体中物质代谢、能量转化、代谢调控以及激素的作用等[19]。MDA是植物膜脂过氧化的主要产物之一,其含量与植物膜系统受到的损伤呈正相关,当MDA含量增加时,说明植物体内膜脂过氧化作用增强,细胞膜透性增大[20]。本研究中,随着铝质量浓度的增加,蜡莲绣球与莼兰绣球MDA质量摩尔浓度呈现先下降后上升的趋势,说明低质量浓度氯化铝处理不会对细胞膜透性造成伤害,高质量浓度处理会使绣球组培苗细胞膜透性增大,但受伤程度不大。
Pro是植物体内重要的渗透调节物质和抗氧化物质,具有调节细胞渗透势以及减缓膜脂过氧化伤害的功能。当植物受到胁迫时,体内的Pro增加以提高抗性[21]。本研究中,蜡莲绣球Pro质量分数在铝胁迫处理下变化与对照组相比差异不显著,Pro质量分数相对稳定说明蜡莲绣球受到伤害较小,耐铝性强。莼兰绣球各铝胁迫处理组的Pro质量分数均高于对照组,200 mg·L−1处理组与对照组差异显著(P<0.05),说明莼兰绣球体内抗铝机制在起作用,以抵御铝胁迫造成的伤害。
植物在正常生长情况下,体内产生的活性氧自由基可通过抗氧化酶系统清除,从而达到平衡状态。在金属胁迫下,植物体内活性氧自由基含量会上升。活性氧升高会使抗氧化酶活性增加。各种抗氧化酶中,SOD、POD和CAT可有效降解活性氧、保护细胞膜、降低氧化应激,是清除活性氧的最重要的酶[22-24]。田小霞等[23]对马蔺Iris lactea var. chinensis的研究表明:叶片CAT活性高于根系CAT活性,原因是 CAT主要参与清除绿色组织中光呼吸途径代谢产生的H2O2。本研究中,2种绣球叶片的SOD活性无明显变化规律,对照组与铝胁迫处理组间差异不显著,可能是采样时间较晚;SOD在胁迫早期活性增加,1个月后趋于平衡,对铝胁迫表现出一定的适应性。CAT和POD活性随着铝质量浓度的增加呈现不断上升的趋势。3种酶起了协同作用,共同清除活性氧自由基等有害物质。
综上所述,2种绣球均有一定的耐铝性。植物体内的抗铝机制极其复杂,不同绣球野生种由于遗传物质的差异,抗铝能力不同。在以后的研究中,需要测定组培苗地上、地下部分以及培养基中铝的含量和存在形态,以探究绣球富集铝的能力,进一步揭示绣球的抗铝机制。
Effect of aluminum stress on growth and physiological characteristics of Hydrangea tissue culture seedlings
-
摘要:
目的 探究蜡莲绣球Hydrangea strigosa和莼兰绣球Hydrangea longipes组培苗的耐铝能力,为抗铝植物的应用和酸性土壤特殊资源的利用奠定基础。 方法 以蜡莲绣球和莼兰绣球组培苗为试验材料,研究培养基中不同氯化铝质量浓度(0、25、50、100、200 mg·L−1)对绣球组培苗生长及生理特性的影响。 结果 较低质量浓度铝胁迫下(25、50 mg·L−1),蜡莲绣球生长正常,长势与对照组相当,莼兰绣球长势不及对照组;中高质量浓度铝胁迫下(100、200 mg·L−1),组培苗长势明显减弱,平均根长和根体积均低于对照组,表明铝胁迫对绣球的地上与地下部分均产生了抑制作用。随着铝胁迫质量浓度的增加,蜡莲绣球叶绿素质量分数在50 mg·L−1时有所增加,莼兰绣球叶绿素质量分数呈现不断下降趋势,表明蜡莲绣球在低质量浓度铝胁迫时促进了叶绿素合成,莼兰绣球在铝胁迫下叶绿素受损。蜡莲绣球与莼兰绣球叶片丙二醛质量摩尔浓度先下降后上升,过氧化氢酶和过氧化物酶活性不断增强,超氧化物歧化酶活性均低于对照组,但差异不显著。蜡莲绣球脯氨酸质量分数在氯化铝质量浓度25 mg·L−1处理下低于对照组,其余质量浓度处理下高于对照组,莼兰绣球铝胁迫处理组脯氨酸质量分数均高于对照组。 结论 绣球在铝胁迫下能作出积极的生长与生理响应,且不同种绣球的耐铝程度有差异。综合各指标分析,蜡莲绣球和莼兰绣球对低质量浓度的铝胁迫有一定的抗性。图2表3参24 Abstract:Objective The aim is to explore the aluminum tolerance of Hydrogena strigosa and H. longipes tissue culture seedlings, so as to lay a foundation for the application of aluminum resistant plants and the utilization of special acid soil resources. Method The effects of different concentrations of AlCl3 (0, 25, 50, 100, 200 mg·L−1) on the growth and physiological characteristics of H. strigosa and H. longipes tissue culture seedlings were studied. Result Under low concentration of aluminum stress (25, 50 mg·L−1), the growth of H. strigosa was normal and similar to that of the control group, while the growth of H. longipes was inferior to that of the control group. Under the medium and high concentration of aluminum stress (100, 200 mg·L−1), the growth of tissue culture seedlings was significantly reduced, and the average root length and root volume were lower than those of the control group, indicating that aluminum stress inhibited both the aboveground and underground parts of Hydrangea. With the increase of aluminum stress concentration, the chlorophyll mass fraction of H. strigosa increased at 50 mg·L−1, while the chlorophyll mass fraction of H. longipes decreased, which indicated that H. strigosa promoted chlorophyll synthesis under low aluminum stress, and H. longipes inhibited chlorophyll synthesis under aluminum stress. The content of malondialdehyde in H. strigosa and H.longipes decreased first and then increased. The catalase and peroxid activities increased continuously. The activities of superoxide dismutase were lower than those of the control group, but the difference was not significant. The proline mass fraction of H. strigosa was lower than that of the control group under the treatment of 25 mg·L−1, and higher than that of the control group under other aluminum concentration treatment. The proline mass fraction of H. longipes under aluminum stress was higher than that of the control group. Conclusion Hydrangea can make positive growth and physiological responses under aluminum stress, and different species of Hydrangea have different aluminum tolerance. In sum, H. strigosa and H. longipes are resistant to low concentration of aluminum.[Ch, 2 fig. 3 tab. 24 ref.] -
表 1 铝胁迫对2种绣球组培苗生根指标的影响
Table 1. Effects of aluminum stress on rooting indexes of Hydrangea tissue culture seedlings
种 氯化铝/
(mg·L−1)生根率/% 平均根长/cm 根体积/cm3 蜡莲绣球 0 100.00 a 5.61±0.45 a 7.35±2.97 a 25 100.00 a 4.85±0.37 ab 2.79±0.76 b 50 100.00 a 4.22±0.32 b 1.85±0.44 b 100 100.00 a 4.27±0.39 b 0.68±0.21 b 200 96.67 a 3.12±0.53 b 0.43±0.23 b 莼兰绣球 0 100.00 a 6.07±0.41 a 3.45±0.92 a 25 100.00 a 5.36±0.21 a 1.22±0.47 b 50 100.00 a 5.60±0.10 a 0.26±0.08 b 100 100.00 a 5.63±0.29 a 0.12±0.02 b 200 93.33 b 2.26±0.36 b 0.02±0.00 b 说明:不同字母表示在0.05水平上差异显著(P<0.05) 表 2 铝胁迫对2种绣球组培苗叶绿素质量分数的影响
Table 2. Effect of aluminum stress on chlorophyll content of Hydrangea tissue culture seedlings
种 氯化铝/
(mg·L−1)叶绿素a/
(mg·g−1)叶绿素b/
(mg·g−1)叶绿素a+b/
(mg·g−1)蜡莲绣球 0 0.78±0.20 a 0.30±0.08 a 1.08±0.28 a 25 0.73±0.29 a 0.29±0.11 a 1.02±0.41 a 50 0.85±0.07 a 0.34±0.03 a 1.18±0.10 a 100 0.78±0.01 a 0.30±0.04 a 1.07±0.05 a 200 0.68±0.03 a 0.20±0.14 a 0.88±0.18 a 莼兰绣球 0 1.18±0.15 a 0.50±0.05 a 1.68±0.20 a 25 0.78±0.08 b 0.32±0.03 b 1.10±0.11 b 50 0.67±0.17 b 0.30±0.07 b 0.97±0.24 b 100 0.58±0.16 b 0.23±0.06 b 0.81±0.20 b 200 0.22±0.12 c 0.09±0.05 c 0.32±0.17 c 说明:不同字母表示在0.05水平上差异显著(P<0.05) 表 3 铝胁迫对绣球组培苗生理指标的影响
Table 3. Effects of aluminum stress on physiological indexes of Hydrangea tissue culture seedlings
种 氯化铝/
(mg·L−1)MDA/
(×10−2 μmol·g−1)Pro/
(μg·g−1)CAT活性/
(×16.67 nkat·g−1·min−1)SOD活性/
(×16.67 nkat·g−1)POD活性/
(×16.67 nkat·g−1·s−1)蜡莲绣球 0 3.40±0.54 a 30.79±1.89 a 2.96±0.57 b 372.41±2.47 a 553.25±33.27 a 25 3.01±0.55 a 30.77±2.16 a 2.97±0.58 b 371.90±7.86 a 554.74±29.89 a 50 3.02±0.25 a 32.52±3.91 a 3.59±0.68 ab 367.34±4.89 a 570.44±23.56 a 100 3.60±0.05 a 31.71±2.14 a 3.92±0.52 ab 364.44±5.86 a 593.59±16.10 a 200 3.74±0.18 a 43.13±8.98 a 5.49±1.17 a 366.51±7.64 a 655.73±86.45 a 莼兰绣球 0 2.72±0.36 a 79.05±3.04 b 4.62±1.19 a 389.24±3.21 a 417.76±39.83 c 25 2.39±0.32 a 80.06±7.65 b 5.89±2.93 a 378.19±2.70 a 562.57±34.05 b 50 2.54±0.76 a 79.22±9.04 b 7.61±1.69 a 373.34±4.89 a 586.71±53.88 b 100 3.05±0.52 a 87.25±7.34 a 13.01±5.50 a 378.67±10.30 a 595.71±11.78 b 200 3.33±0.20 a 100.46±5.16 a 14.72±3.62 a 372.10±5.77 a 798.41±26.64 a 说明:不同字母表示在0.05水平上差异显著(P<0.05) -
[1] 王鑫月, 张梅娟, 熊炳霖, 等. 铝胁迫对水稻膜脂组分和含量的影响[J]. 植物生理学报, 2016, 52(4): 461 − 470. WANG Xinyue, ZHANG Meijuan, XIONG Binglin, et al. Effects of aluminum stress on the composition and content of membrane lipids in rice(Oryza sativa) [J]. Plant Physiol J, 2016, 52(4): 461 − 470. [2] 贾松涛, 郑阳霞, 邱爽, 等. 铝胁迫对西瓜幼苗生长及生理特性的影响[J]. 农业环境科学学报, 2014, 33(8): 1485 − 1492. JIA Songtao, ZHENG Yangxia, QIU Shuang, et al. Effects of aluminum stress on growth and physiological characteristics of watermelon seedlings [J]. J Agro-Environ Sci, 2014, 33(8): 1485 − 1492. [3] 武孔焕, 陈奇, 李昆志, 等. 铝胁迫对黑大豆膜脂过氧化及抗氧化酶活性的影响[J]. 西北植物学报, 2012, 32(3): 511 − 517. WU Konghuan, CHEN Qi, LI Kunzhi, et al. Effects of aluminum stress on membrane lipid peroxidation and antioxidant enzyme activities in black soybean [J]. Acta Bot Boreali-Occident Sin, 2012, 32(3): 511 − 517. [4] 夏斌, 刘莹, 胡尚春, 等. 水淹胁迫对虎尾草生理指标的影响[J]. 东北林业大学学报, 2019, 47(7): 31 − 36. XIA Bin, LIU Ying, HU Shangchun, et al. Physiological responses of Chloris virgata to different flooding stresses [J]. J Northeast For Univ, 2019, 47(7): 31 − 36. [5] KOCHIAN L V. Cellular mechanisms of aluminum toxicity and resistance in plants [J]. Ann Rev Plant Physiol Plant Mol Biol, 1995, 46(1): 237 − 260. [6] GUPTA D K, NICOLOSO F T, SCHETINGER M R C, et al. Antioxidant defense mechanism in hydroponically grown Zea mays seedlings under moderate lead stress [J]. J Hazardous Mater, 2009, 172(1): 479 − 484. [7] 陈海霞, 胡春梅, 彭尽晖, 等. 铝胁迫诱导八仙花根系分泌有机酸的研究[J]. 天津农业科学, 2017, 23(2): 1 − 7, 15. CHEN Haixia, HU Chunmei, PENG Jinhui, et al. Al stress-induced organic acid secretion from roots in Hydrangea macrophylla [J]. Tianjin Agric Sci, 2017, 23(2): 1 − 7, 15. [8] 周红灿. 八仙花抗铝胁迫下的生理特性研究[D]. 长沙: 湖南农业大学, 2008. ZHOU Hongcan. Studies on the Physical Characteristics of Hydrangea macrophylla under Aluminum Stress[D]. Changsha: Hunan Agricultural University, 2008. [9] 龚雯. 铝胁迫下八仙花组培苗的生理特性研究[D]. 长沙: 湖南农业大学, 2011. GONG Wen. Studies on the Physical Characteristics of Tissue Culturing Seedings of H. macrophylla ‘Coerulea’ under Aluminum Stress[D]. Changsha: Hunan Agricultural University, 2011. [10] 彭尽晖, 陈海霞, 龚雯, 等. 铝胁迫对八仙花离体植株质膜透性与抗氧化系统的影响[J]. 湖南农业大学学报(自然科学版), 2013, 39(增刊 1): 42 − 44. PENG Jinhui, CHEN Haixia, GONG Wen, et al. Effects of aluminum stress on plasma membrane permeability and antioxidant system in vitro of Hydrangea [J]. J Hunan Agric Univ Nat Sci, 2013, 39(suppl 1): 42 − 44. [11] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. [12] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006. [13] 蒋时姣, 钟宇, 刘海鹰, 等. 铝胁迫对柳杉组培苗生长及生理特性的影响[J]. 植物生理学报, 2015, 51(2): 227 − 232. JIANG Shijiao, ZHONG Yu, LIU Haiying, et al. Effect of aluminum stress on the growth and some physiological characteristics in Cryptomeria fortunei tisssue culture seedlings [J]. Plant Physiol J, 2015, 51(2): 227 − 232. [14] 胡彦, 何虎翼, 何龙飞. 高等植物铝胁迫研究新进展[J]. 文山师范高等专科学校学报, 2006, 19(1): 74 − 78. HU Yan, HE Huyi, HE Longfei. New progress of aluminum stress in higher plants [J]. J Wenshan Teach Coll, 2006, 19(1): 74 − 78. [15] 初晓辉, 张艾青, 段新慧, 等. 铝胁迫对多花黑麦草生长和生理的影响[J]. 草原与草坪, 2017, 37(6): 48 − 56. CHU Xiaohui, ZHANG Aiqing, DUAN Xinhui, et al. Effects of aluminum stress on growth and physiology of Lolium multiflorum [J]. Grassl Turf, 2017, 37(6): 48 − 56. [16] 李媛, 韩迎儒, 赵冰, 等. 污水胁迫下7种草本地被植物耐污性比较研究[J]. 草地学报, 2018, 26(6): 1392 − 1399. LI Yuan, HAN Yingru, ZHAO Bing, et al. Comparative study on stain resistance of seven herbaceous ground cover plants under sewage stress [J]. Acta Agrestia Sin, 2018, 26(6): 1392 − 1399. [17] 胡雪华, 李蕴, 邹天才. 车前对铝胁迫生理响应的研究[J]. 热带亚热带植物学报, 2014, 22(5): 495 − 501. HU Xuehua, LI Yun, ZOU Tiancai. Studies on physiological responses to aluminum stress of Plantago asiatica [J]. J Trop Subtrop Bot, 2014, 22(5): 495 − 501. [18] 王佳星, 余国源, 谢瑛, 等. 土壤镉胁迫对紫金牛生理特性的影响[J]. 东北林业大学学报, 2019, 47(5): 25 − 29. WANG Jiaxing, YU Guoyuan, XIE Ying, et al. Effects of Cd stress on physiological characteristics of Ardisia japonica [J]. J Northeast For Univ, 2019, 47(5): 25 − 29. [19] AWASTHI J, SAHA B, PANIGRAHI J, et al. Redox balance, metabolic fingerprint and physiological characterization in contrasting North East Indian rice for Aluminum stress tolerance[J]. Sci Rep, 2019, 9(1): doi: 10.1038/s41598-019-45158-3. [20] 安渊, 陈凡毅, 王俊, 等. 半秋眠和非秋眠紫花苜蓿品种耐涝性能研究[J]. 中国草地, 2004, 26(8): 31 − 36. AN Yuan, CHEN Fanyi, WANG Jun, et al. Studies on waterlogging tolerance of semi-fall and non-fall dormant alfalfa cultivars [J]. Grassl China, 2004, 26(8): 31 − 36. [21] HERNÁNDEZ J A, JIMÉNEZ A, MULLINEAUX P, et al. Tolerance of pea (Pisum sativum L.) to long-term salt stress is associated with induction of antioxidant defences [J]. Plant,Cell Environ, 2000, 23(8): 853 − 862. [22] 关梦茜, 董然, 李红婷, 等. Cu胁迫对大花萱草生长及生理的影响[J]. 东北林业大学学报, 2014, 42(7): 91 − 94. GUAN Mengqian, DONG Ran, LI Hongting, et al. Growth and physiological characteristics of Hemerocallis middendorffii under Cu stress [J]. J Northeast For Univ, 2014, 42(7): 91 − 94. [23] 田小霞, 毛培春, 郭强, 等. 镉胁迫对马蔺根系形态及部分生理指标的影响[J]. 西北植物学报, 2019, 39(6): 1105 − 1113. TIAN Xiaoxia, MAO Peichun, GUO Qiang, et al. Effect of cadmium on root morphology and partial physiological indexes of Iris lactea var. chinensis [J]. Acta Bot Boreali-Occident Sin, 2019, 39(6): 1105 − 1113. [24] 袁月, 代志国, 张丙秀, 等. 土壤pH对蓝莓生理特性的影响[J]. 西北植物学报, 2019, 39(8): 1434 − 1443. YUAN Yue, DAI Zhiguo, ZHANG Bingciu, et al. Effects of soil pH on physiological characteristics of blueberry [J]. Acta Bot Boreali-Occident Sin, 2019, 39(8): 1434 − 1443. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20200121







 下载:
下载: