-
园林绿化废弃物包括树木、花草等植物在生长过程中的自然凋落物或者人为修剪的植物残体[1],主要成分有木质素、纤维素和多糖等[2]。其中,木质素由于组分种类多样,结构复杂且无规则,降解比较困难[3-5]。堆肥是一种较好的降解园林绿化废弃物的方式[6],堆肥过程中多个微生物群体共同作用,分泌木质素降解相关酶系而使园林绿化废弃物中的木质素降解[7]。因此,通过研制微生物菌剂,使分泌木质素降解酶酶系的菌株迅速构建优势群落,能有针对性地加快园林绿化废弃物中木质素的降解,提高堆肥效率和质量[8-9]。但是,新菌剂的制备需要在选定目标菌株的条件下,对菌剂制作涉及的培养基配方和发酵条件进行优化。优化过程主要包括试验设计、数学建模和优化设计3个部分[10]。合理的试验设计能用较少的试验数据进行建模,从而获取各因素范围内的最优解。用于发酵条件优化的方法多为响应面法[11-12],但胡欣颖等[13]研究发现:人工神经网络算法比响应面法在预测实验结果方面更准确,误差更小。目前,运用人工神经网络算法对木质素降解菌发酵条件进行优化的研究鲜有报道。因此,本研究拟从北京市植物园的腐叶土和朽木中筛选木质素降解菌,对其进行鉴定,并通过单因素试验对菌株的培养时间、接种量和培养基配方(碳源和氮源)进行优化;采用均匀试验结合Python实现人工神经网络建模与优化,寻找菌株最佳发酵条件,为园林绿化废弃物中木质素的降解提供高效菌剂。
-
腐叶土和朽木采集于北京市植物园。PDA培养基:称取200.00 g土豆,去皮去芽切成小块后加蒸馏水微沸30 min,保留滤液并用蒸馏水补足1 L,制成马铃薯浸汁;葡萄糖 20.00 g,蛋白胨15.00 g,琼脂 20.00 g,pH自然[14]。PDA-苯胺蓝培养基:称取0.10 g苯胺蓝溶于1 L PDA培养基中,pH自然。PDA-愈创木酚培养基:量取0.1 mL愈创木酚溶于1 L PDA培养基中,pH自然。PDB液体培养基:马铃薯浸汁(同PDA培养基),葡萄糖 20.00 g,蛋白胨15.00 g,pH自然。基本发酵培养基:葡萄糖10.00 g·L−1、蛋白胨5.00 g·L−1,酵母粉3.00 g·L−1、酒石酸铵10.00 g·L−1、五水合硫酸铜0.25 g·L−1、氯化钠1.00 g·L−1、pH自然[15]。所有培养基均121 ℃高压蒸汽灭菌 20 min。
-
将采集的样品捣碎[16],称取10.00 g加入装有90 mL无菌水的三角瓶中,在28 ℃、200 r·min−1下震荡摇匀后静置1 h。取上清液1.0 mL稀释成不同质量浓度梯度(10−3~10−7 g·L−1)的溶液,取不同质量浓度稀释液0.1 mL,加入PDA培养基中涂布均匀,28 ℃下培养5~7 d,观察菌落形态,用平板划线分离法纯化菌株。将得到的纯菌株以点接法接到PDA-苯胺蓝平板和PDA-愈创木酚平板中,用苯胺蓝平板褪色圈法和愈创木酚平板变色圈法确定该菌株是否具有降解木质素的能力。
-
观察PDA-苯胺蓝平板上菌体形态特征,并挑取少量菌丝于显微镜下拍照记录。菌株送往北京睿博兴科生物技术有限公司进行内转录间隔区(ITS)测序,测序结果与Genebank数据库中已知的真菌序列BLAST检索对比,采用 Mega 5.0 软件与相近种菌株构建系统发育树[17]。
-
将菌株接种至装有100.0 mL PDB液体培养基的三角瓶中,在IS-RDD3台式恒温振荡器中以30 ℃、200 r·min−1培养3 d,制得种子液。
-
木质素过氧化物酶、锰过氧化物酶和漆酶活性的测定参照田林双[18]的方法。3种木质素降解相关酶酶活性总和标记为总酶活。生物量的测定用称干质量法[19]。
-
试验数据采用Excel 2007和SPSS 22.0进行处理。发酵条件优化用单因素方差分析法,平均值多重比较用LSD最小显著性差异法(P<0.05)。均匀试验利用人工神经网络[20]建模与优化(基于深度学习框架Pytorch[21])。将本实验目标建模为回归任务,并采用SmoothL1损失函数[22]以平滑训练过程。训练过程中,采用k-折交叉验证(k-fold cross-validation)和自适应矩估计(Adam)算法[23]优化神经网络。
-
PDA-苯胺蓝平板上褪色圈的出现表示该菌株具有分泌锰过氧化物酶和木质素过氧化物酶的能力,PDA-愈创木酚平板上显色圈的出现表示该菌株具有分泌漆酶的能力[24]。由表1可知:筛选得到的22株菌(分别命名为Q01~Q22)中,共有10株菌出现褪色圈或/和显色圈。其中:Q01、Q02、Q09和Q11既能出现褪色圈又能出现显色圈,说明这些菌株具备分泌3种木质素降解酶的能力。根据褪色圈和显色圈的出现时间及直径可知(表1),Q01于48 h时在PDA-苯胺蓝平板上出现褪色圈,12 h时在PDA-愈创木酚培养基上出现显色圈,在72 h时显色圈最大,因此,选定菌株Q01为目标菌株。
表 1 不同菌株选择培养基的显色和褪色结果
Table 1. Coloring and decoloring results of different strains on selective mediums
菌株 苯胺蓝褪色结果 愈创木酚显色结果 12 24 36 48 72 12 24 36 48 72 h Q01 − − − + ++ + ++ +++ ++++ ++++ Q02 − − − − + − − − + ++ Q06 − − − − − − − − − + Q09 − − − − + − − − − + Q11 − + + ++ +++ − − − + + Q12 − + ++ +++ +++ − − − − − Q14 − + + ++ ++ − − − − − Q17 − + + + + − − − − − Q19 − + + + + − − − − − Q22 − + + ++ ++ − − − − − 说明:−表示不褪色(或不显色);+、+ +、+ + +、+ + + +表示 褪色(或显色)圈逐渐增大 -
菌株Q01在PDA-苯胺蓝平板上的菌落形态为白色圆形,菌丝为致密的短绒状,向四周扩展,紧贴平板生长(图1A、图1B);前期生长较慢,1~2 d有菌丝长出,此后生长较快,3~5 d铺满整个平板。显微形态可见,菌丝较细长,有分支(图1C),孢子呈球状或柱状(图1D),菌丝可观察到隔膜和锁状联合(图1E,如箭头所示)。
-
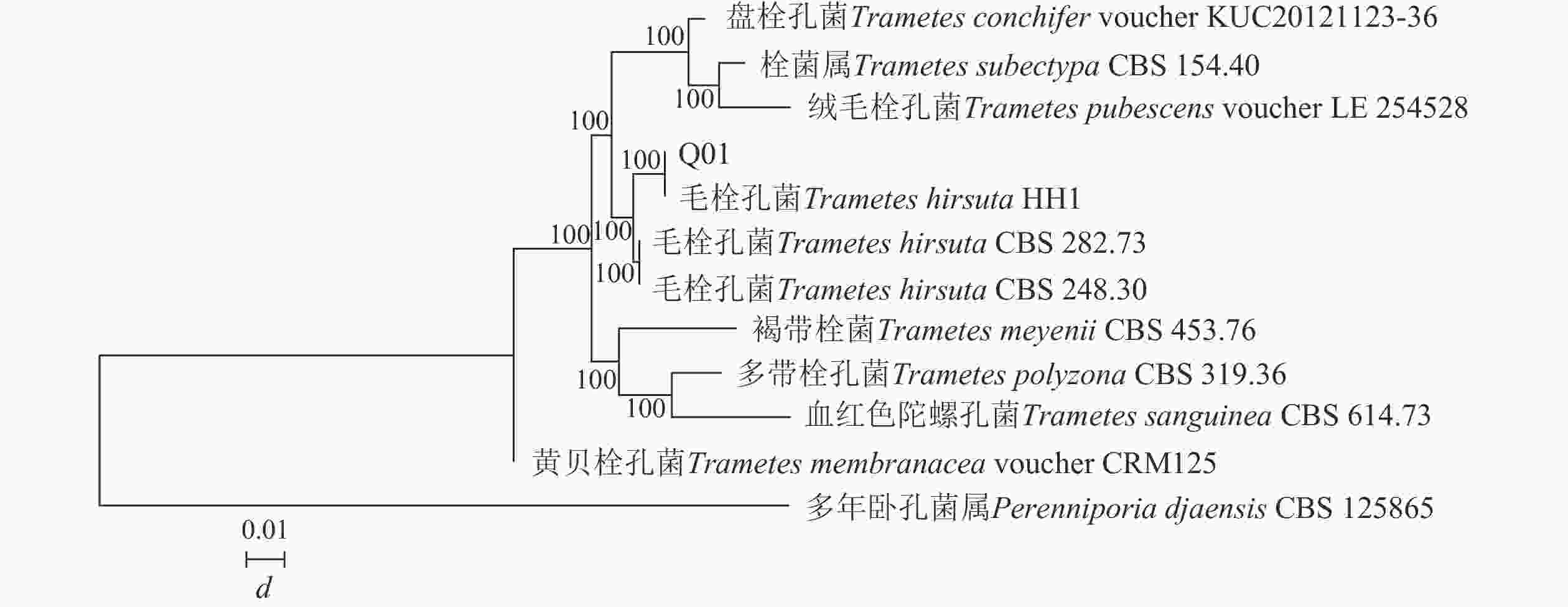
构建菌株Q01系统发育树(图2)可知:菌株Q01与栓菌属Trametes真菌的同源性相似度最高,达到100%。结合形态特征可确定菌株Q01为栓菌属真菌。
-
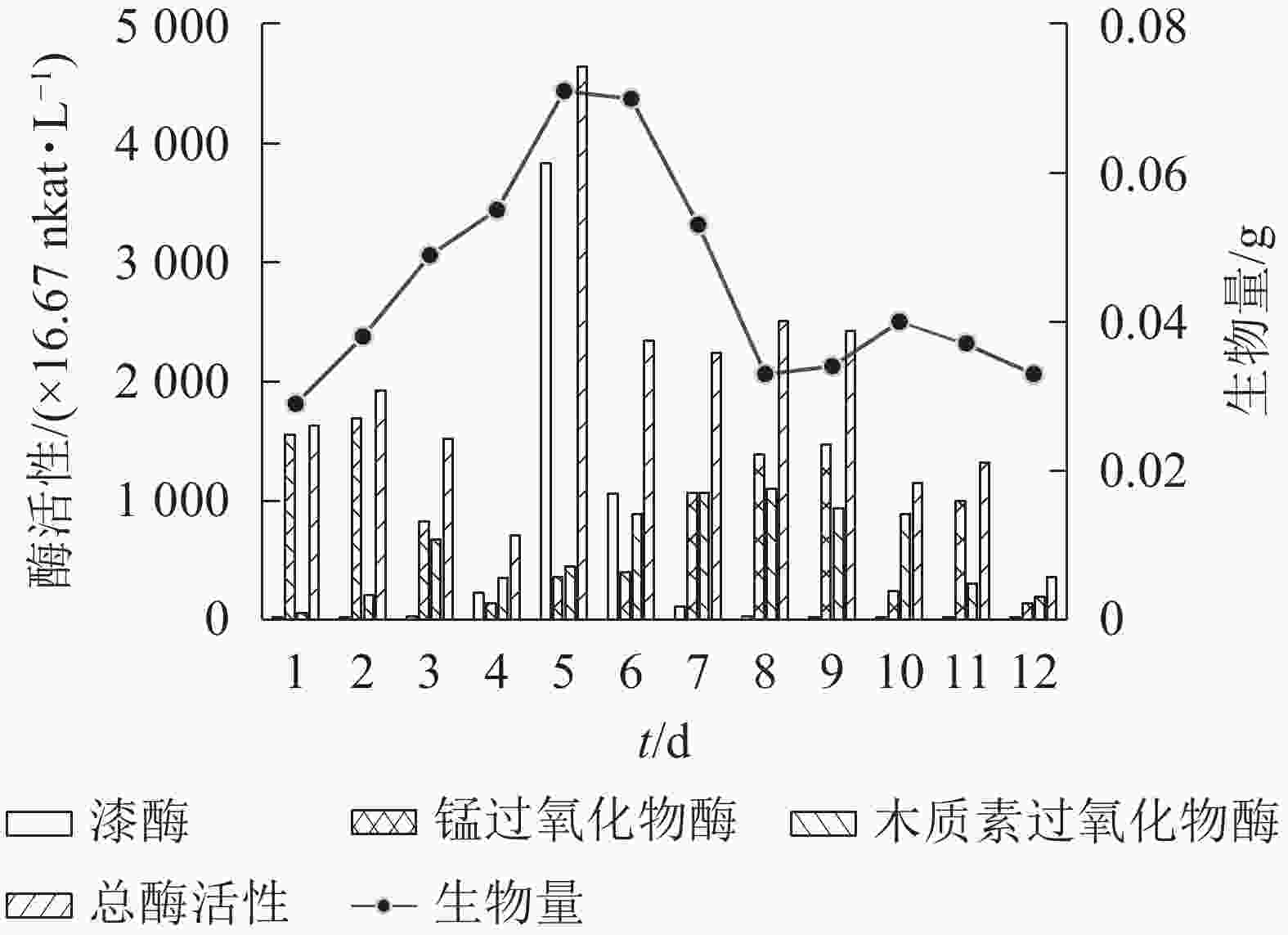
分别在12瓶100 mL基本发酵培养基中接种体积分数为12.5%的菌株Q01种子液,于30 ℃、200 r·min−1下培养,每24 h取出1瓶,测量菌株木质素降解相关酶活性和1 mL菌液中生物量的干质量。由图3可知:3种木质素降解相关酶的酶活性达到最高值时间不同,其中漆酶活性在培养5 d时达最高(3 835.25×16.67 nkat·L−1),锰过氧化物酶活性在培养2 d时达最高(1 690.60×16.67 nkat·L−1),木质素过氧化物酶活性在培养8 d时达到最高(1 096.88×16.67 nkat·L−1)。3种木质素降解相关酶在木质素降解中具有同样重要的作用[25],但不同木质素降解酶活性最高值时间不同,因此以3种木质素降解相关酶的总酶活性作为确定培养时间的依据。随着木质素降解,真菌生物量逐渐增多[26]。图3可知:菌株Q01的总酶活性与生物量均在培养5 d时最高,因此选择培养时间为5 d进行后续研究。
-
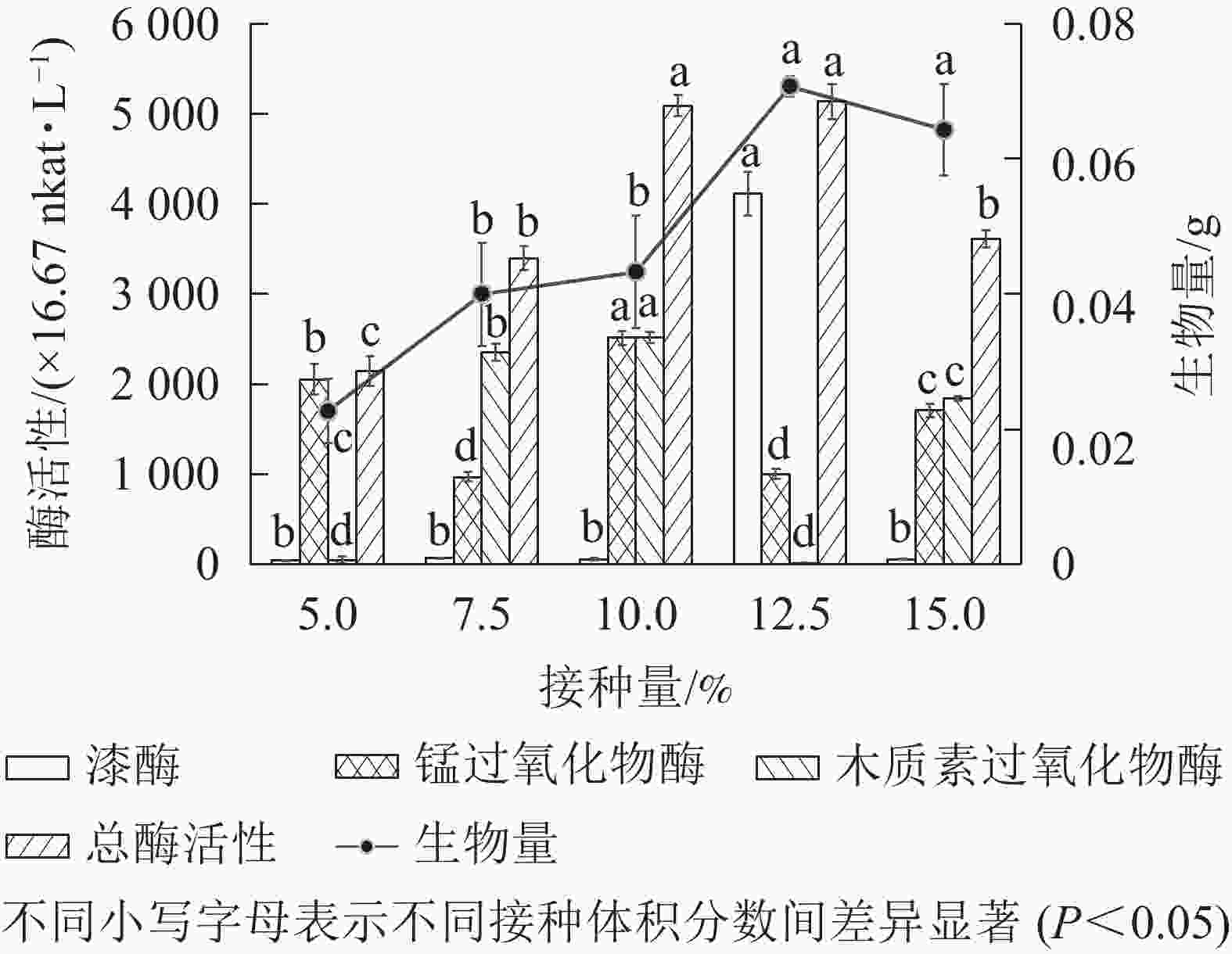
分别在100 mL 基本发酵培养基中接种体积分数为5.0%、7.5%、10.0%、12.5%和 15.0%的种子液,于30 ℃、200 r·min−1下培养5 d,测定菌株木质素降解相关酶活性和菌株生物量。由图4可知:总酶活性在菌液体积分数为12.5%时最高,达到5 129.80×16.67 nkat·L−1。随菌液体积分数增加,菌株生物量呈先上升后下降趋势,体积分数为12.5%时达到最高。与缪晓磊[19]对竹林毛栓菌Trametes sp. 接种量优化的结果一致。可见菌株的繁殖速度受接种量影响,当接种量较少时,菌株需要更多时间适应环境后繁殖生长;而接种量较多时,大量菌株接触新环境,迅速繁殖,使液体培养基黏稠不透气,溶解氧下降,影响菌株的后续生长[19]。因此,综合总酶活性和生物量的变化,选取体积分数12.5%为最适接种量。
-
以基本发酵培养基为对照,分别用 10.00 g·L−1蔗糖、麦芽糖、木质素磺酸钠和可溶性淀粉替代对照中10.00 g·L−1的葡萄糖,接种体积分数为12.5%,于30 ℃、200 r·min−1下培养5 d。由图5可知:以葡萄糖为碳源时,菌株Q01漆酶活性达3 675.23×16.67 nkat·L−1,显著高于其他碳源(P<0.05);认为简单的糖有利于菌体生长[27],可以缩短漆酶的生产时间,与刘宇等[15]结果相似。但就总酶活性和生物量而言,以木质素磺酸钠为碳源对菌株Q01生长和木质素降解相关酶分泌效果最好,最显著(P<0.05),其中总酶活性为6 474.16×16.67 nkat·L−1,总生物量为0.065 g。可能原因是来源于木质素的木质素磺酸钠能刺激菌株Q01分泌木质素过氧化物酶和锰过氧化物酶,并促进细胞快速生长,使生物量最高,与熊乙[28]研究结果相似。综合考虑各碳源生产成本及对菌株Q01生长的促进效果,选择木质素磺酸钠为菌株Q01的液体培养基碳源。
-
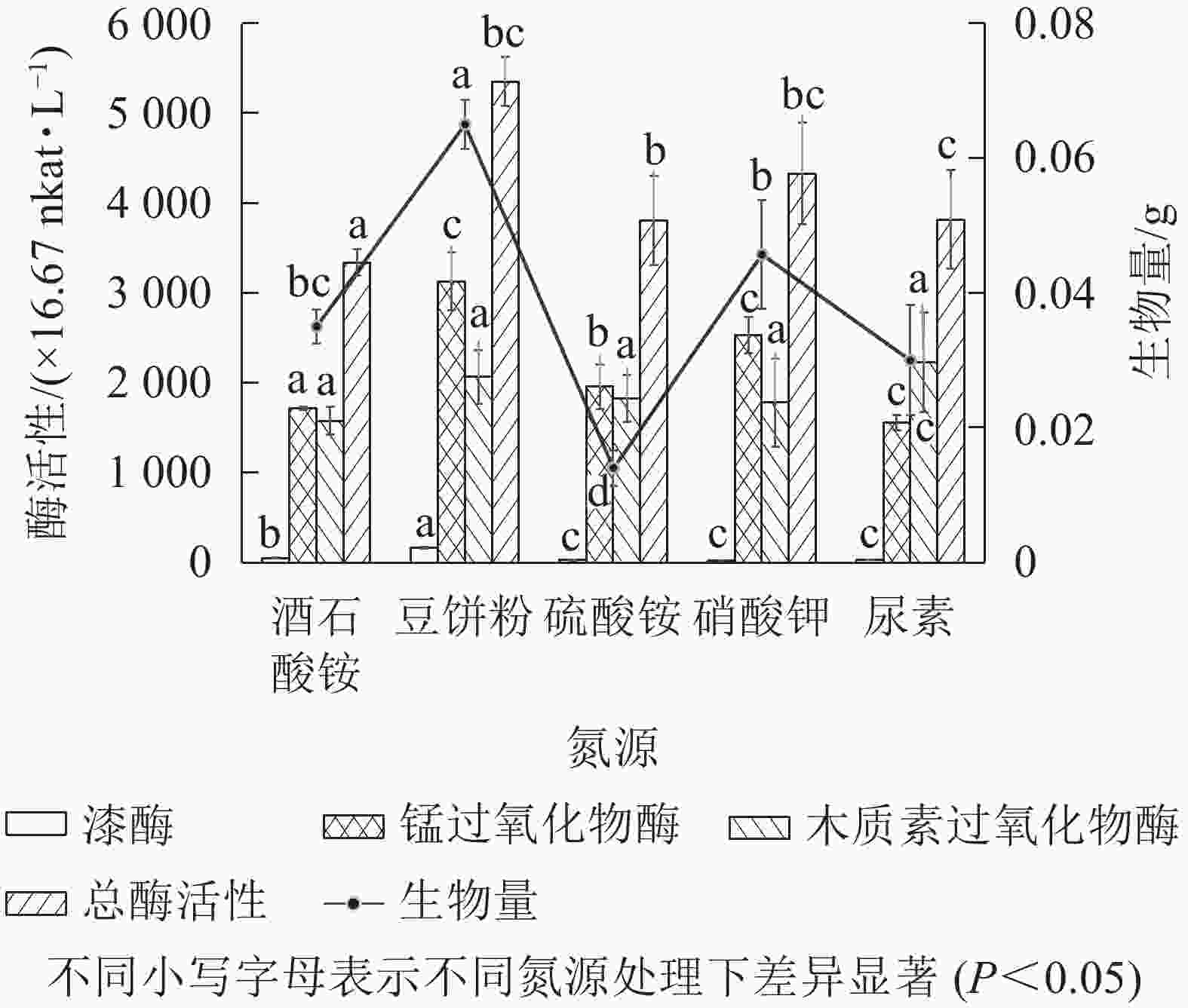
以基本发酵培养基为对照,有效含氮量按1.52 g·L−1进行换算,分别用7.00 g·L−1的豆饼粉、6.50 g·L−1尿素、14.30 g·L−1硫酸铵、11.00 g·L−1硝酸钾替代对照组中的酒石酸铵,发酵培养条件为30 ℃、200 r·min−1,培养5 d。由图6可知:以豆饼粉为有机氮源发酵时,菌株Q01总酶活性最高、生物量最大,与其他无机氮源差异显著(P<0.05)。豆饼粉营养丰富,含大量碳水化合物、蛋白质及少量异黄酮类物质和可溶性多糖,可作为发酵氮源及生长因子。有研究表明[29]:在培养某些真菌时,培养基中添加豆饼粉有利于生物量的积累。综合考虑各氮源生产成本及对菌株Q01生长的促进效果,选择豆饼粉作为菌株Q01的液体培养基氮源。
-
均匀试验设计6因素5水平的10组试验,获取实测值,再通过基于SmoothL1损失函数的人工神经网络模型的训练及自适应矩估计(Adam)算法寻优,得到仿真值。对比实测值和仿真值(表2)可知:3种酶活性误差均小于10.0%,生物量的仿真值基本与观察值相同,可知该模型预测值可信赖。
表 2 均匀试验设计及结果
Table 2. Uniform test design and results
试验号 木质素
磺酸钠/
(g·L−1)蛋白胨/
(g·L−1)酵母粉/
(g·L−1)豆饼粉/
(g·L−1)五水合
硫酸铜/
(g·L−1)氯化钠/
(g·L−1)锰过氧化
物酶活性/
(×16.67 nkat·L−1)木质素过氧
化物酶活性/
(×16.67 nkat·L−1)漆酶活性/
(×16.67 nkat·L−1)总酶活性/
(×16.67 nkat·L−1)生物量/
g实测值1 6.00 5.00 3.00 11.00 0.20 1.50 4 296.20 1 520.43 219.19 6 035.83 0.037 仿真值1 6.00 5.00 3.00 11.00 0.20 1.50 3 186.76 2 888.58 218.40 6 293.73 0.037 实测值2 8.00 10.00 1.00 11.00 0.25 1.25 4 200.35 3 790.22 252.62 8 243.18 0.055 仿真值2 8.00 10.00 1.00 11.00 0.25 1.25 4 190.01 3 799.79 288.91 8 278.71 0.049 实测值3 10.00 2.50 4.00 9.00 0.35 1.00 4 095.77 3 605.59 318.60 8 019.96 0.048 仿真值3 10.00 2.50 4.00 9.00 0.35 1.00 4 094.32 3 712.88 282.19 8 089.38 0.048 实测值4 12.00 7.50 1.00 9.00 0.15 0.75 4 601.21 5 278.06 313.29 10 192.56 0.014 仿真值4 12.00 7.50 1.00 9.00 0.15 0.75 4 607.23 4 178.73 318.24 9 104.20 0.024 实测值5 14.00 12.50 4.00 7.00 0.20 0.50 5 263.50 5 028.28 399.44 10 691.23 0.059 仿真值5 14.00 12.50 4.00 7.00 0.20 0.50 5 290.88 4 799.66 366.29 10 456.83 0.062 实测值6 6.00 2.50 2.00 7.00 0.30 1.50 4 453.06 3 746.77 178.82 8 378.66 0.123 仿真值6 6.00 2.50 2.00 7.00 0.30 1.50 4 446.86 4 033.08 306.97 8 786.91 0.092 实测值7 8.00 7.50 5.00 5.00 0.35 1.25 3 999.91 4 387.53 186.13 8 573.57 0.042 仿真值7 8.00 7.50 5.00 5.00 0.35 1.25 4 018.98 3 644.46 276.89 7 940.33 0.047 实测值8 10.00 12.50 2.00 5.00 0.15 1.00 3 215.62 4 322.37 363.36 7 901.34 0.050 仿真值8 10.00 12.50 2.00 5.00 0.15 1.00 4 289.80 3 890.43 295.93 8 476.16 0.050 实测值9 12.00 5.00 5.00 3.00 0.25 0.75 5 411.65 3 822.80 432.66 9 667.11 0.063 仿真值9 12.00 5.00 5.00 3.00 0.25 0.75 5 287.09 4 905.21 374.46 10 566.76 0.063 实测值10 14.00 10.00 3.00 3.00 0.30 0.50 5 120.37 4 356.31 385.32 9 862.00 0.060 仿真值10 14.00 10.00 3.00 3.00 0.30 0.50 5 241.27 4 754.60 362.81 10 358.68 0.061 -
根据模型预测得到最优发酵培养基组成并进行实验验证。由表3可知:优化后的发酵培养基酶活性和生物量,实测值与预测值误差约为3.0%;结合图3可知:优化前锰过氧化物酶活性为357.29×16.67 nkat·L−1、木质素过氧化物酶活性为445.27×16.67 nkat·L−1、总酶活性为4 637.81×16.67 nkat·L−1、生物量为0.071 g;即在优化培养基上生长的菌株Q01,其生物量比优化前提高1.27倍,锰过氧化物酶活性提高31.71倍,木质素过氧化物酶活性提高19.12倍,总木质素酶酶活性提高4.38倍。
表 3 人工神经网络寻优结果
Table 3. Optimization results of artificial neural network
试验号 木质素磺酸钠/
(g·L−1)蛋白胨/
(g·L−1)酵母粉/
(g·L−1)豆饼粉/
(g·L−1)五水合硫酸铜/
(g·L−1)氯化钠/
(g·L−1)锰过氧化物酶活性/
(×16.67 nkat·L−1)木质素过氧化物酶活性/
(×16.67 nkat·L−1)漆酶活性/
(×16.67 nkat·L−1)总酶活性/
(×16.67 nkat·L−1)生物量/
g预测值 14.00 12.30 5.00 3.00 0.12 0.53 11 727.39 8 795.36 505.56 21 028.31 0.093 7 实测值 14.00 12.30 5.00 3.00 0.12 0.53 11 328.73 8 514.41 484.73 20 327.87 0.090 0 -
通过苯胺蓝平板褪色圈法和愈创木酚平板变色圈法筛选出目标菌株Q01。经鉴定,菌株Q01为栓菌属Trametes真菌。实验证明人工神经网络模型预测结果可值得信赖。根据单因素试验和人工神经网络算法结果,确定菌株Q01的最优发酵条件:培养时间5 d,温度30 ℃,转速200 r·min−1,接种菌液体积分数为12.5%,培养基配方为木质素磺酸钠14.00 g·L−1、蛋白胨12.30 g·L−1、酵母粉5.00 g·L−1、豆饼粉3.00 g·L−1、五水合硫酸铜0.12 g·L−1、氯化钠0.53 g·L−1、pH自然。
菌株Q01在优化后的发酵条件下制得的液体菌剂具有高酶活性和高生物量的特点,可促进园林绿化废弃物堆体初始微生物的数量增长,提高木质素降解相关酶的酶活性,加快木质素的降解。
Screening and identification of a lignin degrading strain and its optimized liquid fermentation conditions
-
摘要:
目的 制作应用于园林绿化废弃物的以木质素降解菌为原材料的高效液体菌剂。 方法 通过苯胺蓝平板褪色圈法和愈创木酚平板变色圈法从分离纯化得到的22株菌中筛选目标菌株,并用内转录间隔区(ITS)测序法对目标菌株进行鉴定,然后通过单因素试验对目标菌株的培养时间、接种量和培养基配方(碳源和氮源)进行优化,最后根据单因素试验结果,采用均匀实验结合人工神经网络算法寻找目标菌株的最佳发酵条件。 结果 根据平板褪色和显色结果,选定菌株Q01为目标菌株。经鉴定,菌株Q01为栓菌属Trametes真菌。根据单因素试验和均匀试验结果,确定菌株Q01的最优发酵条件为培养时间5 d,接种菌液体积分数为12.5%;培养基配方为木质素磺酸钠14.00 g·L−1、蛋白胨12.30 g·L−1、酵母粉5.00 g·L−1、豆饼粉3.00 g·L−1、五水合硫酸铜0.12 g·L−1、氯化钠0.53 g·L−1、pH自然。优化条件后菌株Q01的生物量提高1.27倍,锰过氧化物酶活性提高31.71倍,木质素过氧化物酶活性提高19.12倍,漆酶活性略有降低,但3种木质素酶的总酶活性提高了4.38倍。 结论 菌株Q01在优化后的发酵条件下制得的液体菌剂具有高酶活性和高生物量的特点,在降解园林绿化废弃物木质素方面具有一定应用潜力。图6表3参29 Abstract:Objective The purpose is to produce a high efficient liquid inoculum with lignin-degrading bacteria as raw materials for garden waste. Method The target strains were screened from 22 isolated and purified strains by the aniline blue plate fading circle method and the guaiacol plate fading circle method, and were identified by Internal Transcribed Spacer (ITS) sequencing, and then the single factor test was used to optimize the culture time, inoculum amount and medium formula (carbon and nitrogen source) of the target strains. Finally, according to the results of single factor test, the optimal fermentation conditions of the target strains were found by uniform experiment combined with artificial neural network algorithm. Result According to the results of plate fading and color development, strain Q01 was selected as the target strain and was identified as Trametes. According to the results of single factor test and uniform test, the optimal fermentation conditions for strain Q01 were determined as the culture time of 5 days, inoculation amount 12.5%. The medium formula was composed of sodium lignosulfonate 14.00 g·L−1, peptone 12.30 g·L−1, yeast powder 5.00 g·L−1, soybean cake powder 3.00 g·L−1, copper sulfate pentahydrate 0.12 g·L−1, sodium chloride 0.53 g·L−1, and natural pH. Under the optimized conditions, the biomass, manganese peroxidase activity and lignin peroxidase activity of strain Q01 increased by 1.27 times, 31.71 times and 19.12 times respectively. Laccase activity decreased slightly, but the total enzyme activities of three kinds of lignin enzymes increased by 4.38 times. Conclusion The liquid inoculum prepared by strain Q01 under optimized fermentation conditions has the characteristics of high enzyme activity and high biomass, which has certain application potential in degrading lignin in garden waste. [Ch, 6 fig. 3 tab. 29 ref.] -
Key words:
- lignin degrading bacteria /
- screening /
- laccase /
- manganese peroxidase /
- lignin peroxidase /
- fermentation conditions
-
表 1 不同菌株选择培养基的显色和褪色结果
Table 1. Coloring and decoloring results of different strains on selective mediums
菌株 苯胺蓝褪色结果 愈创木酚显色结果 12 24 36 48 72 12 24 36 48 72 h Q01 − − − + ++ + ++ +++ ++++ ++++ Q02 − − − − + − − − + ++ Q06 − − − − − − − − − + Q09 − − − − + − − − − + Q11 − + + ++ +++ − − − + + Q12 − + ++ +++ +++ − − − − − Q14 − + + ++ ++ − − − − − Q17 − + + + + − − − − − Q19 − + + + + − − − − − Q22 − + + ++ ++ − − − − − 说明:−表示不褪色(或不显色);+、+ +、+ + +、+ + + +表示 褪色(或显色)圈逐渐增大 表 2 均匀试验设计及结果
Table 2. Uniform test design and results
试验号 木质素
磺酸钠/
(g·L−1)蛋白胨/
(g·L−1)酵母粉/
(g·L−1)豆饼粉/
(g·L−1)五水合
硫酸铜/
(g·L−1)氯化钠/
(g·L−1)锰过氧化
物酶活性/
(×16.67 nkat·L−1)木质素过氧
化物酶活性/
(×16.67 nkat·L−1)漆酶活性/
(×16.67 nkat·L−1)总酶活性/
(×16.67 nkat·L−1)生物量/
g实测值1 6.00 5.00 3.00 11.00 0.20 1.50 4 296.20 1 520.43 219.19 6 035.83 0.037 仿真值1 6.00 5.00 3.00 11.00 0.20 1.50 3 186.76 2 888.58 218.40 6 293.73 0.037 实测值2 8.00 10.00 1.00 11.00 0.25 1.25 4 200.35 3 790.22 252.62 8 243.18 0.055 仿真值2 8.00 10.00 1.00 11.00 0.25 1.25 4 190.01 3 799.79 288.91 8 278.71 0.049 实测值3 10.00 2.50 4.00 9.00 0.35 1.00 4 095.77 3 605.59 318.60 8 019.96 0.048 仿真值3 10.00 2.50 4.00 9.00 0.35 1.00 4 094.32 3 712.88 282.19 8 089.38 0.048 实测值4 12.00 7.50 1.00 9.00 0.15 0.75 4 601.21 5 278.06 313.29 10 192.56 0.014 仿真值4 12.00 7.50 1.00 9.00 0.15 0.75 4 607.23 4 178.73 318.24 9 104.20 0.024 实测值5 14.00 12.50 4.00 7.00 0.20 0.50 5 263.50 5 028.28 399.44 10 691.23 0.059 仿真值5 14.00 12.50 4.00 7.00 0.20 0.50 5 290.88 4 799.66 366.29 10 456.83 0.062 实测值6 6.00 2.50 2.00 7.00 0.30 1.50 4 453.06 3 746.77 178.82 8 378.66 0.123 仿真值6 6.00 2.50 2.00 7.00 0.30 1.50 4 446.86 4 033.08 306.97 8 786.91 0.092 实测值7 8.00 7.50 5.00 5.00 0.35 1.25 3 999.91 4 387.53 186.13 8 573.57 0.042 仿真值7 8.00 7.50 5.00 5.00 0.35 1.25 4 018.98 3 644.46 276.89 7 940.33 0.047 实测值8 10.00 12.50 2.00 5.00 0.15 1.00 3 215.62 4 322.37 363.36 7 901.34 0.050 仿真值8 10.00 12.50 2.00 5.00 0.15 1.00 4 289.80 3 890.43 295.93 8 476.16 0.050 实测值9 12.00 5.00 5.00 3.00 0.25 0.75 5 411.65 3 822.80 432.66 9 667.11 0.063 仿真值9 12.00 5.00 5.00 3.00 0.25 0.75 5 287.09 4 905.21 374.46 10 566.76 0.063 实测值10 14.00 10.00 3.00 3.00 0.30 0.50 5 120.37 4 356.31 385.32 9 862.00 0.060 仿真值10 14.00 10.00 3.00 3.00 0.30 0.50 5 241.27 4 754.60 362.81 10 358.68 0.061 表 3 人工神经网络寻优结果
Table 3. Optimization results of artificial neural network
试验号 木质素磺酸钠/
(g·L−1)蛋白胨/
(g·L−1)酵母粉/
(g·L−1)豆饼粉/
(g·L−1)五水合硫酸铜/
(g·L−1)氯化钠/
(g·L−1)锰过氧化物酶活性/
(×16.67 nkat·L−1)木质素过氧化物酶活性/
(×16.67 nkat·L−1)漆酶活性/
(×16.67 nkat·L−1)总酶活性/
(×16.67 nkat·L−1)生物量/
g预测值 14.00 12.30 5.00 3.00 0.12 0.53 11 727.39 8 795.36 505.56 21 028.31 0.093 7 实测值 14.00 12.30 5.00 3.00 0.12 0.53 11 328.73 8 514.41 484.73 20 327.87 0.090 0 -
[1] 王琳, 李素艳, 孙向阳, 等. 不同配比园林绿化废弃物和蘑菇渣混合蚯蚓堆肥的效果[J]. 浙江农林大学学报, 2019, 36(2): 326 − 334. WANG Lin, LI Suyan, SUN Xiangyang, et al. Mixing garden wastes and spent mushroom compost of different ratios for vermicomposting [J]. J Zhejiang A&F Univ, 2019, 36(2): 326 − 334. [2] 蔡琳琳, 李素艳, 龚小强, 等. 好氧堆肥-蚯蚓堆肥结合法处理绿化废弃物与牛粪[J]. 浙江农林大学学报, 2018, 35(2): 261 − 267. CAI Linlin, LI Suyan, GONG Xiaoqiang, et al. Composting-vermicomposting of green waste processing spiked with cow dung [J]. J Zhejiang A&F Univ, 2018, 35(2): 261 − 267. [3] HIMMEL M E, DING Shiyou, JOHNSON D K, et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production [J]. Science, 2007, 315(5813): 804 − 807. [4] KAMIMURA N, SAKAMOTO S, MITSUDA N, et al. Advances in microbial lignin degradation and its applications [J]. Curr Opin Biotechnol, 2019, 56: 179 − 186. [5] 刘瑜, 赵佳颖, 周晚来, 等. 城市园林废弃物资源化利用研究进展[J]. 环境科学与技术, 2020, 43(4): 32 − 38. LIU Yu, ZHAO Jiaying, ZHOU Wanlai, et al. Progress on resource utilization of urban garden waste [J]. Environ Sci Technol, 2020, 43(4): 32 − 38. [6] 孟童瑶, 李素艳, 邹荣松, 等. 固定化木质素降解菌对园林废弃物堆肥的影响[J]. 浙江农林大学学报, 2021, 38(1): 38 − 46. MENG Tongyao, LI Suyan, ZOU Rongsong, et al. Effect of immobilized lignin-degrading bacteria on green waste composting [J]. J Zhejiang A&F Univ, 2021, 38(1): 38 − 46. [7] 梁丛颖, 林璐. 环境微生物介导的木质素代谢及其资源化利用研究进展[J]. 微生物学通报, 2020, 47(10): 3380 − 3392. LIANG Congying, LIN Lu. Environmental microorganisms driven lignin biodegradation and their roles in lignin utilization [J]. Microbiol China, 2020, 47(10): 3380 − 3392. [8] 康跃, 李素艳, 孙向阳, 等. 园林废弃物木质素降解真菌的筛选、鉴别及其能力研究[J]. 林业科学研究, 2019, 32(3): 80 − 87. KANG Yue, LI Suyan, SUN Xiangyang, et al. Study on screening, identification and capability of lignin-degrading fungi for landscaping waste [J]. For Res, 2019, 32(3): 80 − 87. [9] 赵恺凝, 赵国柱, 国辉, 等. 园林废弃物堆肥化技术中微生物菌剂的功能与作用[J]. 生物技术通报, 2016, 32(1): 41 − 48. ZHAO Kaining, ZHAO Guozhu, GUO Hui, et al. The function and role of microbial agents in composting technology of garden waste [J]. Biotechnol Bull, 2016, 32(1): 41 − 48. [10] 李信军, 冯晓晓, 金慧清, 等. 2株内生真菌菌株固态发酵培养基优化[J]. 微生物学通报, 2016, 43(3): 550 − 558. LI Xinjun, FENG Xiaoxiao, JIN Huiqing, et al. Optimization of solid-state fermentation media for growth of two endophytic fungal strains [J]. Microbiol China, 2016, 43(3): 550 − 558. [11] 汪敦飞, 朱胜男, 肖清铁, 等. 基于响应面法的耐镉假单胞菌TCd-1培养条件优化[J]. 浙江农林大学学报, 2020, 37(5): 914 − 921. WANG Dunfei, ZHU Shengnan, XIAO Qingtie, et al. Optimization of culture conditions of Cd-tolerant strain Pseudomonas TCd-1 based on response surface methodology [J]. J Zhejiang A&F Univ, 2020, 37(5): 914 − 921. [12] 王维乐, 牟志美, 张淑君, 等. 响应面法优化Paraconiothyrium variabile GHJ-4产漆酶发酵条件[J]. 应用与环境生物学报, 2011, 17(3): 321 − 325. WANG Weile, MU Zhimei, ZHANG Shujun, et al. Optimization of fermentation conditions of Paraconiothyrium variabile GHJ-4 for laccase production by response surface methodology [J]. Chin J Appl Environ Biol, 2011, 17(3): 321 − 325. [13] 胡欣颖, 李洪军, 李少博, 等. 对比研究响应面法和BP神经网络-粒子群算法优化调理松板肉加工工艺[J]. 食品与发酵工业, 2019, 45(24): 179 − 187. HU Xinying, LI Hongjun, LI Shaobo, et al. A comparative study of the optimization of processing technology of conditioning pine board meat by response surface methodology and BP neural network-particle swarm optimization [J]. Food Ferment Ind, 2019, 45(24): 179 − 187. [14] 周宇光. 菌种目录[M]. 4版. 北京: 北京科学技术文献出版社, 2012: 694. [15] 刘宇, 汤斌, 李松, 等. Trametes sp. LS-10C产漆酶发酵培养基优化及其漆酶对偶氮染料的脱色性能[J]. 环境科学学报, 2017, 37(1): 193 − 200. LIU Yu, TANG Bin, LI Song, et al. Optimization of fermentation medium for laccase production by Trametes sp. LS-10C and its properties in the decolorization of azo dyes [J]. Acta Sci Circumstantiae, 2017, 37(1): 193 − 200. [16] 冯波, 林元山, 胡超, 等. 一株木质素降解菌的筛选、鉴定及其漆酶发酵条件的优化[J]. 湖南师范大学自然科学学报, 2015, 38(2): 12 − 16, 73. FENG Bo, LIN Yuanshan, HU Chao, et al. Screening and Identification of a lignin degrading strain and optimization of fermentation conditions for laccase [J]. J Nat Sci Hunan Norm Univ, 2015, 38(2): 12 − 16, 73. [17] 李雪玲, 姚一建. 基于28S rDNA序列构建侧耳属系统发育树[J]. 菌物学报, 2004, 23(3): 345 − 350. LI Xueling, YAO Yijian. Assembling phylogenetic tree of Pleurotus based on 28S rDNA sequencing [J]. Mycosystema, 2004, 23(3): 345 − 350. [18] 田林双. 木质素降解相关酶类测定标准方法研究[J]. 畜牧与饲料学, 2009, 30(10): 13 − 14. TIAN Linshuang. Research on standard method for determining ligninolytic enzyme activity [J]. Anim Husbandry Feed Sci, 2009, 30(10): 13 − 14. [19] 缪晓磊. 竹林毛栓菌的诱变选育及其产酶条件优化[D]. 杭州: 浙江农林大学, 2019. MIAO Xiaolei. Mutation Breeding of Trametes sp. from Bamboo Forest and Optimization of Enzyme Production Conditions [D]. Hangzhou: Zhejiang A&F University, 2019. [20] SUN Yong, YANG Gang, XU Mengxia, et al. A simple coupled ANNs-RSM approach in modeling product distribution of Fischer-Tropsch synthesis using a microchannel reactor with Ru-promoted Co/Al2O3 catalyst [J]. Int J Energy Res, 2020, 44(2): 1046 − 1061. [21] FLORENCIO F, VALENÇA T, MORENO E D, et al. Performance analysis of deep learning libraries: TensorFlow and PyTorch [J]. J Comp Sci, 2019, 15(6): 785 − 799. [22] LIU Yuliang, JIN Lianwen. Deep matching prior network: toward tighter multi-oriented text detection[C]//IEEE. 30th IEEE Conference on Computer Vision and Pattern Recognition. Honolulu: IEEE, 2017: 1962 − 1969. [23] AN Yang, WANG Xiaocen, CHU Ronghe, et al. Event classification for natural gas pipeline safety monitoring based on long short-term memory network and Adam algorithm [J]. Struct Health Monit, 2020, 19(4): 1151 − 1159. [24] 邓诗贵, 杨晨军, 冯加洲, 等. 一株木质素降解白腐菌的筛选、鉴定及其产漆酶培养基的优化[J]. 食品研究与开发, 2019, 40(16): 178 − 184. DENG Shigui, YANG Chenjun, FENG Jiazhou, et al. Screening and intification of a lignin-degrading wite rot fungi and optimization of its laccase-producing medium [J]. Food Res Dev, 2019, 40(16): 178 − 184. [25] 唐菊, 段传人, 黄友莹, 等. 白腐菌木质素降解酶及其在木质素降解过程中的相互作用[J]. 生物技术通报, 2011(10): 32 − 36. TANG Ju, DUAN Chuanren, HUANG Youying, et al. Characteristics of ligninolytic enzymes of white-rot fungus and their interactions in the process of lignin degradation [J]. Biotechnol Bull, 2011(10): 32 − 36. [26] 习兴梅. 农林废物堆肥化中木质纤维素降解微生物学研究[D]. 长沙: 湖南大学, 2007. XI Xingmei. Research of Lignocelluses Biodegradation by Different Microorganisms in Agriculture and Forestry Waste Composting [D]. Changsha: Hunan University, 2007. [27] 杨柳, 吕丹丹, 邓杰勇, 等. 粗毛栓菌(Trametes hirsuta)D2固态发酵山核桃蒲壳产漆酶的营养条件研究[J]. 微生物学通报, 2014, 41(10): 1955 − 1960. YANG Liu, LÜ Dandan, DENG Jieyong, et al. Nutritional conditions for laccase production by Trametes hirsuta D2 in solid-state fermentation using hickory hull [J]. Microbiol China, 2014, 41(10): 1955 − 1960. [28] 熊乙. 木质纤维素降解菌的筛选鉴定及降解产物研究[D]. 太谷: 山西农业大学, 2019. XIONG Yi. Screening and Identification of Lignocellulose Degrading Bacteria and Degradation Products Research [D]. Taigu: Shanxi Agricultural University, 2019. [29] 彭志妮, 郭丽琼, 张新超, 等. 蛹虫草固体发酵大豆基质的成分及抗氧化活性变化研究[J]. 菌物学报, 2011, 30(2): 338 − 342. PENG Zhini, GUO Liqiong, ZHANG Xinchao, et al. Compositions and antioxidant activities of soybean substrate during solid-state fermentation by Cordyceps militaris [J]. Mycosystema, 2011, 30(2): 338 − 342. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20200814







 下载:
下载: