-
在全球气候变暖的背景下,干旱事件愈渐频发。干旱影响植物的生长代谢,随着干旱强度的增加,轻度干旱导致植物根系活力下降,呼吸作用降低,叶片细胞体积变小,膜系统受到破坏,光合作用受影响[1−3];重度干旱引发活性氧过度积累,产生氧化应激反应,对植物造成永久性伤害[4−5]。因此,干旱被预测为未来农业中最重要的环境压力之一[6]。植物为了减轻干旱造成的损伤,通过一系列的生理生化反应来应对,如产生大量的渗透调节物质以提高渗透电位和增强根细胞的吸水能力[7−8],激活抗氧化防御系统并刺激一些重要的细胞信号过程,如钙信号、植物激素等[9−10]。
香榧Torreya grandis ‘Merrillii’是红豆杉科Taxaceae榧属Torreya常绿乔木,雌雄异株,为第三纪孑遗植物,是榧树Torreya grandis中唯一优良栽培类型,也是中国特有的珍稀木本油料树种,具有较高的营养价值和经济价值[11−13]。随着温室效应的加剧,全球气温不断升高,夏季极端酷热天气使得高温和干旱胁迫极易发生。加之香榧种植区域多位于野外山坡,极端天气不仅限制了香榧苗木的生长发育,甚至会造成其脱水死亡,严重影响其产业发展。
雌雄异株植物是一种特殊的植物类群,在维持生态系统的稳定性和可持续性方面发挥重要作用[14]。研究表明:长期的生物进化过程和性别的特异性表达以及繁殖成本的不同[15−16],使得雌雄异株植物在逆境胁迫下表现出显著的性别差异。因此在全球干旱日益严重的背景下,研究香榧雌雄植株对干旱的生理响应差异,不仅对实际生产具有指导意义,对丰富雌雄异株植物逆境胁迫响应机制也具有重要的科学价值。因此,本研究采取不同生长阶段的香榧雌雄株枝条进行扦插处理,以获得的香榧扦插苗为研究材料,探讨干旱胁迫对香榧雌雄株膜脂过氧化程度、渗透调节物质、活性氧质量摩尔浓度和抗氧化酶活性等方面的影响。
-
于2022年6—12月,在浙江农林大学东湖校区竹子研究院驯化室进行试验,室内恒定温度为21~25 ℃。首先于2022年6、7、8月对香榧雌雄株插穗进行扦插繁殖,获得香榧雌雄株插穗的最佳扦插时间。之后通过聚乙二醇(PEG)模拟干旱处理,测定生理指标,进一步探究香榧雌雄株的抗旱差异性。
基质按V(泥炭)∶V(蛭石)∶V(珍珠岩)=1∶1∶1的比例混合后高压锅内灭菌,冷却后加入适量清水静置过夜,后装入4 cm×10 cm的无纺布袋,整齐摆入30 cm×45 cm的育苗盆中待用。
在浙江农林大学潘母岗基地,分别随机挑选5株10~12年生香榧雌雄株作为采样母树,按雌雄分组并标号。选取生长健壮、长势相对一致,且无病虫害和机械损伤的当年生枝条为插穗进行试验。先对插穗进行消毒,将其浸泡在质量分数为0.125%的多菌灵(25%有效含量)溶液中,消毒2 min;然后用去离子水冲洗3遍,用消毒过的剪刀平口剪去基部(剪去的长度为总长度的1/5,使插穗的长度为5~6 cm)的茎段、顶部的分枝(剪去的长度为分叉枝条长度的1/2)和底部1/3的叶片;再用100 mg·L−1的萘乙酸(NAA)处理20 min。扦插时,将插穗垂直插入基质内,长度约为整个茎段长的1/3,然后轻轻把插穗周围的基质压实,再浇清水以触摸基质有湿润感为宜。
-
对不同月份的香榧枝条分别在扦插3、4、5个月后,随机选取相同月份香榧雌雄株幼苗各35株,拍照并记录每株香榧的根系形态指标,包括成活率、生根率、侧根数、侧根长和根的直径。然后将香榧幼苗小心移栽进8 cm×8 cm×11 cm的方形育苗盆中,同时对过长的根部进行适当修剪。
-
在已生根5~7个月的香榧雌雄株幼苗中,挑选长势一致的香榧雌雄株幼苗各50株,各平均分成5组,并分别按照如下处理:第1组用纯净水培养8 d (干旱胁迫0 d);第2组先用纯净水培养6 d,再用PEG 6000配置质量分数为30%的PEG溶液处理2 d (干旱胁迫2 d);第3组先用纯净水培养4 d,再用质量分数为30%的PEG溶液处理4 d (干旱胁迫4 d);第4组先用纯净水培养2 d,再用质量分数为30%的PEG溶液处理6 d (干旱胁迫6 d);第5组用质量分数为30%的PEG溶液处理8 d (干旱胁迫8 d)。试验时将香榧放入一次性纸杯中,PEG溶液没过香榧根系但不超过香榧叶片,于恒温培养室培养,并每日更换培养液。以上处理组均在第8天拍照记录,随后立即将处理的香榧清洗擦干,将每株所有的叶片取下并在液氮中研磨成粉末,然后取0.1 g的叶片粉末装入2 mL 离心管中,放入液氮中速冻后转移至−80 ℃冰箱备用。
-
超氧化歧物酶(SOD)活性采用WST-8法测定,过氧化物酶(POD)活性采用可见分光光度法测定,过氧化氢酶(CAT)活性采用钼酸铵比色法测定,过氧化氢(H2O2)采用可见分光光度法测定,超氧阴离子(O2−)采用可见分光光度法测定,丙二醛(MDA)采用可见分光光度法测定,脯氨酸(Pro)采用可见分光光度法测定。上述试剂均使用苏州科铭生物技术有限公司生产的试剂盒,具体实验步骤参照对应说明书进行,每个生理指标测定重复4次。
-
采用Excel 2019对所测数据进行整理,用 GraphPad Prism 8进行图表绘制,用 SPSS 25.0对数据进行方差分析,利用最小显著差异法(LSD)进行多重比较。
-
由表1可知:6月处理的香榧雌株成活率高于7和8月;8月处理的香榧雄株成活率高于6和7月,成活率和生根率最高可达100%。香榧雌雄株扦插生根的直径、侧根数和侧根长随扦插时长的增加而增加。对香榧雌株来说,6月扦插生根的侧根数最多,为(4.45±1.37)条,7月扦插生根的直径和侧根长最大,分别为(2.29±0.53) mm和(3.76±2.43) cm。对香榧雄株而言,6月扦插生根的侧根长最大,为(4.21±2.30) cm,7月扦插生根的直径最大,为(2.45±0.67) mm,8月扦插生根的侧根数最多,为(4.22±1.57)条。
表 1 嫩枝扦插结果分析
Table 1. Analysis of softwood cutting results
香榧性别 扦插月份 扦插时长/月 成活率/% 生根率/% 直径/mm 侧根数/条 侧根长/cm 雌株 6月 3 80.00 53.57 1.71±0.36 ef 3.67±1.44 bcdefg 2.20±0.95 cd 4 80.00 92.86 1.49±0.40 f 5.30±1.12 a 3.49±1.51 c 5 40.00 76.47 2.00±0.53 cdef 4.38±1.61 abcd 3.32±1.40 c 7月 3 68.57 66.67 2.28±0.40 abcde 2.44±0.81 ghi 2.12±1.70 cd 4 74.29 42.31 2.48±0.48 abcd 2.18±0.92 hi 2.28±1.78 cd 5 45.71 62.50 2.11±0.70 bcde 2.60±1.65 efghi 6.88±3.82 a 8月 3 71.43 28.00 2.27±0.42 abcde 1.43±0.71 i 1.47±1.21 d 4 48.57 47.06 2.13±0.66 bcde 4.00±1.41 abcd 2.64±1.80 cd 5 37.14 46.15 2.29±0.54 abcde 5.00±1.09 ab 6.68±5.13 a 雄株 6月 3 97.14 79.41 1.72±0.26 ef 3.30±1.54 defgh 3.31±1.82 c 4 82.86 82.76 1.96±0.38 cdef 3.83±1.43 bcdef 3.43±1.45 c 5 85.71 100.00 2.82±0.73 a 3.87±1.46 bcde 5.89±3.73 ab 7月 3 94.29 87.88 2.20±0.70 bcde 2.48±1.30 fghi 1.74±1.29 cd 4 94.29 100.00 2.53±0.73 abcd 3.73±1.56 bcdefg 5.07±2.46 b 5 77.14 92.59 2.63±0.57 ab 3.4±1.35 defgh 5.76±2.41 ab 8月 3 100.00 85.71 2.22±0.95 abcde 4.23±1.52 abcd 3.26±1.94 c 4 97.14 100.00 2.56±0.75 abc 3.59±1.58 cdefgh 3.29±1.89 c 5 88.57 100.00 1.92±0.59 def 4.84±1.61 abc 5.18±3.92 b 说明:直径、侧根数、侧根长为平均值±标准差,同列不同小写字母表示不同时长间差异显著(P<0.05)。 -
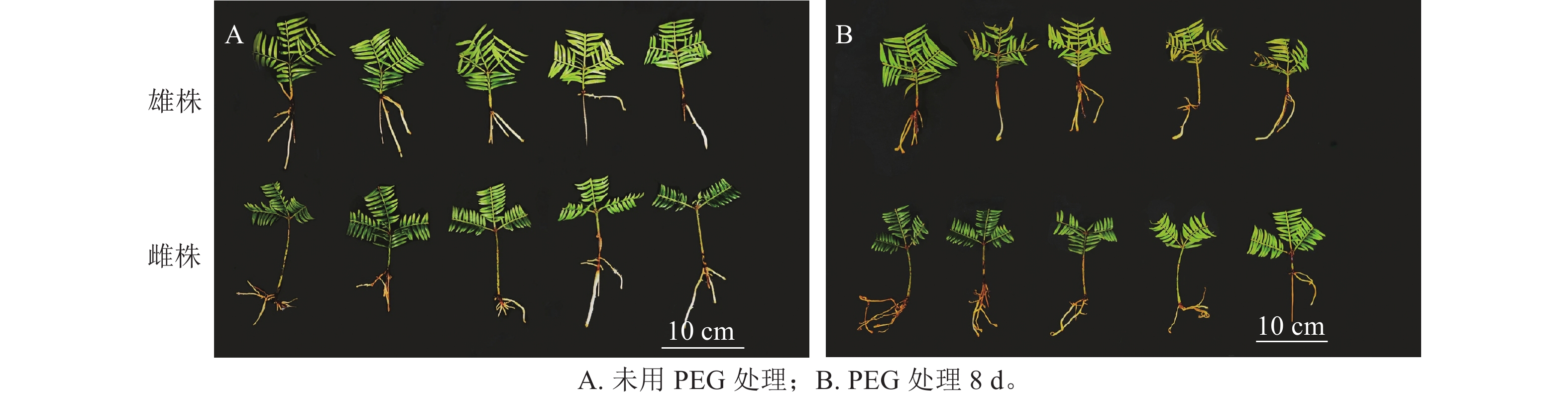
如图1所示:PEG处理香榧8 d后,雄株叶片明显发黄卷曲,表现缺水,而雌株干旱前后叶片无明显变化,说明雌株的抗旱性较强。这意味着在相同的干旱条件下,雌株的外观表现优于雄株。
-
从图2可以看出:干旱胁迫显著影响香榧雌雄株扦插幼苗叶片的MDA质量摩尔浓度。随着干旱胁迫时间的延长,雌雄株MDA质量摩尔浓度呈上升趋势。处理0~2 d,香榧雌雄株MDA质量摩尔浓度无显著差异,处理4~8 d,香榧雌雄株叶片中的MDA质量摩尔浓度表现出上升趋势;干旱8 d时,雄株MDA质量摩尔浓度显著高于雌株(P<0.05)。干旱0~8 d,雌株MDA质量摩尔浓度的变化趋势较小,上升了60.36%,而雄株MDA质量摩尔浓度上升了148.65%。
-
如图3A所示:干旱胁迫引起香榧雌雄株扦插幼苗叶片的SOD活性发生明显变化,不同处理时间下雌株的SOD活性均高于雄株,随着干旱胁迫时间延长呈现先升高后降低的趋势。胁迫4 d时,香榧雌雄株叶片的SOD活性达到最高值,与0 d相比分别增加了152.7%和239.72%;随后雌雄株SOD活性开始下降,胁迫8 d时,雌株SOD活性差异显著高于雄株(P<0.05),雌株SOD活性较0 d增加了65.23%,而雄株SOD活性与0 d差异不显著。
-
由图3B可知:香榧雌雄株扦插幼苗叶片中的POD活性随着干旱胁迫时间的延长呈现先增强后减弱的趋势。胁迫4 d时,雄株POD活性达到最高值,与0 d相比增加了61.49%;胁迫6 d时,雌株POD活性达到最高值,与0 d相比增加了101.88%;胁迫 8 d时,香榧雌株叶片中的POD活性显著高于雄株(P<0.05),较0 d相比,雌株增加了74.51%,而雄株POD活性与0 d相比差异不显著。
-
从图3C可以看出:随着干旱胁迫时间的延长,香榧雌雄株扦插幼苗叶片中的CAT活性呈先升高后降低的趋势。胁迫4 d时,雄株CAT活性达到最高值,与0 d相比增加了47.97%;胁迫6 d时,雌株CAT活性达到最高值,与0 d相比增加了140.3%;胁迫8 d时,香榧雌株叶片中的CAT活性显著高于雄株(P<0.05),雌株CAT活性与 0 d相比差异不显著,雄株较0 d降低了92.62%。
-
由图4可知:香榧雌雄株扦插幼苗叶片中的O2−和H2O2质量摩尔浓度随着干旱胁迫时间的延长,总体呈上升趋势。干旱胁迫0~2 d,香榧雌雄株O2−质量摩尔浓度无明显差异,干旱胁迫4~6 d,香榧雌雄株叶片中的O2−质量摩尔浓度逐渐升高;干旱胁迫8 d时,香榧雄株叶片的O2−质量摩尔浓度显著高于雌株(P<0.05),较0 d相比,雌株增加了102.83%,雄株增加了166.2%。香榧雌雄未遭受干旱胁迫时,叶片中O2−质量摩尔浓度几乎一致,干旱胁迫0~4 d时,香榧雄株H2O2质量摩尔浓度无明显变化,而雌株呈上升趋势;干旱胁迫4~8 d时,香榧雌株H2O2质量摩尔浓度趋于稳定,雄株明显升高;干旱胁迫8 d时,香榧雄株叶片的H2O2质量摩尔浓度显著高于雌株(P<0.05),较0 d相比,雄株增加了124.87%,雌株增加了96.61%。
-
干旱胁迫显著增加了香榧雌雄扦插幼苗叶片中脯氨酸(Pro)质量摩尔浓度,香榧雌雄叶片中Pro质量摩尔浓度随胁迫时间的延长呈增加趋势,但不同处理时间下雄株的Pro质量摩尔浓度均高于雌株(图4)。胁迫8 d时,香榧雌雄叶片中Pro质量摩尔浓度达最大值,雄株的Pro质量摩尔浓度显著高于雌株(P<0.05),与0 d相比,香榧雌雄叶片中Pro质量摩尔浓度分别增加了462.00%和433.38%。
-
本研究表明:夏季扦插繁殖的香榧雌株成活率较低,可能是雌雄异株之间不同的生理特性和生长习性差异所致[17]。雌雄株在生殖特性上存在差异,雌株的无性繁殖能力相对较弱,扦插时容易受到环境条件的影响。其次,雌雄株的生长习性与也存在差异,雄株在生长过程中能够更快地获取养分和水分资源,并能更好地抵抗一些外界压力,例如干旱[18]和盐碱胁迫[19]。这些特点使得雄株植物在一定程度上具备更高的成活率。本研究发现:6月扦插的香榧雌株生根率高于7和8月,而8月扦插的香榧雄株生根率高于6和7月。香榧雌雄株扦插相同天数时,雄株的成活率、生根率和侧根数均优于雌株,这与华中东青Ilex centrochinensis的扦插结果相似[20]。香榧雌雄株在不同月份的扦插效果不同,可能与不同月份的光照强度、日照时间、温度和湿度不同有关。
雌雄异株植物对环境胁迫表现出性别响应差异。有研究发现:镉胁迫对雄株南方四季杨Populus deltoides × nigra ‘Chile’负面影响更大[21],蒙古柳Salix linearistipularis雌株的耐盐碱能力强于雄株[22]。本研究结果显示:香榧雌雄叶片的SOD、POD、CAT活性和MDA质量摩尔浓度在干旱胁迫下表现出显著差异,这表明性别调节了雌雄植株对干旱胁迫的抗氧化酶响应特征。香榧雌雄株抗氧化酶活性在干旱过程中呈先上升后下降趋势,且不同处理天数之间差异显著,表明干旱胁迫下香榧抗氧化酶均能正常发挥作用。香榧雌株的SOD、POD和CAT活性在干旱处理8 d时高于雄株,而MDA质量摩尔浓度较雄株低,说明干旱胁迫中雌株表现出更好的抗氧化酶活性和膜稳定性。这与苟蓉[23]的研究结果一致。通过提高防御酶活性抵抗和适应一定程度的干旱胁迫来维持活性氧产生与清除之间的平衡[24],细胞膜的稳定对植物的生命活动起着重要的作用。
已有研究表明:干旱胁迫下植株的活性氧水平与MDA质量摩尔浓度呈极显著正相关[25]。本研究发现:持续干旱胁迫使得香榧幼苗叶片的H2O2、O2−和MDA质量摩尔浓度显著升高,且香榧雄株的H2O2、O2−和MDA质量摩尔浓度明显高于雌株。表明在干旱胁迫下,香榧雄株叶片膜系统比雌株更容易受损,雌株对干旱胁迫具有更强的适应性,这与刘牧野等[26]的研究结果一致,干旱胁迫下,野牛草Buchloe dactyloides雌株抗旱性强于雄株。
渗透调节是植物抵抗逆境的方式之一,Pro等作为重要的渗透调节物质,会在水分亏缺时主动积累以适应干旱逆境[27]。本研究发现:干旱胁迫处理后香榧Pro质量摩尔浓度随时间的延长而升高,干旱处理8 d时表现出显著的性别响应差异,且雌株Pro质量摩尔浓度高于雄株,说明香榧雄株在相同干旱胁迫下比雌株更易遭受损伤。这与马少薇等[28]的研究结果相同,干旱胁迫下黄柳Salix gordejevii雌株叶片Pro质量摩尔浓度显著低于雄株,雌株叶片保水能力较强,对水分短缺不敏感。
-
本研究表明:香榧雌株选择6月扦插,雄株选择8月扦插,可以获得较为理想的扦插效果。在干旱胁迫下,香榧雌株通过调节抗氧化酶的活性来增强抗氧化能力,降低其活性氧的积累。此外,香榧雌株在干旱胁迫下还表现出更好的细胞膜稳定性,使得香榧雌株比雄株具有更高的抗旱性。
Physiological differences in rooting and response to drought in shoots of female and male Torreya grandis‘Merrillii’
-
摘要:
目的 探究香榧Torreya grandis ‘Merrillii’雌雄植株的生根差异和响应干旱胁迫的生理差异,为香榧抗干旱种质资源的培育提供科学依据。 方法 以香榧新生雌雄株枝条为材料,比较两者夏季扦插生根差异,对生根状况较一致的香榧雌雄株施加聚乙二醇(PEG)模拟干旱处理,比较不同时间下香榧雌雄株幼苗的抗氧化酶活性、渗透调节物质、膜脂过氧化和活性氧质量摩尔浓度的变化。 结果 夏季扦插的香榧雄株成活率普遍高于雌株,雌雄株扦插的最佳时间不同,与7和8月相比,6月扦插的香榧雌株成活率和生根率更高,侧根数更多,而8月扦插的香榧雄株较6和7月的成活率和生根率更高,侧根数更多。在扦插相同时间下,雄株的成活率和生根率均高于雌株。干旱胁迫引起香榧叶片抗氧化酶活性发生显著变化,并扰乱其渗透调节功能和活性氧代谢平衡。在干旱胁迫下,与雄株相比,雌株具有更高的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性,以及较低的丙二醛(MDA)、脯氨酸(Pro)、超氧阴离子(O2−)和过氧化氢(H2O2)质量摩尔浓度。 结论 夏季扦插的香榧雄株比雌株具有更高的扦插成活率。干旱胁迫下,香榧雌株能够更好地利用抗氧化系统来减少干旱胁迫引起的活性氧积累和细胞损伤,从而使香榧雌株比雄株更耐干旱。图4表1参28 Abstract:Objective This study, with an exploration of the rooting differences and the physiological differences in response to drought stress between male and female Torreya grandis ‘Merrillii’, is aimed to provide a scientific basis for the cultivation of drought-resistant germplasm resources of T. grandis ‘Merrillii’. Method First, with the shoots of newborn male and female T. grandis ‘Merrillii’ selected as materials, a comparison is conducted of the differences in rooting of summer cuttings between them. Then, PEG solution was applied to male and female T. grandis ‘Merrillii’ with consistent rooting status for simulated drought treatment after which the changes of antioxidant enzyme activity, osmomodulating substances, membrane lipid peroxidation and reactive oxygen species content of male and female seedlings were compared and analyzed under different treatment times. Result The survival rate of male T. grandis ‘Merrillii’ of summer cuttings was generally higher than female and the best time for cuttings was different for male and female T. grandis ‘Merrillii’. Cuttings for the female in June had higher survival, rooting rates and a higher number of lateral roots than those in July and August whereas the survival rate and rooting rate of male cuttings in August were higher than those in June and July, and the number of lateral roots was higher. When the male and female T. grandis ‘Merrillii’ were cut for the same number of days, the survival rate and rooting rate of male plants were higher than the female ones. Drought stress caused significant changes in antioxidant enzyme activity in fragrant leaves, and disturbed its osmoregulatory function and reactive oxygen species metabolism balance. Under drought stress, female plants had higher superoxide dismutase (SOD) activity, peroxidase (POD) activity and catalase (CAT) activity, as well as lower malondialdehyde (MDA), proline (Pro), superoxide anion (O2−) and hydrogen peroxide (H2O2) than male strains. Conclusion The male T. grandis ‘Merrillii’ of summer cuttings have a higher survival rate of cuttings than female, and under drought stress, the female T. grandis ‘Merrillii’ can better use the antioxidant system to reduce the accumulation of reactive oxygen species and cell damage caused by drought stress. Thus, the female T. grandis ‘Merrillii’ are more drought-tolerant than male ones. [Ch, 4 fig. 1 tab. 28 ref.] -
Key words:
- Torreya grandis ‘Merrillii’ /
- dioecious plant /
- drought stress /
- plant physiology
-
表 1 嫩枝扦插结果分析
Table 1. Analysis of softwood cutting results
香榧性别 扦插月份 扦插时长/月 成活率/% 生根率/% 直径/mm 侧根数/条 侧根长/cm 雌株 6月 3 80.00 53.57 1.71±0.36 ef 3.67±1.44 bcdefg 2.20±0.95 cd 4 80.00 92.86 1.49±0.40 f 5.30±1.12 a 3.49±1.51 c 5 40.00 76.47 2.00±0.53 cdef 4.38±1.61 abcd 3.32±1.40 c 7月 3 68.57 66.67 2.28±0.40 abcde 2.44±0.81 ghi 2.12±1.70 cd 4 74.29 42.31 2.48±0.48 abcd 2.18±0.92 hi 2.28±1.78 cd 5 45.71 62.50 2.11±0.70 bcde 2.60±1.65 efghi 6.88±3.82 a 8月 3 71.43 28.00 2.27±0.42 abcde 1.43±0.71 i 1.47±1.21 d 4 48.57 47.06 2.13±0.66 bcde 4.00±1.41 abcd 2.64±1.80 cd 5 37.14 46.15 2.29±0.54 abcde 5.00±1.09 ab 6.68±5.13 a 雄株 6月 3 97.14 79.41 1.72±0.26 ef 3.30±1.54 defgh 3.31±1.82 c 4 82.86 82.76 1.96±0.38 cdef 3.83±1.43 bcdef 3.43±1.45 c 5 85.71 100.00 2.82±0.73 a 3.87±1.46 bcde 5.89±3.73 ab 7月 3 94.29 87.88 2.20±0.70 bcde 2.48±1.30 fghi 1.74±1.29 cd 4 94.29 100.00 2.53±0.73 abcd 3.73±1.56 bcdefg 5.07±2.46 b 5 77.14 92.59 2.63±0.57 ab 3.4±1.35 defgh 5.76±2.41 ab 8月 3 100.00 85.71 2.22±0.95 abcde 4.23±1.52 abcd 3.26±1.94 c 4 97.14 100.00 2.56±0.75 abc 3.59±1.58 cdefgh 3.29±1.89 c 5 88.57 100.00 1.92±0.59 def 4.84±1.61 abc 5.18±3.92 b 说明:直径、侧根数、侧根长为平均值±标准差,同列不同小写字母表示不同时长间差异显著(P<0.05)。 -
[1] 张希吏, 王萍, 石磊, 等. 干旱胁迫对沙芥幼苗根系形态及抗氧化酶活性的影响[J]. 干旱地区农业研究, 2016, 34(3): 160 − 164. ZHANG Xili, WANG Ping, SHI Lei, et al. Root morphology and antioxidant enzyme activity of Pugionium cornutum (L. ) Gaertn under drought stress [J]. Agricultural Research in the Arid Areas, 2016, 34(3): 160 − 164. [2] 吴丽君, 李志辉, 杨模华, 等. 赤皮青冈幼苗叶片解剖结构对干旱胁迫的响应[J]. 应用生态学报, 2015, 26(12): 3619 − 3626. WU Lijun, LI Zhihui, YANG Mohua, et al. Response of leaf anatomical characteristics of Cyclobalanopsis gilva seedlings to drought stress [J]. Chinese Journal of Applied Ecology, 2015, 26(12): 3619 − 3626. [3] 张兴华, 高杰, 杜伟莉, 等. 干旱胁迫对玉米品种苗期叶片光合特性的影响[J]. 作物学报, 2015, 41(1): 154 − 159. ZHANG Xinghua, GAO Jie, DU Weili, et al. Effects of drought stress on photosynthetic characteristics of maize hybrids at seedling stage [J]. The Crop Journal, 2015, 41(1): 154 − 159. [4] IMPA S M, NADARADJAN S, JAGADISH S V K. . Drought stress induced reactive oxygen species and antioxidants in plants [M]//AHMAD P, PRASAD M N V. Abiotic Stress Responses in Plants: Metabolism Productivityand Sustainability. New York: Springer, 2011: 131 − 147. [5] 赵春桥, 陈敏, 侯新村, 等. 干旱胁迫对柳枝稷生长与生理特性的影响[J]. 干旱区资源与环境, 2015, 29(3): 126 − 130. ZHAO Chunqiao, CHEN Min, HOU Xincun, et al. Effect of drought stress on the growth and physiological characteristics of Panicum virgatum L. [J]. Journal of Arid Land Resources and Environment, 2015, 29(3): 126 − 130. [6] 邹原东, 韩振芹, 李志强. 水分胁迫对玉米苗期生理指标的影响[J]. 安徽农业科学, 2019, 47(24): 25 − 27. ZOU Yuandong, HAN Zhenqin, LI Zhiqiang. Effects of water stress on physiological indexes of maize seedlings [J]. Anhui Agricultural Science, 2019, 47(24): 25 − 27. [7] KAUR H, MANNA M, THAKUR T, et al. Imperative role of sugar signaling and transport during drought stress responses in plants [J]. Physiologia Plantarum, 2021, 171(4): 833 − 848. [8] WANG Xiyue, LI Yongping, WANG Xiaojing, et al. Physiology and metabonomics reveal differences in drought resistance among soybean varieties [J/OL]. Botanical Studies, 2022, 63(1): 8[2023-09-10]. doi: 10.1186/s40529-022-00339-8. [9] WANG Xiaoge, DENG Yongsheng, GAO Liying, et al. Series-temporal transcriptome profiling of cotton reveals the response mechanism of phosphatidylinositol signaling system in the early stage of drought stress [J/OL]. Genomic, 2022, 114(5): 110465[2023-09-10]. doi: 10.1016/j.ygeno.2022.110465. [10] HU Yuanyuan, ZHANG Zuying, HUA Bin, et al. The interaction of temperature and relative humidity affects the main aromatic components in postharvest Torreya grandis nuts [J/OL]. Food Chemistry, 2022, 368: 130836[2023-09-10]. doi: 10.1016/j.foodchem.2021.130836. [11] 郝琪淳, 谢吉全, 戴文圣, 等. 香榧种实充实期叶面施肥对种实品质的影响[J]. 浙江农林大学学报, 2024, 41(3): 457 − 466. HAO Qichun, XIE Jiquan, DAI Wensheng, et al. Effect of foliar fertilization on seed quality of Torreya grandis ‘Merrillii’ during seed filling period [J]. Journal of Zhejiang A&F University, 2024, 41(3): 457 − 466. [12] 何慈颖, 娄和强, 吴家胜. 香榧油脂及其合成调控机制研究进展[J]. 浙江农林大学学报, 2023, 40(4): 714 − 722. HE Ciying, LOU Heqiang, WU Jiasheng. Research progress on synthesis and regulation mechanism of Torreya grandis‘Merrillii’ kernel oil [J]. Journal of Zhejiang A&F University, 2023, 40(4): 714 − 722. [13] 叶淑媛, 曾燕如, 胡渊渊, 等. 香榧初结果母枝性状变化规律与结实能力的关系[J]. 浙江农林大学学报, 2022, 39(1): 41 − 49. YE Shuyuan, ZENG Yanru, HU Yuanyuan, et al. Relationship between character changing and seed-bearing capacity of initial seed-bearing mother shoots in Torreya grandis ‘Merrillii’ [J]. Journal of Zhejiang A&F University, 2022, 39(1): 41 − 49. [14] XU Xiao, YANG Fan, YIN Chunying, et al. Research advances in sex-specific responses of dioecious plants to environmental stress [J]. Chinese Journal of Applied Ecology, 2007, 18(11): 2626 − 2631. [15] STEHLIK I, FRIEDMAN J, BARRETT S C. Environmental influence on primary sex ratio in a dioecious plant [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(31): 10847 − 10852. [16] LEIGH A, NICOTRA A B. Sexual dimorphism in reproductive allocation and water use efficiency in Maireana pyramidata (Chenopodiaceae), a dioecious, semi-arid shrub [J]. Australian Journal of Botany, 2003, 51(5): 509 − 514. [17] 唐学玺. 环境胁迫下雌雄异株植物的差异响应特征及研究进展[J]. 中国海洋大学学报(自然科学版), 2020, 50(7): 74 − 81. TANG Xuexi. Characteristics and research progress of sex-specific responses to environmental stresses of dioecious plant [J]. Periodical of Ocean University of China, 2020, 50(7): 74 − 81. [18] 施梦娇, 李斌, 伊力塔, 等. 美洲黑杨幼苗生长和生理生态指标对干旱-复水响应的性别差异[J]. 植物生态学报, 2023, 47(8): 1159 − 1170. SHI Mengjiao, LI Bin, YI Lita, et al. Sexual divergence of Populus deltoides seedlings growth and ecophysiological response to drought and rewatering [J]. Chinese Journal of Plant Ecology, 2023, 47(8): 1159 − 1170. [19] YU Lei, HUANG Zongdi, TANG Shuanglei, et al. Populus euphratica males exhibit stronger drought and salt stress resistance than females [J/OL]. Environmental and Experimental Botany, 2023, 205: 105114[2023-09-10]. doi: 10.1016/j.envexpbot.2022.105114. [20] 胡曼筠, 曾雯, 蔡梦颖, 等. 华中冬青雌雄株扦插繁殖技术研究[J]. 江西农业大学学报, 2017, 39(2): 327 − 333. HU Manjun, ZENG Wen, CAI Mengying, et al. A study on cutting propagation technique for male and female plants of Ilex centrochinensis [J]. Acta Agriculturae Universitatis Jiangxiensis, 2017, 39(2): 327 − 333. [21] 赵子豪, 宋琦, 李利, 等. 南方四季杨雌雄幼苗对镉胁迫光合生理响应的差异[J]. 森林与环境学报, 2019, 39(2): 201 − 207. ZHAO Zihao, SONG Qi, LI Li, et al. Difference in photosynthesis and physiological response of male and female Populus deltoides × nigra to Cd stress [J]. Journal of Forest and Environment, 2019, 39(2): 201 − 207. [22] 齐琪. 蒙古柳雌雄株扦插苗对盐碱胁迫的响应[D]. 哈尔滨: 东北林业大学, 2020. QI Qi. Response of Cuttings of Salix linearistipularis Male and Female Plant to Saline-alkali Stress [D]. Harbin: Northeast Forestry University, 2020. [23] 苟蓉. 干旱对构树幼苗生长发育及生理代谢影响的性别差异[D]. 南充: 西华师范大学, 2020. GOU Rong. Effects of Drought on Growth and Physiological Metabolism of Broussonetia papyrifera Seedlings [D]. Nanchong: China West Normal University, 2020. [24] 冯蕊, 周琪, 吴令上, 等. PEG-6000模拟干旱胁迫对铁皮石斛幼苗生理和叶绿素荧光特性的影响[J]. 浙江农林大学学报, 2024, 41(1): 132 − 144. FENG Rui, ZHOU Qi, WU Lingshang, et al. Effects of PEG-6000 simulated drought stress on physiological and chlorophyll fluorescence characteristics of Dendrobium candidum seedlings[J]. Journal of Zhejiang A&F University, 2024, 41(1): 132 − 144. [25] BAI Liping, SUI Fanggong, GE Tida, et al. Effect of soil drought stress on leaf water status, membrane permeability and enzymatic antioxidant system of maize [J]. Pedosphere, 2006, 16(3): 326 − 332. [26] 刘牧野, 郭丽珠, 岳跃森, 等. 干旱胁迫下不同性别野牛草生理及抗氧化酶基因表达差异[J]. 草业学报, 2023, 32(10): 93 − 103. LIU Muye, GUO Lizhu, YUE Yuesen, et al. Physiological and antioxidant enzyme gene expression differences between female and male Buchloe dactyloides plants under drought stress [J]. Acta Prataculturae Sinica, 2023, 32(10): 93 − 103. [27] 张淑勇, 国静, 刘炜, 等. 玉米苗期叶片主要生理生化指标对土壤水分的响应[J]. 玉米科学, 2011, 19(5): 68 − 72, 77. ZHANG Shuyong, GUO Jing, LIU Wei, et al. Response of main physiological and biochemical indexes of maize leaf to soil moisture at seedling stage [J]. Journal of Maize Sciences, 2011, 19(5): 68 − 72, 77. [28] 马少薇, 刘果厚, 王蕾, 等. 干旱胁迫对黄柳雌雄扦插苗生长和生理特性的影响[J]. 西北植物学报, 2019, 39(7): 1250 − 1258. MA Shaowei, LIU Guohou, WANG Lei, et al. Effect of drought stress on growth and physiological characterisitics of male and female Salix gordejevii cuttings [J]. Acta Botanica Boreali-Occidentalia Sinica, 2019, 39(7): 1250 − 1258. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20230471






 下载:
下载: