-
生物体在有氧代谢过程中会不断地产生自由基。自由基的产生和清除在正常情况下是动态平衡的,对机体伤害小,如果自由基的产生量超过生物体的清除能力,生物体就会出现相应的疾病[1]。如人体内主要的活性氧自由基,即羟自由基(·OH)和超氧阴离子自由基(O2-·)可经过一系列反应生成其他氧自由基,累积过多就会损伤生物膜中的不饱和脂肪酸,引起脂质过氧化,从而导致机体衰老、心血管疾病及肿瘤的发生[2],严重危害人体健康。因此,寻找合适的抗氧化剂来清除活性氧自由基,使机体免受损伤就显得非常重要。多糖是由多个单糖分子失水、缩合而成的一类结构复杂的生物大分子,在动物、植物、微生物和海藻中普遍存在[3]。许多研究表明:多糖具有特殊的生物活性和药理特性,能够清除自由基,减少慢性疾病的发生,并且基本无毒副作用[4-7],在医药卫生和食品行业具有很好应用价值,受到了人们的广泛关注。因此,从生物体内筛选出具有很强抗氧化能力的多糖成分已成为当今的一个研究热点。近年来,许多学者从植物和真菌中提取了多糖,并进行了抗氧化研究。对动物,特别是昆虫源多糖的提取及抗氧化活性研究的报道也较多,如何钊等[8]研究了黄粉虫Tenebrio molitor多糖体外抗氧化活性,结果表明:黄粉虫多糖对二苯代苦味酰自由基(DPPH)清除率为50%时的质量浓度(IC50值)为0.65 g·L-1,在质量浓度为1.76 g·L-1时,对羟基自由基(·OH)的清除率达到99.3%,但在实验范围内,对超氧阴离子自由基(O2-·)的清除率均在50%以下,效果较不显著;武忠伟等[9]研究了冬虫夏草Cordyceps sinensis与富硒虫草多糖的抗氧化活性,认为冬虫夏草和富硒虫草多糖对羟基自由基(·OH),超氧阴离子自由基(O2-·)和H2O2具有较好的清除作用,当100 mg·L-1多糖溶液添加量分别高于80,40,90 μL时,各组多糖对3种自由基的抑制率均高于50%;赵秋蓉等[10]对冬虫夏草多糖进行纯化和抗氧化活性研究,认为冬虫夏草多糖质量浓度为0.5 g·L-1时,对羟基自由基(·OH)的清除率已经达55.56%,当质量浓度为3.0 g·L-1时,清除率为65.74%,在质量浓度为0.5 g·L-1时,对超氧阴离子自由基(O2-·)的抑制率为20.99%,当质量浓度为1.0 g·L-1时,抑制率为25.62%。这些研究结果表明:昆虫种类不同以及多糖的提取方法不同,其多糖的抗氧化活性均存在一定差异。昆虫是自然界中种类最多、数量最大的类群,是地球上尚未被充分开发利用的巨大生物资源。中国昆虫种类繁多,占世界种类总量的10%[11],尚有很多种类未进行相关研究。因此,进行昆虫多糖的抗氧化活性研究对开发新药源具有非常重要的意义。金银花尺蠖Heterolocha jinyinhuaphaga属鳞翅目Lepidoptera尺蛾科Geometridae昆虫,别名拱腰虫,是近年来新发现的金银花Lonicera japonica主要食叶害虫之一,在河南、山东、安徽等地已有报道[12-15]。该虫常将金银花叶片咬成缺刻或孔洞,甚至将叶片全部吃光,造成金银花的大面积减产,给金银花生产带来严重损失。目前,国内对金银花尺蠖的生物学特性及防治方面已有一些研究[12-16],而有关其多糖抗氧化活性研究还未见报道。笔者已研究了金银花尺蠖的一些生物学特性,初步建立了实验室种群,现在前期研究的基础上提取金银花尺蠖蛹粗多糖,进行体外抗氧化活性研究,以期为从昆虫中开发天然抗氧化药物和功能食品提供科学参考,从而达到变害为宝的目的。
HTML
-
石油醚(60~90 ℃),正丁醇,氯仿,体积分数为95%乙醇,丙酮,葡萄糖,无水乙醇,苯酚,浓硫酸,碳酸氢钠,三氯乙酸,三氯化铁,磷酸氢二钠,磷酸二氢钠,铁氰化钾,二苯代苦味酰自由基(DPPH),邻菲罗啉,硫酸亚铁,过氧化氢,二乙基三胺五乙酸(DTPA),三羟甲基胺基甲烷,盐酸,邻苯三酚,标准抗坏血酸(Vc),均为国产分析纯。
-
人工气候箱(RXZ-288A型,宁波江南仪器制造厂),索氏提取器(郑州兴华玻璃仪器厂),旋转蒸发仪(RE-52AA型,上海亚荣生化仪器厂),循环水式多用真空泵(SHB-Ⅲ型,郑州长城科工贸有限公司),800B型台式离心机(上海市安亭科学仪器制造厂),高速万能粉碎机(FW80型,天津市泰斯特仪器有限公司),HH-6数显恒温水浴锅(江苏省金坛市荣华仪器制造厂),精密烘箱(20011243型,西班牙Selecta公司),85-2磁力加热搅拌器(江苏金坛红凯仪器厂),723C可见分光光度计(上海欣茂仪器有限公司)。
-
从安徽省明光市三界镇野生金银花上采集金银花尺蠖幼虫,放入罐头瓶内,10头·瓶-1,然后放在人工气候箱中用新鲜的金银花叶片饲养,每天更换叶片,直至化蛹。人工气候箱的光周期设置为光照期(L):暗期(D)=14:10,相对湿度设置为(75±7)%,温度设置为(25±1)℃。
-
采用热水浸提法[2]。取金银花尺蠖蛹,经烘箱(45 ℃)干燥后粉碎,过40目筛。称取金银花尺蠖蛹粉末10.0 g,置于索氏提取器中,加入石油醚(沸点60~90 ℃)100.0 mL,70 ℃回流提取1 h脱脂,抽滤,浓缩回收溶剂,重复2次。将滤渣经45 ℃烘干后置于烧瓶中,加入10倍量的蒸馏水,在沸水浴中提取1 h,过滤,滤渣再用蒸馏水重复提取1次,将2次滤液合并。将滤液用旋转蒸发仪(60 ℃)缩浓至一定体积,Sevage法除蛋白[17],流动自来水透析24 h,再次浓缩,加入4倍体积的体积分数为95%乙醇,在4 ℃冰箱中过夜醇沉,离心10 min(4 000 r·min-1),沉淀用无水乙醇、丙酮各洗涤2次,低温干燥至恒量,即得金银花尺蠖蛹粗多糖。称取一定量的粗多糖,用重蒸馏水溶解,并配制成不同浓度的试样,待用。
-
蛹粗多糖质量分数的测定采用苯酚-硫酸比色法[18]。葡萄糖标准曲线的测定:取分析纯葡萄糖于105 ℃烘箱中干燥至恒量,精密称取50.0 mg,置于100 mL容量瓶中,用蒸馏水定容,即配制成0.5 g·L-1的葡萄糖标准溶液。用移液管精密移取0,1.0,2.0,3.0,4.0,5.0,6.0 mL的葡萄糖标准溶液,分别置于50.0 mL容量瓶中,加蒸馏水定容,并摇匀。精确吸取上述溶液2.0 mL,置于具塞试管中,加质量分数为5%的苯酚1.0 mL,摇匀,快速滴加浓硫酸5 mL,摇匀,放置10 min,置沸水浴中加热20 min后取出冷却,以蒸馏水作空白对照,在490 nm处测定吸光度值。以葡萄糖质量浓度(mg·L-1)为横坐标,吸光度值D(490)为纵坐标,绘制葡萄糖标准曲线,并回归出标准曲线方程。样品中粗多糖质量分数测定:称取干燥至恒量的蛹粗多糖样品100.0 mg,置于100 mL容量瓶中,加水溶解,摇匀,定容。精确吸取该溶液4.0 mL至50 mL容量瓶中,加水稀释,摇匀,定容。按照葡萄糖标准曲线的测定方法测定吸光度值。实验重复3次,采用葡萄糖标准曲线线性回归方程算出样品中粗多糖的平均质量分数。
-
参考李润丰等[6]的方法。取各质量浓度粗多糖样品液2.5 mL置于具塞试管中,然后加入0.2 mol·L-1磷酸盐缓冲液(pH 6.6)2.5 mL和质量分数为1%铁氰化钾溶液2.5 mL,盖上塞子充分摇匀,在50 ℃水浴锅中保温20 min,取出后快速冷却,加入质量分数为10%三氯乙酸2.5 mL,充分摇匀后离心10 min(4 000 r·min-1),取上清液2.5 mL,加入质量分数为0.1 %三氯化铁0.5 mL和蒸馏水2.5 mL,充分摇匀后静止10 min,在700 nm处测定吸光度值D(700),将样品液换成蒸馏水进行参比测定实验,用同浓度的维生素C作阳性对照。
-
参照赵爱云等[7]的方法,称取金银花尺蠖蛹粗多糖,用蒸馏水配制成0.2,0.4,0.6,0.8,1.0和1.2 g·L-1等6种质量浓度。称取20.0 mg的DPPH置于500 mL容量瓶中,用无水乙醇溶解,并定容为0.1 mmol·L-1的溶液。精确量取2.0 mL DPPH溶液放入10 mL具塞试管中,分别加入2.0 mL各质量浓度的样品溶液,充分混匀并静置30 min,在517 nm处测定溶液吸光度值。实验重复3次,以蒸馏水作空白对照,以维生素C作阳性对照。按下面公式计算蛹粗多糖清除DPPH自由基的能力:DPPH自由基清除率(%)=[D0-(D2-D1)/ D0]×100。其中:D0为2.0 mL DPPH溶液+2.0 mL蒸馏水的吸光度值;D1为2.0 mL乙醇+2.0 mL样品溶液的吸光度值;D2为2.0 mL DPPH溶液+2.0 mL粗多糖溶液的吸光度值。
-
参照单斌等[2]的方法,设空白组、对照组和样品组。在各样品管中分别依次加入1.0 mL不同质量浓度(0.2,0.4,0.6,0.8,1.0,1.2 g·L-1)蛹粗多糖溶液,再依次分别加入0.4 mol·L-1 PBS缓冲溶液(pH 7.4)1.0 mL,2.5 mmol·L-1邻菲罗啉溶液1.0 mL,2.5 mmol·L-1硫酸亚铁溶液1.0 mL,20.0 mmol·L-1过氧化氢溶液0.5 mL;空白组中把样品溶液换成1.0 mL蒸馏水;对照组中用1.5 mL蒸馏水代替过氧化氢溶液和样品溶液。各管摇匀,在37 ℃恒温水浴中准确反应1 h后,迅速在536 nm处测定吸光度值。以等质量浓度的维生素C为阳性对照,实验重复3次。根据下列公式计算粗多糖样品对羟自由基(·OH)的清除率[2]:羟自由基(·OH)清除率(%)=[(D2-D1)/(D0-D1)]×100。其中:D0,D1,D2分别为标准对照组吸光度值、空白组吸光度值和样品组吸光度值。
-
采用邻苯三酚自氧化法[2],取3 mmol·L-1 DTPA溶液2.0 mL和150 mmol·L-1 Tris-HCl缓冲液2.0 mL(pH 8.2)放入10 mL具塞试管中,分别加入0.5 mL各质量浓度(0.2,0.4,0.6,0.8,1.0,1.2 g·L-1)待测粗多糖溶液,经25 ℃恒温水浴保温20 min后,立即加入经25 ℃预热的45 mmol·L-1邻苯三酚溶液0.1 mL,迅速摇匀,在3.5 min内,隔30 s在325 nm处测定1次溶液的吸光度值,计算吸光度值随时间的变化率。实验重复3次,以等质量浓度的维生素C为阳性对照,并与空白溶液比较。根据下列公式计算粗多糖样品对超氧阴离子自由基的清除率。超氧阴离子自由基清除率(%)=[(F0-Fx)/F0]×100。其中:F0为空白溶液吸光度值随时间的变化率;Fx为被测溶液吸光度值随时间的变化率。
1.1. 试剂
1.2. 主要仪器
1.3. 试验方法
1.3.1. 供试昆虫的饲养
1.3.2. 金银花尺蠖蛹粗多糖的制备
1.3.3. 金银花尺蠖蛹粗多糖质量分数测定
1.3.4. 金银花尺蠖蛹粗多糖总还原力测定
1.3.5. 金银花尺蠖蛹粗多糖清除二苯代苦味酰自由基(DPPH)试验
1.3.6. 金银花尺蠖蛹粗多糖清除羟自由基(·OH)试验
1.3.7. 金银花尺蠖蛹粗多糖清除超氧阴离子自由基(O2-·)试验
-
采用SPSS 11.5统计软件进行数据处理和统计学分析,采用Duncan氏新复极差法在P<0.05水平上进行差异显著性检验。
-
将所测定各质量浓度标准葡萄糖溶液的吸光度值D(490)为纵坐标,对应的葡萄糖质量浓度C(mg·L-1)为横坐标绘制标准曲线,得出吸光度D(490)与葡萄糖标准品质量浓度C关系的线性回归方程为D(490)=0.069 3C -0.050 9,相关系数R2为0.992 2,说明葡萄糖在2.5~15.0 mg·L-1范围内,其质量浓度与吸光度线性关系良好。此回归方程可以很好地拟合试验数据。按1.3.3方法步骤测得金银花尺蠖蛹中粗多糖质量分数(干质量)为34.6 g·kg-1。
-
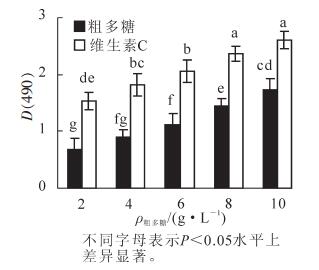
在反应体系中,铁氰化钾与还原物质发生反应生成亚铁氰化钾,再与Fe3+反应生成普鲁士蓝,在700 nm处有特异性吸收,吸光度值越大,说明样品的还原能力就越强。一般情况下,物质的还原能力越强,其抗氧化活性就越强。图 1显示:金银花尺蠖蛹粗多糖具有较强的还原能力,在2.0 g·L-1时的吸光度值为0.67,随质量浓度的增加吸光度值也在增加。当质量浓度上升到10.0 g·L-1时,吸光度值增加到1.72,差异达显著水平(P<0.05),说明还原力随粗多糖质量浓度的增加而增大,但各质量浓度下的还原力均低于维生素C,差异达显著水平(P<0.05)。在2.0~10.0 g·L-1的质量浓度范围内,多糖的总还原力(y)与质量浓度(x)之间呈显著的线性关系,拟合方程为y=0.133x+0.372, R2=0.994 0。
-
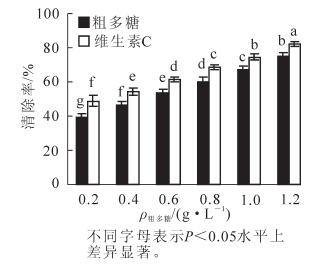
由图 2可知:金银花尺蠖蛹粗多糖对DPPH自由基具有较强的清除作用,在0.2 g·L-1时的清除率为39.32%,随着粗多糖质量浓度的增加,对DPPH自由基的清除率也逐渐增加。当质量浓度上升到1.2 g·L-1时,清除率已达到74.93%,增加了35.61%,差异达显著水平(P<0.05)。各质量浓度下的清除率均低于维生素C,差异达显著水平(P<0.05)。在0.2~1.2 g·L-1的质量浓度范围内,粗多糖对DPPH自由基的清除率(y)与质量浓度(x)之间呈显著的线性关系,拟合方程为y=35.381x+32.215, R2=0.999 8。
-
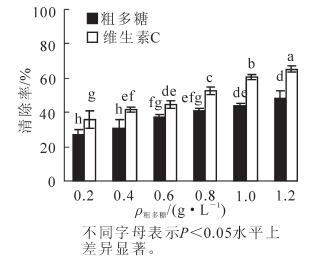
由图 3可知:在体外,金银花尺蠖蛹粗多糖能明显地清除羟自由基(·OH),在0.2 g·L-1时,即显示较强清除能力,清除率达35.62%,其清除作用随着粗多糖质量浓度的升高而逐渐加强,当质量浓度上升到1.2 g·L-1时,清除率已达到61.59%,增加了25.97%,差异达显著水平(P<0.05),各质量浓度下的清除率均低于维生素C,差异达显著水平(P<0.05)。在0.2~1.2 g·L-1的质量浓度范围内,粗多糖对羟自由基(·OH)的清除率(y)与质量浓度(x)之间呈显著的线性关系,拟合方程为y=26.787x+29.907,R2=0.995 9。
-
由图 4可知:金银花尺蠖蛹粗多糖在体外对超氧阴离子自由基(O2-·)具有一定的清除作用,具有直接清除超氧阴离子自由基的抗氧化活性。在0.2 g·L-1时,对超氧阴离子自由基(O2-·)的清除率为26.75%,随着多糖质量浓度的增加,对超氧阴离子自由基(O2-·)的清除率也逐渐增加,当质量浓度上升到1.2 g·L-1时,清除率达47.84%,增加了21.09%,差异达显著水平(P<0.05),各质量浓度下的清除率均低于维生素C,差异达显著水平(P<0.05)。在0.2~1.2 g·L-1的质量浓度范围内,粗多糖对超氧阴离子自由基(O2-·)的清除率(y)与质量浓度(x)之间呈显著的线性关系,拟合方程为y=21.037x+23.101,R2=0.986 4。
3.1. 葡萄糖标准曲线及粗多糖含量
3.2. 金银花尺蠖蛹粗多糖总还原力
3.3. 金银花尺蠖蛹粗多糖对二苯代苦味酰自由基(DPPH)自由基的清除作用
3.4. 金银花尺蠖蛹粗多糖对羟自由基(·OH)的清除作用
3.5. 金银花尺蠖蛹粗多糖对超氧阴离子自由基(O2-·)的清除作用
-
昆虫体内多糖丰富,是开发多糖资源的良好材料。目前,有关昆虫多糖抗氧化活性研究已有较多的报道[8-10]。笔者在室内提取了金银花尺蠖蛹粗多糖,并测定了其体外抗氧化活性。结果表明:金银花尺蠖蛹粗多糖在体外均能明显地清除DPPH自由基、羟自由基(·OH)和超氧阴离子自由基(O2-·),并且清除作用随着多糖质量浓度的增加而不断增强,呈明显的线性关系。这表明金银花尺蠖蛹粗多糖具有较强的抗氧化作用,能够清除机体内产生的氧自由基,因而在抗氧化、防衰老方面具有一定的作用,是一种很有开发潜力的资源昆虫,在医学及人类保健事业上具有潜在的开发利用价值。
何钊等[8]的研究表明:在试验范围内,黄粉虫多糖对DPPH自由基、羟自由基(·OH)和超氧阴离子自由基(O2-·)的清除能力随质量浓度的增加而增强,存在一定的量效关系,但没有呈线形关系,当上升到一定质量浓度时,清除率趋于稳定。笔者的研究则表明:在试验范围内,金银花尺蠖蛹粗多糖对这3种自由基的清除作用与多糖质量浓度之间呈明显的线性关系。这说明金银花尺蠖蛹粗多糖对自由基的清除能力比较稳定,显示了持续的抗氧化效果。武忠伟等[9]和赵秋蓉等[10]的研究也显示:冬虫夏草对自由基具有一定的清除作用,但都没有做阳性对照试验。笔者的研究表明:金银花尺蠖蛹粗多糖对3种自由基的清除作用均低于维生素C,这与何钊等[8]的研究结果一致。作为一种酸性多羟化合物,维生素C是通过逐级供给电子来清除活性氧自由基的[19],可能由于金银花尺蠖蛹粗多糖供电子能力不及维生素C,所以对自由基的清除作用低于维生素C。
本试验只是研究金银花尺蠖蛹粗多糖的体外抗氧化活性,不能代表其体内清除自由基的实际情况,今后还需进行动物活体试验,以进一步明确其粗多糖抗氧化活性。本试验中金银花尺蠖蛹粗多糖对3种自由基的清除活性不同,这可能与多糖中不同组分所起的作用不同有关[20]。今后还需对金银花尺蠖蛹粗多糖的各组分进行分离纯化,研究其分子结构与生物活性之间的构效关系,探讨其抗氧化的药理作用,并且还需研究金银花尺蠖人工大量繁殖技术,为进一步开发利用提供科学依据。













 DownLoad:
DownLoad: