-
香港四照花Dendrobenthamia hongkongensis是山茱萸科Cornaceae四照花属Dendrobenthamia常绿乔木,自然分布于华东、华南、西南等地区。主干通直,冠型饱满;初夏头状花序顶生,花苞片大而洁白,观赏性强;秋季核果聚生成球形,红艳可爱,既可食用又可酿酒、入药[1-2]。四照花属的大部分植物种子都具有深休眠的特性,影响了优良种质资源的有性繁殖和推广[3]。植物组织培养技术作为一种成熟的扩繁技术,不仅能保持繁殖体的优良特性,且繁殖速度快,周期短,不受场地、环境限制,是苗木良种化、工厂化的重要途径[4]。因此,进行香港四照花的诱导培养研究,对香港四照花的扩繁和推广应用具有现实意义。香港四照花在初代培养中极易褐化,会影响外植体的诱导与生长,严重时能致其死亡,故对它进行抗褐化研究显得尤为重要。目前,常用的抗褐化措施有预处理材料,选择适宜的培养条件,使用抗褐化剂等[5]。其中,常用抗褐化剂主要有聚乙烯吡咯烷酮(PVP),活性炭(AC),抗坏血酸(VC),硫代硫酸钠(Na2S2O3)及柠檬酸(CA)等[6]。刘均利等[7]发现PVP对华盖木Manglietiastrum sinicum外植体的抗褐化效果显著。李萍等[8]研究表明,在培养基中加入2.0 g·L-1AC培养4 d再转入不含AC的培养基中,能有效控制牡丹Paeonia suffruticosa外植体褐化。本研究选择香港四照花嫩叶、茎段和带芽茎段为外植体,通过不同消毒方式处理、筛选基本培养基、材料预处理和使用抗褐化剂等方法,以期得出能有效降低香港四照花外植体褐化率的最佳方案,并采用正交试验法,研究不同植物生长调节剂种类及质量浓度对外植体诱导的影响。
HTML
-
试验所用材料为浙江农林大学校园的香港四照花,于2017年3月中旬至5月中旬,选择生长健壮、无病虫害的当年生嫩叶、茎段和带芽茎段作为外植体。
-
所有基本培养基若无特殊说明均为木本植物用培养基(woody plant medium,WPM),添加蔗糖30.0 g·L-1,琼脂6.0 g·L-1,除植物生长调节剂配比试验外,均附加1.0 mg·L-16苄基腺嘌呤(6-BA)+0.2 mg·L-1萘乙酸(NAA),pH 5.8。各试验中3种外植体均接种20瓶·处理-1,3个·瓶-1,重复3次·处理-1。培养室温度为(25±2) ℃,光照时间12 h·d-1,光照强度1 800~2 000 lx,接种后先暗培养7 d再进行光培养。
-
将采集的3种外植体用流水冲洗并用软毛笔刷去表面脏物,放在洗洁精溶液中浸泡5 min,流水冲洗1 h。沥干水后,在超净工作台上先用体积分数为70%乙醇消毒30 s,用无菌水漂洗3次后,分别用2种消毒剂处理:30.0 mL·L-1次氯酸钠(NaClO)溶液(5,10,15 min)和1.0 g·L-1氯化汞(HgCl2)溶液(5,8,10 min),消毒后用无菌水漂洗5遍。切除与消毒液接触的伤口部位,将嫩叶切成1.0 cm × 1.0 cm大小,茎段和带芽茎段切成1.0~1.5 cm长,接种于培养基上。每日观察统计污染率和存活率。
-
采用1.2.2筛选出的最佳消毒方式处理的3种外植体,分别接种在MS(Murashige and Skoog),DKW(Driver and Kuniyuki),WPM培养基上。每日观察统计褐化率及诱导率。
-
将流水冲洗1.0 h后的外植体分别置于1.0 g·L-1PVP,1.0 g·L-1柠檬酸和1 g·L-1VC中浸泡3.0 h,以未预处理为对照(ck),浸泡后将3种外植体置于超净工作台上消毒并接种。每日观察统计褐化率。
-
在培养基中添加不同质量浓度的PVP(0.5,1.0,2.0 g·L-1),柠檬酸(0.5,1.0,2.0 g·L-1),VC(0.5,1.0,2.0 g·L-1),活性炭(0.5,1.0,2.0 g·L-1)和硫代硫酸钠(0.1,0.2,0.5 g·L-1),以不添加任何抗褐化剂为对照(ck),将3种外植体接种到各培养基中。每日统计外植体褐化率。
-
采用正交试验设计L9(34),在WPM培养基中添加不同质量浓度6-BA(0.5,1.0,2.0 mg·L-1),NAA(0,0.1,0.2 mg·L-1)和2, 4-二氯苯氧乙酸(2, 4-D,0.1,0.2,0.5 mg·L-1),接种后每日观察并记录外植体启动时间,统计出愈率及萌发率。
-
在接种后第30天统计各处理的数据。用Excel 2007进行数据处理,SPSS 19.0进行方差分析。污染率=(形成愈伤组织的外植体数/接种外植体数)×100%;褐化率=(外植体褐化数/接种外植体数)×100%;存活率=(存活的外植体数/接种外植体数)×100%;诱导率=(诱导数/接种外植体数)×100%;出愈率=(诱导出愈伤组织的外植体数/接种外植体数)×100%;萌发率=(诱导出芽的外植体数/接种外植体数)×100%。
1.1. 试验材料
1.2. 试验方法
1.2.1. 培养基与培养条件
1.2.2. 外植体的消毒处理
1.2.3. 基本培养基的筛选
1.2.4. 外植体抗褐化预处理
1.2.5. 抗褐化剂实验
1.2.6. 植物生长调节剂配比试验
1.3. 数据统计与处理
-
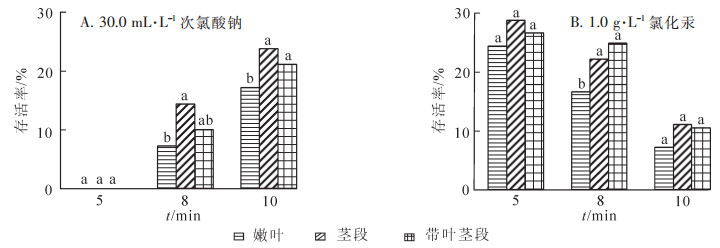
3种外植体消毒处理结果表明(表 1):随着消毒时间延长,3种外植体污染率都有显著下降(P<0.05)。结合30 d后统计的存活率(图 1B),1.0 g·L-1氯化汞溶液消毒5 min为最佳消毒时间,嫩叶污染率仅为33.89%,茎段、带芽茎段分别为25.00%和27.78%,3种外植体之间差异显著(P<0.05)。用30.0 mL·L-1次氯酸钠溶液消毒的外植体褐化情况较轻,但自培养第4天起不断出现污染,污染率较高,且存活率较低(图 1A)。
消毒剂 t/min 接种数/(个·外植体-1) 污染率/% 嫩叶 茎段 带芽茎段 30.0mL·L-1次氯酸钠 5 60 100.00 Aa 100.00 Aa 100.00 Aa 10 60 91.11 Ab 83.33 Bb 88.89 Ab 15 60 80.55 Ac 70.00 Bc 76.11 Ac 1.0 g·L-1氯化汞 5 60 33.89 Ad 25.00 Cd 27.78 Bd 8 60 26.67 Ae 18.89 Be 20.55 Be 10 60 18.33 Af 11.11 Bf 11.67 Bf 说明:不同大写字母表示同一消毒时间内不同外植体之间差异显著(P < 0.05),不同小写字母表示同种外植体不同消毒时间之间的差异显著(P < 0.05) Table 1. Effects of different disinfectants and time on the contamination rate of 3 explants
-
将3种外植体接种于MS,DKW和WPM等3种不同基本培养基,结果表明(表 2):接种于WPM培养基的3种外植体褐化率均低于接种于MS和WPM培养基的褐化率,嫩叶、茎段和带芽茎段的褐化率分别是67.8%,60.0%和61.7%。试验中发现茎段与嫩叶经诱导产生愈伤组织,带芽茎段经诱导易萌发出新芽,其中接种于WPM培养基的外植体生长状况最好,诱导率最高。WPM与其他2种培养基的外植体褐化率与诱导率均差异显著(P<0.05),故以WPM培养基为最适基本培养基。
培养基类型 外植体类型 接种数 褐化率/% 诱导率/% 生长状况 愈伤组织 新芽 MS 嫩叶 180 72.8 Aa 6.1 Ba 淡黄色,结构疏松 茎段 180 68.3 Ba 10.6 Ab 黄绿色,结构紧密 带芽茎段 180 67.8 Ba 9.4 Ab 生长缓慢,叶片发黄 DKW 嫩叶 180 75.5 Aa 4.4 Ba 黄褐色,结构松散 茎段 180 66.7 Ba 13.9 Ab 黄绿色,结构紧密 带芽茎段 180 70.6 Aa 16.1 Aa 生长缓慢,叶片发黄 WPM 嫩叶 180 67.8 Ab 8.9 Ba 淡黄色,结构疏松 茎段 180 60.0 Ab 20.6 Aa 黄绿色,结构紧密 带芽茎段 180 61.7 Ab 18.9 Aa 生长迅速,叶片嫩绿 说明:不同大写字母表示同一基本培养基不同外植体之间差异显著(P<0.05),不同小写字母表示同种外植体不同基本培养基之间的差异显著(P<0.05) Table 2. Effects of different basic culture medium on the browning rate and induction rate of explants
-
表 3表明:采用1.0 g·L-1 PVP,1.0 g·L-1VC和1.0 g·L-1柠檬酸浸泡3 h的外植体褐化率都有所下降,其中1.0 g·L-1PVP预处理后的外植体褐化率最低,与对照(ck)差异显著(P<0.05)。3种外植体经1.0 g·L-1PVP预处理后,茎段褐化率为33.3%,显著低于嫩叶褐化率(50.6%)和带芽茎段褐化率(38.9%)(P<0.05)。
处理方式 接种数/(个·外植体-1) 褐化率/% 嫩叶 茎段 带芽茎段 ck 180 67.8 Aa 62.8 Ba 61.7 Ba 1.0 g·L-1 PVP 180 50.6 Ac 33.3 Cd 38.9 Bd 1.0 g·L-1 VC 180 61.7 Ab 46.7 Bc 47.3 Bc 1.0 g·L-1柠檬酸 180 65.7 Aa 53.3 Bb 55.6 Bb 说明:不同大写字母表示同一预处理不同外植体之间差异显著(P<0.05),不同小写字母表示同种外植体不同预处理之间的差异显著(P<0.05) Table 3. Effects of pretreatment with different anti browning agents on the browning rate of 3 explants
-
以未添加抗褐化剂为对照(ck),在培养基中添加不同质量浓度的PVP,柠檬酸和VC后,3种外植体褐化率均低于ck(表 4),且与ck差异显著(P<0.05)。添加0.5 g·L-1活性炭后,外植体褐化情况显著下降(P<0.05),但若培养基活性炭质量浓度过高,反而加重外植体褐化。在培养基中添加了不同质量浓度的硫代硫酸钠,3种外植体褐化率随质量浓度上升而上升。由表 4得知:2.0 g·L-1PVP为茎段和带芽茎段的最佳抗褐化剂,其褐化率分别为13.3%和16.7%,与其他抗褐化剂有显著的差异(P<0.05)。嫩叶的最佳抗褐化剂为1.0 g·L-1柠檬酸,褐化率为27.4%。嫩叶褐化率与茎段、带芽茎段褐化率差异性显著(P<0.05),茎段与带芽茎段之间差异不显著(P>0.05)。
抗褐化剂 ρ/(g·L-1) 接种数/(个·外植体-1) 褐化率/% 嫩叶 茎段 带芽茎段 ck 0 180 50.6 Ab 33.3 Cc 38.9 Bc PVP 0.5 180 45.0 Ac 25.0 Bd 22.8 Be 1.0 180 33.3 Ae 18.9 Be 22.2 Be 2.0 180 35.0 Ae 13.3 Bf 16.7 Bf 柠檬酸 0.5 180 37.8 Ae 26.7 Bf 30.0 Bf 1.0 180 27.4 Af 25.6 Ad 27.2 Ae 2.0 180 31.1 Ae 27.2 Ad 26.7 Ae VC 0.5 180 47.8 Ac 32.2 Bc 36.8 Bc 1.0 180 42.2 Ad 28.5 Bc 31.7 Bd 2.0 180 41.1 Ad 26.1 Bd 29.4 Bd 活性炭 0.5 180 45.56 Ac 28.9 Bc 33.9 Bd 1.0 180 51.1 Ab 36.1 Bb 36.7 Bc 2.0 180 53.3 Ab 40.0 Bb 42.8 Bb 硫代硫酸钠 0.1 180 48.9 Ab 31.1 Bc 35.0 Bc 0.2 180 58.3 Aa 45.0 Ba 46.7 Bb 0.5 180 61.7 Aa 48.9 Ca 53.3 Ba 说明:不同大写字母表示同一抗褐化剂和质量浓度不同外植体之间差异显著(P<0.05),不同小写字母表示同种外植体不同抗褐化剂和质量浓度之间的差异显著(P<0.05) Table 4. Effects of different concentrations of anti browning agents on the browning rate of 3 explants
-
由6-BA,NAA和2, 4-D的极差(R)可知:嫩叶与茎段愈伤组织诱导的主因素分别为2, 4-D(11.30)和NAA(20.52)(表 5)。叶片诱导愈伤组织的最佳培养基组合为WPM+1.0 mg·L-16-BA+0.2 mg·L-1NAA+0.1 mg·L-1 2, 4-D,出愈率为58.3%,8 d叶片四周产生愈伤组织(图 2A)。茎段与叶片启动时间相近,7 d基部膨大并长出少量愈伤组织(图 2B),其最佳愈伤组织诱导培养基为WPM+2.0 mg·L-16-BA +0.5 mg·L-1 2, 4-D,出愈率为75.4%,与其他处理间存在显著差异(P<0.05)。
处理编号 ρ/(mg·L-1) 接种数/(个·外植体-1) 嫩叶 茎段 6-BA(A) NAA(B) 2, 4-D(C) 出愈率/% 开始时间/d 出愈率/% 开始时间/d 1 0.5(1) 0(1) 0.1(1) 180 33.9 c 10 51.7 c 8 2 0.5 0.1(2) 0.2(2) 180 45.6 b 7 48.3 c 7 3 0.5 0.2(3) 0.5(3) 180 36.1 c 8 38.3 d 9 4 1.0(2) 0 0.2 180 40.0 b 9 37.8 d 9 5 1.0 0.1 0.5 180 17.8 e 12 26.7 e 12 6 1.0 0.2 0.1 180 58.3 a 8 60.0 b 7 7 2.0(3) 0 0.5 180 42.2 b 10 75.4 a 7 8 2.0 0.1 0.1 180 31.1 d 11 28.3 e 12 9 2.0 0.2 0.2 180 26.1 d 14 40.6 d 10 K1 38.52 38.70 41.11 k1 46.11 54.97 46.67 K2 38.70 31.48 29.81 k2 41.49 34.45 42.22 K3 33.15 40.18 32.04 k3 48.11 46.30 46.82 R 5.55 8.70 11.30 R 6.62 20.52 4.60 优水平 A2 B3 C1 优水平 A3 B1 C3 说明:左下列为嫩叶出愈率的极差分析,右下列为茎段出愈率的极差分析。不同小写字母表示不同处理差异显著(P<0.05) Table 5. Effects of different hormone kinds and concentrations on callus induction
由不同因素的极差(R)可知(表 6):影响带芽茎段诱导的主因素为6-BA。经Tukey s-b分析可知:7号和4号处理与其他处理有显著差异(P<0.05),其萌发率分别为76.7%和72.8%。故带芽茎段诱导新芽的最佳组合为WPM+2.0 mg·L-16-BA +0.5 mg·L-12, 4-D,萌发时间为8 d(图 2C)。
处理编号 ρ/(mg·L-1) 接种数/(个·外植体-1) 带芽茎段 6-BA(A) NAA(B) 2, 4-D(C) 萌发率/% 开始时间/d 1 0.5(1) 0(1) 0.1(1) 180 23.9 10 2 0.5 0.1(2) 0.2(2) 180 18.3 11 3 0.5 0.2(3) 0.5(3) 180 37.8 8 4 1.0(2) 0 0.2 180 72.8 6 5 1.0 0.1 0.5 180 30.6 11 6 1.0 0.2 0.1 180 45.6 8 7 2.0(3) 0 0.5 180 76.7 7 8 2.0 0.1 0.1 180 57.2 9 9 2.0 0.2 0.2 180 61.1 7 K1 26.67 57.78 42.22 K2 49.63 35.37 36.67 K3 65.00 48.15 48.34 R 38.33 22.41 11.67 优水平 A3 B1 C3 说明:左下列为带芽茎段萌发率的极差分析 Table 6. Effects of different hormone kinds and concentrations on the induction of stem segment with bud
2.1. 消毒时间对外植体污染率及存活率的影响
2.2. 不同基本培养基对外植体褐化及诱导的影响
2.3. 不同抗褐化剂预处理对外植体褐化率的影响
2.4. 不同抗褐化剂及质量浓度对外植体褐化率的影响
2.5. 不同植物生长调节剂种类及质量浓度对外植体诱导的影响
-
褐化现象制约着木本植物组织培养的发展,本试验采用单因素试验法,从不同消毒方式、基本培养基、外植体预处理方式、抗褐化剂等4个方面进行研究,寻找降低香港四照花褐化率的有效途径。结果表明:外植体采用1.0 g·L-1氯化汞消毒5 min存活率最高。这与路承香等[9]的研究结果一致,与唐佳佳等[3]在狭叶四照花Dendrobenthamia angustata的研究结果不一致,可能因其选用1年生幼苗更易灭菌。3种外植体接种于WPM培养基中褐化率最低,诱导率相对较高,生长状况最好。推测原因为WPM培养基无机盐总含量较低,减轻了外植体褐变[10]。想从根本上解决组织培养中外植体褐化的问题,还需从分子、遗传等角度对其外植体进行更深入的研究。
PVP为专一吸附酚类物质的常用吸附剂,能阻止酚类物质被氧化为醌类物质,可降低外植体褐化程度。柠檬酸通过抑制多酚氧化酶的活性来抑制褐化[11]。本研究发现:在接种前用1.0 g·L-1PVP浸泡香港四照花外植体能有效降低褐化率,在培养基中添加2.0 g·L-1PVP能明显减轻茎段与带芽茎段的褐化现象。嫩叶在添加1.0 g·L-1柠檬酸的培养基中褐化率最低,但柠檬酸遇高温会产生酸性物质,影响培养基凝固,故需高压灭菌后用注射器加入,不利于工厂化生产。硫代硫酸钠与柠檬酸活性炭褐化效果不明显,甚至在高质量浓度下加重了外植体褐化。这与在核桃楸Juglans mandshurica[12]和黑莓Rubus[13]上的研究结论不一致,可能因选用基本培养基不同,也可能是不同树种差异性所致。
不同的外植体类型对该种植物的诱导培养有很大的影响。试验结果表明:茎段是诱导愈伤组织的最佳外植体,而带芽茎段诱导属腋芽萌发,污染率及褐化率较低,最易萌发产生新芽;叶片褐化率较高,出愈率低于茎段,可能因其分化程度较高;试验中发现少数带芽茎段会在切口处长出奶黄色愈伤组织,但不影响带芽茎段继续萌发,故本试验只统计其萌发率。
植物生长调节剂对外植体的形态建成及其调控起着重要作用。本试验将组织培养中广泛应用的3种植物生长调节剂组合使用,以期寻找最佳诱导培养基。结果表明:嫩叶最佳植物生长调节剂组合为:1.0 mg·L-16-BA+0.2 mg·L-1NAA+0.1 mg·L-12, 4-D;茎段与带芽茎段的最佳激素组合均为:2.0 mg·L-16-BA +0.5 mg·L-12, 4-D。通过对正交试验结果的直观分析,2, 4-D和NAA对嫩叶、茎段诱导愈伤组织的影响较大,而6-BA在诱导腋芽萌发具有突出的促进作用[14]。











 DownLoad:
DownLoad:
