-
桢楠Phoebe zhennan为樟科Lauraceae楠属Phoebe常绿大乔木,是中国特有的珍贵用材树种和国家二级重点保护植物[1-2],是“金丝楠木”中最好的一种;主要分布于四川、重庆,少量分布在湖北西部和贵州西北部等地区[2]。由于长期砍伐破坏,桢楠自然森林资源近于枯竭,现只在四川邛崃山、大娄山、小凉山及其周边地区的以散生状态存在小片天然林,以及在寺庙、风景名胜区与村舍旁偶有大树存在[3-4]。作为珍稀用材树种,桢楠人工林的发展正日益受到重视,苗木培育、栽培技术等方面取得了一定成果[5-7];近年来,在华东地区如浙江、安徽等地区有少量引种栽培[8-10]。桢楠为耐荫树种,幼年期尤喜阴湿的生长环境,成年后渐好阳[2],但目前还没有关于光环境对桢楠苗期生长影响的报道。桢楠苗期生长速度缓慢,寿命长,因此桢楠人工林常以大径材为培育目标。对天然林中桢楠的生长过程的研究发现:自然状态下桢楠生长速度非较慢;其中,0~20 a树高生长缓慢,20~70 a为速生期,之后趋于平缓;胸径生长0~30 a较慢,30~90 a为快速生长期,90 a后稍减缓;材积生长为0~50 a较慢,50~90 a为速生期,90 a左右趋于平缓但并未达到峰值。四川地区90年生天然林大树的平均树高为33.8 m,平均胸径为43.1 cm,平均材积为2.24 m3[11]。因此,培育措施调控桢楠苗期生长以缩短桢楠培育周期成为桢楠培育中的重要内容。由于自然资源有限,要恢复桢楠自然资源和发展珍贵用材,开展桢楠人工林资源培育成为必要途径。张炜[7]研究发现适度施肥可以明显促进桢楠的高生长;本研究拟探索光照条件和养分需求对1年生桢楠苗生长的影响,以期为桢楠人工林苗期生长调控提供科学依据。
-
试验地安徽省舒城县德昌苗木基地(31°12′26″N,116°47′54″E)为亚热带温润性季风气候,四季分明,雨水充沛。年平均气温16.2 ℃,极端最低温−16.8 ℃,最高温度40.5 ℃,最热为7月,最冷为1月,年日照时数1 969.0 h,有效积温4 972.4 ℃,平均降水量约1 100.0 mm。基地土壤为砂壤土,土质疏松肥沃,土壤有机质含量为1.67%,水解氮、有效磷和速效钾分别为120.6、71.2 和13.2 mg·kg−1。
-
以2018年初从四川引种的1年生桢楠实生苗为材料,苗木长势良好,大小一致。所有苗木定植于基地大田中,株行距为0.5 m × 1.0 m。
遮光和施肥处理于2018年6月初进行,试验采用二裂式裂区试验设计,主区为遮光处理(A),包括3个不同处理,分别为不遮光(透光率100%,A1)、遮光1层(透光率45.5%,A2)、遮光2层(透光率14.7%,A3);副区为施肥处理(B),也包括3个不同水平,分别为不施肥(0 g·株−1,B1)、中度施肥(3.3 g·株−1,B2)和大量施肥(6.7 g·株−1,B3),具体如表1所示。即试验共包括9个处理,每个处理重复3次,每个重复包括4株幼苗。同一遮光强度下的3个处理不做分隔,不同遮光处理间隔约2.0 m用遮阳网分隔。本试验遮光采用遮阳率为60%的黑色尼龙网,遮阳网架设于离地面约2.0 m高处;施肥使用复合肥(N∶P2O5∶K2O = 15∶15∶15),于6月初和6月中旬分2次采用环状施肥法施入。于6月下旬开始进行相关指标的测定和数据收集。
表 1 二裂式裂区试验设计
Table 1. Split-plot randomized design of the experiment
处理 透光率/% 施肥量/(g·株−1) 处理 透光率/% 施肥量/(g·株−1) A1B1 100 0 A2B3 45.5 6.7 A1B2 100 3.3 A3B1 14.7 0 A1B3 100 6.7 A3B2 14.7 3.3 A2B1 45.5 0 A3B3 14.7 6.7 A2B2 45.5 3.3 -
于6月下旬开始测量各试验单元中桢楠幼苗的苗高(cm)和地径(cm),以后每月下旬进行调查,直至11月下旬。
-
待苗高和地径测定完毕,按处理挖取所有桢楠植株,清水洗净后分根、茎和叶于70 ℃烘干至恒质量。称取各部分干质量,并用根、茎和叶干质量之和表示总生物量。
-
不同处理桢楠苗净光合速率测定于8月下旬进行。根据当月苗高和地径测定结果,从各处理中选取接近其平均值的5株桢楠苗进行标记。选取标记植株顶芽向下的第3个枝条中间部位的健康、完全功能叶片作为测量对象,并于天气晴朗的9:00−11:00采用LI-6400XT光合系统(LI-COR,Inc. Lincoln NE,美国)在自然光条件下测量。为了尽量减小测量时间带来的误差,各处理每次只测定1株,并依此循环直至将标记植株全部测完。测定期间,全光下的光照强度、空气温度和相对湿度分别为1 088~1 619 μmol·m−2·s−1,36.5~41.4 ℃和50%~69%;1层遮光下的光照强度、空气温度和相对湿度分别为312~497 μmol·m−2·s−1,33.6~37.3 ℃和63%~80%;2层遮光下的的光照强度、空气温度和相对湿度分别为105~178 μmol·m−2·s−1,32.4~35.7 ℃,68%~85%。从测量光合参数后的植株上采集新鲜小叶,洗净、擦干,剪碎后采用丙酮-乙醇(V/V=17/3)溶液浸提叶片中的光合色素,过夜,待叶片变白后取上清液分别在λ=663 nm和λ=645 nm下测定光密度,叶绿素相对含量按AMON方法[12]计算。
-
收集1.3.2中烘干至恒质量的植物样品,粉碎过筛后称取0.5 mg左右,用2 mm × 5 mm的锡杯包裹,使用元素分析仪(EA3000,Euro Vector,Italy)测定样品中的总碳和总氮质量。
-
以双因素方差分析结果比较遮光、施肥以及两者交互作用对桢楠生长、氮素相对含量等指标的影响;以Duncan’s多重比较分析处理之间的差异。所有统计数据均由SPSS进行分析,分析结果表示为95%的置信水平上的显著水平。
-
如图1A所示:在6−11月,不同处理桢楠的苗高月生长量均表现为“慢—快—慢”的月份生长节律,其中7−9月为苗的生长高峰期,其生长量平均达到整个观测期的52.4%。但苗高月生长量在处理间存在一定差异,双因素方差分析结果表明:遮光、施肥和两者交互作用均对月生长节律产生了显著影响(P<0.05,表2)。平均苗高在1层遮光下(A2)达到最大,明显高于全光和2层遮光处理(表3),变异范围为7.35~16.55 cm。最大平均苗高在中度施肥水平(B2)下测得,明显高于大量施肥(B3)和不施肥(B1)处理,但变异范围略小(10.71~12.85 cm)。双因素作用下,1层遮光和中度施肥(A2B2)处理时苗高总生长量最大,并向两侧依次下降,呈“单峰”变异模式。桢楠地径的月生长量和总生长量均与苗高基本一致(图1B),但施肥及交互作用对地径生长未产生显著影响(表2和表3)。
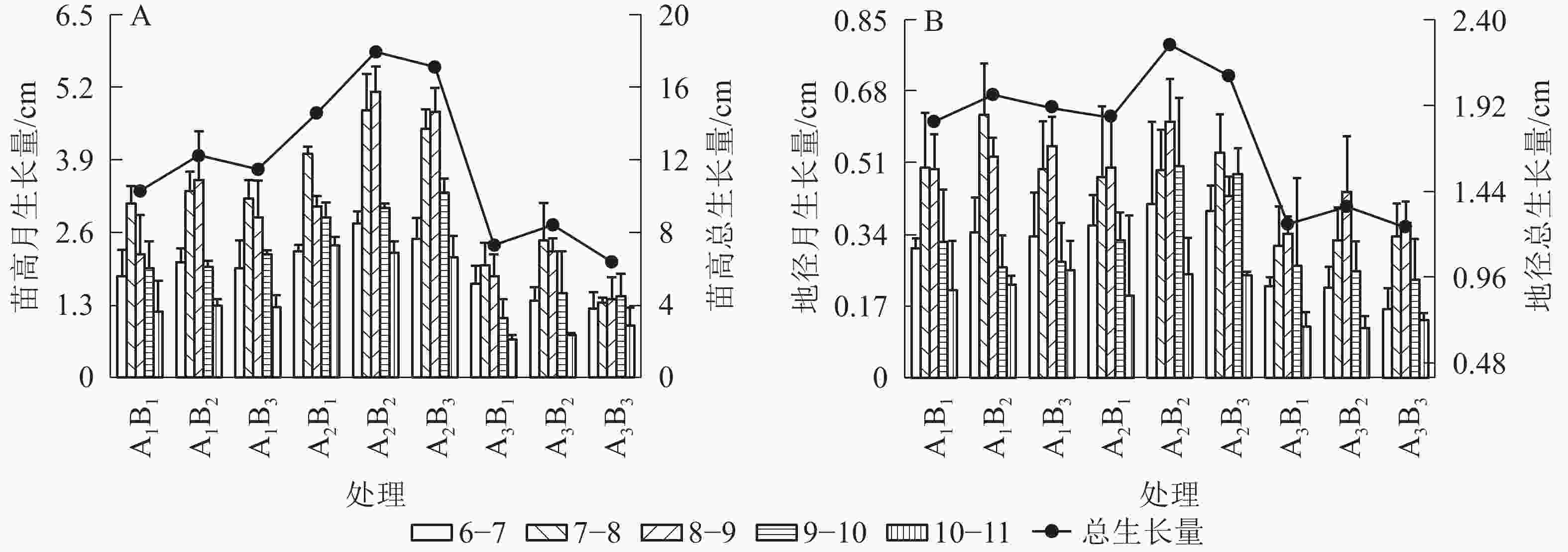
图 1 遮光和施肥对桢楠苗高(A)、地径(B)生长的影响
Figure 1. Effects of shading and fertilization on tree height (A) and basal diameter (B) growth of P. zhennan seedlings
表 2 遮光和施肥对桢楠生长、生物量积累、光合速率、叶绿素相对含量及氮素积累影响的显著性分析
Table 2. Summary of significance levels for the effects of shading and fertilization on growth, biomass accumulation, photosynthetic rate, chlorophyll content and nitrogen accumulation
因子 苗高 地径 总生物量 根冠比 光合速率 叶绿素相对含量 叶绿素a/b 氮质量分数 氮素积累量 遮光(A) <0.001 <0.001 <0.001 0.001 <0.001 <0.001 <0.001 <0.001 <0.001 施肥(B) <0.001 0.205 <0.001 0.108 <0.001 <0.001 0.694 <0.001 <0.001 交互作用 0.027 0.825 <0.001 0.768 0.002 0.001 0.801 <0.001 <0.001 表 3 遮光和施肥对桢楠生长、生物量积累、光合速率、叶绿素相对含量及氮素积累影响的多重比较
Table 3. Duncan’s multiple-range test of growth, biomass accumulation, photosynthetic rate, chlorophyll content and nitrogen accumulation after a two-way analysis of variance
处理 水平 苗高 地径 总生物量 根冠比 光合速率 叶绿素相对含量 叶绿素a/b 氮质量分数 氮素积累量 遮光(A) A1 11.34 b 1.91 a 14.02 b 0.51 a 4.66 a 1.50 c 1.72 a 1.84 c 0.26 b A2 16.55 a 2.07 a 19.57 a 0.39 b 4.28 b 2.54 a 1.29 b 2.34 a 0.46 a A3 7.35 c 1.28 b 10.13 c 0.38 b 2.12 c 1.92 b 1.11 b 1.99 b 0.21 c 施肥(B) B1 10.71 c 1.65 a 12.10 b 0.46 a 3.19 c 1.77 b 1.43 a 1.98 b 0.24 c B2 12.85 a 1.86 a 18.32 a 0.41 a 4.31 a 2.32 a 1.38 a 2.10 a 0.39 a B3 11.67 b 1.74 a 13.31 b 0.40 a 3.55 b 1.87 b 1.32 a 2.09 a 0.30 b 说明:同列不同字母表示差异显著(P<0.05) -
由表4可知:桢楠苗的根系、茎秆、叶片和总生物量在不同处理间的变异趋势基本一致。全光和1层遮光处理时,中度施肥促进生物量的积累,不施肥组生物量最低。2层遮光处理时,除茎生物量外,中度施肥有利于生物量积累,大量施肥抑制生物量的积累。方差分析结果表明:遮光、施肥和两者交互作用均对生物量积累产量了显著影响(P<0.05);遮光还对桢楠苗的根冠比产生了显著影响(P<0.05),随着遮光强度加大,桢楠苗根冠比明显下降。另外,随着施肥量的增大,桢楠苗根冠比也依次下降,但差异不显著(P>0.05)。
表 4 遮光与施肥对桢楠生物量积累的影响
Table 4. Effects of shading and fertilization on biomass accumulation in P. zhennan
处理 根/(g·株−1) 茎/(g·株−1) 叶/(g·株−1) 总生物量/(g·株−1) 根冠比 A1B1 3.91 ± 0.71 cde 4.59 ± 0.52 de 2.73 ± 0.61 d 11.24 ± 1.53 ef 0.53 ± 0.04 a A1B2 5.87 ± 0.29 ab 5.80 ± 0.27 cd 5.60 ± 0.83 b 17.27 ± 0.84 c 0.52 ± 0.07 a A1B3 4.28 ± 0.61 cde 5.27 ± 1.18 cde 4.01 ± 0.77 c 13.56 ± 2.53 de 0.47 ± 0.04 ab A2B1 4.55 ± 0.49 cd 6.19 ± 0.94 c 4.04 ± 0.78 c 14.78 ± 0.62 d 0.45 ± 0.04 ab A2B2 6.41 ± 1.20 a 9.63 ± 0.75 a 8.27 ± 0.59 a 24.30 ± 2.15 a 0.36 ± 0.05 b A2B3 5.12 ± 0.89 bc 8.19 ± 1.02 b 6.33 ± 0.47 b 19.64 ± 0.31 b 0.35 ± 0.07 b A3B1 2.98 ± 0.57 ef 4.07 ± 0.64 e 3.22 ± 0.75 cd 10.27 ± 0.40 f 0.41 ± 0.08 ab A3B2 3.39 ± 0.64 de 3.92 ± 0.59 e 6.08 ± 0.32 b 13.40 ± 0.38 de 0.34 ± 0.08 b A3B3 1.86 ± 0.55 f 2.39 ± 0.72 f 2.47 ± 0.58 d 6.73 ± 1.03 g 0.37 ± 0.07 b 说明:根冠比为地下部分干质量与地上部分干质量的比值。同列不同字母表示差异显著(P<0.05) -
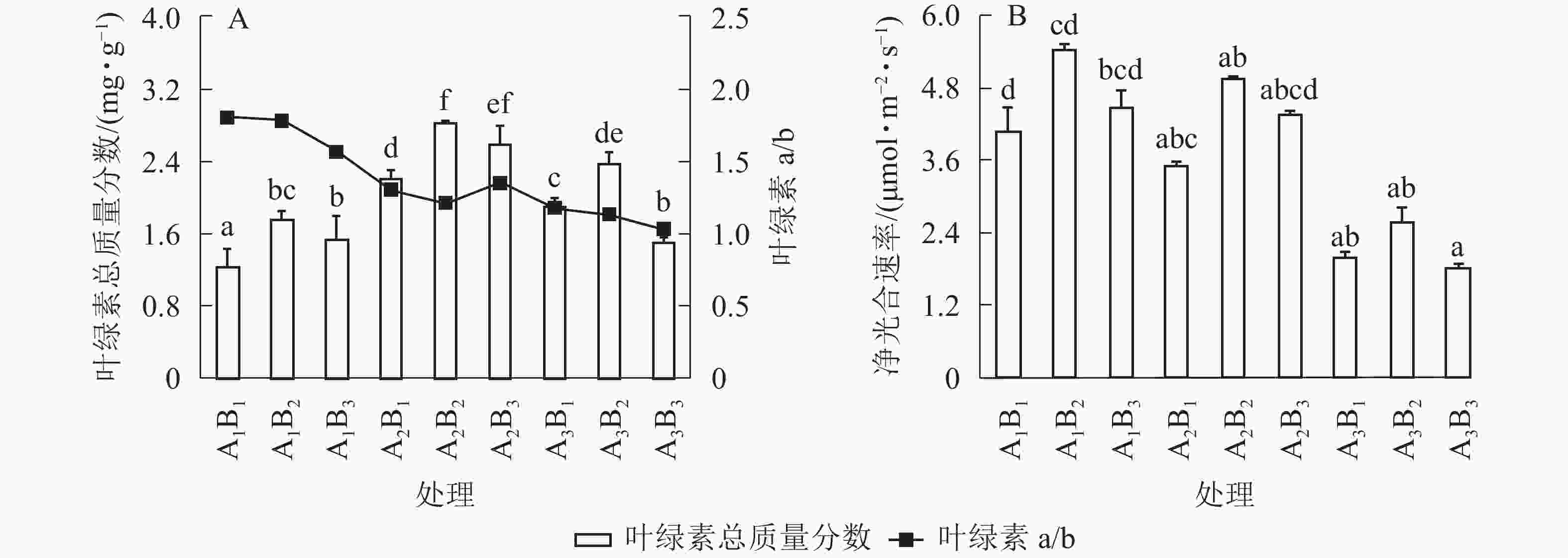
遮光和施肥对桢楠苗净光合速率影响显著,且存在显著的交互作用(P<0.05,表2)。随着遮光强度增大,桢楠叶净光合速率显著下降,2层遮光处理时净光合速率仅为全光下的45%(表3和图2)。随着光照减少,桢楠叶片中叶绿素a/b呈直线下降,但总叶绿素质量分数在1层遮光时达到最大,明显高于全光和2层遮光下(P<0.05)。由此可见,桢楠叶片叶绿素质量分数与净光合速率对遮光的响应并不完全一致。总体来说,施肥有利于桢楠叶片叶绿素合成和净光合速率提高,两者均在中度施肥水平下达最大;随着施肥量增大,叶绿素a/b不断下降,但并未达到显著水平(P>0.05)。
-
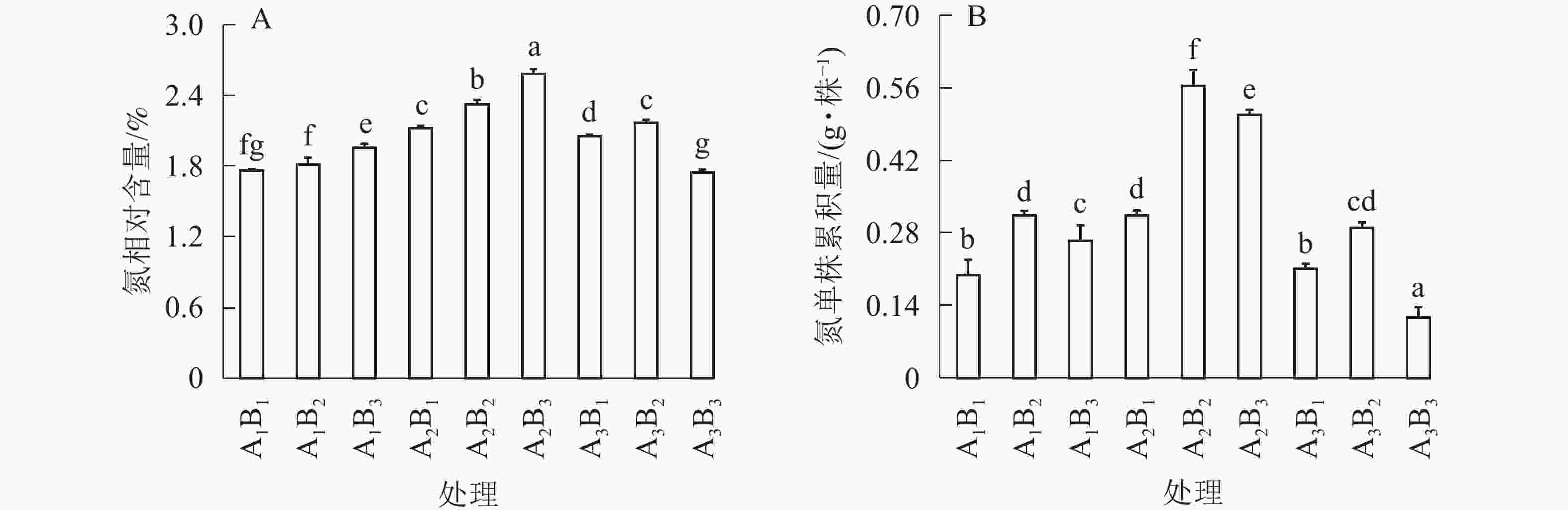
如图3A所示:全光和1层遮光处理,桢楠苗氮素相对含量随着施肥量的增大而不断增大;但1层遮光下桢楠苗氮相对含量明显高于全光(P<0.05)。2层遮光处理时,大量施肥降低了桢楠苗的氮相对含量,中度施肥时达到最大值。由图3B可知:单株氮累积量与苗中氮相对含量呈现不同的变异模式,不同遮光处理时,均以中度施肥的单株生物量最大,单株氮素累积量也最大。相比之下,1层遮光强度中度施肥(A2B2)处理下单株桢楠苗积累的氮素最多(P<0.05)。
-
桢楠是中国特有的珍贵用材和观赏树种,幼年期生长速度较慢,成材周期长,其苗期生长调控一直是珍贵用材树种研究和产业发展的重要内容。本研究发现:中等遮光和施肥有利于桢楠苗高和地径生长、生物量积累,过度遮光一定程度上抑制桢楠苗生长,过量施肥则降低桢楠生长量。罗杰[13]发现:不施肥及过量施肥均不利于桢楠苗的生长和生物量积累,相比于复合肥,油枯和鸭粪等有机肥更利于促进桢楠苗的生长。在自然界,桢楠适生于肥沃、偏酸性土壤的山谷或山洼的阴坡中下部,在土壤贫瘠、干旱的地方往往生长不良[14]。本研究也证明通过施肥提高土壤肥力可以促进桢楠苗期的生长,但要控制施肥量,过多无机肥的施用会在一定程度上降低生长量。为了实现更加精细化的生长调控和管理,今后还需要进一步养分需求规律及施肥量的研究。光照是影响植物生长发育最重要的环境因子之一,净光合速率和叶片叶绿素相对含量可以在一定程度上解释遮光和施肥的综合效益对桢楠苗生长和生物量积累的影响。本研究设置的9个处理,桢楠苗生长和叶绿素相对含量的变异规律基本一致,都呈“单峰”变异模式,说明适度遮光促进桢楠苗生长和干物质积累,而遮光过度则会抑制其生长。为适应遮光和施肥处理而发生的生长环境的变化,桢楠苗在形态结构上也发生了一系列适应性改变,如随着遮光强度的加大,桢楠苗的地上部分生物量比例和叶绿素b相对含量升高等;这一结果与之前在其他植物上开展的相关研究结果基本一致[15-18],提示对桢楠等耐荫树种开展光照探索具有重要意义。
全年中7−9月是桢楠苗的生长高峰期,苗高和地径生长量分别占观测期生长总量的52.4%和53.4%,表现为“慢—快—慢”的变化规律,与大多数物种生长节律一致。不同作物生长发育阶段的生长速率不同,但对水分和养分需求量也表现为“两头少中间多”[19-20]。研究发现:甘蔗Saccharum arunndinaceum干物质快速积累期处于全年水热条件最好的季节,植株对养分的需求量达到整个生长季的50%以上,吸氮量占到全生育期的80%,而在成熟期氮素不再积累[21];即在旺盛生长期结束前,随着株龄的增大,植株体内氮素不断积累,到旺盛生长期结束后,氮素积累逐渐达到最大值并不再增加[22]。说明植物体内养分的累积速率与干物质的累积速率保持着较高的同步性,并且这种同步性对处在营养生长期的植物而言更加明显[22]。本研究中,分析不同处理间的氮素累积量与生长间的关系可知:中等强度遮光和施肥处理,桢楠植株中氮素积累量最大,苗高和地径生长、生物量积累也最大。因此,本研究可以为桢楠苗期施肥量和施肥时期的确定提供更加可靠的依据。
与氮素在桢楠叶片中的积累相比,氮素相对含量在不同处理间表现出不同的变异规律,施肥和适度遮光提高了桢楠叶片的氮相对含量,但过度遮光则使叶片中的氮含量下降。这也可以解释为什么在重度遮光下桢楠叶片的叶绿素含量和光合速率比中度遮光更低。植物体保持较高水平的氮含量有利于植物在生长过程中对储存氮素的逐步利用,从而延长植物生长期,促进生长[19]。但是,在华东地区引种桢楠尤其需要注意冬季可能发生的冻害。因此,桢楠引种培育还需加强施肥技术和防冻技术的相关研究。
遮光和施肥显著影响了桢楠苗的生长和氮素积累(P<0.05),且两者存在显著的交互效应,生长和氮素积累在适度遮光和施肥(A2B2)下达到最大值。6−11月,桢楠表现为“慢—快—慢”的生长节律,其中7−9月为其生长高峰,苗高和地径生长量分别占观测期总生长量的52.4%和53.4%。综上所述,适度遮光和施肥可以通过提高桢楠对氮素的吸收,提高叶绿素含量和净光合速率,促进生长和生物量积累。
Effects of shading and fertilization on growth and nitrogen accumulation of Phoebe zhennan seedlings
-
摘要:
目的 探索遮光和施肥对桢楠Phoebe zhennan苗期生长和氮素积累的影响,可为其苗期生长调控提供科学依据。 方法 采用二裂式裂区试验设计,设置全光(A1,遮光率0%)、1层遮光(A2,遮光率54.5%)、2层遮光(A3,遮光率85.3%)等3个遮光水平和不施肥(B1)、中度施肥(B2,施复合肥3.3 g·株−1)、大量施肥(B3,施复合肥6.7 g·株−1)等3个施肥水平,分析遮光、施肥及两者交互作用对1年生桢楠生长、生物量积累和氮素积累的影响。 结果 遮光、施肥和两者交互作用显著影响了桢楠的生长和氮素积累(P<0.05),其中A2B2处理下桢楠的苗高、地径和总生物量比其他处理平均高77.2%、30.3%和62.1%。同样氮素积累量在A2B2处理下达最大值,比其他处理平均高68.3%。然而,桢楠苗氮质量分数在A3B3处理下达最大,且显著高于其他处理(P<0.05)。 结论 中等强度的遮光和施肥可提高桢楠幼苗氮素的积累,促进光合作用,提高生长和生物量积累,但过度的遮光和施肥则会在一定程度上抑制其生长。图3表4参22 Abstract:Objective This study aims to reveal the effects of shading and fertilization on growth and nitrogen accumulation of Phoebe zhennan seedlings to provide scientific basis for the growth control of this plant. Method The two-split-plot test design was used to analyze the effects of shading, fertilization, and interaction of shading and fertilization on the growth, biomass accumulation and nitrogen accumulation of the 1-year-old P. zhennan seedlings. The main plot contained three different shading levels: natural light (A1, 0% of shading rate), one-layer shading (A2, 54.5% of shading rate), and two-layer shading (A3, 85.3% of shading rate). Each main plot contained three different sub-plots with three different fertilization levels: no fertilization (B1), mild fertilization (B2, 3.3 g compound fertilizer per plant), and moderate fertilization (B3, 6.7 g compound fertilizer per plant). A total of 9 treatments were included in this study. Result The growth and nitrogen accumulation were significantly influenced by shading, fertilization, and their interaction (P<0.05). The seedling height, basal diameter, and biomass accumulation under A2B2 treatment were 77.2%, 30.3% and 62.1% higher than those under other treatments, respectively. Furthermore, the nitrogen accumulation reached the maximum under A2B2 treatment, 68.3% higher than that of other treatments. However, the nitrogen content was highest under A3B3 treatment, and was significantly higher than that under other treatments (P<0.05). Conclusion Moderate shading and fertilization can increase the nitrogen accumulation, and promote the photosynthesis, growth and biomass accumulation of P. zhennan, but excessive shading and fertilization can inhibit its growth to some extent. [Ch, 3 fig. 4 tab. 22 ref.] -
Key words:
- silviculture /
- shading /
- fertilization /
- biomass /
- nitrogen accumulation /
- Phoebe zhennan
-
表 1 二裂式裂区试验设计
Table 1. Split-plot randomized design of the experiment
处理 透光率/% 施肥量/(g·株−1) 处理 透光率/% 施肥量/(g·株−1) A1B1 100 0 A2B3 45.5 6.7 A1B2 100 3.3 A3B1 14.7 0 A1B3 100 6.7 A3B2 14.7 3.3 A2B1 45.5 0 A3B3 14.7 6.7 A2B2 45.5 3.3 表 2 遮光和施肥对桢楠生长、生物量积累、光合速率、叶绿素相对含量及氮素积累影响的显著性分析
Table 2. Summary of significance levels for the effects of shading and fertilization on growth, biomass accumulation, photosynthetic rate, chlorophyll content and nitrogen accumulation
因子 苗高 地径 总生物量 根冠比 光合速率 叶绿素相对含量 叶绿素a/b 氮质量分数 氮素积累量 遮光(A) <0.001 <0.001 <0.001 0.001 <0.001 <0.001 <0.001 <0.001 <0.001 施肥(B) <0.001 0.205 <0.001 0.108 <0.001 <0.001 0.694 <0.001 <0.001 交互作用 0.027 0.825 <0.001 0.768 0.002 0.001 0.801 <0.001 <0.001 表 3 遮光和施肥对桢楠生长、生物量积累、光合速率、叶绿素相对含量及氮素积累影响的多重比较
Table 3. Duncan’s multiple-range test of growth, biomass accumulation, photosynthetic rate, chlorophyll content and nitrogen accumulation after a two-way analysis of variance
处理 水平 苗高 地径 总生物量 根冠比 光合速率 叶绿素相对含量 叶绿素a/b 氮质量分数 氮素积累量 遮光(A) A1 11.34 b 1.91 a 14.02 b 0.51 a 4.66 a 1.50 c 1.72 a 1.84 c 0.26 b A2 16.55 a 2.07 a 19.57 a 0.39 b 4.28 b 2.54 a 1.29 b 2.34 a 0.46 a A3 7.35 c 1.28 b 10.13 c 0.38 b 2.12 c 1.92 b 1.11 b 1.99 b 0.21 c 施肥(B) B1 10.71 c 1.65 a 12.10 b 0.46 a 3.19 c 1.77 b 1.43 a 1.98 b 0.24 c B2 12.85 a 1.86 a 18.32 a 0.41 a 4.31 a 2.32 a 1.38 a 2.10 a 0.39 a B3 11.67 b 1.74 a 13.31 b 0.40 a 3.55 b 1.87 b 1.32 a 2.09 a 0.30 b 说明:同列不同字母表示差异显著(P<0.05) 表 4 遮光与施肥对桢楠生物量积累的影响
Table 4. Effects of shading and fertilization on biomass accumulation in P. zhennan
处理 根/(g·株−1) 茎/(g·株−1) 叶/(g·株−1) 总生物量/(g·株−1) 根冠比 A1B1 3.91 ± 0.71 cde 4.59 ± 0.52 de 2.73 ± 0.61 d 11.24 ± 1.53 ef 0.53 ± 0.04 a A1B2 5.87 ± 0.29 ab 5.80 ± 0.27 cd 5.60 ± 0.83 b 17.27 ± 0.84 c 0.52 ± 0.07 a A1B3 4.28 ± 0.61 cde 5.27 ± 1.18 cde 4.01 ± 0.77 c 13.56 ± 2.53 de 0.47 ± 0.04 ab A2B1 4.55 ± 0.49 cd 6.19 ± 0.94 c 4.04 ± 0.78 c 14.78 ± 0.62 d 0.45 ± 0.04 ab A2B2 6.41 ± 1.20 a 9.63 ± 0.75 a 8.27 ± 0.59 a 24.30 ± 2.15 a 0.36 ± 0.05 b A2B3 5.12 ± 0.89 bc 8.19 ± 1.02 b 6.33 ± 0.47 b 19.64 ± 0.31 b 0.35 ± 0.07 b A3B1 2.98 ± 0.57 ef 4.07 ± 0.64 e 3.22 ± 0.75 cd 10.27 ± 0.40 f 0.41 ± 0.08 ab A3B2 3.39 ± 0.64 de 3.92 ± 0.59 e 6.08 ± 0.32 b 13.40 ± 0.38 de 0.34 ± 0.08 b A3B3 1.86 ± 0.55 f 2.39 ± 0.72 f 2.47 ± 0.58 d 6.73 ± 1.03 g 0.37 ± 0.07 b 说明:根冠比为地下部分干质量与地上部分干质量的比值。同列不同字母表示差异显著(P<0.05) -
[1] CHEN Zhan, CAO Jixin, YU Hao, et al. Effects of elevated ozone levels on photosynthesis, biomass and non-structural carbohydrates of Phoebe bournei and Phoebe zhennan in subtropical China [J]. Front Plant Sci, 2018, 9: 1764. [2] 邓波,余云云,赵慧,等. 桢楠资源培育的研究进展[J]. 安徽农业大学学报, 2018, 45(3): 428 − 432. DENG Bo, YU Yunyun, ZHAO Hui, et al. Progress and prospects on siviculture of Phoebe zhennan resources [J]. J Anhui Agric Univ, 2018, 45(3): 428 − 432. [3] 李晓清,杜宜建,朱纯燕,等. 四川桢楠栽培气候区划与应用研究[J]. 四川林业科技, 2013, 34(2): 16 − 19. LI Xiaoqing, DU Yijian, ZHU Chunyan, et al. A study of climate regionalization and application of Phoebe zhennana in Sichuan [J]. J Sichuan For Sci Technol, 2013, 34(2): 16 − 19. [4] 王琦. 湖北恩施桢楠群落特征研究[D]. 杭州: 浙江农林大学, 2012. WANG Qi. Study on Community Characteristics of Phoebe zhenan in Enshi, Hubei Province [D]. Hangzhou: Zhejiang A&F University, 2012. [5] 李冬林,金雅琴,向其柏. 我国楠木属植物资源的地理分布、研究现状和开发利用前景[J]. 福建林业科技, 2004, 31(1): 5 − 9. LI Donglin, JIN Yaqin, XIANG Qibai. The geographical distribution, research status and developmental utilization prospect of Phoebe nees plant resource of our country [J]. J Fujian For Sci Technol, 2004, 31(1): 5 − 9. [6] 陈孝,纪程灵,周正清,等. 1年生桢楠容器苗质量分级研究[J]. 农业科学与技术, 2014, 15(11): 1990 − 1994. CHEN Xiao, JI Chengling, ZHOU Zhengqing, et al. Study on grading standard for one-year-old container seedling quality of Phoebe zhennan [J]. Agric Sci Technol, 2014, 15(11): 1990 − 1994. [7] 张炜. 桢楠种质资源遗传多样性和水肥管理技术对幼树生长与生理特性的影响[D]. 雅安: 四川农业大学, 2015. ZHANG Wei. Genetic Diversity and Effects of Water and Fertilizer Management on Growth and Physiology Characteristics of Phoebe zhennan [D]. Ya’an: Sichuan Agricultural University, 2015. [8] 曾武,程建勤,林锦荣,等. 桢楠引种栽培早期生长分析[J]. 林业科技, 2017, 42(3): 1 − 3. ZENG Wu, CHENG Jianqin, LIN Jinrong, et al. Analysis of early growth about the introduction and cultivation of Phoebe Zhennan [J]. For Sci Technol, 2017, 42(3): 1 − 3. [9] 李高志,朱亚军,周生财,等. 2种叶型桢楠对低温胁迫的生理响应及耐寒性分析[J]. 浙江农林大学学报, 2017, 34(2): 310 − 318. LI Gaozhi, ZHU Yajun, ZHOU Shengcai, et al. Physiological indices at low temperature stress for two types of Phoebe zhennan [J]. J Zhejiang A&F Univ, 2017, 34(2): 310 − 318. [10] 孙兵,宗卫,李金玲,等. CaCl2和水杨酸对桢楠和闽楠抗寒性的影响[J]. 长江大学学报(自然科学版), 2016, 13(33): 16 − 21. SUN Bing, ZONG Wei, LI Jinling, et al. Effects of CaCl2 and salicylic acid on cold tolerance of Phoebe zhennan and Phoebe bournei [J]. J Yangtze Univ Nat Sci Ed, 2016, 13(33): 16 − 21. [11] 张炜,何兴炳,唐森强,等. 四川桢楠生长特性与分布[J]. 林业科技开发, 2012, 26(5): 38 − 41. ZHANG Wei, HE Xingbing, TANG Senqiang, et al. Study on the growth characteristics and distribution of Phoebe zhennan in Sichuan [J]. China For Sci Technol, 2012, 26(5): 38 − 41. [12] ARNON D I. Copper enzymes in isolated chloroplasts polyphenoloxidase in Beta vulgaris [J]. Plant Physiol, 1949, 24(1): 1 − 15. [13] 罗杰. 不同肥料及其施用水平对桢楠幼苗生长特性及土壤肥力的影响[D]. 雅安: 四川农业大学, 2017. LUO Jie. Effect of Different Fertilizers and Levels on Growth of Phoebe zhennan S. Lee Seedlings and Soil Fertility [D]. Ya’an: Sichuan Agricultural University, 2017. [14] 龙汉利,张炜,宋鹏,等. 四川桢楠生长初步分析[J]. 四川林业科技, 2011, 32(4): 89 − 91. LONG Hanli, ZHANG Wei, SONG Peng, et al. An analysis of the growth of Phoebe zhennan in Sichuan [J]. J Sichuan For Sci Technol, 2011, 32(4): 89 − 91. [15] CARBONE F, PREUSS A, de VOS R C H, et al. Developmental, genetic and environmental factors affect the expression of flavonoid genes, enzymes and metabolites in strawberry fruits [J]. Plant Cell Environ, 2009, 32: 1117 − 1131. [16] RUBERTI I, SESSA G, CIOLFI A, et al. Plant adaptation to dynamically changing environment: the shading avoidance response [J]. Biotechnol Adv, 2012, 30(5): 1047 − 1058. [17] 冯晓燕,刘宁,郭晋平,等. 控制光照条件下华北山地4个混交树种幼苗幼树的形态响应和可塑性[J]. 林业科学, 2013, 49(11): 42 − 49. FENG Xiaoyan, LIU Ning, GUO Jinping, et al. Morphological responses and morphological plasticity indices of seedlings and saplings of four woody species in montane forest of Northern China to experimental light regimes [J]. Sci Sil Sin, 2013, 49(11): 42 − 49. [18] 邓波,曹燕妮,方升佐,等. 光照强度对青钱柳叶形态结构、光合特性和生长的影响[J]. 东北林业大学学报, 2015, 43(8): 1 − 6. DENG Bo, CAO Yanni, FANG Shengzuo, et al. Influence of light intensity on leaf morphological structure, photosynthesis characteristics and growth of Cyclocarya paliurus [J]. J Northeast For Univ, 2015, 43(8): 1 − 6. [19] 黄振瑞. 高产甘蔗养分需求规律及施肥调控研究[D]. 北京: 中国农业大学, 2015. HUANG Zhenrui. Nutrient Requirement of High Yield Sugarcane and Fertilizer Recommendations [D]. Beijing: China Agricultural University, 2015. [20] 何文寿,何进勤,郭瑞英. 宁夏引黄灌区春小麦不同生育期吸收氮、磷、钾养分的特点[J]. 植物营养与肥料学报, 2006, 12(6): 789 − 796. HE Wenshou, HE Jinqin, GUO Ruiying, et al. Characteristics of N, P and K uptake at different growth stages of spring wheat in irrigating region of Ningxia [J]. Plant Nutrit Fert Sci, 2006, 12(6): 789 − 796. [21] PETTIGREW W T. Potassium influence on yield and quality production for maize, wheat, soybean and cotton [J]. Physiol Plant, 2008, 133: 670 − 681. [22] 宋海星,李生秀. 玉米生长量、养分吸收量及氮肥利用率的动态变化[J]. 中国农业科学, 2003, 36(1): 71 − 76. SONG Haixing, LI Shengxiu. Dynamics of nutrient accumulation in maize plants under different water and N supply condition [J]. Sci Agric Sin, 2003, 36(1): 71 − 76. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20190399






 下载:
下载: