-
土壤有机碳矿化是土壤中有机碳周转的重要过程,是在微生物参与下分解和利用土壤中活性有机组分并释放出二氧化碳的过程,直接关系到养分元素的释放与供应、温室气体的形成与排放及土壤质量的保持等[1-2]。土壤有机碳的矿化过程受多种因素的影响,如土壤有机碳及其组分[3]、土壤理化性质[4]等。近年来,学术界对土壤有机碳矿化及其影响因素进行了大量的研究,如GALANTINI等[5]和CAYUELA等[6]研究认为:土壤有机碳含量越高,土壤矿化速率和累计矿化量就越高;FANG等[7]的分析结果表明:土壤有机碳的矿化程度随土壤深度、培养时间及培养温度的增加而减少。国内外学者对热解生物质炭的土壤修复性能已经开展了广泛而深入的研究。热解生物质炭可以增加土壤有机碳和有效性营养元素的含量[8]。热解炭还被认为是一种在土壤中相对稳定的物质,主要原因是其与土壤混合后会降低土壤中的有机碳矿化速率[9]。水热炭是一种以生物质为原料,在有水、中等温度(180~260 ℃)和自生压力下通过热化学反应得到的生物质炭[10]。与热解炭制备过程相比,水热炭化省去了耗能且繁复的预干燥过程,具有使废弃生物质以快速有效的方式持续转化为资源的潜力。SONG等[11]研究认为:水热炭化对猪粪的快速处理减少了盐分和重金属元素的危害,并有效地回收了猪粪中的养分。比较猪粪水热炭和热解炭中可溶性有机物的特性表明:水热炭中可溶性有机物具有更好的适用性,因为其含量更高,芳香性更低,有机官能团种类更多[12]。目前,已有水热炭用于农业环境和提高养分释放的研究报道,如MAU等[13]发现:低浓度的水热炭施入土壤后可改善植物生长,同时减少硝酸盐的浸出;CHU等[14]将3种不同水热炭施入水稻土后发现:水热炭能减少氨气的挥发,增加土壤氮保留的同时还增加了谷物的氮含量和产量。BENTO等[15]发现:水热炭可以增强土壤肥力,提升有机碳含量,但具体效果取决于水热炭原料、土壤类型和水热炭的施用比。BREULMANN等[16]分析评估了不同工艺条件下制备的水热炭及热解炭后指出:热解炭更适合改善长期的碳固存,而水热炭更适合于提升土壤养分含量。因此,与热解炭相比,水热炭在土壤修复以及提升土壤肥力等应用中显示出更大的应用前景。目前,水热炭研究所采用的原料主要为甘蔗渣、稻壳秸秆等农林废弃物和城市污泥及藻类等,有关畜禽粪便水热炭化的研究也逐渐增多,但国内尚无研究猪粪水热炭对土壤影响的研究报道。本研究通过矿化试验以及土壤培养试验,研究了单施不同水平猪粪水热炭[质量分数分别为0(对照)、1%、2%和4%]对土壤有机碳矿化、土壤营养成分以及pH和电导率的影响,以期为猪粪水热炭的实际应用提供理论依据。
-
制备水热炭的原料来自杭州市某养殖场干湿分离后的猪粪,采集到实验室后放入冰柜中冷冻保存,水热炭化前解冻,然后加入反应釜内。猪粪固水质量比为3.5∶6.5,在180 ℃、自生压力1.8 MPa条件下炭化1 h。炭化结束后打开泄压阀闪蒸排气,等反应釜自然降温到室温后,取出水热炭。再将水热炭在105 ℃烘箱内干燥至恒量,磨细过2 mm筛后装于密封袋中封存待用。
供试土样取自浙江农林大学东湖校区后山表层土壤(0~15 cm)。土壤风干,挑去细根后磨细过2 mm筛备用。水热炭和土壤的基本理化性质见表1。
表 1 样品的理化性质
Table 1. Physical and chemical properties of the samples
材料 总有机碳/(g·kg−1) 水溶性有机碳/(g·kg−1) 碱解氮/(mg·kg−1) 速效磷/(mg·kg−1) 速效钾/(g·kg−1) pH 电导率/(μS·cm−1) 水热炭 124.39 6.35 109.21 91.39 6.88 5.69 1 308.25 土壤 19.42 0.10 67.43 11.52 0.16 7.17 158.38 -
将50 g风干土样分别平铺于3个小烧杯中,并加水至最大持水量的60%,在25 ℃下预培养2 d后进行添加水热炭处理。水热炭的质量分数分别为0(ck)、1%、2%和4%,每个处理设3个重复。将水热炭与50 g土壤混匀,调节水分达到田间饱和持水量的60%,于25 ℃下放入小桶中进行室内密闭培养。小桶中同时放入装有适量氢氧化钠的容器,以仅装碱液容器的小桶做空白对照。培养1、2、4、7、11、16、25、40、60 d时取出碱液,再放入新的碱液(60 d不用)。在培养过程中,定期适量喷水,维持土壤湿润状态。
取出的碱液加入2 mL浓度为1.0 mol·L−1的氯化钡溶液,以2滴酚酞为指示剂,用0.1 mol·L−1盐酸进行滴定,计算二氧化碳的释放量。
-
选用 160 mm×120 mm(上口径×高)塑料盆,装500 g·盆−1风干土壤。将称好的风干土壤与水热炭按设定用量混合均匀,然后装入底部铺有滤网的塑料盆中。按田间最大持水量60%浇透水。试验在室内进行,定期进行日常的浇水管理。从培养开始到结束共80 d。培养期间在1、2、5、10、15、25、50、80 d取样测定土壤的理化性质。
-
样品总有机碳采用重铬酸钾-氧化外热法测定;碱解氮采用碱解扩散法测定;速效磷采用盐酸-氟化铵法测定,速效钾采用乙酸铵浸提-火焰光度计法测定[17]。
水溶性有机碳的测定:将样品用水浸提,震荡离心后过45 μm滤膜,使用总有机碳分析仪进行测定。样品pH与电导率的测定:用5∶1水土比(质量比)浸提后,用pH电位法及电导率仪测定。
采用SPSS 19对数据进行分析和显著性检验,其中显著性水平为P<0.05。采用Origin 2018作图。采用一级动力学方程模拟分析土壤有机碳矿化动态:Cm=Cp(1−e−kt)。其中:Cm为t时刻土壤有机碳累计矿化量,Cp为土壤潜在矿化碳库,t为培养天数,k为有机碳矿化常数。
-
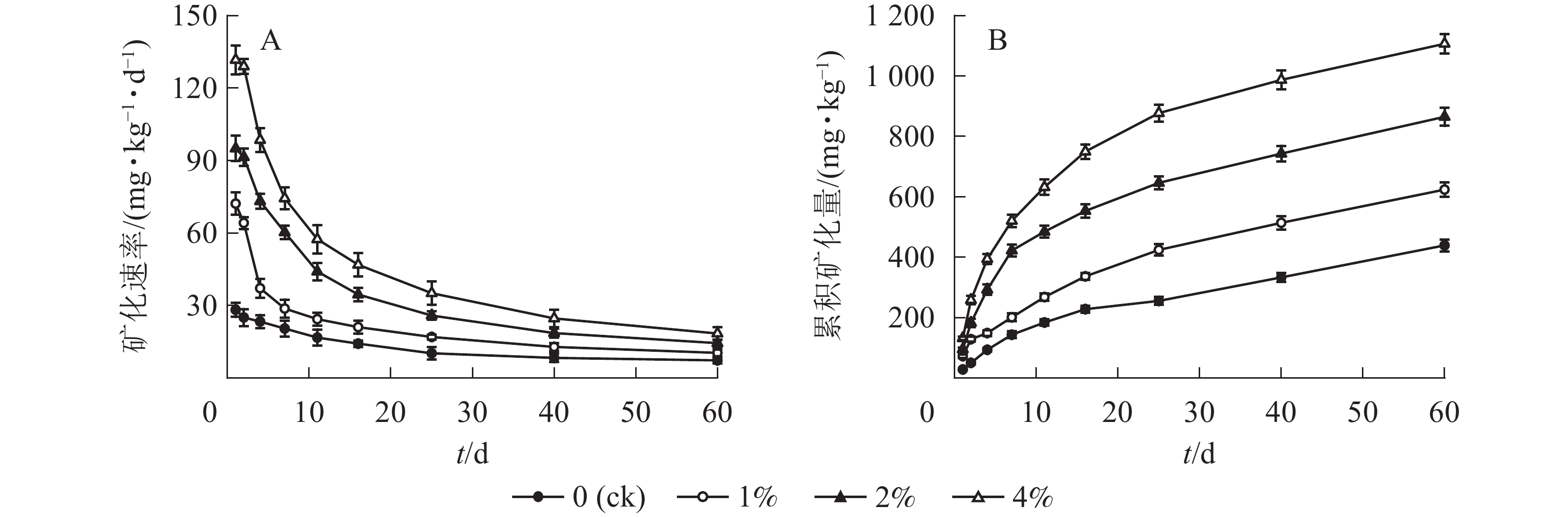
由图1A可见:各处理的土壤有机碳矿化速率呈相似的变化特征,即培养的前11 d土壤有机碳矿化速率从最高点迅速下降,之后缓慢下降并最终趋于稳定。同时,水热炭添加量越多矿化速率越高。土壤有机碳矿化速率(y)与培养时间(x)的变化呈对数函数关系:y=a+blnx,a、b为模型系数且拟合效果很好(表2)。

图 1 水热炭对土壤有机碳矿化速率(A)和累积矿化量(B)的影响
Figure 1. Influence of hydrochar on the mineralization rate(A) and cumulative mineralization(B) of soil organic carbon
表 2 土壤中有机碳矿化速率的回归方程
Table 2. Regression equations of organic carbon mineralization rate in soil
水热炭添加量/% 回归方程 R2 0(ck) y=29.438−5.501lnx 0.977* 1 y=66.731−15.485lnx 0.918* 2 y=100.388−22.090lnx 0.980* 4 y=137.835−30.918lnx 0.976* 说明:*表示显著相关(P<0.05) 由图1B可见:各处理不同时间段的土壤有机碳矿化释放量有明显不同。培养前期释放量大,后期释放量小。其中培养的前11 d二氧化碳释放量占60 d总累积矿化量的41.9%~57.1%。同时,水热炭施量越高,累积矿化量越大。另外,不同处理60 d的土壤有机碳累积矿化量差异显著,各处理从大到小依次为4%、2%、1%、0(ck),与对照相比,培养结束后处理组的土壤累积矿化量显著增加了42.1%、97.0%和152.1%。
通过一级动力学方程对4种处理土壤的有机碳累积矿化量与培养天数进行拟合(表3),决定系数均达到了显著水平(P<0.05)。这表明一级动力学方程可以很好地描述不同处理土壤有机碳累积矿化量的动态变化特征。动力学方程的模拟结果显示:不同处理的土壤潜在矿化碳库(Cp)存在显著差异(P<0.05),范围为436.86~1029.80 mg·kg−1,1%、2%和4%处理组的Cp较对照分别提高了41.2%、79.9%和135.7%。k表示有机碳矿化速率常数,其范围为0.045~0.094 d−1。同时随着水热炭添加量的增加,Cp和k均呈增加趋势。
表 3 土壤中有机碳矿化的动力学参数
Table 3. Kinetic parameters of organic carbon mineralization in soil
水热炭添加量/% Cp/(mg·kg−1) k/d−1 R2 0(ck) 436.857 a 0.045 0.965 1 617.018 b 0.052 0.964 2 786.049 c 0.092 0.958 4 1 029.796 d 0.094 0.969 说明:不同小写字母表示处理间差异显著(P<0.05) -
通过测定不同水热炭处理的土壤中的总有机碳质量分数,结合单因素方差分析可以看出(图2A):与对照组相比,添加水热炭显著提高了土壤总有机碳的质量分数(P<0.05),同时在培养第10天后不同处理之间也存在着显著差异(P<0.05),4%处理组在培养全过程与其他组之间均存在显著差异(P<0.05)。培养结束后,1%、2%、4%处理组的总有机碳质量分数与对照组相比分别提高了7.0%、22.8%和54.3%,并且土壤中水热炭的添加量越多土壤有机碳总量就越大。由图2A可知:水热炭的添加减缓了土壤总有机碳质量分数的下降;在对照处理中,培养结束后总有机碳质量分数比培养开始时降低了5.7 g·kg−1,而1%、2%和4%处理的土壤中,培养结束后各组总有机碳质量分数与培养开始时相比分别降低了4.8、2.3和2.1 g·kg−1。
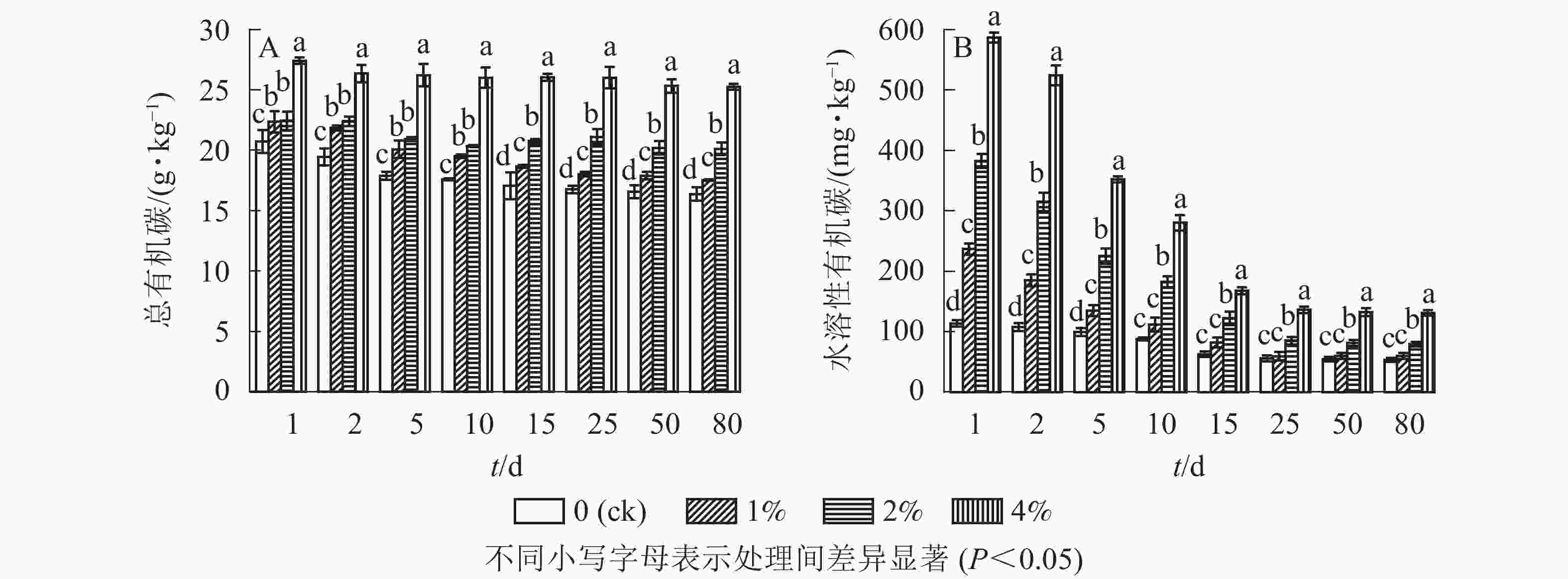
图 2 水热炭对土壤中总有机碳(A)和水溶性有机碳(B)的影响
Figure 2. Influence of hydrochar on total organic carbon contents (A) and water-soluble organic carbon contents (B) in the soil
通过测定各处理土壤中的水溶性有机碳质量分数,结合单因素方差分析结果可以看出(图2B):培养前期(1~10 d)各处理比对照显著提高了土壤中可溶性有机碳的质量分数(P<0.05),培养结束后,1%、2%、4%处理组的水溶性有机碳质量分数与对照组相比分别提高了12.6%、49.6%和146.4%,但只有较高添加量的处理组(2%和4%)与对照相比仍然呈显著增加的态势(P<0.05)。由此可见,水热炭的添加显著增加了土壤水溶性有机碳的质量分数。由图2B可知:培养初期各处理土壤水溶性有机碳质量分数最高,随培养时间延长,对照土壤水溶性有机碳呈现了缓慢下降的趋势,而处理组在培养的前15 d内快速下降,随后趋于平缓。
-
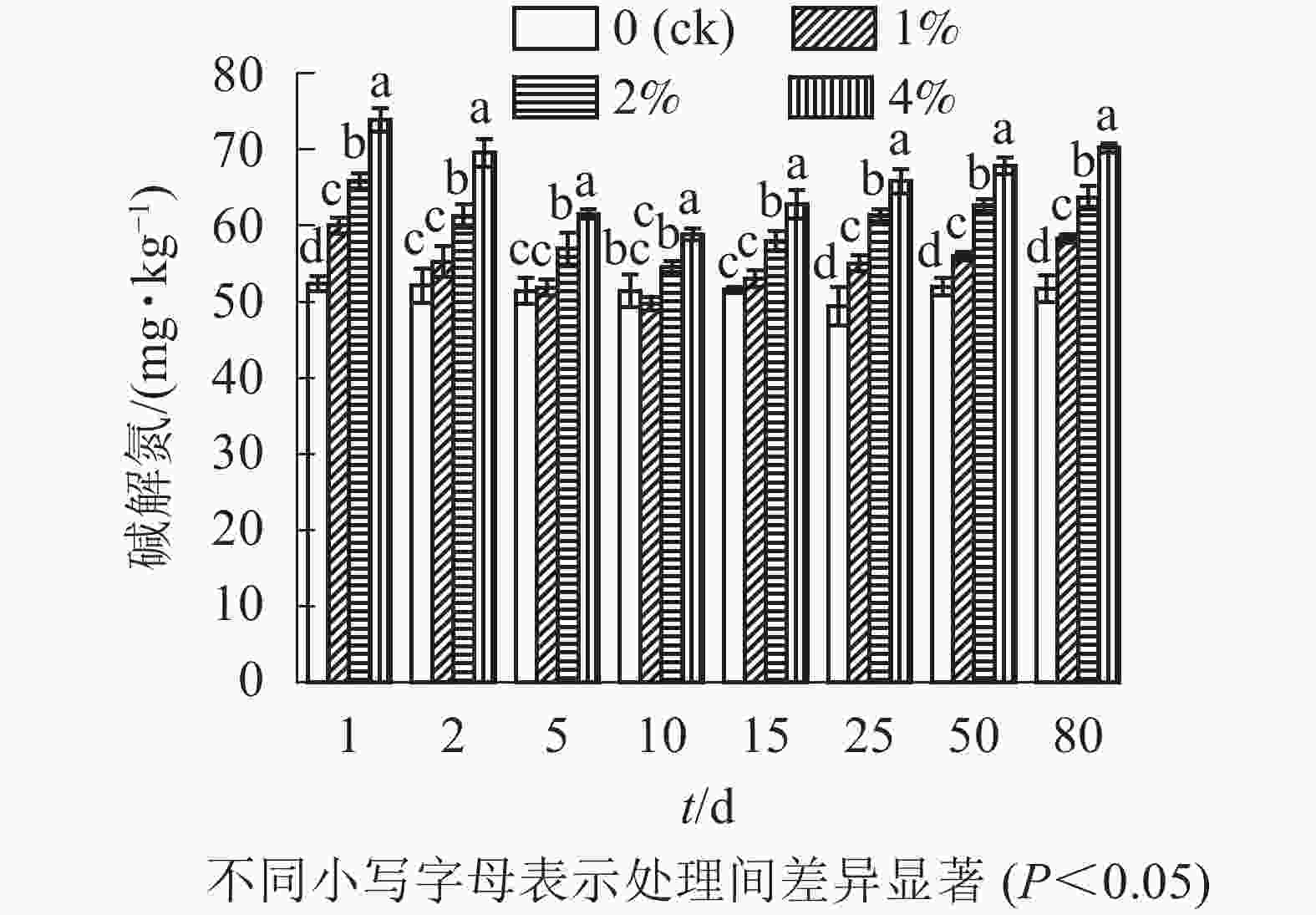
通过测定各处理土壤中的碱解氮质量分数,单因素方差分析结果可以看出(图3):与对照组相比,添加水热炭在培养第1天及第15天之后均显著提高了土壤碱解氮的质量分数(P<0.05),第2~15天1%处理组与对照组无显著差异(P>0.05),2%与4%处理组在培养全过程与其他组之间均存在显著差异(P<0.05),同时不同水热炭处理之间也存在着显著差异(P<0.05),第80天培养结束时,1%、2%、4%处理相较于对照组土壤的碱解氮质量分数分别增加了12.9%、21.3%、27.4%。在80 d的培养时间内,各处理土壤中碱解氮质量分数前期下降,在第10天达到最低点后开始上升,对照组的土壤碱解氮质量分数无较大变化。
-
通过测定各处理土壤中的速效磷质量分数,结合单因素方差分析可以看出(图4):除第1天1%处理组的速效磷质量分数与对照组无显著差异(P>0.05)外,其余整个培养过程中的处理组与对照相比均显著提高了土壤速效磷的质量分数(P<0.05),同时不同水热炭处理之间也存在着显著差异(P<0.05),80 d培养结束后,1%、2%、4%处理组比对照土壤的速效磷质量分数分别增加了119.6%、287.3%、591.2%。在80 d的培养时间内,各处理土壤中速效磷质量分数前期上升,在第10天开始下降,第15天降至最低点后开始回升。对照组的土壤速效磷质量分数变化不大。
-
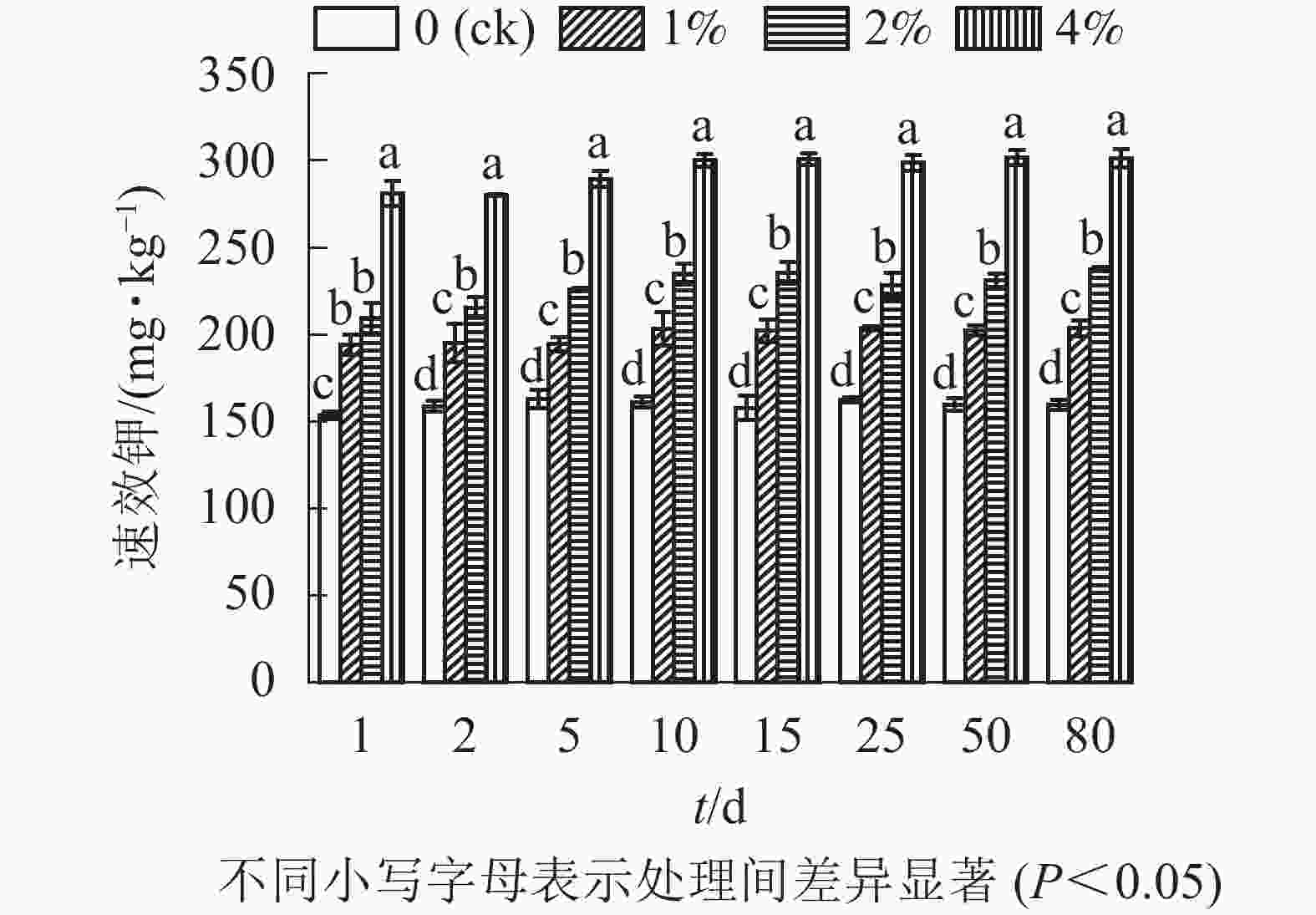
通过测定各处理土壤中的速效钾质量分数,结合单因素方差分析可以看出(图5):与对照组相比,添加水热炭显著提高了土壤速效钾质量分数(P<0.05),同时不同水热炭处理之间也有着显著性差异(P<0.05)。80 d培养结束后,1%、2%、4%处理组相较于对照组土壤的速效钾质量分数分别增加了30.0%、50.0%、88.6%。在80 d的培养时间内,各处理土壤中速效钾质量分数前期略有上升,在第10天后趋于稳定。对照组的土壤速效钾质量分数无较大变化。
-
施加水热炭后土壤pH随培养时间的变化情况如图6A所示。施加水热炭后,土壤的pH随培养时间的延长呈先降后升的趋势。1%、2%、4%处理组土样的pH从添加后开始下降,在第15天达到最低,最低值分别为6.83、6.78和6.67,且土壤pH的下降程度随水热炭添加量的增加而增加。至第80天时,1%、2%、4%处理土壤的pH分别达6.98、6.95和6.93,但依然低于对照组。整个培养期内,对照组的土壤pH无较大变化。
通过分析测定各处理土壤电导率,结合单因素方差分析结果可以看出(图6B):与对照组相比,添加水热炭显著提高了土壤电导率(P<0.05),同时不同处理之间也存在着显著性差异(P<0.05)。培养结束后,1%、2%和4%处理土壤电导率与比对照分别提高了24.1%、39.2%和58.9%。随着培养时间的增长,处理组土壤电导率呈缓慢上升的趋势。
-
已有研究表明:土壤有机碳含量越高,土壤矿化速率和累积矿化量就越高[6, 18]。由表1可知:本研究所采用的水热炭含有大量的有机碳和不稳定性有机碳,因此水热炭的添加增加了土壤中总有机碳和不稳定性有机碳质量分数,从而提高了土壤的矿化速率和累积矿化量。KHALIL等[19]在拟合90 d恒河地区0~15 cm土壤碳矿化过程的研究中得出:土壤快速矿化阶段为2~9 d,这与本研究的结果较为符合。在培养初期水热炭中大量易分解组分被快速分解释放,为微生物提供大量的易分解碳源,表现为培养初期的有机碳迅速矿化。随着易分解有机碳的矿化完成,土壤中水溶性有机碳减少,土壤微生物活性减弱,矿化速率降低并最终趋于稳定。本研究对不同培养时间土壤水溶性有机碳质量分数的测定为这种结果提供了支持。培养后期主要是稳定性好的有机碳组分发生了缓慢降解。与SCHIMMELPFENNIG等[20]使用热解生物质炭进行土培试验的结果相比,含有大量不稳定碳组分(以水溶性有机碳表示)的水热炭在土壤中的矿化速度明显高于热解碳。
Cp是土壤中可被分解的总有机碳,可用来表征土壤中生物有效性碳库的大小。土壤养分含量是微生物矿化的限制因素,水热炭本身含有较高的有机碳及养分,施用水热炭保证了微生物所需的营养元素供应,促进了微生物活性及数量,从而使Cp增加。k是由土壤类型、颗粒组成、营养元素、有机碳化学结构稳定性等因子综合作用的结果[21]。本研究中,处理组的有机碳周转速率高于对照组,表明施用水热炭可调高土壤有机碳周转速率,减少土壤有机碳周转时间,这可能是由于水热炭影响了土壤结构及化学性质。k的增加说明水热炭的添加有利于土壤碳氮转化以及提高肥力。
-
土壤总有机碳质量分数随着水热炭的施入明显升高,与BENTO等[15]的研究结果类似。这是因为水热炭是高碳材料,将水热炭施入土壤相当于向土壤中输入了大量外源有机碳,从而提高了土壤的总有机碳质量分数。土壤培养过程中,对照及处理组土壤中总有机碳会下降,这是由土壤及水热炭中不稳定组分的矿化作用所导致。水热炭的添加减缓了土壤总有机碳的下降,可能是因为水热炭表面由高度浓缩的芳香环结构组成,含有较高的芳构化结构[22],这种结构具有较强的生物稳定性。水热炭施入土壤后,其中活性有机碳在相对较短的时间内作为碳源被微生物分解,而惰性碳在试验的80 d内表现了较好的稳定性[23-24]。
水热炭含有较高的水溶性有机碳,加入土壤后可作为土壤有机碳的一部分增加土壤水溶性有机碳质量分数。此外,水热炭本身含有部分脂肪族和氧化态碳[10],可迅速被土壤微生物分解并转化为小分子可溶性有机物。处理组土壤水溶性有机碳降幅大于对照组的原因可能是水热炭中含有大量可被微生物直接分解利用的物质,施入土壤后促进了土壤呼吸作用[25],从而增加了水溶性有机碳的消耗。
-
有研究表明:水热炭可以释放出包括氮、磷、钾、钙、镁等在内的大量养分[26]。YU等[27]在土柱实验中发现:将水热炭添加到土壤中会增加土壤可溶性氮的含量,这与本研究结果相符。MELO等[28]通过盆栽实验分析土壤特性也证实:水热炭具有通过矿化作用将有效氮释放到土壤中的能力。培养前期检测到的处理组碱解氮质量分数均先下降。BARGMANN等[25]与SUBEDI等[29]均认为:微生物固氮作用可能是向土壤中添加水热炭后土壤溶液中矿质氮浓度降低的主要原因。BENTO等[15]则认为:除了微生物的消耗之外还有可能是水热炭对硝酸盐的吸附。PRATIWI等[30]也观察到了类似的现象,他将其归因于氧官能团(傅里叶红外光谱中1 576 cm−1处的1个谱带)的存在,该官能团具有吸附硝酸盐的能力。后期出现上升趋势表明这时候发生的是矿化而不是固定化,MELO等[28]在第2次盆栽实验中也观察到类似现象。这可能是因为正面的激发效应使得施加水热炭增加了原生土壤氮的矿化,同时改变了有机物的分解速率。
-
DAI等[31]在水热炭化对牛粪中磷元素的固定化研究发现:水热炭化可能是一种将磷固定在牛粪中的有效措施,磷元素偏向于更稳定的状态固存于水热炭中。尽管如此,仍有相当一部分磷以有效态的形式保留在水热炭中。还有研究发现:水热炭的添加量与土壤中速效磷的含量成正比[27],这与本研究结果一致。培养初期处理组速效磷质量分数上升的原因可能是,原土壤中速效磷质量分数较低,从而使处理组的土壤速效磷在水热炭施入初期有一个较为直观的提升。有许多生物与非生物机制可以导致培养中段土壤有效磷质量分数下降。已有的研究[32-33]中,描述的最主要的原因是①土壤颗粒的吸附、解吸以及阻塞,②沉淀以及溶解,③通过土壤微生物迁移或固定化。CHRISTEL等[34]在将生物质炭施加到土壤中后观察到了类似的现象,他认为:由于一开始的磷利用率低,水热炭不适合用作起始磷肥料,但可能是有价值的缓释肥料,与常规矿物磷肥料相比,磷损失到水生环境中的风险较低。
-
处理组土壤速效钾质量分数较对照组有显著增加,原因是水热炭本身就含有较高的速效钾,并且在培养过程中稳定存在。FEI等[35]将水热炭与热解炭及原料就碳含量和元素组成等方面进行了对比,结果表明:尽管炭化处理后可利用的无机养分(即氮、磷和钾)减少了,但可利用的养分含量仍远高于土壤需求,同时与热解炭相比,水热炭的速效钾含量较高。BENTO等[15]通过添加水热炭的土柱实验也发现:添加水热炭后土壤中钾含量显著增加,且增量与水热炭添加量呈正比。
-
施加水热炭后,处理组土壤pH在培养前期表现出下降趋势,首先因为水热炭本身呈酸性。MELO等[36]通过傅立叶红外光谱发现水热炭表面存在羧酸基团。另外,水热炭施入土壤促进了物质转化,一些化学反应可能会生成酸性物质,微生物代谢活动产生二氧化碳等酸性气体也部分残留在土壤中,导致土壤pH下降[37]。与GEORGE等[38]观察到的水热炭会导致土壤pH显著降低的结果不同,本研究处理组在培养第15天后土壤pH开始回升,这一现象与RILLING等[37]及BUSCH等[39]的研究结果一致。pH回升可能是由于水热炭中的灰分元素(例如钾、钙和镁)可溶,可以改善土壤中盐基饱和度,从而提高pH。pH升高的另一个可能解释是添加水热炭促进了土壤微生物还原反应,导致微生物活性增加[37],到了培养后期土壤生态系统趋于稳定,酸性气体挥发,土壤系统自身的酸碱调节使得土壤pH向对照的中性pH靠拢。本研究表明:猪粪水热炭对土壤pH的影响与时间有关。
往土壤中添加水热炭可显著增土壤电导率,这种影响程度与时间及添加量有关。水热炭本身具有较高的电导率,施入土壤后可以较为直接地提高土壤电导率。研究发现:较高的灰分元素含量可以提高土壤的电导率[40]。同时,水热炭含有较多的可溶性盐,有机质分解时也会释放出矿质盐分,这些都可能是土壤电导率升高的原因。
-
总体而言,猪粪水热炭施入土壤后可显著增加土壤电导率,显著提升总有机碳、水溶性有机碳、碱解氮、速效磷和速效钾的质量分数。在培养过程中,土壤pH有先降后升的现象,同时猪粪水热炭可导致土壤碱解氮及速效磷质量分数先降后升,建议可作缓释肥添加或加入土壤时配施氮磷肥。
添加猪粪水热炭提升了土壤矿化速率,显著增加了土壤累积矿化量。同时调高土壤有机碳周转速率,降低土壤有机碳周转时间。这说明水热炭的添加有利于土壤碳氮转化以及肥力提高。
综上所述,猪粪水热炭在加速土壤有机碳矿化的同时,能显著提高土壤养分,是一种较为合适的土壤改良剂。
Effects of swine manure hydrochar on soil organic carbon mineralization and soil properties
-
摘要:
目的 评价猪粪水热炭对土壤有机碳矿化、pH、电导率及营养成分的影响,为猪粪水热炭的实际应用提供理论依据。 方法 以猪粪为原料在180 ℃和1 h炭化条件下制备水热炭,将质量百分率为0(对照)、1%、2%和4%的水热炭与土壤混合进行培养试验。 结果 猪粪水热炭可提升土壤矿化速率、土壤矿化潜力及土壤有机碳周转速率。当添加量为4%时,土壤累积矿化量增加了1.52倍。培养过程中土壤的pH由7.17降至6.67~6.98,总体变化趋势为先降后升。碱解氮与速效磷含量分别在第10天和第15天降至最低后回升。土壤电导率及营养成分随水热炭添加量增加而增加,当添加量为4%时土壤电导率和总有机碳、水溶性有机碳、速效氮、有效磷、速效钾质量分数分别提升了58.9%、54.3%、146.4%、27.4%、591.2%和88.6%。 结论 猪粪水热炭在加速土壤有机碳矿化的同时能显著提升土壤养分含量,是一种较为合适的土壤改良剂。图6表3参40 Abstract:Objective The purpose of this study is to evaluate the effects of swine manure hydrochar on soil organic carbon mineralization, pH, conductivity and nutrients, in order to provide a theoretical basis for the practical application of swine manure hydrochar. Method The hydrochar was prepared by swine manure under 180 ℃ for 1 h, and mixed with soil at the mass fraction of 0(ck), 1%, 2%, and 4% for cultivation experiments. Result Swine manure hydrochar could improve soil mineralization rate, soil mineralization potential, and soil organic carbon turnover rate. When the mixing ratio was 4%, the cumulative mineralization of soil increased by 1.52 times. The pH value of soil decreased from 7.17 to 6.67−6.98 during the cultivation process, and the overall trend of change was first down and then up. The mass fraction of soil available nitrogen and available phosphorus decreased to the lowest level on the 10th and 15th day and then increased. The soil electrical conductivity and nutrient composition increased with the addition of hydrochar. When the mixing ratio was 4%, the soil electrical conductivity, total organic carbon, water-soluble organic carbon, available nitrogen, available phosphorus and available potassium increased by 58.9%, 54.3%, 146.4%, 27.4%, 591.2% and 88.6%, respectively. Conclusion Swine manure hydrochar can accelerate the mineralization of soil organic carbon and significantly improve soil nutrient content, and is a suitable soil amendment. [Ch, 6 fig. 3 tab. 40 ref.] -
Key words:
- soil science /
- swine manure /
- hydrochar /
- organic carbon mineralization /
- soil nutrients
-
表 1 样品的理化性质
Table 1. Physical and chemical properties of the samples
材料 总有机碳/(g·kg−1) 水溶性有机碳/(g·kg−1) 碱解氮/(mg·kg−1) 速效磷/(mg·kg−1) 速效钾/(g·kg−1) pH 电导率/(μS·cm−1) 水热炭 124.39 6.35 109.21 91.39 6.88 5.69 1 308.25 土壤 19.42 0.10 67.43 11.52 0.16 7.17 158.38 表 2 土壤中有机碳矿化速率的回归方程
Table 2. Regression equations of organic carbon mineralization rate in soil
水热炭添加量/% 回归方程 R2 0(ck) y=29.438−5.501lnx 0.977* 1 y=66.731−15.485lnx 0.918* 2 y=100.388−22.090lnx 0.980* 4 y=137.835−30.918lnx 0.976* 说明:*表示显著相关(P<0.05) 表 3 土壤中有机碳矿化的动力学参数
Table 3. Kinetic parameters of organic carbon mineralization in soil
水热炭添加量/% Cp/(mg·kg−1) k/d−1 R2 0(ck) 436.857 a 0.045 0.965 1 617.018 b 0.052 0.964 2 786.049 c 0.092 0.958 4 1 029.796 d 0.094 0.969 说明:不同小写字母表示处理间差异显著(P<0.05) -
[1] 李顺姬, 邱莉萍, 张兴昌. 黄土高原土壤有机碳矿化及其与土壤理化性质的关系[J]. 生态学报, 2010, 30(5): 1217 − 1226. LI Shunji, QIU Liping, ZHANG Xingchang. Mineralization of soil organic carbon and its relations with soil physical and chemical properties on the Loess Plateau [J]. Acta Ecol Sin, 2010, 30(5): 1217 − 1226. [2] 王朔林, 杨艳菊, 王改兰, 等. 长期施肥对栗褐土有机碳矿化的影响[J]. 植物营养与肥料学报, 2016, 22(5): 1278 − 1285. WANG Shuolin, YANG Yanju, WANG Gailan, et al. Effects of long-term fertilization on organic carbon mineralization of cinnamon soil [J]. J Plant Nutr Fert, 2016, 22(5): 1278 − 1285. [3] 徐广平, 李艳琼, 沈育伊, 等. 桂林会仙喀斯特湿地水位梯度下不同植物群落土壤有机碳及其组分特征[J]. 环境科学, 2019, 40(3): 1491 − 1503. XU Guangping, LI Yanqiong, SHEN Yuyi, et al. Soil organic carbon distribution and components in different plant communities along a water table gradient in the Huixian Karst Wetland in Guilin [J]. Environ Sci, 2019, 40(3): 1491 − 1503. [4] GARCIA C, HERNANDEZ T. Organic matter in bare soils of the mediterranean region with a semiarid climate [J]. Arid Soil Res Manage, 1996, 10(1): 31 − 41. [5] GALANTINI J A, ROSELL R. Long-term fertilization effects on soil organic matter quality and dynamics under different production systems in semiarid Pampean soils [J]. Soil Tillage Res, 2006, 87(1): 72 − 79. [6] CAYUELA M L, SINICCO T, MONDINI C. Mineralization dynamics and biochemical properties during initial decomposition of plant and animal residues in soil [J]. Appl Soil Ecol, 2009, 41(1): 118 − 127. [7] FANG Changming, SMITH P, MONCRIEFF J B, et al. Similar response of labile and resistant soil organic matter pools to changes in temperature [J]. Nature, 2005, 433(7021): 57 − 59. [8] XU Gang, LÜ Yingchun, SUN Junna, et al. Recent advances in biochar applications in agricultural soils: benefits and environmental implications [J]. Clean-Soil Air Water, 2012, 40(10): 1093 − 1098. [9] SPOKAS K, BAKER J M, REICOSKY D C. Ethylene: potential key for biochar amendment impacts [J]. Plant Soil, 2010, 333(1/2): 443 − 452. [10] HITZL M, CORMA A, POMARES F, et al. The hydrothermal carbonization (HTC) plant as a decentral biorefinery for wet biomass [J]. Catal Today, 2015, 257: 154 − 159. [11] SONG Chengfang, YUAN Wenqiao, SHAN Shengdao, et al. Changes of nutrients and potentially toxic elements during hydrothermal carbonization of pig manure[J]. Chemosphere, 2019, 243: 125331. doi: 10.1016/j.chemosphere.2019.125331. [12] SONG Chengfang, SHAN Shengdao, YANG Chao, et al. The comparison of dissolved organic matter in hydrochars and biochars from pig manure[J]. Sci Total Environ, 2020, 720(15). doi: 10.1016/j.scitotenv.2020.137423. [13] MAU V, ARYE G, GROSS A. Poultry litter hydrochar as an amendment for sandy soils[J]. J Environ Manage, 2020, 271. doi: 10.1016/j. jenvman. 2020.110959. [14] CHU Qingnan, XUE Lihong, SINGH B P, et al. Sewage sludge-derived hydrochar that inhibits ammonia volatilization, improves soil nitrogen retention and rice nitrogen utilization[J]. Chemosphere, 2020, 245: 125558. doi: 10.1016/j.chemosphere.2019.125558. [15] BENTO L, CASTRO J, MOREIRA A B, et al. Release of nutrients and organic carbon in different soil types from hydrochar obtained using sugarcane bagasse and vinasse [J]. Geoderma, 2019, 334: 24 − 32. [16] BREULMANN M, van AFFERDEN M, MUELLER R A, et al. Process conditions of pyrolysis and hydrothermal carbonization affect the potential of sewage sludge for soil carbon sequestration and amelioration [J]. J Anal Appl Pyrolysis, 2017, 124: 256 − 265. [17] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. [18] KIMETU J M, LEHMANN J, KINYANGI J M, et al. Soil organic C stabilization and thresholds in C saturation [J]. Soil Biol Biochem, 2009, 41(10): 2100 − 2104. [19] KHALIL M I, HOSSAIN M B, SCHMIDHALTER U. Carbon and nitrogen mineralization in different upland soils of the subtropics treated with organic materials [J]. Soil Biol Biochem, 2005, 37(8): 1507 − 1518. [20] SCHIMMELPFENNIG S, GLASER B. One step forward toward characterization: some important material properties to distinguish biochars [J]. J Environ Qual, 2012, 41(4): 1001 − 1013. [21] 陈吉, 赵炳梓, 张佳宝, 等. 长期施肥潮土在玉米季施肥初期的有机碳矿化过程研究[J]. 土壤, 2009, 41(5): 719 − 725. CHEN Ji, ZHAO Bingzi, ZHANG Jiabao, et al. Research on process of fluvo-aquic soil organic carbon mineralization in initial stage of maize growth under long-term different fertilization [J]. Soils, 2009, 41(5): 719 − 725. [22] ZHANG Zhikun, ZHU Zhongyuan, SHEN Boxiong, et al. Insights into biochar and hydrochar production and applications: a review [J]. Energy, 2019, 171: 581 − 598. [23] 韩玮, 申双和, 谢祖彬, 等. 生物炭及秸秆对水稻土各密度组分有机碳及微生物的影响[J]. 生态学报, 2016, 36(18): 5838 − 5846. HAN Wei, SHEN Shuanghe, XIE Zubin, et al. Effects of biochar and straw on both the organic carbon in different density fractions and the microbial biomass in paddy soil [J]. Acta Ecol Sin, 2016, 36(18): 5838 − 5846. [24] SMITH J L, COLLINS H P, BAILEY V L. The effect of young biochar on soil respiration [J]. Soil Biol Biochem, 2010, 42(12): 2345 − 2347. [25] BARGMANN I, MARTENS R, RILLIG M C, et al. Hydrochar amendment promotes microbial immobilization of mineral nitrogen [J]. J Plant Nutr Soil Sci, 2014, 177(1): 59 − 67. [26] MCGAUGHY K, REZA M T. Recovery of macro and micro-nutrients by hydrothermal carbonization of septage [J]. J Agric Food Chem, 2018, 66(8): 1854 − 1862. [27] YU Shan, FENG Yanfang, XUE Lihong, et al. Biowaste to treasure: application of microbial-aged hydrochar in rice paddy could improve nitrogen use efficiency and rice grain free amino acids [J]. J Clean Prod, 2019, 240: 1 − 12. [28] MELO T M, BOTTLINGER M, SCHULZ E, et al. Plant and soil responses to hydrothermally converted sewage sludge (sewchar) [J]. Chemosphere, 2018, 206: 338 − 348. [29] SUBEDI R, KAMMANN C, PELISSETTI S, et al. Does soil amended with biochar and hydrochar reduce ammonia emissions following the application of pig slurry? [J]. Eur J Soil Sci, 2015, 66(6): 1044 − 1053. [30] PRATIWI E P A, HILLARY A K, FUKUDA T, et al. The effects of rice husk char on ammonium, nitrate and phosphate retention and leaching in loamy soil [J]. Geoderma, 2016, 277: 61 − 68. [31] DAI Lichun, TAN Furong, WU Bo, et al. Immobilization of phosphorus in cow manure during hydrothermal carbonization [J]. J Environ Manage, 2015, 157: 49 − 53. [32] HANSEN H C B, HANSEN P E, MAGID J. Empirical modelling of the kinetics of phosphate sorption to macropore materials in aggregated subsoils [J]. Eur J Soil Sci, 2010, 50(2): 317 − 327. [33] FROSSARD E, CONDRON L M, OBERSON A, et al. Processes governing phosphorus availability in temperate soils [J]. J Environ Qual, 2000, 29(1): 15 − 23. [34] CHRISTEL W, BRUUN S, MAGID J, et al. Phosphorus availability from the solid fraction of pig slurry is altered by composting or thermal treatment [J]. Bioresour Technol, 2014, 169: 543 − 551. [35] FEI Yingheng, ZHAO Dan, LIU Ye, et al. Feasibility of sewage sludge derived hydrochars for agricultural application: Nutrients (N, P, K) and potentially toxic elements (Zn, Cu, Pb, Ni, Cd)[J]. Chemosphere, 2019, 236: 124841. doi: 10.1016/j.chemosphere.2019.124841. [36] MELO C A, JUNIOR F H S, BISINOTI M C, et al. Transforming sugarcane bagasse and vinasse wastes into hydrochar in the presence of phosphoric acid: an evaluation of nutrient contents and structural properties [J]. Waste Biomass Valorization, 2017, 8(4): 1139 − 1151. [37] RILLING M C, WAGNER M, SALEM M, et al. Material derived from hydrothermal carbonization: effects on plant growth and arbuscular mycorrhiza [J]. Appl Soil Ecol, 2010, 45(3): 238 − 242. [38] GEORGE C, WAGNER M, KÜCKE M, et al. Divergent consequences of hydrochar in the plant-soil system: arbuscular mycorrhiza, nodulation, plant growth and soil aggregation effects [J]. Appl Soil Ecol, 2012, 59: 68 − 72. [39] BUSCH D, STARK A, KAMMANN C I, et al. Genotoxic and phytotoxic risk assessment of fresh and treated hydrochar from hydrothermal carbonization compared to biochar from pyrolysis [J]. Ecotoxicol Environ Saf, 2013, 97: 59 − 66. [40] QIN Peng, WANG Hailong, YANG Xing, et al. Bamboo- and pig-derived biochars reduce leaching losses of dibutyl phthalate, cadmium, and lead from co-contaminated soils [J]. Chemosphere, 2018, 198: 450 − 459. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20200651






 下载:
下载: