-
广义乌蔹莓属Cayratia s.l. 隶属于葡萄科Vitaceae,全世界约60余种,分布于亚洲、非洲和大洋洲。该属为草质藤本,有时木质化;叶为鸟足状5小叶,或3小叶;复二歧聚伞花序或伞房状多歧聚伞花序,腋生或假腋生;花4数;花瓣展开,各自分离脱落;花盘发达;柱头不裂;果为浆果[1]。中国记载有17种,南北各地均有分布,以西南地区种类最为丰富[2]。
王文采[3]在对中国葡萄科系统整理时,记载了浙江产2种:乌蔹莓Cayratia japonica (Thunb.) Gagnep. 和大叶乌蔹莓C. oligocarpa Gagnep. [包括变种樱叶乌蔹莓C. oligocarpa var. glabra (Gagnep.) Rehder]。《浙江植物志》第4卷[4]作了同样的记述。丁炳扬等[5]报道了车索藤C. japonica var. pubifolia Merr. et Chun在浙江(庆元)的新分布。李朝銮[6]研究了C. oligocarpa的模式标本,发现其茎、叶柄、叶背面及花序梗上均被褐色节状长柔毛,与中国以往被鉴定为C. oligocarpa的大多数标本差异很大,遂将这类密被灰白色短柔毛的命名为白毛乌蔹莓C. albifolia C. L. Li,并引用了浙江龙泉的标本。《中国植物志》第48卷第2分册[1],除记载浙江产C. japonica、C. albifolia 2种外,还有变种尖叶乌蔹莓C. japonica var. pseudotrifolia (W. T. Wang) C. L. Li。郑朝宗[7]在《浙江种子植物检索鉴定手册》中记载了C. japonica及其变种C. japonica var. pseudotrifolia、C. albifolia及其变种C. albifolia var. glabra (Gagnep.) C. L. Li、C. oligocarpa等3种。CHEN等[2]在Flora of China Vol. 12中,记载了浙江产C. japonica、C. albifolia、C. japonica var. pseudotrifolia,将C. albifolia var. glabra作为C. albifolia的异名。陈贤兴等[8]报道了角花乌蔹莓Causonis corniculata Gagnep.在浙江苍南的分布新记录。
近来,对葡萄科及广义乌蔹莓属的系统学研究表明:被广泛接受并使用的Cayratia Juss. (中文以往称乌蔹莓属)和崖爬藤属Tetrastigma Planch.、葡萄瓮属Cyphostemma (Planch.) Alston构成单系,但Cayratia本身并非单系[9]。Cayratia植物可以清楚地分为4支,除了拟乌蔹莓属Pseudocayratia J. Wen, L. M. Lu et Z. D. Chen接近崖爬藤属外,还有3支分别是:乌蔹莓属Causonis Raf. (约30种,分布于亚洲和大洋洲)、苦蔹莓属Afrocayratia J. Wen, L. M. Lu, Rabarijaona et Z. D. Chen (7种,大部分产于非洲)和大麻藤属Cayratia (约25种,分布于亚洲和大洋洲)[10-12]。因此,传统使用的Cayratia现在被认为是广义的,其狭义的所包含的种类浙江不产。WEN等[11]在发表新属拟乌蔹莓属Pseudocayratia时,认为浙江南部叶背具灰白色短柔毛的类型(作者引用的标本为“章绍尧2961”号)是新种美丽拟乌蔹莓P. speciose J. Wen et L. M. Lu,但根据其描述,浙江原记载的C. albifolia var. glabra实为白毛拟乌蔹莓P. pengiana Hsu et J. Wen。在对浙江野生植物资源调查、采集和《浙江植物志(新编)》(第6卷)的编研过程中,作者对浙江的广义乌蔹莓属进行了文献查阅、标本采集、整理鉴定,同时结合茎叶毛被特征、种子形态和系统发育关系(atpB-rbcL,trnC-petN,trnH-psbA和trnL-F)分析,除先期描述发表了3个新种外[13],现将主要研究结果报道如下。
-
用于茎、叶毛被特征观察的9种9个样品和种子形态观察的6种6个样品取自野外采集的标本。样品的凭证标本信息见表1。DNA材料均取自野外采集经硅胶干燥的叶片,凭证标本保存于杭州师范大学植物标本馆(HTC)和浙江自然博物院植物标本馆(ZM);部分用于系统发育分析的序列下载自GenBank (表2),系统发育分析共涉及61种(包括种下等级) 73样品(其中外类群4种4样品)。
表 1 材料来源
Table 1. Source of materials
物种 产地 凭证标本 角花乌蔹莓Causonis corniculata* 浙江苍南(Cangnan of Zhejiang) 谢文远(W. Y. Xie) CN18071806(HTC) 乌蔹莓C. japonica* 浙江杭州(Hangzhou of Zhejiang) 陈征海(Z. H. Chen) HZ18062501(HTC) 山地乌蔹莓C. montana* 浙江景宁(Jingning of Zhejiang) 陈征海,等(Z. H. Chen, et al.) JN18062003(HTC) 文采乌蔹莓C. wentsiana* 浙江文成(Wencheng of Zhejiang) 陈征海,等(Z. H. Chen, et al.) WC17061004(ZM) 尖叶乌蔹莓C. pseudotrifolia 浙江湖州(Huzhou of Zhejiang) 陈煜初(Y. C. Chen)无号 (HTC) 薄叶乌蔹莓Cayratia tenuifolia 浙江乐清(Yueqing of Zhejiang) 陈征海,等(Z.H. Chen, et al.) LQ001(HTC) 华东拟乌蔹莓Pseudocayratia orientalisinensis* 浙江临安(Lin’an of Zhejiang) 陈征海,等(Z.H. Chen, et al.) LA17061817(HTC) 白毛拟乌蔹莓P. pengiana 浙江龙泉(Longquan of Zhejiang) 金孝锋,等 (X. F. Jin, et al.) 4208 (HTC) 美丽拟乌蔹莓P. speciosa* 浙江天台(Tiantai of Zhejiang) 陈征海,等(Z. H. Chen, et al.) TT18060901 (HTC) 说明:带*为同时用于种子形态观察的材料;HTC为杭州师范大学植物标本馆代码缩写,ZM为浙江自然博物院植物标本馆代码 缩写 表 2 用于系统发育树构建的材料及各个基因的GenBank序列号
Table 2. Species and their Genbank accession numbers of DNA sequences used in the phylegenetic study
物种学名 atpB-rbcL trnC-petN trnH-psbA trnL-F Afrocayratia debilis (Baker) J. Wen & L. M. Lu KC166301 JF437189 JF437075 JF437295 Afrocayratia delicatula (Desc.) J.Wen & Z. D. Chen MT995939 MT995982 MT995964 MT995992 Afrocayratia gracilis (Guill. & Perr.) J.Wen & Z. D. Chen KC166306 KC166483 KC166559 KC166632 Afrocayratiai merinensis (Baker) J. Wen & L. M. Lu HM585520 JX476669 HM585663 HM585936 Afrocayratia longiflora (Desc.) J. Wen & Rabarijaona KC166307 KC166484 KC166560 KC166633 Afrocayratia triternata (Baker) J. Wen & Rabarijaona KC166324 KC166501 KC166575 KC166644 Causonis corniculata (Benth.) J. Wen & L. M. Lu MT104033 MT104056 MT104079 MT104102 Causonis japonica (Thunb.) Raf. [Wen 12103] KC166311 KC166487 KC166563 KC166636 Causonis japonica (Thunb.) Raf. [Wen 8537] KC166313 KC166488 KC166564 KC166637 Causonis japonica (Thunb.) Raf. [Nie & Meng 453] KC166308 KC166485 KC166561 KC166634 Causonis japonica (Thunb.) Raf. [Wen 12110] KC166309 KC166486 KC166562 KC166635 Causonis japonica (Thunb.) Raf. [Wen 9262] KC166310 JF437197 JF437083 JF437300 Causonis japonica (Thunb.) Raf. 1 [Z. H. Chen & al. XJ18060201] MT104049 MT104072 MT104095 MT104118 Causonis japonica (Thunb.) Raf. 2 [Z. H. Chen & al. XJ18060202] MT104050 MT104073 MT104096 MT104119 Causonis japonica (Thunb.) Raf. 3 [Z. H. Chen HZ18062501] MT104051 MT104074 MT104097 MT104120 Causonis montana Z. H. Chen, Y. F. Lu & X. F. Jin MT104029 MT104052 MT104075 MT104098 Causonis trifolia (L.) Raf. KC166323 KC166500 KC166574 AB235007 Causonis wentsaiana Z. H. Chen, F. Chen & X. F. Jin MT104039 MT104062 MT104085 MT104108 Cayratia acris (F. Muell.) Domin KT344149 KT344499 KT344234 KT344410 Cayratia albifolia C. L. Li var. glabra (Gagnep.) C. L. Li KC166294 KC166472 KC166549 KC166622 Cayratia cardiophylla Jackes KC428766 KC428790 KC428809 KC428824 Cayratia cheniana L. M. Lu & J. Wen KU167491 KU167493 KU167494 KU167495 Cayratia ciliifera (Merr.) Chun KC166296 KC166474 KC166551 KC166624 Causonis clematidea (F. Muell.) Jackes KC166297 KC166475 KC166552 KC166625 Cayratia cordifolia C. Y. Wu ex C. L. Li HM585518 JX476668 HM585661 HM585934 Cayratia emarginata Trias-Blasi & J. Parn. HQ214187 − − HQ214229 Cayratia geniculata (Blume) Gagnep. HM585519 KC166480 HM585662 HM585935 Cayratia grandifolia (Warb.) Merr. & L. M. Perry − KC428796 KC428815 KX951227 Cayratia lineata (Warb.) Merr. & L. M. Perry − KC428791 KC428810 KX951228 Cayratia maritima (Jackes) Jackes JQ182482 − JQ182533 JQ182576 Cayratia melananthera Gagnep. KC166316 KC166491 KC166566 KC166639 Cayratia mollissima (Wall.) Gagnep. HM585522 JX476671 HM585665 AB235003 Cayratia oligocarpa (H. Lév. & Vaniot) Gagnep. KC166319 KC166494 KC166569 KC166642 Cayratia pedata (Lam.) Gagnep. KC166321 KC166497 KC166572 AB235005 Cayratia pseudotrifolia W. T. Wang [Y. C. Chen s. n.] MT104046 MT104069 MT104092 MT104115 Cayratia pseudotrifolia W. T. Wang [Wen 8085] AB234920 KC166498 KC166573 AB235006 Cayratia tenuifolia Wright & Arn. 1 [Z. H. Chen & L. Chen LQ001] MT104043 MT104066 MT104089 MT104112 Cayratia tenuifolia Wright & Arn. 2 [Z. H. Chen & L. Chen LQ002] MT104044 MT104067 MT104090 MT104113 Cayratia tenuifoliaWright & Arn. 3 [Z.H. Chen & L. Chen LQ003] MT104045 MT104068 MT104091 MT104114 Cayratia wrayi (King) Gagnep. KC166326 KC166504 JQ182497 JQ182544 Cyphostemma bainesii (Hook.) Desc. AB234922 KC166506 KC166579 AB235025 Cyphostemma buchananii (Planch.) Desc. ex Wild & R.B. Drumm. KC166329 KX925943 KC166580 KC166648 Cyphostemma cyphopetalum (Fresen.) Desc. ex Wild & R.B. Drumm. KC166330 KC166507 KC166581 KC166649 Cyphostemma dehongense L. M. Lu & V. C. Dang KY660246 KY660236 KY660241 KY660251 Pseudocayratia orientalisinensis Z. H. Chen, W. Y. Xie & X. F. Jin MT104037 MT104060 MT104083 MT104106 Pseudocayratia pengiana Hsu & J. Wen [X. F. Jin & Y. F. Lu 4208-1] MT104042 MT104065 MT104088 MT104111 Pseudocayratia pengiana Hsu & J. Wen [Huang 458] MH253932 MH253934 MH253935 MH253936 Pseudocayratia speciosa J. Wen & L. M. Lu [Wen 11412] KC166376 KC166541 KC166615 KC166681 Pseudocayratia speciosa J. Wen & L. M. Lu [Z. H. Chen & al. XJ18600204] MT104031 MT104054 MT104077 MT104100 Pseudocayratia yoshimurae (Makino) J. Wen & V. C. Dang MH253937 MH253939 MH253940 MH253941 Tetrastigma bioritsense (Hayata) Hsu & Kuoh HM585548 JF437252 JF437140 HM585964 Tetrastigma campylocarpum (Kurz) Planch. HM585550 KX925955 HM585690 HM585966 Tetrastigma ceratopetalum C. Y. Wu HM585557 KC166538 HM585697 HM585973 Tetrastigma cf. tuberculatum (Blume) Latiff HM585559 KX925971 HM585699 HM585975 Tetrastigma curtisii (Ridl.) Suess. HM585563 − HM585703 HM585979 Tetrastigma cf. delavayi Gagnep. AB234932 KC166539 HM585705 AB235050 Tetrastigma diepenhorstii (Miq.) Latiff HM585567 − HM585707 HM585983 Tetrastigma ellipticum Merr. HM585569 − HM585709 HM585985 Tetrastigma hemsleyanum Diels & Gilg HM585584 JF437255 JF437143 HM586000 Tetrastigma jinghongense C. L. Li HM585590 JF437256 JF437144 HM586006 Tetrastigma lanyuense C. E. Chang HM585593 JF437257 JF437145 HM586009 Tetrastigma lawsoni (King) Burkill HM585599 − HM585737 HM586015 Tetrastigma laxum Merr. HM585602 − HM585740 HM586018 Tetrastigma obtectum (Wall. ex M. A. Lawson) Planch. ex Franch. HM585614 JF437266 JF437154 JF437349 Tetrastigma pachyphyllum (Hemsl.) Chun HM585615 KT344516 HM585752 HM586031 Tetrastigma papillosum (Blume) Planch. HM585617 − HM585754 HM586033 Tetrastigma pedunculare (Wall. ex M. A. Lawson) Planch. HM585620 KX925967 HM585757 HM586036 Tetrastigma planicaule (Hook. f.) Gagnep. HM585622 KC166540 HM585759 HM586037 Tetrastigma rumicispermum (M. A. Lawson) Planch. HM585626 − HM585763 HM586041 Tetrastigma serrulatum (Roxb.) Planch. HM585627 JF437261 JF437149 HM586042 Tetrastigma strumarum (Planch.) Gagnep. HM585641 − HM585778 HM586056 Tetrastigma trifoliolatum Merr. HM585643 − HM585780 HM586058 Tetrastigma triphyllum (Gagnep.) W. T. Wang HM585646 JF437263 JF437151 HM586061 说明:−为美国国家生物信息中心(NCBI)中暂无此种的序列 -
茎、叶毛被特征用扫描电镜观察。9种共9个样品材料取自采集的腊叶标本,在标本上取下健康成熟的茎段约5 mm长,叶片材料剪取叶片中部,大小约0.5 cm×0.5 cm。将所取的茎、叶材料直接粘贴于样品台上,置于喷金仪内抽真空后溅射式喷金2 min,再置于KYKY-EM 3200扫描电镜下观察并摄像。
-
观察种子形态的共有6种,6个样品。在对种子样品观察时,先剥去果实外果皮、果肉,取出种子,在清水中揉搓,去除膜质层后晾干。每个种随机取出10粒种子,测量大小(种子长度和宽度),并在解剖镜下观察和描述种子的背面、腹面洼穴形态和横切胚乳形状,逐一记录后拍照。
-
DNA提取和PCR扩增:取约0.1 g经硅胶干燥的叶片,利用TIANGEN的植物基因组试剂盒(Plant Genomic DNA Kit)提取样品总DNA,后保存于−20 ℃的冰箱中备用。选取4个叶绿体基因atpB-rbcL、trnC-petN、trnH-psbA和trnL-F进行系统发育分析,所用引物参考SOEJIMA等[14]、CHEN等[15]和REN等[16]。PCR反应体系为25.0 μL,其中包括12.5 μL 2×Reaction Mix,上下游引物各1.0 μL,1.0 μL基因组DNA,0.3 μL Golden DNA Polymerase (TIANGEN,中国)(2.5×16.67 mkat·L−1)和9.2 μL双蒸水。PCR反应程序为:DNA模板94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s和72 ℃延伸1 min (37个循环),最后72 ℃总延伸5 min。凝胶电泳检测扩增产物,选取条带明显、单一的样品送北京擎科生物公司双向测序。
数据分析:用Lasergene中的SeqMan对测序产物进行拼合,后在MAFFT中比对序列并在BioEdit中进行手动调整和剪切,利用jModeltest分别计算4个叶绿体基因片段的最佳核苷酸模型(atpB-rbcL和trnL-F为GTR+I,trnC-petN和trnH-psbA为GTR+G),利用SequenceMatrix将4个片段进行拼接。系统发育分析构建了贝叶斯树和最大似然(maximum likelihood, ML)树,利用Mrbayes v3.2.6构建贝叶斯树,用MCMC (Markov chain Monte Carlo)算法搜索10 000 000代,每1000代取1次样,舍弃起始的2 500棵不稳定树(burn in为0.25),并计算后验概率(PP)。用门户网站CIPRES工具箱中的RAxML-HPC BlackBox构建ML树,其中设置bootstraps为1000,核苷酸替代模型为GTR+G+I。构建完成的系统发育树在FigTree中查看和编辑。
-
所观察的浙江广义乌蔹莓属9种植物(乌蔹莓属6种和拟乌蔹莓属3种)茎和叶的毛被形态特征见图1。茎上的毛被除了角花乌蔹莓无毛,文采乌蔹莓被多节长柔毛外,其他7种均疏被短柔毛。叶片背面的毛被,乌蔹莓、薄叶乌蔹莓、尖叶乌蔹莓、山地乌蔹莓、华东拟乌蔹莓等5种沿中脉和侧脉疏被短柔毛,角花乌蔹莓为无毛,文采乌蔹莓则被多节长柔毛;美丽拟乌蔹莓叶片背面仅中脉和侧脉密被伏生柔毛,而白毛拟乌蔹莓叶片背面密被开展柔毛。可见,茎和叶片背面的毛被在种间存在一定的差异。
-
浙江乌蔹莓属4种和拟乌蔹莓属2种植物的种子形态和横切胚乳形态特征如图2及表3。所有种子背腹面外形均为宽倒卵形,大小有差异,最小的是文采乌蔹莓(3.88~4.20 mm×3.18~3.91 mm),最大的是华东拟乌蔹莓(6.23~7.48 mm×5.30~5.94 mm),属内(乌蔹莓属4种间、拟乌蔹莓属2种间)无显著差异,但这2属之间种子大小存在显著差异(P<0.05)。乌蔹莓属4种的种子背面具明显横棱纹,但数目有差异,拟乌蔹莓属2种的种子背面无横棱纹;所有种的种子腹面具突出的中棱脊,两侧具洼穴。洼穴形状和凹陷程度在属间有差异。种子横切面乌蔹莓属4种植物为M型,而拟乌蔹莓属2种为T型。
表 3 浙江乌蔹莓属和拟乌蔹莓属6种植物种子形态
Table 3. Seed morphology of six species of Causonis and Pseudocayratia from Zhejiang
种名 测量数 形状 大小(长×宽)/(mm×mm) 背面 腹面 洼穴 横切面 角花乌蔹莓 10 宽倒卵形 (4.55±0.28)×(4.04±0.23) 具横棱纹 中棱脊突出,两侧具洼穴 倒狭卵状椭圆形,深凹 M型 乌蔹莓 10 宽倒卵形 (4.71±0.37)×(3.58±0.16) 具横棱纹 中棱脊突出,两侧具洼穴 倒狭卵形,深凹 M型 山地乌蔹莓 10 宽倒卵形 (4.64±0.23)×(3.91±0.23) 具横棱纹 中棱脊突出,两侧具洼穴 倒狭卵状椭圆形,深凹 M型 文采乌蔹莓 10 宽倒卵形 (4.06±0.17)×(3.52±0.37) 具横棱纹 中棱脊突出,两侧具洼穴 倒狭卵状椭圆形,深凹 M型 华东拟乌蔹莓 10 宽倒卵形 (6.92±0.36)×(5.63±0.24) 无横棱纹 中棱脊突出,两侧具洼穴 椭圆形,浅凹 T型 美丽拟乌蔹莓 10 宽倒卵形 (5.81±0.29)×(5.00±0.19) 无横棱纹 中棱脊突出,两侧具洼穴 椭圆形,浅凹 T型 -
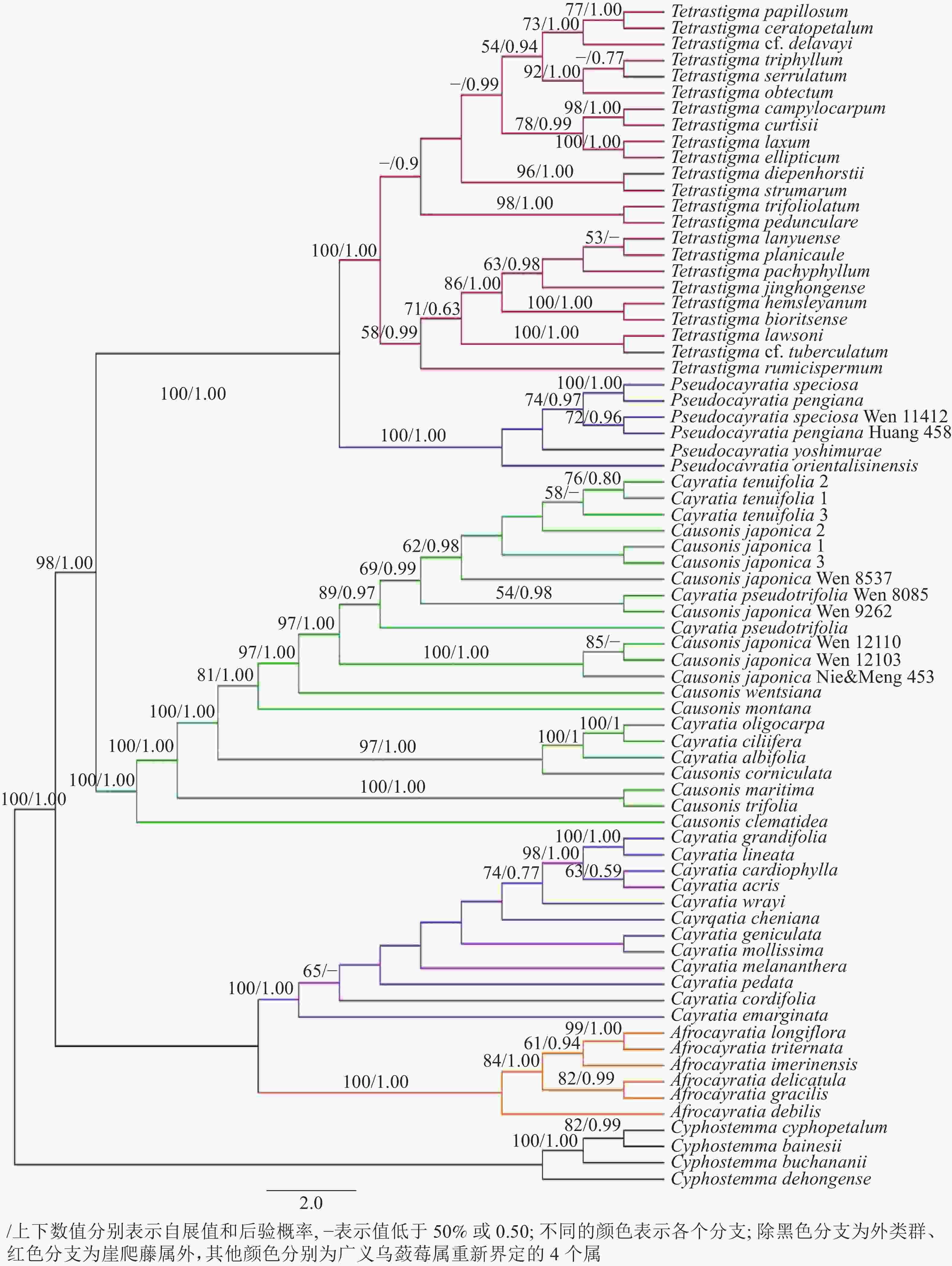
联合4个叶绿体基因片段总长度为3478 bp,atpB-rbcL、trnC-petN、trnH-psbA和trnL-F分别为914、993、497和1074 bp。构建的贝叶斯树和植物系统发育树树形一致,崖爬藤属Tetrastigma、拟乌蔹莓属Pseudocayratia、乌蔹莓属Causonis、大麻藤属Cayratia和苦蔹藤属Afrocayratia均为单系类群并且有很高的支持率(后验概率为1.00,自展值为100%)(图3)。其中:浙江产崖爬藤属、拟乌蔹莓属和乌蔹莓属3属,在拟乌蔹莓属支中。浙江所产3种为美丽拟乌蔹莓、白毛拟乌蔹莓和华东拟乌蔹莓,美丽拟乌蔹莓2个个体和白毛拟乌蔹莓2个个体组成1支(后验概率为0.97,自展值为74%),但在支内两者无法区分;在乌蔹莓属中,浙江有6种:薄叶乌蔹莓、乌蔹莓、尖叶乌蔹莓、文采乌蔹莓、山地乌蔹莓和角花乌蔹莓,薄叶乌蔹莓的3个个体、乌蔹莓8个个体和尖叶乌蔹莓2个个体组成1支(后验概率为1.00,自展值为97%),但在支内三者混杂,无法区分。
-
茎和叶的毛被是以往广义乌蔹莓属分类的重要依据之一[1-2]。对浙江乌蔹莓属和拟乌蔹莓属9植物的茎、叶毛被扫描电镜观察结果显示:其毛被较为稳定,其叶片背面沿脉的毛被在种间具有差异,分别疏被短柔毛(乌蔹莓、山地乌蔹莓、薄叶乌蔹莓、尖叶乌蔹莓和华东拟乌蔹莓)、多节长柔毛(文采乌蔹莓)、无毛(角花乌蔹莓)、密被柔毛(白毛拟乌蔹莓和美丽拟乌蔹莓),可见毛被特点在近似种之间具有可区别的差异,如角花乌蔹莓和文采乌蔹莓、美丽拟乌蔹莓和华东拟乌蔹莓之间,但乌蔹莓属和拟乌蔹莓属之间尚无法判断是否存在差异。
种子形态是广义乌蔹莓属分亚属(或组)的重要依据[1-2],是分属的重要依据[10–13]。所观察的浙江6种植物而言,乌蔹莓属和拟乌蔹莓属之间在种子大小、背面是否具横棱纹、腹面洼穴形态和种子横切面形态存在本质区别,可以作为这2个属的区别特征。
除了毛被类型、种子形态外,小叶片数目、叶缘锯齿数目与形态,叶柄、小叶柄长短,卷须分枝数目,花瓣先端形态等常作为分种(或变种)的依据[1-4, 7]。值得注意的是,乌蔹莓属植物花序均为上举,但果序有上举与下垂2类,果序总梗、果梗的颜色有红色与绿色2类,果实成熟前的颜色变化有由红色转黑色、由绿色转黑色、由绿色转白色、淡蓝紫色转黑色等类型;花盘的颜色在初花时至花后期也会发生变化;种子新鲜时和压干制作标本以后的形状变化。以上形态性状在标本室难以观察,故而也是腊叶标本容易被误定的主要原因。
-
本研究的系统发育分析和以往研究结果一致,均证实了崖爬藤属、拟乌蔹莓属、乌蔹莓属、大麻藤属和苦蔹藤属为单系类群,承认了这些属的独立地位[10-12]。以往认为:浙江产的广义乌蔹莓属植物现分为2属:拟乌蔹莓属和乌蔹莓属,前者现知3种,分别为美丽拟乌蔹莓、白毛拟乌蔹莓和华东拟乌蔹莓,其中美丽拟乌蔹莓和白毛拟乌蔹莓在系统发育树上亲缘关系最近且无法区分,但在形态上后者叶柄、小叶柄、小叶片背面(至少中、侧脉上)均密被灰白色开展柔毛,有一定的区别,茎叶毛被作为种下等级处理较为合适。乌蔹莓属有6种,其中尖叶乌蔹莓和薄叶乌蔹莓在系统发育树上与乌蔹莓无法区分开,但在形态上,尖叶乌蔹莓小叶3 (稀4或5),中央小叶片具4~7对侧脉,边缘每侧有2~9 (12)浅钝齿,卷须不分枝(稀2分枝),花盘黄色,花后转白色;而薄叶乌蔹莓花盘黄色,花后转白色,果实幼时中上部常缢缩,呈乳头状、倒梨形或葫芦形,与乌蔹莓有明显区别。
-
综合考虑形态特征、种子形态和系统发育关系等多方面的证据,将薄叶乌蔹莓和白毛拟乌蔹莓分别作为乌蔹莓和美丽乌蔹莓的亚种处理,尖叶乌蔹莓归属发生改变,故作出如下组合。
-
Causonis japonica (Thunb.) Raf. subsp. tenuifolia (Wight et Arn.) X. F. Jin et Z. H. Chen, comb. et stat. nov. − Vitis tenuifolia Wight et Arn., Prodr Fl Ind Orient,1834, 1: 129. − Cayratia tenuifolia (Wight et Arn.) Gagnep., Notul Syst (Paris), 1911, 1: 348.
《中国植物志》第48卷第2分册[1]未对薄叶乌蔹莓作处理,而CHEN等[2]在Flora of China中将其处理为乌蔹莓的异名。从形态上看,薄叶乌蔹莓的花盘黄色,花后转白色,果实幼时中上部常缢缩,呈乳头状、倒梨形或葫芦形;乌蔹莓的花盘橙黄色,花后通常变为粉红色,浆果近球形。薄叶乌蔹莓主要分布在浙江滨海地区,乌蔹莓主要为山地分布。从系统发育关系树上看,薄叶乌蔹莓的3个个体嵌套于乌蔹莓的个体之中。本研究认为将薄叶乌蔹莓作为乌蔹莓的亚种处理较合适。
-
Causonis japonica (Thunb.) Raf. subsp. pseudotrifolia (W. T. Wang) Z. H. Chen, Y. F. Lu et X. F. Jin, comb. et stat. nov. —— Cayratia pseudotrifolia W. T. Wang, Acta Phytotax Sin, 1979, 17(3): 79. —— Cayratia japonica (Thunb.) Gagnep. var. pseudotrifolia (W. T. Wang) C. L. Li, Chin J Appl Environ Biol, 1996, 2(1): 51.
王文采[3]在发表新种尖叶乌蔹莓时,明确指出其为叶片3小叶,有时可为4或5小叶。李朝銮[6]将其作为乌蔹莓的变种处理,CHEN等[2]也采纳这个观点。从浙江的材料来看,小叶3,稀4或5,中央小叶片具4~7对侧脉,边缘每侧具2~9 (12)个浅锯齿,卷须不分枝,稀具2分枝,花盘黄色,花后变为白色;乌蔹莓的鸟足状复叶具5小叶,中央小叶片具5~9对侧脉,边缘每侧具6~12 (15)个锯齿,卷须具2或3分枝,花盘橙黄色,花后通常变为粉红色。系统发育树显示尖叶乌蔹莓的2个个体也嵌套于乌蔹莓种,故作为亚种处理,并作了转隶组合。
-
Pseudocayratia speciosa J. Wen et L. M. Lu subsp. pengiana (T. W. Hsu et J. Wen) Z. H. Chen, Y. F. Lu et X. F. Jin, comb. et stat. nov. —— P. pengiana T. W. Hsu et J. Wen, J Syst Evol, 2018, 56: 378.
WEN等[11]在建立新属拟乌蔹莓属时,共收录了2个新种和3个新组合种,认为新种P. pengiana与另一新种P. speciosa的区别在于叶片背面均被短柔毛,沿脉尤密。这与本研究所观察的完全一致(包括扫描电镜结果)。但当时系统发育分析时,P. pengiana仅1个个体,与本次研究结果不同。本研究增加了浙江的P. pengiana和P. speciosa各1个个体后发现,两者在系统树上无法区分。因此,将P. pengiana作为P. speciosa的亚种更为合理。
-
杭州植物园教授级高级工程师裘宝林先生指导并审阅全文,浙江清凉峰国家级自然保护区高级工程师张宏伟先生、代英超女士协助采集标本。在此一并致谢!
Taxonomic study of Cayratia s.l. from Zhejiang, China
-
摘要:
目的 分子系统学引发了广义乌蔹莓属Cayratia s.l. (葡萄科Vitaceae)的界定的一系列争议。以浙江广义乌蔹莓属植物为对象,采用多种不同证据进行综合分类研究。 方法 比较了种子形态、茎叶毛被特征,结合atpB-rbcL、trnC-petN、trnH-psbA和trnL-F等4个叶绿体基因片段的系统发育关系分析,探讨浙江广义乌蔹莓属的分类问题。 结果 浙江广义乌蔹莓属植物的茎、叶毛被有所不同,毛被类型(无毛、短柔毛和多节长柔毛)和疏密程度在种间有差异。乌蔹莓属Causonis Raf. 植物和拟乌蔹莓属Pseudocayratia J. Wen, L. M. Lu & Z. D. Chen植物种子胚乳横切面形态和背腹面洼穴形态有很大差异。前者种子胚乳横切M形,腹面洼穴倒狭卵形或倒狭卵状椭圆形,深凹;后者种子胚乳横切T型,腹面洼穴椭圆形,浅凹。基于4个叶绿体基因片段的系统发育树支持将浙江广义乌蔹莓属明显分为乌蔹莓属和拟乌蔹莓属2个属。 结论 基于形态和系统发育关系研究,将薄叶乌蔹莓Cayratia tenuifolia (Wight et Arn.) Gagnep.和尖叶乌蔹莓C. japonica var. pseudotrifolia (W. T. Wang) C. L. Li作为乌蔹莓C. japonica (Thunb.) Gagnep.的亚种,将白毛拟乌蔹莓Pseudocayratia pengiana Hsu et J. Wen作为美丽拟乌蔹莓P. speciosa J. Wen et L. M. Lu的亚种处理。图3表3参16 Abstract:Objective Molecular systematics have aroused a series of disputes on the classification of Cayratia s.l. (Vitaceae). Taking the species of Cayratia s.l. from Zhejiang Province as the research object, the present study aims to conduct a comprehensive classification research based on different evidences. Method The seed morphology and characteristics of stem and leaf indumentum were compared. Based on the phylogenetic analysis of four chloroplast gene fragments such as atpB-rbcL, trnC-petN, trnH-psbA and trnL-F, the classification of Cayratia s.l. from Zhejiang Province was discussed. Result The stem and leaf indumentum of Cayratia s.l. were different, and the type (glabrous, pubescent or multicellular-pilose) and density of the indumentum were different among species. There existed significant difference in the cross-sectional morphology and dorsal ventral infold morphology of endosperm between Causonis (M-shape in cross section, and ventral infolds narrowly obovate or obovate-elliptic, deeply concave) and Pseudocayratia (T-shape in cross section, and ventral infolds elliptic, shallowly concave). The phylogenetic tree supported the evidence that Cayratia s.l. in Zhejiang could be clearly divided into two genera: Causonis and Pseudocayratia. Conclusion Cayratia tenuifolia and C. japonica var. pseudotrifolia are treated as subspecies of C. japonica, and Pseudocayratia pengiana is treated as a subspecies of P. speciosa. [Ch, 3 fig. 3 tab. 16 ref.] -
Key words:
- Cayratia s.l. /
- Zhejiang /
- phylogeny /
- taxonomic treatment
-
表 1 材料来源
Table 1. Source of materials
物种 产地 凭证标本 角花乌蔹莓Causonis corniculata* 浙江苍南(Cangnan of Zhejiang) 谢文远(W. Y. Xie) CN18071806(HTC) 乌蔹莓C. japonica* 浙江杭州(Hangzhou of Zhejiang) 陈征海(Z. H. Chen) HZ18062501(HTC) 山地乌蔹莓C. montana* 浙江景宁(Jingning of Zhejiang) 陈征海,等(Z. H. Chen, et al.) JN18062003(HTC) 文采乌蔹莓C. wentsiana* 浙江文成(Wencheng of Zhejiang) 陈征海,等(Z. H. Chen, et al.) WC17061004(ZM) 尖叶乌蔹莓C. pseudotrifolia 浙江湖州(Huzhou of Zhejiang) 陈煜初(Y. C. Chen)无号 (HTC) 薄叶乌蔹莓Cayratia tenuifolia 浙江乐清(Yueqing of Zhejiang) 陈征海,等(Z.H. Chen, et al.) LQ001(HTC) 华东拟乌蔹莓Pseudocayratia orientalisinensis* 浙江临安(Lin’an of Zhejiang) 陈征海,等(Z.H. Chen, et al.) LA17061817(HTC) 白毛拟乌蔹莓P. pengiana 浙江龙泉(Longquan of Zhejiang) 金孝锋,等 (X. F. Jin, et al.) 4208 (HTC) 美丽拟乌蔹莓P. speciosa* 浙江天台(Tiantai of Zhejiang) 陈征海,等(Z. H. Chen, et al.) TT18060901 (HTC) 说明:带*为同时用于种子形态观察的材料;HTC为杭州师范大学植物标本馆代码缩写,ZM为浙江自然博物院植物标本馆代码 缩写 表 2 用于系统发育树构建的材料及各个基因的GenBank序列号
Table 2. Species and their Genbank accession numbers of DNA sequences used in the phylegenetic study
物种学名 atpB-rbcL trnC-petN trnH-psbA trnL-F Afrocayratia debilis (Baker) J. Wen & L. M. Lu KC166301 JF437189 JF437075 JF437295 Afrocayratia delicatula (Desc.) J.Wen & Z. D. Chen MT995939 MT995982 MT995964 MT995992 Afrocayratia gracilis (Guill. & Perr.) J.Wen & Z. D. Chen KC166306 KC166483 KC166559 KC166632 Afrocayratiai merinensis (Baker) J. Wen & L. M. Lu HM585520 JX476669 HM585663 HM585936 Afrocayratia longiflora (Desc.) J. Wen & Rabarijaona KC166307 KC166484 KC166560 KC166633 Afrocayratia triternata (Baker) J. Wen & Rabarijaona KC166324 KC166501 KC166575 KC166644 Causonis corniculata (Benth.) J. Wen & L. M. Lu MT104033 MT104056 MT104079 MT104102 Causonis japonica (Thunb.) Raf. [Wen 12103] KC166311 KC166487 KC166563 KC166636 Causonis japonica (Thunb.) Raf. [Wen 8537] KC166313 KC166488 KC166564 KC166637 Causonis japonica (Thunb.) Raf. [Nie & Meng 453] KC166308 KC166485 KC166561 KC166634 Causonis japonica (Thunb.) Raf. [Wen 12110] KC166309 KC166486 KC166562 KC166635 Causonis japonica (Thunb.) Raf. [Wen 9262] KC166310 JF437197 JF437083 JF437300 Causonis japonica (Thunb.) Raf. 1 [Z. H. Chen & al. XJ18060201] MT104049 MT104072 MT104095 MT104118 Causonis japonica (Thunb.) Raf. 2 [Z. H. Chen & al. XJ18060202] MT104050 MT104073 MT104096 MT104119 Causonis japonica (Thunb.) Raf. 3 [Z. H. Chen HZ18062501] MT104051 MT104074 MT104097 MT104120 Causonis montana Z. H. Chen, Y. F. Lu & X. F. Jin MT104029 MT104052 MT104075 MT104098 Causonis trifolia (L.) Raf. KC166323 KC166500 KC166574 AB235007 Causonis wentsaiana Z. H. Chen, F. Chen & X. F. Jin MT104039 MT104062 MT104085 MT104108 Cayratia acris (F. Muell.) Domin KT344149 KT344499 KT344234 KT344410 Cayratia albifolia C. L. Li var. glabra (Gagnep.) C. L. Li KC166294 KC166472 KC166549 KC166622 Cayratia cardiophylla Jackes KC428766 KC428790 KC428809 KC428824 Cayratia cheniana L. M. Lu & J. Wen KU167491 KU167493 KU167494 KU167495 Cayratia ciliifera (Merr.) Chun KC166296 KC166474 KC166551 KC166624 Causonis clematidea (F. Muell.) Jackes KC166297 KC166475 KC166552 KC166625 Cayratia cordifolia C. Y. Wu ex C. L. Li HM585518 JX476668 HM585661 HM585934 Cayratia emarginata Trias-Blasi & J. Parn. HQ214187 − − HQ214229 Cayratia geniculata (Blume) Gagnep. HM585519 KC166480 HM585662 HM585935 Cayratia grandifolia (Warb.) Merr. & L. M. Perry − KC428796 KC428815 KX951227 Cayratia lineata (Warb.) Merr. & L. M. Perry − KC428791 KC428810 KX951228 Cayratia maritima (Jackes) Jackes JQ182482 − JQ182533 JQ182576 Cayratia melananthera Gagnep. KC166316 KC166491 KC166566 KC166639 Cayratia mollissima (Wall.) Gagnep. HM585522 JX476671 HM585665 AB235003 Cayratia oligocarpa (H. Lév. & Vaniot) Gagnep. KC166319 KC166494 KC166569 KC166642 Cayratia pedata (Lam.) Gagnep. KC166321 KC166497 KC166572 AB235005 Cayratia pseudotrifolia W. T. Wang [Y. C. Chen s. n.] MT104046 MT104069 MT104092 MT104115 Cayratia pseudotrifolia W. T. Wang [Wen 8085] AB234920 KC166498 KC166573 AB235006 Cayratia tenuifolia Wright & Arn. 1 [Z. H. Chen & L. Chen LQ001] MT104043 MT104066 MT104089 MT104112 Cayratia tenuifolia Wright & Arn. 2 [Z. H. Chen & L. Chen LQ002] MT104044 MT104067 MT104090 MT104113 Cayratia tenuifoliaWright & Arn. 3 [Z.H. Chen & L. Chen LQ003] MT104045 MT104068 MT104091 MT104114 Cayratia wrayi (King) Gagnep. KC166326 KC166504 JQ182497 JQ182544 Cyphostemma bainesii (Hook.) Desc. AB234922 KC166506 KC166579 AB235025 Cyphostemma buchananii (Planch.) Desc. ex Wild & R.B. Drumm. KC166329 KX925943 KC166580 KC166648 Cyphostemma cyphopetalum (Fresen.) Desc. ex Wild & R.B. Drumm. KC166330 KC166507 KC166581 KC166649 Cyphostemma dehongense L. M. Lu & V. C. Dang KY660246 KY660236 KY660241 KY660251 Pseudocayratia orientalisinensis Z. H. Chen, W. Y. Xie & X. F. Jin MT104037 MT104060 MT104083 MT104106 Pseudocayratia pengiana Hsu & J. Wen [X. F. Jin & Y. F. Lu 4208-1] MT104042 MT104065 MT104088 MT104111 Pseudocayratia pengiana Hsu & J. Wen [Huang 458] MH253932 MH253934 MH253935 MH253936 Pseudocayratia speciosa J. Wen & L. M. Lu [Wen 11412] KC166376 KC166541 KC166615 KC166681 Pseudocayratia speciosa J. Wen & L. M. Lu [Z. H. Chen & al. XJ18600204] MT104031 MT104054 MT104077 MT104100 Pseudocayratia yoshimurae (Makino) J. Wen & V. C. Dang MH253937 MH253939 MH253940 MH253941 Tetrastigma bioritsense (Hayata) Hsu & Kuoh HM585548 JF437252 JF437140 HM585964 Tetrastigma campylocarpum (Kurz) Planch. HM585550 KX925955 HM585690 HM585966 Tetrastigma ceratopetalum C. Y. Wu HM585557 KC166538 HM585697 HM585973 Tetrastigma cf. tuberculatum (Blume) Latiff HM585559 KX925971 HM585699 HM585975 Tetrastigma curtisii (Ridl.) Suess. HM585563 − HM585703 HM585979 Tetrastigma cf. delavayi Gagnep. AB234932 KC166539 HM585705 AB235050 Tetrastigma diepenhorstii (Miq.) Latiff HM585567 − HM585707 HM585983 Tetrastigma ellipticum Merr. HM585569 − HM585709 HM585985 Tetrastigma hemsleyanum Diels & Gilg HM585584 JF437255 JF437143 HM586000 Tetrastigma jinghongense C. L. Li HM585590 JF437256 JF437144 HM586006 Tetrastigma lanyuense C. E. Chang HM585593 JF437257 JF437145 HM586009 Tetrastigma lawsoni (King) Burkill HM585599 − HM585737 HM586015 Tetrastigma laxum Merr. HM585602 − HM585740 HM586018 Tetrastigma obtectum (Wall. ex M. A. Lawson) Planch. ex Franch. HM585614 JF437266 JF437154 JF437349 Tetrastigma pachyphyllum (Hemsl.) Chun HM585615 KT344516 HM585752 HM586031 Tetrastigma papillosum (Blume) Planch. HM585617 − HM585754 HM586033 Tetrastigma pedunculare (Wall. ex M. A. Lawson) Planch. HM585620 KX925967 HM585757 HM586036 Tetrastigma planicaule (Hook. f.) Gagnep. HM585622 KC166540 HM585759 HM586037 Tetrastigma rumicispermum (M. A. Lawson) Planch. HM585626 − HM585763 HM586041 Tetrastigma serrulatum (Roxb.) Planch. HM585627 JF437261 JF437149 HM586042 Tetrastigma strumarum (Planch.) Gagnep. HM585641 − HM585778 HM586056 Tetrastigma trifoliolatum Merr. HM585643 − HM585780 HM586058 Tetrastigma triphyllum (Gagnep.) W. T. Wang HM585646 JF437263 JF437151 HM586061 说明:−为美国国家生物信息中心(NCBI)中暂无此种的序列 表 3 浙江乌蔹莓属和拟乌蔹莓属6种植物种子形态
Table 3. Seed morphology of six species of Causonis and Pseudocayratia from Zhejiang
种名 测量数 形状 大小(长×宽)/(mm×mm) 背面 腹面 洼穴 横切面 角花乌蔹莓 10 宽倒卵形 (4.55±0.28)×(4.04±0.23) 具横棱纹 中棱脊突出,两侧具洼穴 倒狭卵状椭圆形,深凹 M型 乌蔹莓 10 宽倒卵形 (4.71±0.37)×(3.58±0.16) 具横棱纹 中棱脊突出,两侧具洼穴 倒狭卵形,深凹 M型 山地乌蔹莓 10 宽倒卵形 (4.64±0.23)×(3.91±0.23) 具横棱纹 中棱脊突出,两侧具洼穴 倒狭卵状椭圆形,深凹 M型 文采乌蔹莓 10 宽倒卵形 (4.06±0.17)×(3.52±0.37) 具横棱纹 中棱脊突出,两侧具洼穴 倒狭卵状椭圆形,深凹 M型 华东拟乌蔹莓 10 宽倒卵形 (6.92±0.36)×(5.63±0.24) 无横棱纹 中棱脊突出,两侧具洼穴 椭圆形,浅凹 T型 美丽拟乌蔹莓 10 宽倒卵形 (5.81±0.29)×(5.00±0.19) 无横棱纹 中棱脊突出,两侧具洼穴 椭圆形,浅凹 T型 -
[1] 中国科学院中国植物志编辑委员会. 中国植物志: 第48卷[M]. 北京: 科学出版社, 1998. Editorial Committee of Flora Reipublicae Popularis Sinicae, Chinese Academy of Sciences. Flora Reipublicae Popularis Sinicae: Vol. 48[M]. Beijing: Science Press, 1998. [2] CHEN Zhiduan, REN Hui, WEN Jun, et al. Flora of China: Vol. 12[M]. Beijing: Science Press, 2007. [3] 王文采. 葡萄科的新发现[J]. 植物分类学报, 1979, 17(3): 73 − 96. WANG Wencai. Vitacea rum novitates [J]. Acta Phytotaxonmica Sin, 1979, 17(3): 73 − 96. [4] 浙江植物志编辑委员会. 浙江植物志: 第4卷[M]. 杭州: 浙江科学技术出版社, 1993. Editorial Committee of Flora of Zhejiang. Flora of Zhejiang: Vol. 4[M]. Hangzhou: Zhejiang Science and Technology Publishing House, 1993. [5] 丁炳扬, 洪林. 浙江植物区系增补[J]. 杭州大学学报(自然科学版), 1997, 24(3): 275 − 276. DING Bingyang, HONG Lin. Additions to the flora of Zhejiang [J]. J Hangzhou Univ Nat Sci, 1997, 24(3): 275 − 276. [6] 李朝銮. 中国葡萄科植物新分类群[J]. 应用与环境生物学报, 1996, 2(1): 43 − 53. LI Chaoluan. New taxa in Vitaceae from China [J]. Chin J Appl Environ Biol, 1996, 2(1): 43 − 53. [7] 郑朝宗. 浙江种子植物检索鉴定手册[M]. 杭州: 浙江科学技术出版社, 2005. ZHENG Chaozong. Key to Seed Plants from Zhejiang[M]. Hangzhou: Zhejiang Science and Technology Publishing House, 2005. [8] 陈贤兴, 周庄, 胡仁勇, 等. 浙江维管植物新纪录[J]. 温州大学学报(自然科学版), 2013, 34(1): 54 − 56. CHEN Xianxing, ZHOU Zhuang, HU Renyong, et al. Three new records of vascular plants in Zhejiang Province [J]. J Wenzhou Univ Nat Sci, 2013, 34(1): 54 − 56. [9] LU Limin, WANG Wei, CHEN Zhiduan, et al. Phylogeny of the non-monophyletic Cayratia Juss (Vitaceae) and implications for character evolution and biogeography [J]. Mol Phylogenet Evol, 2013, 68: 502 − 515. [10] WEN Jun, LU Limin, NIE Zelong, et al. A new phylogenetic tribal classification of the grape family (Vitaceae) [J]. J Syst Evol, 2018, 56(4): 262 − 272. [11] WEN Jun, LU Limin, HSU T W, et al. Pseudocayratia, a new genus of Vitaceae from China and Japan with two new species and three new combinations [J]. J Syst Evol, 2018, 56(4): 374 − 393. [12] RABARIJAONA R N, DANG V C, PARMAR G, et al. Phylogeny and taxonomy of Afrocayratia, a new genus of Vitaceae from continental Africa and Madagascar [J]. J Syst Evol, 2020, 58(6): 1090 − 1107. [13] CHEN Zhenghai, CHEN Feng, LU Yifei, et al. Three new species of Cayratia-like genera (Vitaceae) from Zhejiang, East China [J]. Phytotaxa, 2020, 475(4): 253 − 266. [14] SOEJIMA A, WEN Jun. Phylogenetic analysis of the grape family (Vitaceae) based on three chloroplast markers [J]. Am J Bot, 2006, 93(2): 278 − 287. [15] CHEN Pingting, CHEN Longqing, WEN Jun. The first phylogenetic analysis of Tetrastigma (Miq. ) Planch., the host of Rafflesiaceae [J]. Taxon, 2011, 60(2): 499 − 512. [16] REN Hui, LU Limin, SOEJIMA A, et al. Phylogenetic analysis of the grape family (Vitaceae) based on the noncoding plastid trnC-petN, trnH-psbA, and trnL-F sequences [J]. Taxon, 2011, 60(3): 629 − 637. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210751







 下载:
下载: