-
由于经济快速发展和环境基础设施建设滞后,城市河流受到了不同程度的污染,黑臭已成为城市河流的一种普遍现象,严重影响了城市的可持续发展[1]。雨水管和污水管的混接和搭接,导致污水经由雨水管排入河流,为大部分城区河流黑臭的主要原因[2]。原位生物修复技术通过曝气增氧、投加微生物菌剂、构建生态浮床等技术对河水进行治理,因具有经济安全、对水生态系统扰动小、利于提高水体自净能力等优点,在污染河流修复中得到了广泛的应用[3-5],但对于污水排入量大、黑臭严重的河流,常规原位修复技术因注重于整体治理,实际投资过大,且效果不甚显著[6]。以河流空间为处理场所,对排入河道的主要污染源进行就地治理与控制将有效降低其对主河段的污染程度,其技术与方法逐渐成为河流原位修复的研究热点[7-8]。上庄河地处温州市蒲州街道,西北向与屿田河交界,东南向与石坦河和三郎桥河相交,全长1 300.0 m,平均宽度58.0 m,平均深度1.8 m。河水一般不流动,由于大量生活污水和工业废水及其尾水经雨水管网排入,导致河水发黑发臭,且水面泡沫较多,严重影响了两岸居民的正常生产生活;2009年上半年上庄河化学需氧量和氨氮平均为78.3 mg·L-1和16.7 mg·L-1。经污染源排查,上庄河与屿田河交汇处有一直径为1 200.0 mm的雨水管,污水流量约为900.0 m3·d-1,为上庄河最大的污染源。为了控制该雨水管所排污水对河水的污染,本试验在雨水管出水口周围构建了软隔离原位生物修复区,研究了污水经原位生物修复处理后,污水及河水溶解氧、化学需氧量、氨氮、总氮及总磷的动态变化,以期为污染河水原位生物修复提供参考和借鉴。
-
浮水植物李氏禾Leersia hexandr和粉绿狐尾藻Myriophyllum aquaticum均采自浙江温州。聚乙烯经编无结渔网,网目为0.5 cm。NOZZLE-A2200强力造流曝气机,功率为2.2 kW,循环通量为615.0 m3·h-1,溶氧(O2)能力为4.1 kg·h-1。生物漂带[9]宽5.0 cm,长度与河水深度一致。
-
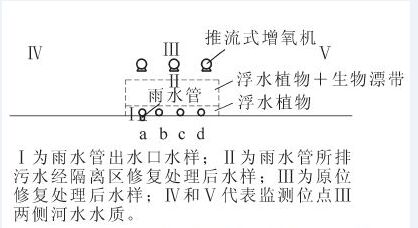
试验区河宽为65.0 m,均深2.5 m。采用2层渔网将直通河道的雨水管出水口围隔在内(图 1),构成原位生物修复区(120.0 m×20.0 m);近岸5.0 m区域内种植浮水植物李氏禾,构成浮水植物区;浮水植物+生物漂带区内,生物漂带间距为15.0 cm,水面种植粉绿狐尾藻。采用4支直径为150 mm的聚氯乙烯(PVC)管将雨水管中的污水引至a,b,c,d等4个点,间距均为24.0 m,使雨水管中的污水均匀分配至原位修复区域。原位处理区外10.0 m左右平行安装3台强力造流曝气机,间距均为50.0 m,曝气机运行12.0 h·d-1,工作时间为20:00至次日8:00。渔网围隔、浮水植物种植、生物漂带安装于2011年4月实施完毕,待李氏禾和粉绿狐尾藻长满隔离区后,开始实施水质监测。
-
水质监测位点如图 1所示。其中:Ⅰ为雨水管出水口水样;Ⅱ代表雨水管所排污水经隔离区修复处理后水样,位于近河中心渔网内侧0.5 m处;Ⅲ代表原位修复处理后水样;Ⅳ和Ⅴ代表河水水质,分别位于监测位点Ⅲ两侧150.0 m处;Ⅲ,Ⅳ和Ⅴ监测位点均处于河道中心线。水质监测于2011年7月10日开始,连续监测100 d;隔5 d于上午10:00采用500.0 mL采样瓶采集水面下30.0 cm处水样,并于当天测定各项指标。化学需氧量、氨氮、总氮和总磷参照废水监测分析方法(第4版);溶解氧采用HI9147-04便携式溶解氧测定仪现场测定;硝态氮采用美国戴安ICS1500型离子色谱仪测定。
-
所有实验数据均为3个平行样均值。采用Excel 2007对数据进行分析和作图。
-
上庄河两岸分布着人造革厂、制笔厂、钢管厂等多家企业,部分生活污水、工业废水及其尾水经雨水管排入上庄河,由于有机污染物的耗氧作用,导致河水溶解氧接近于0而出现黑臭。由于浮水植物的根际泌氧作用[10],试验期间测得浮水植物区水面下30.0 cm处溶解氧平均为0.87 mg·L-1,高于雨水管所排污水溶解氧平均值0.26 mg·L-1(图 2)。原位修复区溶解氧较低,说明水生植物虽然能一定程度上提高水体的溶解氧,但其提高量有限,宜结合人工增氧。污水经浮水植物区和浮水植物+生物漂带区处理后,经软隔离渔网进入河道,在强力曝气增氧机的作用下,河水溶解氧升高至4.40~5.98 mg·L-1。曝气增氧机的运行时间为20:00至次日8:00,溶解氧测定于10:00进行。因此,2.0 h内溶解氧并未显著下降,仍平均可达5.50 mg·L-1,表明河水中大部分有机污染物为耗氧速率慢的难降解污染物质[11]。监测位点Ⅳ和Ⅴ周围溶解氧值平均为1.93 mg·L-1和1.89 mg·L-1,接近GB 3838-2002《地表水环境质量标准》之Ⅴ类水标准的2.0 mg·L-1。
-
污水化学需氧量为100.20~178.80 mg·L-1时,经浮水植物区和浮水植物+生物漂带区处理后,化学需氧量降为43.40~62.70 mg·L-1,平均去除率为63.8%(图 3)。浮水植物区近岸约1.8 m宽区域水深较浅,李氏禾扎根于底泥中,构成了120.0 m × 1.8 m的近岸植物带,由于李氏禾根茎及其上负载的生物膜的过滤截留及吸附吸收作用[12],污水中大部分悬浮物得以截留,部分难溶化学需氧量为生物膜所吸附。污水经浮水植物区处理后,进入浮水植物+生物漂带区,其上层为粉绿狐尾藻,下层为比表面积达5 000.0 m2·m-3的软性悬浮载体即生物漂带,上部由于粉绿狐尾藻的根际泌氧作用及河中心高浓度溶解氧的扩散作用,表层处于好氧和兼氧状态;下部则由于生物漂带负载生物膜的耗氧作用处于厌氧状态;污水经浮水植物区的过滤截留、吸附吸收作用及浮水植物+生物漂带区的上部好氧、兼氧和下部厌氧的共同作用[13],化学需氧量降低显著。若将隔离区看作污水处理设施,则水力停留时间为6.67 d时,对于化学需氧量为100.20~178.80 mg·L-1的污水,采用水生植物和微生物联合处理后,化学需氧量平均降至50.36 mg·L-1。
在河水的稀释作用及河水中土著细菌的作用下,位点Ⅲ处化学需氧量进一步降低为29.70~38.80 mg·L-1,稳定达到GB 3838-2002《地表水环境质量标准》之Ⅴ类水标准,即化学需氧量<40.00 mg·L-1。监测位点Ⅳ和Ⅴ 化学需氧量分别为28.50~36.70 mg·L-1和31.60~41.30 mg·L-1,表明雨水管排出污水基本得到有效控制,并未对主体河段水质产生显著影响。监测位点Ⅴ处化学需氧量略高于位点Ⅳ,说明位点Ⅴ周围河段存在其他潜在污染源或底泥对上覆水体的污染较为严重。
-
污水氨氮和总氮分别为10.50~17.89 mg·L-1和12.15~21.47 mg·L-1时,由于李氏禾和粉绿狐尾藻的吸收作用及其根系负载生物膜的硝化作用,氨氮和总氮分别降低为3.12~7.21 mg·L-1和3.19~6.16 mg·L-1(图 4~5),平均去除率分别达70.26%和71.41%。监测位点Ⅱ处硝态氮平均为0.42 mg·L-1,由于隔离区表层溶解氧较低,说明氨氮的去除并非微生物的好氧硝化作用;氨氮/总氮平均达91.06%,表明污水中氮的去除主要为植物的吸收作用[14]。监测位点Ⅱ,Ⅲ,Ⅳ和Ⅴ氨氮平均分别为4.29,3.41,3.10和3.34 mg·L-1,总氮平均分别为4.70,4.43,4.37和4.41 mg·L-1,位点Ⅴ氨氮和总氮均较位点Ⅳ略高;位点Ⅲ氨氮和总氮分别较位点Ⅱ降低了20.51%和5.74%,氨氮降低的比例较大,而监测位点Ⅲ溶解氧较高,说明该河段氨氮的去除主要为微生物的硝化作用[15]。由于河水的稀释及扩散作用,位点Ⅳ和Ⅴ氨氮和总氮略有降低,进一步说明位点Ⅴ周围河段存在其他潜在污染源或底泥对上覆水体的污染较为严重。污水经原位修复处理后,同GB 3838-2002《地表水环境质量标准》之Ⅴ类水标准要求的氨氮和总氮均小于2.00 mg·L-1相比,仍存在一定差距,表明污水经本试验原位修复处理氨氮和总氮尚不能达到Ⅴ类水标准,有待采取其他措施进行强化。
-
污水经隔离区处理后,总磷由2.24~2.62 mg·L-1降低为0.24~0.43 mg·L-1,平均为0.36 mg·L-1(图 6),达GB 3838-2002《地表水环境质量标准》之Ⅴ类水标准,即总磷<0.40 mg·L-1;总磷的去除主要有微生物同化和植物吸收2种途径,隔离区溶解氧较低,故该区中总磷的去除主要为植物的吸收作用[16]。监测位点Ⅲ,Ⅳ和Ⅴ总磷平均为0.29,0.28和0.25 mg·L-1;位点Ⅲ周围河水中溶解氧较高,由于微生物的同化作用,位点Ⅲ较位点Ⅱ平均降低了19.44%;在河水的稀释作用下,位点Ⅳ和Ⅴ较位点Ⅲ总磷有所降低,均小于0.30 mg·L-1,表明经雨水管排入河道的总磷得到了有效控制,主体河段水质未受直接经由软隔离渔网进入的总磷所污染。
-
对于经由雨水管排入温州上庄河的化学需氧量、氨氮、总氮和总磷分别为100.2~178.8,10.50~17.89,12.15~21.47和2.19~3.17 mg·L-1的污水,采用渔网、浮水植物和生物漂带构建软隔离区结合人工增氧进行原位修复处理,主体河段溶解氧、化学需氧量和总磷平均为5.50,33.05和0.29 mg·L-1,达GB 3838-2002《地表水环境质量标准》之Ⅴ类水标准;氨氮和总氮平均为3.41 mg·L-1和4.43 mg·L-1。
隔离区内河水溶解氧由0.26 mg·L-1升至0.87 mg·L-1。隔离区外在强力曝气增氧机的作用下,河水溶解氧升至4.40~5.98 mg·L-1。因此,单一依靠植物作用不能有效提高河水溶解氧,仍需借助人工增氧;通过浮水植物根系过滤截留、吸附吸收和微生物降解作用,化学需氧量平均降至50.36 mg·L-1,去除率达63.8%。
隔离区氮的去除主要为植物吸收氨氮,氨氮和总氮的平均去除率达70.26%和71.41%,经曝气区好氧微生物硝化作用,氨氮和总氮进一步降低20.51%和5.74%;隔离区内总磷的去除也主要为植物的吸收作用,处理后总磷平均降为0.36 mg·L-1,去除率达85.1%,曝气区微生物的同化作用使总磷平均降低19.44%。
An in situ remediation test for polluted water in the Shangzhuang River
-
摘要: 采用渔网、浮水植物(李氏禾Leersia hexandr,粉绿狐尾藻Myriophyllum aquaticum)和生物漂带构建软隔离区,结合人工增氧对浙江省温州市上庄河经雨水管排放污水进行原位处理。结果表明:污水化学需氧量、氨氮、总氮和总磷分别为100.20~178.80,10.50~17.89,12.15~21.47和2.19~3.17 mg·L-1,处理后主体河段溶解氧、化学需氧量和总磷平均为5.50,34.3和0.29 mg·L-1,达GB 3838-2002《地表水环境质量标准》之Ⅴ类水标准;氨氮和总氮平均为3.41和4.43 mg·L-1。软隔离区内氮的去除主要为植物吸收氨氮,氨氮和总氮的平均去除率达70.26%和71.41%,曝气区好氧微生物的硝化作用使氨氮和总氮进一步下降20.51%和5.74%;总磷的去除主要通过软隔离区内植物的吸收作用和曝气区微生物的同化作用,原位修复处理后总磷平均降至0.29 mg·L-1,去除率达88.1%。Abstract: The objective of this work is to find a feasible approach for in situ remediation of main sources of river pollution. An isolated research area constructed of fishing nets, floating plants (Leersia hexandra,and Myriophyllum aquaticum),and biological belts coupled with artificial aeration was used for in situ remediation of sewage from rainwater pipes in the Shangzhuang River,Zhejiang Province. Water samples were collected every day and analyzed for water quality properties including dissolved oxygen (DO),chemical oxygen demand (COD),ammonium nitrogen (NH4+-N),total nitrogen (TN),and total phosphorus (TP) over a 100-day period. Results showed that when sewage concentrations were COD (100.20-178.80 mg·L-1), NH4+-N (10.50-17.89 mg·L-1),TN (12.15-21.47 mg·L-1),and TP (2.19-3.17 mg ·L-1),average after-treatment concentrations (in mg·L-1) for the main section dropped to DO of 5.50,COD of 34.3,and TP of 0.29,which were the fifth class for the national surface water quality standard;whereas NH4+-N was 3.41 mg·L-1 and TN was 4.43 mg·L-1. In the isolated research area,floating plants were directly responsible for N losses due to uptake of NH4+-N with the removal efficiencies of NH4+-N reaching 70.26% and TN being 71.41%. However,in the aerated field,N loss was mainly attributed to nitrification of bacteria,which accounted for 20.51% removal of NH4+-N and 5.74% removal of TN;uptake of floating plants and assimilation of bacteria removed TP with concentrations dropping to 0.29 mg·L-1 and removal efficiency reaching 88.1%. Thus,the isolated area constructed of fishing nets,floating plants,and biological belts coupled with artificial aeration could be an alternative for in situ remediation of main sources of river pollution.
-
Key words:
- ecology /
- Shangzhuang River /
- polluted river water /
- in situ remediation /
- Leersia hexandra /
- Myriophyllum aquaticum
-
-
[1] HENRY C P,AMOROS C,ROSET N. Restoration ecology of river in wetlands:a 5 year post-operation survey on the Rhone River,France[J]. Ecol Eng,2002,18:543-554. [2] 李青,孙夏平,陈晓宏,等. 广州市石井河受污染水体修复中试研究[J]. 中山大学学报:自然科学版,2008,47(2):131-135. LI Qing,SUN Xiaping,CHEN Xiaohong,et al. Pilot-scale study on restoring polluted river water in the Shijing River, Guangzhou City[J]. Acta Sci Nat Unive Sunyatseni,2008,47(2):131-135. [3] 卢晓明,张勇,陈建军. 连续曝气下河水水质及睡莲生理响应的季节变化[J]. 环境工程学报, 2010,4(9):1978-1984. LU Xiaoming,ZHANG Yong,CHEN Jianjun. Seasonal variation of river water qualities and physiological responses of Nymphaea tetragona L. under continuous aeration[J]. Chin J Environml Eng,2010,4(9):1978-1984. [4] 黎贞,卫晋波,任随周,等. 生物制剂对城市黑臭河涌的原位修复技术[J]. 环境科学与技术, 2010,33(12F):435-439. LI Zhen,WEI Jinbo,REN Suizhou,et al. Recent progress of biological preparations for in situ remediation of urban black-odor river[J]. Environ Sci & Technol,2010,33(12F):435-439. [5] 李先宁,宋海亮,朱光灿,等. 组合型生态浮床的动态水质净化特性[J]. 环境科学,2007,28(11):2448-2452. LI Xianning,SONG Hailiang,ZHU Guangcan,et al. Characteristic of combined floating bed ecosystem for water purification under dynamic condition[J]. Environ Sci,2007,28(11):2448-2452. [6] PEDERSEN M L, ANDERSEN J M, NIELSEN K,et al. Restoration of Skjern River and its valley:project description and general ecological changes in the project area[J]. Ecol Eng,2007,30(2):131-144. [7] FARIA M S,LOPES R J,MALCATO J,et al. In situ bioassays with Chironomus riparius larvae to biomonitor metal pollution in rivers and to evaluate the efficiency of restoration measures in mine areas[J]. Environ Pollut,2008,151(1):213-221. [8] 肖继波,王慧明,褚淑祎,等. 生态槽净化污染河水的动态试验研究[J]. 水土保持学报,2012, 26(2):220-223. XIAO Jibo,WANG Huiming,CHU Shuyi,et al. Dynamic test-study of eco-tank on polluted river purification[J]. J Soil Water Conserv,2012,26(2):220-223. [9] 肖继波,蒋凯凤,吴加伟. 生物漂带接触氧化处理废纸造纸废水[J]. 中国造纸,2009,28(9):38-42. XIAO Jibo,JIANG Kaifeng,WU Jiawei. Study on bio-contact oxidation reactor treatment of wastewater from recycled paper mill[J]. China Pulp & Paper,2009,28(9):38-42. [10] 吴海明,张建,李伟江,等. 人工湿地植物泌氧与污染物降解耗氧关系研究[J]. 环境工程学报,2010,4(9):1974-1977. WU Haiming,ZHANG Jian,LI Weijiang,et al. Relationship between oxygen release from plants in constructed wetland and oxygen demand for pollutant degradation[J]. Chin J Environ Eng, 2010,4(9):1974-1977. [11] 高尚,黄民生,吴林林,等. 生物净化槽对黑臭河水净化的中试研究[J]. 中国环境科学,2008,28(5):433-437. GAO Shang,HUANG Minsheng,WU Linlin,et al. The control test-study of biological purification tank on malodorous river water purification[J]. China Environ Sci,2008,28(5):433-437. [12] 李睿华,管运涛,何苗,等. 河岸混合植物带处理受污染河水中试研究[J]. 环境科学,2006, 27(4):651-654. LI Ruihua,GUAN Yuntao,HE Miao,et al. Pilot-scale study on riparian mixed plant zones treating polluted river water[J]. Environ Sci,2006,27(4):651-654. [13] 向律成,郝虎林,杨肖娥,等. 多年生漂浮植物对富营养化水体的响应及净化效果研究[J]. 水土保持学报,2009,23(5):152-155,194. XIANG Lücheng,HAO Hulin, YANG Xiaoe,et al. Response and purification of perennial floating plants in eutrophic waterbody[J]. J Soil Water Conserv,2009,23(5):152-155,194. [14] 吴湘,杨肖娥,李廷强,等. 漂浮植物对富营养化景观水体的净化效果研究[J]. 水土保持学报,2007,21(5):128-132. WU Xiang,YANG Xiaoe,LI Tingqiang,et al. Study on purified efficiency of phosphorus and nitrogen from eutrophicated sight water by several floating macrophytes[J]. J Soil Water Conserv,2007,21(5):128-132. [15] 赵丰,卢晓明,黄民生,等. 净化槽水质改善与植物生理日变化关系的研究[J]. 华东师范大学学报:自然科学版,2010(2):50-57. ZHAO Feng,LU Xiaoming,HUANG Minsheng,et al. Study on the relationship between water quality improvement and Nymphaea tetragona physiological diurnal variation in purification tanks[J]. J East China Norm Univ Nat Sci, 2010(2):50-57. [16] 刘士哲,林东教,唐淑军,等. 利用漂浮植物修复系统栽培风车草、彩叶草和茉莉净化富营养化污水的研究[J]. 应用生态学报,2004,15(7):1261-1265. LIU Shizhe,LIN Dongjiao,TANG Shujun,et al. Purification of eutrophic wastewater by Cyperus alternfolius,Coleus blumei and Jasminum sambac planted in a floating phytoremediation system[J]. Chin J Appl Ecol,2004,15(7):1261-1265. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2014.01.016







 下载:
下载: