-
木材构造特征是木材识别的主要依据[1], 包括宏观构造、微观构造和超微构造, 对木材化学、物理性质有重大影响, 也是木材分类的主要依据, 因此国内外木材研究学者对木材构造特征进行了广泛的研究, 如1992年出版的《中国木材志》收录了528种代表树种的木材构造特征。此后, 又对《中国木材志》未涉及到的部分树种的木材构造特征进行研究[2-3]。挥发性有机物成分是指植物通过次生代谢所产生的产物[4], 与植物对环境的适应能力[5]及其抵抗不利条件[6]密切相关, 其药用和生态价值极高。如萜类化合物[7-8]通常具有调节神经系统、镇静大脑、抗菌消炎和净化空气等作用。吴楚材等[9]从植物体中采集挥发性气体进行化学成分研究。近年来随着气相色谱-质谱联用(GC-MS)技术的发展, 对木材挥发物的研究逐渐增多, 如孙继平等[10]探讨了2种肤小蠹Phloeosinus对几种针叶树挥发物的行为反应; 徐磊等[11]分析了5种针叶树球果所含挥发性物质与丽江球果花蝇Strobilomyia lijiangensis危害关系; 李阳等[12]测定分析了4种樟科Lauraceae园林树种挥发性物质的有效成分及其杀菌能力。黑壳楠Lindera megaphylla为樟科山胡椒属Lindera多年生常绿乔木, 观赏性强, 抗逆性好, 分布范围广, 枝、果、叶所含芳香油具备杀菌、驱虫和净化空气等功效, 是一种集观赏、生态和药用于一体的优质园林树种[13-14]。中国民间用其抽提物抗肿瘤和愈合伤口, 用其根治风湿麻木、胃寒气滞, 用其树皮治疗咽喉肿痛、湿疹瘙痒、外伤出血等[15]。卞京军等[16]研究了黑壳楠树叶精油的有机物成分, 分离鉴定出有机物成分87种。国外日本学者从黑壳楠的根中提取出d-荷苞牡丹碱(d-dicentrine), 发现它具有抗肿瘤作用[17], 同时还从花和花梗中分离出6个阿朴菲型生物碱[18]和1个新异喹啉生物碱[19]。未检索到国内外关于其木质部挥发性有机物成分的研究报道。另外, 木材构造特征作为区分黑壳楠木材与其他木材的重要理论依据, 也未见报道。因此本研究拟通过研究黑壳楠木材的构造特征, 以期为区分黑壳楠与其他木材提供重要的理论依据, 并采用GC-MS技术分析黑壳楠木材挥发性有机物成分的主要组分, 为科学评定和深层次开发利用黑壳楠资源提供科学依据。
-
所选黑壳楠活立木树龄约100 a, 胸径为1.79 m, 直径为0.54 m, 取样处离地高度1.3 m, 沿树干东、西、南、北4个方向用树木生长锥(长500 mm, 直径5.15 mm)钻取4根木芯样(钻取至树干髓心), 用密封袋密封处理(标记东、南、西、北方向)后, 带回实验室。取样点位于四川省雅安市云峰寺后山, 海拔为1 024.2 m, 29°76′N, 102°87′E; 东邻成都平原, 西接青藏高原, 地处高原东南麓陡峭坡地边缘; 气候类型是以亚热带季风气候为基带的山地气候, 气候温和, 雨量充沛; 1961-2010年雅安市年平均气温为16.2 ℃, 年平均降水量为1 270.9 mm[20]。
-
取南、北向木芯样, 砂纸打磨后, 分别在肉眼、放大镜和手持显微镜下观察黑壳楠木芯样生长轮、管孔、轴向薄壁组织、木射线、纹理、构造等宏观特征。标记南、北向木芯样的生长轮, 以每20轮龄为梯度截断木芯样, 取经过编号的5支试管, 分别盛少量蒸馏水, 加入5段截断后的木芯样, 置入水浴锅内蒸煮至木材软化, 软化后的木材用TU-231大型滑走式切片机切片, 参照《木材鉴别方法通则》[21]制片, 风干后放在OLYMPUS BX51光学显微镜下观察其微观构造并拍摄照片; 用冰醋酸-过氧化氢法进行离析, 并制备临时性试片, 在显微镜下拍摄图片, 利用计算机图像测量分析系统测量木材的构造特征参数和组织比量, 并利用JSM-6490LV扫描电子显微镜观察黑壳楠木材超微观构造特征, 补充完善其微观构造特征。
-
取黑壳楠东、西向木芯样, 粉碎, 取≤30目的样品(4.0 ± 0.1) g置于萃取瓶中, 将固相微萃取手柄插入瓶中, 伸出萃取头, 在85 ℃下(能够最大限度检测其挥发性有机物成分化学成分的最佳温度)保温40 min; 退回萃取头, 拔出SPME手柄, 得其挥发性有机物成分样品。解析时间为3 min。将挥发性有机物成分经过GC-MS分析后, 把分离化合物质谱数据经计算机检索与质谱库相匹配, 并以人工解析为辅, 利用色谱峰面积归一化法计算各化学成分的相对百分含量。①色谱条件:HP-INNOWax毛细管色谱柱(柱长30 m, 内径0.25 mm, 膜厚0.25 um); 进样量为1 μL, 分流比50:1;进样口温度为250 ℃; 载气为高纯氦气; 柱温箱升温程序:120 ℃保持3 min, 以5 ℃·min-1速率升温到140 ℃保持4 min, 以2 ℃·min-1速率升温到160 ℃保持10 min; 流速:1 mL·min-1[22]。②质谱条件:离子源为EI, 电离能70 eV, 辅助加热区为280 ℃, 离子源230 ℃, 四级杆150 ℃, 采集模式为全扫描, 质量扫描范围50~550, 溶剂延迟3 min[22]。
-
黑壳楠树皮灰褐色至灰黑色, 木材呈黄白色或浅灰绿色, 心边材区分不明显; 木材表面有较弱光泽; 气微香, 味略辛; 木材纹理直至斜, 木材构造细腻且均匀; 生长轮不明显至略明显; 心材轮间细线颜色较边材轮间细线颜色深; 散生; 宽度较均匀, 3~8轮·cm-1; 横切面上管孔肉眼下略可见, 放大镜下明晰, 大小略一致, 分布均匀, 散生; 管孔内少见侵填体; 轴向薄壁组织放大镜下可见, 稀疏傍管状; 横切面上木射线在肉眼下可见至不可见, 在放大镜下明显, 比管孔小。在放大镜下弦切面木射线明显, 径切面上射线斑纹明显。波痕及胞间道缺如。
-
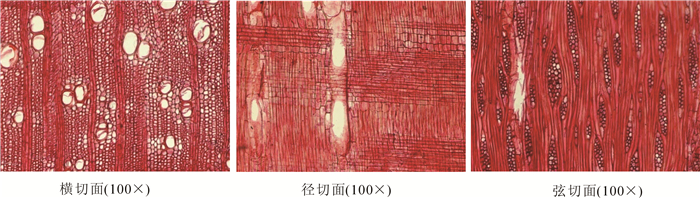
如图 1所示:导管横切面为圆形或卵圆形, 部分略具多角形轮廓; 管孔数少[23], 9~13个·mm-2, 平均为11个·mm-2; 管孔组合以单管孔和短径列(2~3个)复管孔为主, 偶见短弦列(2个)复管孔和管孔团; 散孔材; 管孔中[23], 最大弦径≥150 μm, 多数为90~110 μm, 平均为102 μm; 导管分子长255~596 μm, 平均446 μm, 导管长度属于中级别[23]; 导管细胞壁厚, 为7.5 μm; 导管细胞端部的穿孔类型为单穿孔, 穿孔板水平至略倾斜; 相邻导管间细胞壁上纹孔的排列形式为互列纹孔; 导管-射线间纹孔式为同管间纹孔式和大圆形; 纹孔口内含, 卵圆形及圆形; 轴向薄壁组织量少, 傍管形稀疏状为主, 可见环管状; 边材侵填体少见, 心材侵填体较边材多; 横切面上木纤维细胞壁较薄, 壁厚为3.7 μm, 直径多为20~26 μm, 平均23 μm, 长740~1 450 μm, 平均1 110 μm, 与邓恩桉Eucalyptus dunni木材纤维[24]同属中等木纤维[23]; 形状大多呈扁圆形、多角形; 弦向腔径略大于径向; 细胞沿径向排列整齐有序, 弦向上呈交错排列, 较松散; 木射线非叠生, 稀少[23], 5 mm内25~32条, 平均28条; 单列射线极少, 宽15~25 μm, 高36~312 μm(2~7个细胞); 多列射线宽度细至中[23], 宽32~68 μm(2~3个细胞), 高136~864 μm(3~31个细胞); 同一射线内间或出现2次多列部分; 射线组织异型Ⅲ型和Ⅱ型; 油细胞未见; 树胶及晶体未见; 螺纹加厚缺如; 胞间道缺如。
组织比量是衡量木材材性的重要参数, 与木材物理性质、力学性质和化学性质都有着密切的关系[24]。黑壳楠木纤维的组织比量为52.7%, 占整个组织的1/2以上; 木射线的组织比量为24.6%;导管的组织比量为13.2%;轴向薄壁组织的组织比量为9.5%。
-
由图 2可知:导管上的纹孔为互列纹孔, 射线与导管间纹孔式为同管间纹孔式和大圆形; 木射线细胞中可见球状物和块状物(图 2C), 通过能量色散分析仪(EDS)分析, 块状物的主要成分有钙、碳、氧, 球状物的主要成分为碳、氧(表 1), 初步预测木射线块状物可能是含钙有机物形成的结晶体, 木射线中球状物可能并非无机盐类, 而是树胶类物质, SCURFIELD等[25]将此类物质认定为淀粉颗粒。
表 1 木射线中块状物和球状物成分分析
Table 1. Block and globular material composition in wood ray
元素 块状物 球状物 质量百分比/% 原子百分比/% 质量百分比/% 原子百分比/% 碳 16.61 32.55 57.26 64.09 氧 20.90 30.75 42.74 35.91 钙 62.49 36.70 -
通过GC-MS分析, 得到黑壳楠木材挥发性有机物成分总离子流图(图 3), 共分离出39个峰, 参照质谱的裂解规律, 将质谱数据经计算机检索与质谱库检索和分析, 并以人工解析为辅, 共鉴定出23种化合物(表 2), 占总化学成分的87.11 %, 主要为烃类化合物及其含氧衍生物。

图 3 黑壳楠木材有机挥发性成分总离子流图
Figure 3. Total ion chromatogram(TIC) of volatile organic compounds in L.megaphylla wood
表 2 黑壳楠木材挥发性有机物成分分析结果
Table 2. Volatile organic compounds of Lindera megaphylla wood
序号 t/min 化合物 分子式 分子量 相对含量/% 类别 1 8.97 α-荜澄茄油烯 .alpha.-cubebene C15H24 204 0.85 烯烃 alkenes * 2 9.33 δ-榄香烯 .delta.-elemene C15H24 204 0.36 烯烃 alkenes * 3 9.83 α-可巴烯 .alpha.-copaene C15H4 204 0.90 烯烃 alkenes * 4 10.49 (1s,7r)-1,4, 4, 7-四甲基-1,4, 5, 6, 7, 8-六氢-2(3h)-萘酮 (1s,7r)-1,4, 4, 7-tetramethyl-1, 4, 5, 6, 7, 8-hexahydro-2(3h)-naphtalenone C14H22O 206 3.74 酮 ketone 5 10.93 4, 7-二甲基-1-异丙基全氢萘 4, 7-dimethyl-1-isopropyl perhy-dronaphthalene C15H28 208 22.46 环院烃 cycloparaffin 6 11.45 α-柏木烯 .alpha.-cedrene C15H24 204 2.04 烯烃 alkenes * 7 12.44 3, 7愈创木二烯 3, 7-guaiadiene C15H24 204 20.11 烯烃 alkenes * 8 12.74 香树烯 1h-cycloprop [e] azulene, decahydro-1, 1, 7-trimethyl-4-methylene-, [1ar-(1aa, 4ab, 7b, 7ab, 7ba)]- C15H24 204 1.00 烯烃 alkenes * 9 14.21 α-紫穗槐烯 .alpha.-amorphene C15H24 204 5.89 烯烃 alkenes * 10 15.68 δ-荜澄茄烯 .delta.-cadinene C15H24 204 0.80 烯烃 alkenes * 11 16.06 芳-香姜黄烯 ar-curcumene C15H22 202 2.23 烯烃 alkenes * 12 17.37 1s, 顺去氢白菖烯 1s, cis-calamenene C15H22 202 12.05 烯烃 alkenes * 13 18.76 3-[(3e)-4, 8-二甲基-3, 7-壬二烯]呋喃3-[(3e)-4, 8-dimethylnona-3, 7-dienyl] furan C15H22O 218 0.84 呋喃 furan * 14 19.30 去二氢菖蒲烯 calacorene C15H20 200 1.38 烯烃 alkenes 15 20.32 α-二去氢菖蒲烯 .alpha.-calacorene C15H20 200 0.57 烯烃 alkenes 16 20.87 石竹烯环氧化物 caryophyllene oxide C15H24 220 0.88 氧化物 oxide * 17 23.58 异构吉马酮环氧化物 isogermacrone-epoxide C15H22O2 234 3.09 氧化物 oxide * 18 23.89 γ-按叶醇 .gamma. - eudesmol C15H26O 222 0.53 醇类 alcohols * 19 25.80 沉香螺旋醇 agaruspirol C15H26O 222 1.58 醇类 alcohols * 20 26.79 呋喃,3-甲基-2-[3-甲基-4-(4-甲基-2-呋喃基)-2-丁烯基]-,(e)-furan, 3-methyl-2- [3-methyl-4-(4-methyl-2-furanyl)-2-butenyl] -, (e)- C15H18O2 230 1.39 呋喃 furan * 21 27.04 愈创木奠1, 4-dimethyl-7 - (1 -methylethyl) -azulene C15H18 198 3.26 奠 azulene * 22 31.75 愈创蓝油烃 guaiazulene C15H18 198 0.83 奠 azulene * 23 34.67 亚油酸乙酷 ethyl linoleate C20H36O2 308 0.35 酯 ester 说明:*表示倍半萜化合物 黑壳楠木材挥发性有机物成分中相对含量超过1%的成分共有13种, 占总峰面积的80.22%, 其中相对含量最高的化合物为4, 7-二甲基-1-异丙基全氢萘(22.46%), 其次为3, 7-愈创木二烯(20.11%), 1s, 顺去氢白菖烯(12.05%), α-紫穗槐烯(5.89%), (1s, 7r)-1, 4, 4, 7-四甲基-1, 4, 5, 6, 7, 8-六氢-2(3H)-萘酮(3.74%), 愈创木薁(3.26%), 异构吉马酮环氧化物(3.09%), 芳-香姜黄烯(2.23%), α-柏木烯(2.04%), 沉香螺旋醇(1.58%), 呋喃, 3-甲基-2-[3-甲基-4-(4-甲基-2-呋喃基)-2-丁烯基]-, (E)-(1.39%), 去二氢菖蒲烯(1.38%)和(+)-香橙烯(1.00%)。由表 3可知:黑壳楠木材挥发性成分中相对含量最高的是烯烃类化合物(48.18%), 其化合物种类最多, 共12种。
表 3 黑壳楠木材挥发性有机物成分统计
Table 3. Volatile organic compounds of L.megaphylla wood
成分类别 数量/种 相对含量/% 烯烃类 12 48.18 环院烃 1 22.46 奠类 2 4.09 酮类 1 3.74 氧化物 2 3.62 呋喃类 2 2.23 醇类 2 2.11 酯类 1 0.35 黑壳楠木材挥发性有机物成分主要含萜类化合物, 有18种萜类化合物, 均为倍半萜化合物, 累计相对含量高达58.63%。其中烯类化合物10种, 累计相对含量高达46.23%;醇类化合物2种, 累计相对含量达2.11%;酮类化合物有1种, 累计相对含量高达3.09%;呋喃类化合物有2种, 累计相对含量达2.23%;薁类衍生物2种, 累计相对含量达4.09%;倍半萜含氧衍生物2种, 累计相对含量达3.97%。相对含量超过1%的倍半萜类成分10种, 累计相对含量为52.64%, 包括3, 7-愈创木二烯(20.11%), 1s, 顺去氢白菖烯(12.05%), α-紫穗槐烯(5.89%), 愈创木薁(3.26%), 异构吉马酮环氧化物(3.09%), 芳-香姜黄烯(2.23%), α-柏木烯(2.04%), 沉香螺旋醇(1.58%), 呋喃, 3-甲基-2-[3-甲基-4-(4-甲基-2-呋喃基)-2-丁烯基]-, (E)-(1.39%)和(+)-香橙烯(1.00%)。
-
黑壳楠木材构造特征为散孔材, 木射线及导管肉眼下可见; 木射线非叠生, 每5 mm内有25~32条, 平均28条; 单列射线极少, 宽15~25 μm, 高36~312 μm(2~7个细胞); 多列射线宽度细至中, 宽32~68 μm(2~3个细胞), 高136~864 μm(3~31个细胞); 同一射线内间或出现2次多列部分; 射线组织异型Ⅲ型和Ⅱ型。导管横切面为圆形或卵圆形, 部分略具多角形轮廓, 单位面积管孔数少, 管孔组合以单管孔和短径列(2~3个)复管孔为主, 偶见短弦列(2个)复管孔和管孔团, 最大弦径≥150 μm, 多数90~110 μm, 平均102 μm; 导管分子长255~596 μm, 平均446 μm; 横切面上木纤维细胞壁较薄, 壁厚为3.7 μm; 直径多为20~26 μm, 平均23 μm; 长740~1 450 μm, 平均1 110 μm; 轴向薄壁组织以傍管形稀疏状为主, 可见环管状; 导管细胞端部的穿孔类型为单穿孔, 穿孔板水平至倾斜; 相邻导管间细胞壁上纹孔的排列形式为互列纹孔, 导管-射线间纹孔式为同管间纹孔; 纹孔口内含, 卵圆形及圆形; 油细胞未见。木射线细胞中的球状物可能是含钙有机物形成的结晶体; 木射线中块状物可能并非无机盐类, 而是树胶类物质。黑壳楠木纤维的组织比量为52.7%, 占整个组织的1/2以上; 木射线的组织比量为24.6%;导管的组织比量为13.2%;轴向薄壁组织的组织比量为9.5%。黑壳楠木材的宏微观特征可作为区分于其他木种的理论依据之一。
黑壳楠木材挥发性有机物成分中鉴定出的23种化合物, 其相对含量之和占总化学成分的87.11%, 主要为烃类化合物及其含氧衍生物; 挥发性有机物成分中相对含量超过1%的成分共有13种, 占总峰面积的80.22%;挥发性有机物成分主含萜类化合物, 有18种萜类化合物, 均为倍半萜化合物, 累计相对含量高达58.63%。
从生源来看, 1s, 顺去氢白菖烯、去二氢菖蒲烯、α-二去氢菖蒲烯属菖蒲烷型来源于没药烷型倍半萜类; 3, 7-愈创木二烯、愈创木薁、愈创蓝油烃属愈创木烷型来源于吉马烷类的倍半萜。通常, 没药烷型倍半萜类衍生物具有显著抗乙肝病毒活性及抗肿瘤的功效[26]。研究表明:萜类化合物多有芳香气味, 通常具有提神、抗菌消炎和镇痛等作用, 具有多种生物活性, 是许多药物的有效成分, 可以治疗疾病, 如调节血糖浓度、降低血脂和血压; 杀虫、杀菌、活血化淤、消炎镇痛消肿、抗肿瘤、抗疟、抗人类免疫缺陷病毒(HIV); 强化免疫; 局部麻醉、止痒; 解热、祛痰、止咳等[27]。例如, 沉香螺旋醇具有镇静催眠作用[28]; 去氢白菖烯被认为是强效的抗菌和抗肿瘤剂[29]; 石竹烯环氧化物具有抗菌消炎和抗真菌等活性, 具有平喘作用, 乙酸己酯不仅能够镇痛抗炎, 还可以愉悦心情, 同时也是食用添加香料[30-31]; 榄香烯是一种广谱、高效的抗肿瘤药物, δ-榄香烯可诱导Hela细胞凋亡[32]; γ-桉叶醇是沉香的主要成分之一, 同时也是蜂胶的主要成分之一[33]; 《抗病毒中药学》提到荔枝核主治行气散结、散寒止痛, 水提物能完全抑制乙型肝炎病毒病毒的复制, 是乙型肝炎病毒复制的高效抑制剂, 其主要成分在黑壳楠木材挥发性有机物成分中有7种, 累计相对含量达22.13%。这表明黑壳楠木材有较高的医药利用价值。
愈创木薁为美国化妆品协会(CTFA)认可的化妆品助剂, 具有抗炎, 抗过敏的作用, 在防晒制品中用于预防或治疗阳光灼伤, 缓解其他物质对皮肤的刺激和过敏反应, 为常见的外用抗过敏剂[34]。α-荜澄茄油烯是目前香料工业的重要原料, 也是柏木精油的3种主要成分之一[35]。这表明黑壳楠木材作为芳香理疗产品具有极大的应用潜力。
Structural characteristics of Lindera megaphylla wood and its volatile organic compounds
-
摘要: 以四川省雅安市黑壳楠Lindera megaphylla活立木为研究对象,通过观察黑壳楠木材的宏微观构造特征,测量和分析导管、木纤维、木射线、轴向薄壁细胞的形态参数及其组织比量,同时采用气相色谱-质谱联用(GC-MS)技术分析黑壳楠木材挥发性有机物成分的主要组分,探究其木材构造特征并分析挥发性化学成分。结果表明:黑壳楠木材构造特征为散孔材,管孔数少,导管长度属于中级别,木纤维长度中,多列射线宽度细至中,轴向薄壁组织量少。木纤维、木射线、导管、轴向薄壁组织的组织比量分别为52.7%,24.6%,13.2%,9.5%。共分离出黑壳楠木材挥发性有机物成分39个峰,鉴定出23种化合物,占总成分的87.11%,主要为烃类化合物及其含氧衍生物。黑壳楠木材挥发性有机物成分中相对含量超过1%的成分共有13种,占总峰面积的80.22%。黑壳楠木材挥发性有机物成分含18种萜类化合物,均为倍半萜化合物,累计相对含量高达58.63%。得出以下结论:实验所得黑壳楠木材构造特征可作为其区分于其他木种的重要理论依据之一; 黑壳楠木材具有较高的医药利用价值,同时在芳香理疗产品的应用方面具有极大的潜力。
-
关键词:
- 木材学 /
- 黑壳楠 /
- 木材构造特征 /
- 挥发性有机物成分 /
- 气相色谱-质谱联用(GC-MS)
Abstract: To explore the structural characteristics of wood and its volatile organic compounds for the purpose of scientific and objective evaluation, as well as for offering an important basis for reasonable and further exploitation of the resource, Lindera megaphylla was studied in Ya'an City, Sichuan Province. First, the macroscopic and microscopic structure of L. megaphylla were observed, and then the morphological parameters and tissue proportion of vessels, wood fibers, wood rays, and longitudinal parenchyma were measured and analyzed. Meanwhile, gas chromatography-mass spectrometry (GC-MS) technology was applied to analyze the chemical components of the volatile organic compounds. Results indicated structural characteristics of L. megaphylla included diffuse porous wood, a few pores, vessels and wood fibers having medium length, multiseriate rays with widths ranging from thin to medium level, and a small number of longitudinal parenchyma. The tissue proportions were as follows:wood fibers-52.7%, wood rays-24.6%, vessels-13.2%, and longitudinal parenchyma-9.5%. In the volatile organic compounds of L. megaphylla, 39 peaks were separated. Altogether, 23 types of compounds, accounting for 87.11% of the total composition and being mainly composed of hydrocarbons and oxygenated derivatives, were identified. Among the volatile organic compounds, 13 kinds had more than 1% of the total components in relative content accounting for 80.22% of the total peak area. The main volatile organic compounds contained 18 kinds of terpenoids and were all sesquiterpenoid compounds with a total relative content of 58.63%. Thus, structural characteristics of L. megaphylla could distinguish it from other species of wood, and analysis of volatile organic compounds showed that its wood had a high medical utilization value and great potential for application in aromatherapy products. -
表 1 木射线中块状物和球状物成分分析
Table 1. Block and globular material composition in wood ray
元素 块状物 球状物 质量百分比/% 原子百分比/% 质量百分比/% 原子百分比/% 碳 16.61 32.55 57.26 64.09 氧 20.90 30.75 42.74 35.91 钙 62.49 36.70 表 2 黑壳楠木材挥发性有机物成分分析结果
Table 2. Volatile organic compounds of Lindera megaphylla wood
序号 t/min 化合物 分子式 分子量 相对含量/% 类别 1 8.97 α-荜澄茄油烯 .alpha.-cubebene C15H24 204 0.85 烯烃 alkenes * 2 9.33 δ-榄香烯 .delta.-elemene C15H24 204 0.36 烯烃 alkenes * 3 9.83 α-可巴烯 .alpha.-copaene C15H4 204 0.90 烯烃 alkenes * 4 10.49 (1s,7r)-1,4, 4, 7-四甲基-1,4, 5, 6, 7, 8-六氢-2(3h)-萘酮 (1s,7r)-1,4, 4, 7-tetramethyl-1, 4, 5, 6, 7, 8-hexahydro-2(3h)-naphtalenone C14H22O 206 3.74 酮 ketone 5 10.93 4, 7-二甲基-1-异丙基全氢萘 4, 7-dimethyl-1-isopropyl perhy-dronaphthalene C15H28 208 22.46 环院烃 cycloparaffin 6 11.45 α-柏木烯 .alpha.-cedrene C15H24 204 2.04 烯烃 alkenes * 7 12.44 3, 7愈创木二烯 3, 7-guaiadiene C15H24 204 20.11 烯烃 alkenes * 8 12.74 香树烯 1h-cycloprop [e] azulene, decahydro-1, 1, 7-trimethyl-4-methylene-, [1ar-(1aa, 4ab, 7b, 7ab, 7ba)]- C15H24 204 1.00 烯烃 alkenes * 9 14.21 α-紫穗槐烯 .alpha.-amorphene C15H24 204 5.89 烯烃 alkenes * 10 15.68 δ-荜澄茄烯 .delta.-cadinene C15H24 204 0.80 烯烃 alkenes * 11 16.06 芳-香姜黄烯 ar-curcumene C15H22 202 2.23 烯烃 alkenes * 12 17.37 1s, 顺去氢白菖烯 1s, cis-calamenene C15H22 202 12.05 烯烃 alkenes * 13 18.76 3-[(3e)-4, 8-二甲基-3, 7-壬二烯]呋喃3-[(3e)-4, 8-dimethylnona-3, 7-dienyl] furan C15H22O 218 0.84 呋喃 furan * 14 19.30 去二氢菖蒲烯 calacorene C15H20 200 1.38 烯烃 alkenes 15 20.32 α-二去氢菖蒲烯 .alpha.-calacorene C15H20 200 0.57 烯烃 alkenes 16 20.87 石竹烯环氧化物 caryophyllene oxide C15H24 220 0.88 氧化物 oxide * 17 23.58 异构吉马酮环氧化物 isogermacrone-epoxide C15H22O2 234 3.09 氧化物 oxide * 18 23.89 γ-按叶醇 .gamma. - eudesmol C15H26O 222 0.53 醇类 alcohols * 19 25.80 沉香螺旋醇 agaruspirol C15H26O 222 1.58 醇类 alcohols * 20 26.79 呋喃,3-甲基-2-[3-甲基-4-(4-甲基-2-呋喃基)-2-丁烯基]-,(e)-furan, 3-methyl-2- [3-methyl-4-(4-methyl-2-furanyl)-2-butenyl] -, (e)- C15H18O2 230 1.39 呋喃 furan * 21 27.04 愈创木奠1, 4-dimethyl-7 - (1 -methylethyl) -azulene C15H18 198 3.26 奠 azulene * 22 31.75 愈创蓝油烃 guaiazulene C15H18 198 0.83 奠 azulene * 23 34.67 亚油酸乙酷 ethyl linoleate C20H36O2 308 0.35 酯 ester 说明:*表示倍半萜化合物 表 3 黑壳楠木材挥发性有机物成分统计
Table 3. Volatile organic compounds of L.megaphylla wood
成分类别 数量/种 相对含量/% 烯烃类 12 48.18 环院烃 1 22.46 奠类 2 4.09 酮类 1 3.74 氧化物 2 3.62 呋喃类 2 2.23 醇类 2 2.11 酯类 1 0.35 -
[1] 汪杭军, 张广群, 祁亨年, 等.木材识别方法研究综述[J].浙江林学院学报, 2009, 26(6):896-902. WANG Hangjun, ZHANG Guangqun, QI Hengnian, et al. A review of research on wood recognition technology[J]. J Zhejiang For Coll, 2009, 26(6):896-902. [2] 胡汉志, 徐峰, 周少英.维腊木与愈疮木木材构造特征比较解剖研究[J].西北林学院学报, 2010, 25(6):165-167. HU Hanzhi, XU Feng, ZHOU Shaoying. Comparative anatomical research on the wood structure between Bulnesia and Guajacum[J]. J Northwest For Univ, 2010, 25(6):165-167. [3] 高振忠, 孙瑾, 吴鸿, 等.樟科10属14种木材解剖学特征的比较研究[J].林业科学研究, 2009, 22(3):413-417. GAO Zhenzhong, SUN Jin, WU Hong, et al. Comparative study on wood anatomical structure of 14 species belonging to 10 genera of Lauraceae[J]. For Res, 2009, 22(3):413-417. [4] 王琦, 刘华红, 王彬, 等. 7种槭树释放挥发性有机化合物组分分析[J].浙江农林大学学报, 2016, 33(3):524-530. WANG Qi, LIU Huahong, WANG Bin, et al. Component analysis of volatile organic compounds from branches and leaves in seven Acer species[J]. J Zhejiang A & F Univ, 2016, 33(3):524-530. [5] 陈晓亚.植物次生代谢研究[J].世界科技研究与发展, 2006, 28(5):1-4. CHEN Xiaoya. Plant secondary metabolism[J]. World Sci-Technol R&D, 2006, 28(5):1-4. [6] LORETO F, PINELLI P, MANES F, et al. Impact of ozone on monoterpene emissions and evidence for an isoprene-like antioxidant action of monoterpenes emitted by Quercus ilex leaves[J]. Tree Physiol, 2004, 24(4):361. [7] 丁倩倩, 吴兴波, 刘芳, 等.木兰科4种植物鲜花挥发物成分分析[J].浙江农林大学学报, 2013, 30(4):477-483. DING Qianqian, WU Xingbo, LIU Fang, et al. Volatile organic compounds in flowers of four Magnoliaceae species[J]. J Zhejiang A & F Univ, 2013, 30(4):477-483. [8] BAKKALI F, AVERBECK S, AVERBECK D, et al. Biological effects of essential oils:a review[J]. Food Chem Toxicol, 2008, 46(2):446-475. [9] 吴楚材, 郑群明.植物精气研究[J].中国城市林业, 2005, 3(4):61-63. WU Chucai, ZHENG Qunming. The study of phytoncidere[J]. J Chin Urban For, 2005, 3(4):61-63. [10] 孙继平, 付金华, 樊巍, 等. 2种肤小蠹对几种针叶树挥发物的行为反应研究[J].中国园艺文摘, 2013(5):157-160. SUN Jiping, FU Jinhua, FAN Wei, et al. Field responses of two sympatric phloeosinus bark beetles to coniferous plant volatiles[J]. Zhongguo Yuanyi Wenzhai, 2013(5):157-160. [11] 徐磊, 潘勇智, 薛辉, 等. 5种针叶树球果所含挥发性物质与丽江球果花蝇危害关系研究[J].林业调查规划, 2016, 41(1):95-97. XU Lei, PAN Yongzhi, XUE Hui, et al. Relationship research on volatile components of five coniferous species plants and damage of Strobilomyia lijiangensis[J]. Fort Invent Plann, 2016, 41(1):95-97. [12] 李阳, 江广渝, 王海洋. 4种樟科园林树种挥发性物质杀菌能力测定及有效成分分析[J].西南师范大学学报(自然科学版), 2014, 39(6):29-34. LI Yang, JIANG Guangyu, WANG Haiyang. On analysis of bactericidal ability and effective component of four garden trees[J]. J Southwest China Norm Univ Nat Sci Ed, 2014, 39(6):29-34. [13] 中国科学院中国植物志编辑委员会.中国植物志:第31卷[M].北京:科学出版社, 1982:384-386. [14] 陈随清, 左艇.河南山胡椒属植物资源及其药理、化学及应用研究[J].中医学报, 2005, 20(3):25-27. CHEN Suiqing, ZUO Ting. Medicinal plant resources Lindera genus in Henan:studies of its pharmacology, chemical components and application[J]. China J Chin Med, 2005, 20(3):25-27. [15] 南京中医药大学.中药大辞典:上册[M]. 2版.上海:上海科学技术出版社, 2013:2891-2891. [16] 卞京军, 程密密, 罗思源, 等.黑壳楠叶片精油挥发性成分的GC/MS鉴定与应用分析[J].西南大学学报(自然科学版), 2014, 36(10):82-88. BIAN Jingjun, CHENG Mimi, LUO Siyuan, et al. GC/MS Analysis of volatile substances in essential oil of Lindera megaphylla blade and its application[J]. J Southwest Univ Nat Sci, 2014, 36(10):82-88. [17] HUANG Rayling, CHEN Chienchih, HUANG Yulin, et al. Anti-tumor effects of d-dicentrine from the root of Lindera megaphylla[J]. Planta Med, 1998, 64(3):212-215. [18] CHEN Chienchih, LIN Chwanfwu, HUANG Yulin, et al. Bioactive constituents from the flower buds and peducles on Lindera megaphylla[J]. Nat Prod, 1995, 58(9):1423-1425. [19] CHOU Chengjen, LIN Liechwen, CHEN Kuotung, et al. Northalifoline, a new isoquinolene alkaloid from the spedicels of Lindera megaphylla[J]. J Nat Prod, 1994, 57(6):689-694. [20] 房伟. 1961-2010年雅安市气候变化趋势[J].贵州气象, 2012, 36(6):40-42. FANG Wei. Climate change trend in Ya'an in 1961-2010 years[J]. J Guizhou Meteorol, 2012, 36(6):40-42. [21] 中华人民共和国国家质量监督检验检疫总局.木材鉴别方法通则: GB/T 29894-2013[S].北京: 中国标准出版社, 2013. [22] DING Wen, NING Liping, XIONG Yan, et al. Essential oils extracted from Phoebe hui Cheng ex Yang:chemical constituents, antitumor and antibacterial activities, and potential use as a species identifier[J]. J Wood Chem Technol, 2017, 37(3):1-10. [23] WHEELER E A, BAAS P, GASSON P. IAWA list of microscopic features for hardwood identification[S]. IAWA Bull, 1989, 10(1):218-332. [24] 郭东强, 叶露, 周维, 等. 2个种源邓恩桉木材纤维特性及变异[J].浙江农林大学学报, 2014, 31(4):502-507. GUO Dongqiang, YE Lu, ZHOU Wei, et al. Wood fiber features for two provenances of Eucalyptus dunni[J]. J Zhejiang A & F Univ, 2014, 31(4):502-507. [25] SCURFIELD G, MICHELL A J, SILVA S R. Crystals in woody stems[J]. Bot J Linnean Soc, 2008, 66(4):277-289. [26] 吉恺, 孔峰, 沈涛, 等.没药倍半萜成分的分离鉴定及抗肿瘤活性[J].山东大学学报医学版, 2008, 46(4):344-348. JI Kai, KONG Feng, SHEN Tao, et al. Separation and identification of myrrh sesquiterpenoids and their anti-proliferation effect on tumor cells[J]. J Shandong Univ Health Sci, 2008, 46(4):344-348. [27] 樊芙秀.牛王刺的研究进展[J].中国民族民间医药, 2014, 23(20):8-9. FAN Fuxiu. Research progress of Caesalpinia decapetala[J]. Chin J Ethnomed Ethnopharm, 2014, 23(20):8-9. [28] 李红念.沉香叶与沉香药材药理作用的对比研究[D].广州: 广州中医药大学, 2013. LI Hongnian. Comparison of the Pharmacological Effects between Leaves of Aquilaria sinensis (Lour.) Gilg and the Lignum of Aquilaria sinensis (Lour.) Gilg[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2013. [29] LIN Jianbo, DOU Jun, XU Jiangling, et al. Chemical composition, antimicrobial and antitumor activities of the essential oils and crude extracts of Euphorbia macrorrhiza[J]. Molecules, 2012, 17(5):5030-5039. [30] 唐小江, 黄华荣, 方铁铮, 等.毛大丁草根止咳化痰活性成分的研究[J].中国中药杂志, 2003, 28(5):426-429. TANG Xiaojiang, HUANG Huarong, FANG Tiezheng, et al. Study on Gerbera piloselloides cough phlegm active ingredients[J]. China J Chin Mater Med, 2003, 28(5):426-429. [31] 谢小洋, 冯永忠, 王得祥, 等. 5种园林树木挥发性成分分析[J].西北农林科技大学学报(自然科学版), 2016, 44(7):146-153. XIE Xiaoyang, FENG Yongzhong, WANG Dexiang, et al. Composition of volatile organic compounds from five landscape trees[J]. J Northwest A&F Univ Nat Sci Ed, 2016, 44(7):146-153. [32] WANG Xisha, YANG Wei, TAO Shujuan, et al. Effect of δ-elemene on Hela cell lines by apoptosis induction[J]. Yakugaku Zasshi, 2006, 126(10):979-990. [33] 延莎, 张红城, 董捷.不同地域蜂胶的挥发性成分分析[J].食品科学, 2011, 32(20):191-196. YAN Sha, ZHANG Hongcheng, DONG Jie. Analysis of volatile components of propolis from different geographical origins[J]. Food Sci, 2011, 32(20):191-196. [34] 季宇彬.天然药物有效成分药理与应用[M].北京:科学出版社, 2007:285. [35] 蒋剑波.毛细管气相色谱法分析柏木精油中萜烯成分[J].吉首大学学报(自然科学版), 2001, 22(3):92-93. JIANG Jianbo. Analysis of terpene components in the essential oil of cedarwood with capillary gas chromatography[J]. J Jishou Univ Nat Sci Ed, 2001, 22(3):92-93. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2018.05.018







 下载:
下载: