-
种子活力是指种子具有的发芽潜力、生长潜力和生产潜力,是检验种子质量优劣的最可靠指标[1-2]。高活力的种子抗逆性强,具有实现高产量和优品质的潜在能力[3]。测定种子活力是农林业生产中不可缺少的步骤。目前,种子活力的测定方法主要有直接法和间接法2类。直接法指在实验室模拟一定条件直接测定萌发率,如低温发芽测定[4]和冷冻测定[5];间接法通过测定某些与种子活力相关的生理生化指标间接评价种子活力的方法,比较常用的方法如四氮唑法(TTC)测定、电导率测定[6]、加速老化测定[7]等。不同物种的最适种子活力测定方法也不相同。POONGUZHALI等[8]发现最能正确反映黑吉豆Vigna mungo种子活力的方法是加速老化法;电导率法评价紫花苜蓿Medicago sativa种子活力最为敏感[9];而通过记录平均胚根突出时间是测定燕麦Avena sativa种子活力高低的重要指标[10]。一般来讲,直接法测定种子活力最准确,但较为耗费时间,难以大规模进行。因此多采用电导率法和TTC法等间接法测定种子活力。TTC法测定种子活力具有方便快速、结果重复性好等优点,主要用于农作物种子活力的测定[11]。电导率法根据细胞膜的完整性来评价种子活力大小,但精度受到标准参考物、温度、水质等因素的影响较大[12]。紫外分光光度计法(UVS)由电导率法改进而来,通过测定种子浸出液的紫外吸光值,来判定浸出液中氨基酸等有机物的相对含量间接推断种子活力。鲁黎明等[13]利用UVS法测定烟草Nicotiana tabacum种子活力时发现:UVS法测定种子活力简便快捷,准确度较高。杉木Cunninghamia lanceolata是中国南方地区的优良速生用材树种,生长快、材质较好,在中国商品材生产中占有重要地位。杉木种子活力的测定与评价是杉木良种培育、种苗生产和人工林营建的重要环节,但由于杉木种子细小、种皮坚硬,胚小易碎等,一般的种子测量方法并不能快速有效检测。本研究以标准发芽试验为参照,比较了TTC法和UVS法测定杉木种子活力的准确性和便捷性,旨在建立一种快速方便且较为准确的种子活力检测方法。
-
2017年10月底至11月初,分别收集普通杉木(普杉)ZLP-1、速生型杉木(速杉)ZLS-9、龙15×闽33双系杂交(杂杉)种子,其中普杉种子和速杉种子采自浙江农林大学林木种质资源圃,杂杉种子由浙江省开化县林场提供。另于2018年11月初在浙江农林大学林木种质资源圃中采集优良无性系速1、新6和红47的半同胞种子用于测定方法验证。
-
采集健康成熟球果,于阴凉通风处晾干;将种子从球果抖出,挑选健康饱满种子装入玻璃广口瓶,密封后置于4 ℃冰箱保存,约6个月后用于种子活力测定。
-
取3个品种杉木种子各150粒,体积分数为10%的安替福明灭菌15 min,无菌水清洗3次,无菌水中25 ℃浸泡24 h。取无菌培养皿,铺上无菌滤纸,并用无菌水湿润;将浸泡后的种子铺于滤纸上,置于25 ℃光照培养箱中萌发。各样品重复3次,每5 d 观察统计发芽情况,15 d后统计萌发种子数,计算平均萌发率(%)。
-
取3个品种杉木种子各150粒,按1.2.2灭菌浸泡后剥去种皮,切下种胚,加质量分数为0.1%的TTC溶液10 mL,置于35 ℃恒温箱中染色120 min。吸去多余TTC液,清水冲洗1~2次,观察并记录被染色的种胚数。胚染成红色的为具有活力的种子,计算染色百分率(%)。重复3次。
-
取3个品种杉木种子各150粒,蒸馏水清洗2次,超纯水清洗1次,滤纸吸干后放入50 mL离心管中,用20 mL超纯水在25 ℃下浸泡,于4、8、12、24 h后测定种子浸出液吸光度D(260)。重复3次。以D(260)为x,种子真实萌发率为y,利用Excel软件进行线性回归分析,建立不同时间浸出液与萌发率间的回归方程,通过拟合系数(R2)选定用于种子活力预测的回归方程。
-
采用Excel及SPSS进行统计分析。
-
由表1发现:相同萌发环境下,3个品种杉木种子萌发率差异显著(P<0.05)。杂杉种子萌发初期萌发率较小,普杉和速杉种子在萌发初期(5 d)就表现出很高的发芽势,均在萌发15 d时趋于稳定。统计萌发15 d 时的萌发率发现:速杉种子萌发率最高(44.88%),普杉较低(41.11%),杂杉最低,仅为37.33%;总体上萌发率变异系数较小,均略大于5%。
表 1 不同杉木种子真实萌发率
Table 1. Real germination rate of different C. lanceolata seeds
种子类型 萌发率/% 变异系数/% 普杉 41.11±2.34 b 5.69 速杉 44.88±2.25 a 5.01 杂杉 37.33±2.33 c 6.24 说明:同列不同字母表示差异显著(P<0.05) -
如表2可知:不同杉木种子的胚染色率存在差异,其中速杉最高(49.78%),杂杉略低(42.22%),普杉最低(38.89%);变异系数波动较大。
表 2 不同杉木种子胚TTC染色率
Table 2. TTC staining rate of different C. lanceolata seed embryos
种子类型 染色率/% 变异系数/% 普杉 38.89±8.88 c 22.83 速杉 49.78±3.04 a 6.10 杂杉 42.22±3.35 b 7.93 说明:同列不同字母表示差异显著(P<0.05) -
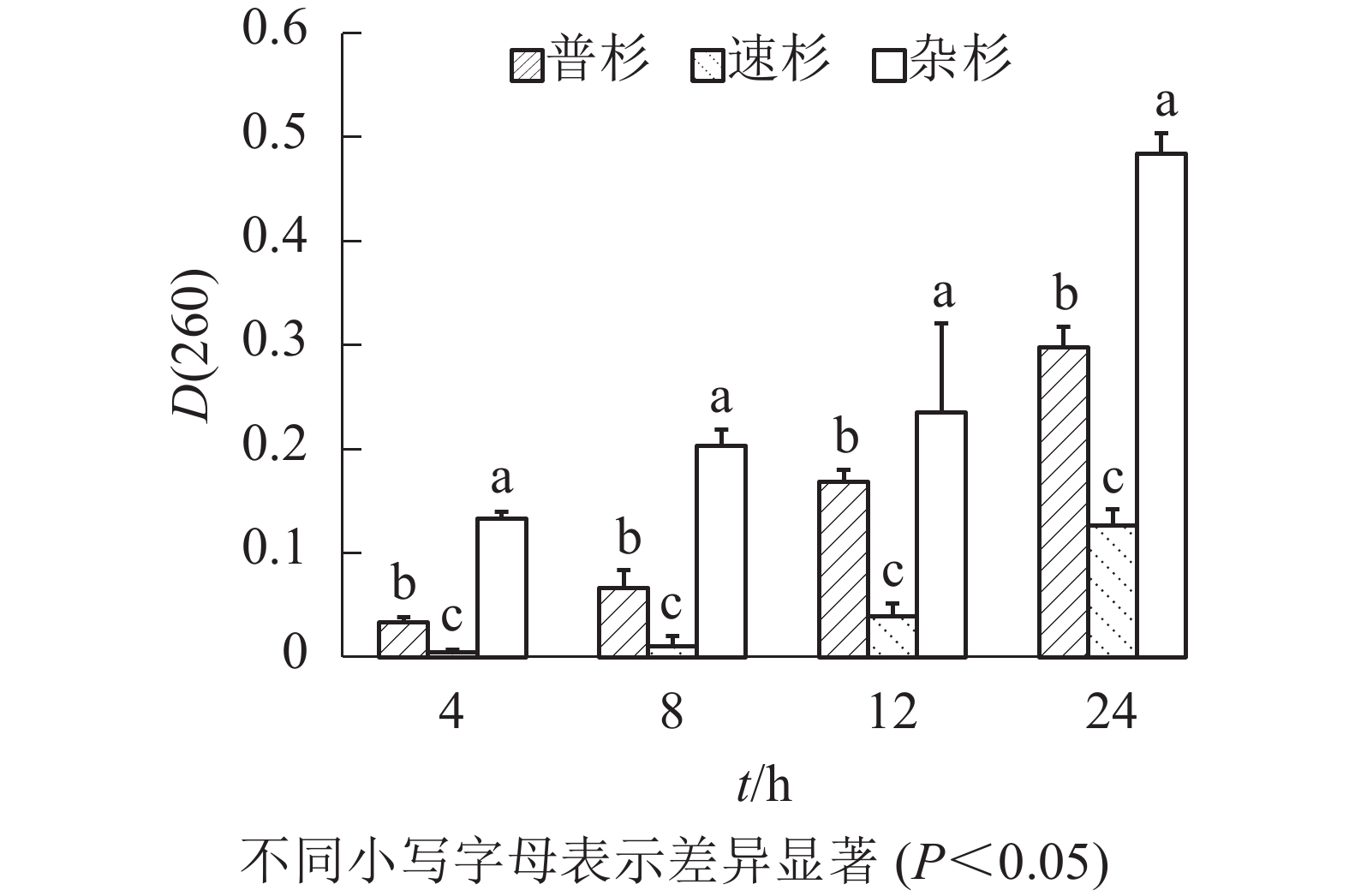
由图1可知:随着浸泡时间延长,同一种子浸出液吸光度[D(260)]呈现逐渐增大的趋势;相同浸泡时长下,不同种子浸出液吸光度[D(260)]不同,3种种子间存在显著差异。速杉种子浸出液紫外吸光值最小,说明萌发率最高,杂杉紫外吸光值最大,说明种子萌发率最低,与实际萌发率一致。对不同浸泡时间下吸光度[D(260)]与真实萌发率做线性回归分析,得到回归方程如下:① 4 h浸泡,y=−0.566 6x+0.449 3 (R2=0.953);② 8 h浸泡,y=−0.309 7x+0.440 2 (R2=0.899);③ 12 h浸泡,y=−0.506 7x+0.458 8 (R2=0.902);④ 24 h浸泡,y=−0.145 7x+0.444 6 (R2=0.689)。由回归方程可看出4 h种子浸出液的紫外吸光度与萌发率之间拟合系数最高(0.953),说明在本研究条件下,杉木种子浸泡4 h后的浸出液紫外吸光值能够较好地反映杉木种子的活力。利用该回归方程计算3个品种种子的萌发率(表3),发现速杉种子萌发率为44.94%,普杉为41.00%,杂杉为37.39%;且其变异系数均约为5%。
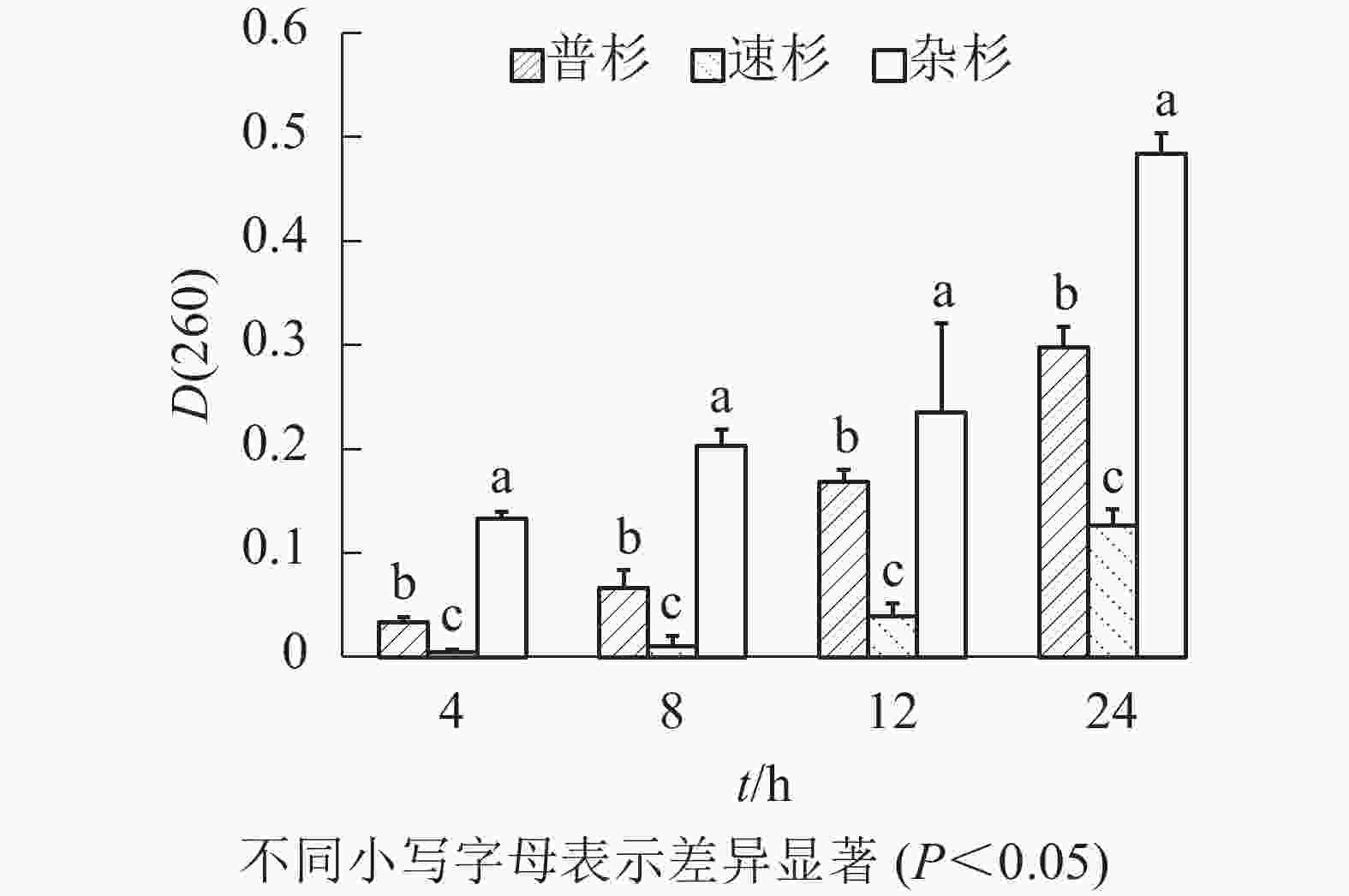
图 1 不同浸泡时间下杉木种子浸出液吸光度
Figure 1. Absorbance of leaching solution of different C. lanceolata seeds at different soaking times
表 3 浸泡4 h后杉木种子吸光度[D(260)]所对应的萌发率波动
Table 3. Fluctuation range of germination rate corresponding to obsorbance [D(260)] of different C. lanceolata seeds soaked for 4 h
种子类型 萌发率/% 变异系数/% 普杉 41.00±1.96 b 4.78 速杉 44.94±1.95 a 4.33 杂杉 37.39±2.10 c 5.61 说明:同列不同字母表示差异显著(P<0.05) -
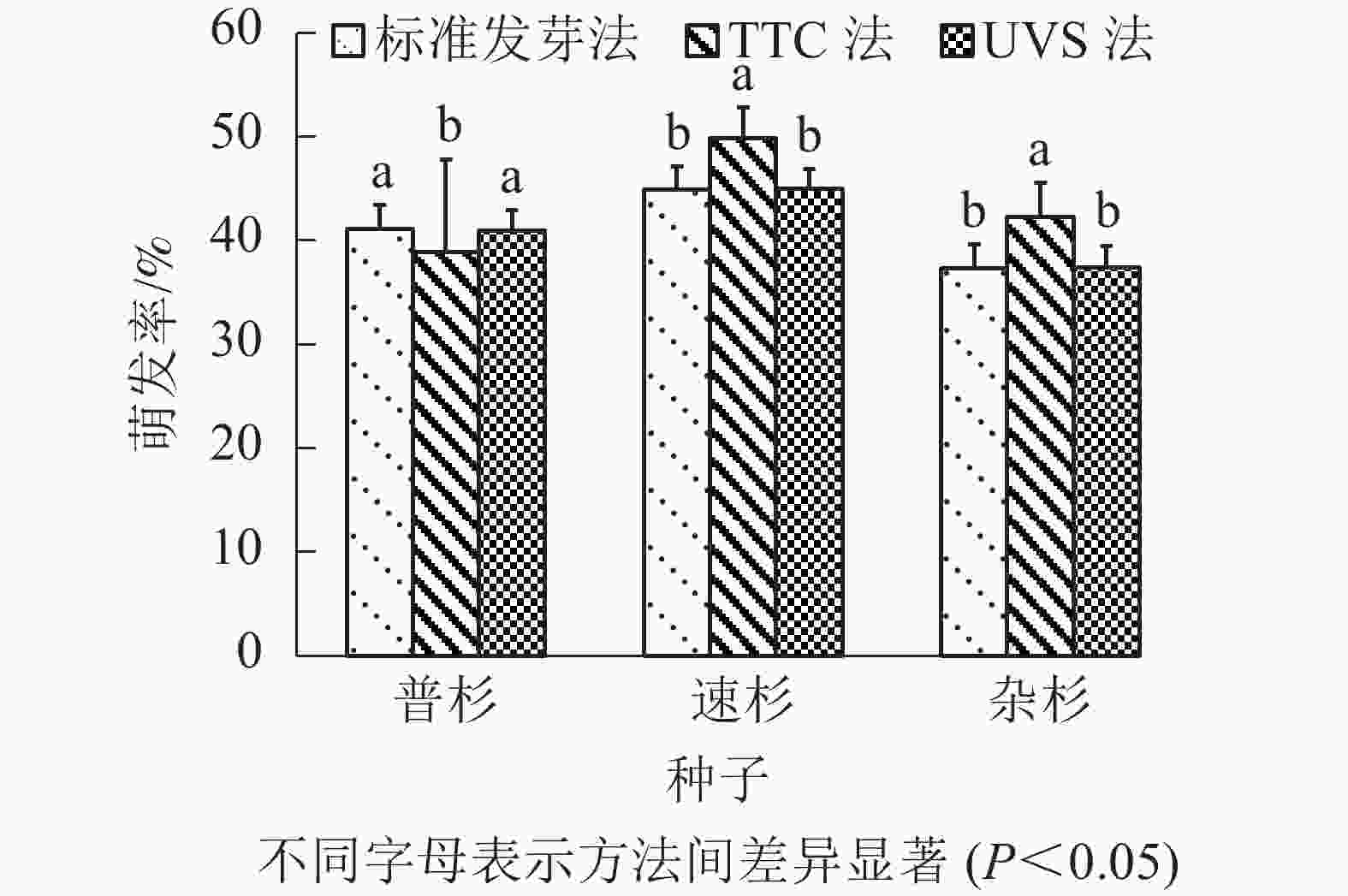
由表4可知:标准发芽法步骤简单,但耗时最长;TTC染色法需将种胚剥出染色,操作最为繁琐,且较为耗时;UVS法操作简单,耗时也最短。比较3种方法测定的萌发率(图2),TTC法测得的种子萌发率与实际萌发率间存在显著差异(P<0.05),UVS法测定的种子活力与实际萌发率没有显著差异(P>0.05)。
表 4 3种方法测定种子活力步骤与耗时比较
Table 4. Comparison of three methods for determining seed vigor and time-consuming
方法 步骤(耗时) 总耗时/h 标准发芽法 安替福明灭菌(15 min) 无菌水浸泡(24 h) 测定自然萌发率(15 d) 约384 TTC法 安替福明灭菌(15 min) 蒸馏水浸泡(24 h) 剥种胚恒温染色(1~3 h) 结果统计(1 h) 26~28 UVS法 种子清洗(1 h) 去离子水浸泡(4 h) OD值测定(0.5 h) 5.5 -
为了进一步验证UVS法的稳定性,随机选取速1、新6和红47共3个杉木无性系,于2018年11月采集其半同胞种子进行UVS法种子活力测定,同时也采用标准发芽法和TTC法测定进行比较。活力测定方法按方法1.2.2,1.2.3和1.2.4进行。结果如表5所示:UVS法测定的结果与标准发芽法较为一致,没有显著差异,而TTC法测得的萌发率与其他2种方法差异显著,说明UVS法所测得的萌发率可靠程度较高,也比较稳定,是杉木种子活力测定的较好方法。
表 5 3种测定方法的稳定性比较
Table 5. Comparison of the stability of the three methods
方法 萌发率/% 速1 新6 红47 TTC法 57.33±10.28 a 55.33±7.83 a 56.67±9.55 a 标准发芽法 49.33±3.47 b 46.67±3.67 b 50.00±3.26 b UVS法 44.81±5.71 b 45.16±3.06 b 45.27±5.51 b 说明:同列不同字母表示差异显著(P<0.05) -
种子活力可以通过标准发芽法、加速老化法、TTC染色法和电导率法等多种方法进行评价,但由于受到物种、基因型和环境等因素的影响,目前并没有通用的种子活力测定方法[14-15]。因此,针对特定植物进行种子活力测定方法的比较,对于建立适用于特定植物种子活力测定具有重要意义。
作为一种公认的种子活力测定标准方法[16],TTC法可以根据种子的种属、状态等调整染色时间以达到最佳活力检测效果[17-19]。本研究发现:由于杉木种子种皮较厚,用TTC法测定活力时需从种子中将胚剥离后再进行染色;此过程不仅费时费力,剥胚时还会造成损伤。同时由于不同种子胚的染色效果存在差异,易造成假阳性,导致活力测定结果与实际萌发率偏差较大。UVS法测定时间短、通量高、所需样本量少,可以有效提高检测效率,是近年来使用较多的测定种子活力的方法。边子星等[20]在利用该方法测定濒危华石斛 Dendrobium sinense种子活力时发现:浸泡4 h的种子浸出液吸光值与发芽率相关性较高,通过拟合回归方程可快速预测华石斛的种子活力。岳媛[21]比较了5种杜鹃Rhododendron种子活力测定方法发现,UVS法(种子浸泡8 h)能较准确地反映出田间出苗的情况,变异系数相对较小,试验结果较稳定,可以作为杜鹃花属植物种子活力测定的方法。本研究首次采用UVS法对杉木种子活力进行了测定,结果发现种子浸泡4 h后,种子浸出液吸光度[D(260)]与种子活力间有较高相关性(R2=0.953),通过预测回归方程可以较好地拟合杉木种子活力。在实际操作中,受试种子往往不同批次、不同年份,因而萌发率会有较大波动,因此应分别计算不同批次种子浸出液吸光值与真实萌发率的相关性,从而避免较大的误差。总体上来讲,这种方法简便快速,准确性高,有利于提高测定效率。
综合上述实验结果,本研究认为TTC法在测定杉木种子活力时,检测准确率与速度上均较差;UVS法可快速检测杉木种子活力,且操作简便,尤其对于检测大量不同杉木种子的活力具有更高效率。
A comparative study of three determination methods for seed vigor of Cunninghamia lanceolata
-
摘要:
目的 建立一种快速简便的杉木Cunninghamia laneolata种子活力测定方法。 方法 以3个不同品种杉木种子为材料,以标准发芽法为参照,比较四氮唑法(TTC)和紫外分光光度计法(UVS)测定种子活力时的准确性和便捷性。 结果 标准发芽法测定种子活力最为准确,但耗费时间长,难以开展大批量测定;TTC法测定杉木种子活力准确度不稳定,且操作繁琐;UVS法的测定值与真实萌发率比较接近,有较高可信度,且操作简便。 结论 UVS法可作为快速测定杉木种子活力的优选方法。图2表5参21 Abstract:Objective This study is aimed to establish a quick and simple method for the determination of the seed vigor of Cunninghamia lanceolata. Method With the seeds selected from three different cultivars of C. lanceolata, a comparison was conducted of the accuracy and efficiency of triphenyltetrazolium chloride (TTC) and ultraviolet spectrophotometer (UVS) methods with the standard germination test for reference. Result The standard germination test was the most accurate but most time-consuming method, which could not be performed on a large scale. TTC method was unstable and inaccurate with cumbersome operation for C. lanceolata seeds. UVS method displayed an estimated value quite close to the real germination rate and enjoyed advantages such as high reliability and simple operation. Conclusion UVS method could be taken as an efficient method for the rapid determination of seed vigor in C. lanceolata. [Ch, 2 fig. 5 tab. 21 ref.] -
表 1 不同杉木种子真实萌发率
Table 1. Real germination rate of different C. lanceolata seeds
种子类型 萌发率/% 变异系数/% 普杉 41.11±2.34 b 5.69 速杉 44.88±2.25 a 5.01 杂杉 37.33±2.33 c 6.24 说明:同列不同字母表示差异显著(P<0.05) 表 2 不同杉木种子胚TTC染色率
Table 2. TTC staining rate of different C. lanceolata seed embryos
种子类型 染色率/% 变异系数/% 普杉 38.89±8.88 c 22.83 速杉 49.78±3.04 a 6.10 杂杉 42.22±3.35 b 7.93 说明:同列不同字母表示差异显著(P<0.05) 表 3 浸泡4 h后杉木种子吸光度[D(260)]所对应的萌发率波动
Table 3. Fluctuation range of germination rate corresponding to obsorbance [D(260)] of different C. lanceolata seeds soaked for 4 h
种子类型 萌发率/% 变异系数/% 普杉 41.00±1.96 b 4.78 速杉 44.94±1.95 a 4.33 杂杉 37.39±2.10 c 5.61 说明:同列不同字母表示差异显著(P<0.05) 表 4 3种方法测定种子活力步骤与耗时比较
Table 4. Comparison of three methods for determining seed vigor and time-consuming
方法 步骤(耗时) 总耗时/h 标准发芽法 安替福明灭菌(15 min) 无菌水浸泡(24 h) 测定自然萌发率(15 d) 约384 TTC法 安替福明灭菌(15 min) 蒸馏水浸泡(24 h) 剥种胚恒温染色(1~3 h) 结果统计(1 h) 26~28 UVS法 种子清洗(1 h) 去离子水浸泡(4 h) OD值测定(0.5 h) 5.5 表 5 3种测定方法的稳定性比较
Table 5. Comparison of the stability of the three methods
方法 萌发率/% 速1 新6 红47 TTC法 57.33±10.28 a 55.33±7.83 a 56.67±9.55 a 标准发芽法 49.33±3.47 b 46.67±3.67 b 50.00±3.26 b UVS法 44.81±5.71 b 45.16±3.06 b 45.27±5.51 b 说明:同列不同字母表示差异显著(P<0.05) -
[1] 刘毓侠, 王铁固. 种子活力研究进展[J]. 玉米科学, 2012, 20(4): 90 − 94. LIU Yuxia, WANG Tiegu. Research progress of seed vigor [J]. J Maize Sci, 2012, 20(4): 90 − 94. [2] 孙群, 王建华, 孙宝启. 种子活力的生理和遗传机理研究进展[J]. 中国农业科学, 2007, 40(1): 48 − 53. SUN Qun, WANG Jianhua, SUN Baoqi. Advances on seed vigor physiological and genetic mechanisms [J]. Sci Agric Sin, 2007, 40(1): 48 − 53. [3] 颜启传, 胡伟民, 宋文坚. 种子活力测定的原理和方法[M]. 北京: 中国农业出版社, 2006. [4] 李彬, 应建恺, 赵光武, 等. 三系杂交籼稻种子活力测定及其与田间出苗率的相关性[J]. 西北农业学报, 2016, 25(11): 1615 − 1622. LI Bin, YING Jiankai, ZHAO Guangwu, et al. Seed vigor determination of three-line indica hybrid rice and their relationship with field emergence percentage [J]. Acta Agric Boreali-Occident Sin, 2016, 25(11): 1615 − 1622. [5] 王婷婷, 杨建宇, 张文明, 等. 液氮超低温贮藏对玉米种子活力的影响[J]. 种子, 2014, 33(12): 30 − 32, 36. WANG Tingting, YANG Jianyu, ZHANG Wenming, et al. Influence on vigor of maize seeds after liquid nitrogen cryopreservation [J]. Seed, 2014, 33(12): 30 − 32, 36. [6] 张文明, 郑文寅, 任冲, 等. 电导法测定大豆种子活力的初步研究[J]. 种子, 2003(2): 34 − 36, 38. ZHANG Wenming, ZHENG Wenyin, REN Chong, et al. Study on testing method of seed vigor by electrical conductivity in soybean [J]. Seed, 2003(2): 34 − 36, 38. [7] 田茜, 李群, 段乃彬, 等. 人工老化对小麦种子活力及超弱发光的影响[J]. 中国农学通报, 2017, 33(3): 15 − 18. TIAN Qian, LI Qun, DUAN Naibin, et al. Effects of artificial aging on vigour and ultra-weak luminescence of wheat seeds [J]. Chin Agricl Sci Bull, 2017, 33(3): 15 − 18. [8] POONGUZHALI S, KANAGARASU S. Standardization and identification of reliable vigour test for delineation of unknown seed lots of blackgram (Vigna mungo (l) hepper) cv. VBN 5 [J]. Res J Agric Sci, 2015, 6(4): 834 − 837. [9] 潘佳, 李荣, 郭耘欣, 等. 紫花苜蓿种子活力测定方法的比较[J]. 草业科学, 2017, 34(5): 1042 − 1048. PAN Jia, LI Rong, GUO Yunxin, et al. Comparative study of seed vigor test in Medicago sativa [J]. Pratacultural Sci, 2017, 34(5): 1042 − 1048. [10] MAO P S, ZHANG X Y, SUN Y, et al. Relationship between the length of the lag period of germination and the emergence performance of oat (Avena sativa) seeds [J]. Seed Sci Technol, 2013, 41(2): 281 − 291. [11] 王金丽. 玉米种子活力测定方法比较[J]. 农业科技与装备, 2015(7): 11 − 12. WANG Jinli. Comparisons of determination methods of maize seed activity [J]. Agric Sci Technol Equip, 2015(7): 11 − 12. [12] 段永红, 李小湘, 李卫红. 利用电导法测定杂交水稻种子活力的探讨[J]. 湖南农业科学, 2010(23): 17 − 19. DUAN Yonghong, LI Xiaoxiang, LI Weihong. Determination of seed activity of hybrid rice by conductivity method [J]. Hunan Agric Sci, 2010(23): 17 − 19. [13] 鲁黎明, 叶科媛, 安影, 等. 一种快速测定烟草种子活力的方法:紫外吸收分光光度法[J]. 种子, 2009, 28(8): 115 − 117. LU Liming, YE Keyuan, AN Ying, et al. A rapid method of determining tobacco seed vigor: uv absorption spectrophotometry method [J]. Seed, 2009, 28(8): 115 − 117. [14] MARCOS-FILHO J. Seed vigor testing: an overview of the past, present and future perspective [J]. Sci Agric, 2015, 72(4): 363 − 374. [15] COPELAND L O, McDONALD M B. Seed Vigor and Vigor Tests[M]//COPELAND L O, McDONALD M B. Principles of Seed Science and Technology. 3rd ed. New York: Springer Science and Business Media, 1999: 153–180. [16] WEN Daxing, HOU Hongcun, MENG Aiju, et al. Rapid evaluation of seed vigor by the absolute content of protein in seed within the same crop [J]. Sci Rep, 2018, 8(1): 5569. [17] VUJANOVIC V, ST-ARNAUD M, BARABÉA D, et al. Viability testing of orchid seed and the promotion of colouration and germination [J]. Annl Bot, 2000, 86(1): 79 − 86. [18] 田伟莉, 吴家森, 金水虎, 等. 3种蜡梅属植物种子活力测定方法的比较[J]. 种子, 2008, 27(4): 21 − 23. TIAN Weili, WU Jiasen, JIN Shuihu, et al. Comparative study on testing methods for seed vigor of three Chimonanthus species [J]. Seed, 2008, 27(4): 21 − 23. [19] BATTY A L, DIXON K W, BRUNDRETT M. Long-term storage of mycorrhizal fungi and seed as a tool for the conservation of endangered Western Australian terrestrial orchids [J]. Aust J Bot, 2001, 49: 619 − 628. [20] 边子星, 颜彩燕, 姚肖健, 等. 濒危华石斛种子活力测定方法研究[J]. 热带作物学报, 2017, 38(3): 403 − 407. BIAN Zixing, YAN Caiyan, YAO Xiaojian, et al. Determination of seed viability in endangered orchid of Dendrobium sinense [J]. Chin J Trop Crops, 2017, 38(3): 403 − 407. [21] 岳媛. 杜鹃花属植物种子育苗技术及耐热性研究[D]. 南京: 南京林业大学, 2013. YUE Yuan. Study on Seed Breeding Technology and Heat Tolerance of Rhododendron L.[D]. Nanjing: Nanjing Forestry University, 2013. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20190615






 下载:
下载: