-
植物化感作用对其生态功能以及植物之间、植物与环境之间的关系产生重要影响[1]。探讨生态系统中种群间相互干扰和物种进化之间的关系是目前化感研究领域的热点[2]。除了制约其他物种的生长,植物产生化感作用的化学物质还具有如调节植物养分吸收和土壤生物群落、影响凋落物分解过程和土壤肥力等作用[2−4]。因此,探讨化感作用有助于深入地理解和解释竹林生态系统中植物组成分布、群落演替、协同进化及入侵等效应[5]。
毛竹Phyllostachys edulis是常绿乔木状竹类植物。毛竹的不同器官和毛竹林土壤浸提液含有不同化感物质,不同质量浓度的浸提液对其他物种生长及种子萌发产生抑制或促进效应[5−8]。从植物化感作用入手,充分利用毛竹林生态系统中化感物质的正效应,避免负效应,探寻合理的毛竹林立体经营模式具有较好的实践意义。
林药复合经营模式可利用林下生态群落学的生态位和空间结构原理,把竹类、灌木、草本等合理配置,形成多层次和多种群的健康生态系统。高效的毛竹-药用植物复合经营模式需要探索与其相适应的林下伴生物种。本研究选择大宗药材浙贝母Fritillaria thunbergii为目标植物,探讨毛竹不同器官及林内土壤的化感作用,为在毛竹林下和林窗发展林药复合经营的森林生态系统提供参考和技术支撑。
-
研究区设在浙江省磐安县大盘山博物馆(28°49′N,120°17′E)。该区域属于亚热带季风气候,多年平均气温为 13.9~17.4 ℃,1 月最低平均气温为4.3 ℃,7 月最高平均气温为 28.8 ℃,无霜期短,雨量充沛,多年平均降水量为 1 409.8~1 527.8 mm。
-
于2019年9月在集约经营毛竹林内采集径级为0~5 mm的根系、3年生植株的新鲜枝叶、林下凋落物和0~20 cm土壤作为制备浸提液的材料。其中:根系的取材半径为以竹篼为中心的0.5 m范围内;新鲜枝叶取第6盘枝的3级枝和叶片;采集凋落物的范围与根系相同,尽量采集完整并去除杂质。
0~5 mm径级根系放置阴凉处风干;将新鲜枝叶洗净,均剪成1 cm左右的小段;凋落物混合均匀后从叶端开始向另一端剪碎,宽约1 mm;林下0~20 cm鲜土样风干,研碎,过2 mm筛。取1 g上述4种材料,加10 mL蒸馏水在室温[(26±1.2) ℃]下浸泡48 h后进行3重过滤:先用4层棉纱布过滤,再用普通滤纸过滤,然后用0.45 µm的微孔滤膜过滤。4 ℃消毒后置于冰箱。
-
以蒸馏水作空白对照(ck),将不同浸提液用蒸馏水稀释成0.005 kg·L−1 (T1)、0.010 kg·L−1 (T2)、0.020 kg·L−1(T3)、0.050 kg·L−1 (T4)和0.100 kg·L−1(T5) 等5个质量浓度并相应设置5个处理[9]。9月,选取无病虫害、颗粒饱满、大小均一的浙贝母块茎(10.9±1.12) g,选用直径30 cm、高30 cm的圆柱形控根容器种植,每盆种植3颗浙贝母块茎,穴距10 cm,呈等边三角形;每个处理设置5个重复,即5盆共15株,处理间所选用的块茎质量无显著差异。土壤为沙壤土,并混入竹炭肥100 g,搅拌均匀。竹碳肥理化性质:pH 5.6,全氮为(1.48±0.11) g·kg−1,全磷为(1.32±0.20) g·kg−1,全钾为(26.15±4.06) g·kg−1。将埋置块茎后的控根容器放置于大田,进行90 d的适应生长。随后隔15 d浇浸提液1次,每次每盆浇200 mL,处理期为90 d,期间进行常规管理。
-
于2020年4月选取植株上部成熟、无病虫害叶片,采用Li-6400便携式光合仪测量光合特征参数。设置光照强度梯度为0、20、60、100、200、400、800、1 200、1 600 μmol·m−2·s−1,选择晴朗无风的天气于9:00—11:00采用内置红蓝光源测定植株光响应曲线。人工二氧化碳摩尔分数控制为400 µmol·mol−1,相对湿度约为70%。
用直尺测量浙贝母的高度,每个处理10株,并将这10株取回实验室分根、茎、叶放入烘箱中105 ℃杀青30 min后80 ℃烘至恒量,用天平称其质量。采用剪纸称量法计算叶面积[7]。
在每个处理中,选取剩余5株浙贝母植株同一方向的上、中、下层叶片各3片,混合后采用徐琳煜等[9]的方法提取光合色素,用紫外分光光度计测定波长为665、649、470 nm处的吸光度。同时,每个处理选取成熟度相近中下层的叶片10片,放入干冰中迅速带回实验室,放−80 ℃冰箱备用。叶片过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性以及丙二醛(MDA)质量摩尔浓度均采用试剂盒(南京建成生物工程研究所)测定。
采用王文文等[10]和车朋等[11]的方法测定浙贝母的贝母素甲和贝母素乙。色谱条件:采用ELSD检测器检测,色谱柱为 Supersil ODS2 (4.6 mm×25 cm) E1828368。流动相:偶氮二环己基甲腈(AcCN)∶0.05%三乙胺溶液为75∶25,压力为10.0 MPa,流速为1 mL·min−1,柱温为30 ℃,进样量为20 µL。依次检测对照品和供试品溶液,并计算贝母素甲和贝母素乙的质量分数。
-
采用SPSS 19.0的非直角双曲线模型拟合光合—光响应曲线,依据光响应曲线计算得出表观量子效率、最大净光合速率、光饱和点和光补偿点。
化感效应指数IR=1−C/T(T≥C)或IR=T/C−1(T<C)。其中:T为试验值,C为对照值。IR>0表示促进作用, IR<0表示抑制作用[12]。综合化感效应指数用浙贝母的生长指标、光合色素和光响应特征参数的化感效应指数的算术平均值表示。
采用SPSS 19.0进行单因素方差分析及最小显著差异法(LSD法)检验(α=0.05)。
-
化感效应指数表明:毛竹根系、新鲜枝叶、凋落叶和土壤浸提液对浙贝母株高的影响表现为低质量浓度促进高质量浓度抑制(“低促高抑”)的效应(表1),在T5处理时均表现出抑制浙贝母高生长的现象;凋落物和土壤浸提液处理时,分别从T3、T4处理开始发生抑制作用。差异显著性分析表明:新鲜枝叶和凋落物浸提液处理对浙贝母株高的影响不显著。
表 1 毛竹不同浸提液对浙贝母株高、生物量和叶面积的影响
Table 1. Effects of different extracts of Ph. edulis forest on height of F. thunbergia
浸提液 浙贝母株高 ck/cm T1 T2 T3 T4 T5 数值/cm IR 数值/cm IR 数值/cm IR 数值/cm IR 数值/cm IR 根系 42.75±2.31c 57.93±0.86 a 0.26 53.20±3.43 b 0.20 52.27±2.75 b 0.18 43.30±0.85 c 0.01 37.78±3.12 d −0.12 新鲜枝叶 42.75±2.31 a 46.80±3.89 a 0.09 46.00±2.73 a 0.07 45.50±3.51 a 0.06 44.55±5.39 a 0.04 42.50±1.84 a −0.01 凋落物 42.75±2.31 a 44.03±3.89 a 0.03 44.47±3.42 a 0.04 42.75±6.04 a 0.00 41.58±10.41 a −0.03 38.43±6.84 a −0.10 土壤 42.75±2.31 ab 46.47±3.78 a 0.08 43.97±1.08 a 0.03 42.02±3.99 ab −0.02 38.13±4.11 b −0.11 37.90±3.65 b −0.11 浸提液 浙贝母地上生物量 ck/g T1 T2 T3 T4 T5 数值/g IR 数值/g IR 数值/g IR 数值/g IR 数值/g IR 根系 0.85±0.03 b 1.02±0.09 a 0.17 1.09±0.11 a 0.22 1.08±0.15 a 0.21 0.81±0.03 b −0.05 0.75±0.10 b −0.12 新鲜枝叶 0.85±0.03 c 1.10±0.02 bc 0.15 1.16±0.04 ab 0.27 1.27±0.04 a 0.33 1.09±0.17 b 0.22 0.86±0.01 c 0.02 凋落物 0.85±0.03 b 0.90±0.07 b 0.05 1.04±0.10 a 0.18 0.93±0.04 b 0.09 0.90±0.02 b 0.06 0.85±0.06 b 0.00 土壤 0.85±0.03 b 0.87±0.04 b 0.02 1.15±0.06 a 0.26 0.10±0.17 ab 0.15 0.97±0.07 ab 0.12 0.87±0.04 b 0.02 浸提液 浙贝母地下生物量 ck/g T1 T2 T3 T4 T5 数值/g IR 数值/g IR 数值/g IR 数值/g IR 数值/g IR 根系 1.16±0.20 c 1.41±0.10 bc 0.18 2.21±0.01 a 0.48 1.59±0.29 b 0.27 1.16±0.11 c 0.00 1.05±0.01 c −0.10 新鲜枝叶 1.16±0.20 a 1.29±0.06 a 0.10 1.43±0.03 a 0.19 1.46±0.36 a 0.20 1.40±0.10 a 0.17 1.34±0.07 a 0.13 凋落物 1.16±0.20 b 1.51±0.05 a 0.23 1.55±0.10 a 0.25 1.46±0.06 a 0.20 1.23±0.16 b 0.06 1.18±0.05 b 0.02 土壤 1.16±0.20 a 1.58±0.40 a 0.27 1.87±0.64 a 0.38 1.66±0.21 a 0.30 1.42±0.01 a 0.18 1.30±0.28 a 0.14 浸提液 浙贝母叶面积 ck/cm2 T1 T2 T3 T4 T5 数值/cm2 IR 数值/cm2 IR 数值/cm2 IR 数值/cm2 IR 数值/cm2 IR 根系 5.29±1.35 a 7.03±2.39 a 0.25 7.37±0.41 a 0.28 6.50±4.31 a 0.19 5.92±0.26 a 0.11 3.18±1.17 a −0.40 新鲜枝叶 5.29±1.35 a 6.21±1.16 a 0.15 7.28±2.35 a 0.27 6.08±4.20 a 0.13 5.77±1.03 a 0.08 5.60±1.72 a 0.06 凋落物 5.29±1.35 a 7.19±0.32 a 0.27 6.91±0.82 a 0.24 6.65±0.97 a 0.21 5.58±0.21 a 0.05 5.57±0.45 a 0.05 土壤 5.29±1.35 a 6.52±0.88 a 0.19 8.89±2.40 a 0.41 7.55±2.90 a 0.30 6.30±1.28 a 0.16 5.43±1.54 a 0.03 说明:同行不同小写字母表示处理间差异显著(P<0.05);表中数值为平均值±标准差。 除根系浸提液外,其他浸提液处理对浙贝母地上生物量的影响均表现为促进效应,促进程度随浸提液质量浓度的增加先升高后降低,且凋落物和土壤浸提液均在T2处理时地上生物量最大,在T5处理时最小(表1)。根系浸提液处理对浙贝母的地上和地下生物量的影响均表现为“低促高抑”的双重效应,均在T2处理时促进作用较为明显,T5处理时表现出抑制效应;新鲜枝叶浸提液对浙贝母地下生物量的影响不显著,对其地上生物量的影响在T2~T4处理时显著(P<0.05)高于ck;凋落物浸提液处理时,T2处理地上部分生物量显著(P<0.05)高于ck,而地下生物量在T1~T3处理时显著(P<0.05)高于ck;土壤浸提液对地上生物量的影响在T2处理时显著(P<0.05)高于ck。
毛竹根系、新鲜枝叶、凋落物和土壤浸提液对浙贝母叶面积的影响均无显著性差异(表1)。但化感效应指数表明:除了根系浸提液的T5处理外,其他浸提液对叶面积有促进作用,趋势为随着浸提液质量浓度的增加先升高后降低,除凋落物浸提液外,均在T2处理时叶面积最大,但各处理组间差异性均不显著,表明毛竹根系、新鲜枝叶、凋落物和土壤浸提液对浙贝母叶面积的影响不大。根系浸提液处理时对浙贝母叶面积的影响表现为“低促高抑”的效应。
-
化感效应指数表明:除了根系浸提液的T5处理,不同浸提液对浙贝母的叶绿素a、叶绿素b和叶绿素a+b质量分数均有促进作用,随浸提液质量浓度增加呈现先升高后降低的趋势,且均在T5处理时质量分数最低。叶绿素a/b数值则随浸提液质量浓度的增加而增加(根系浸提液除外),根系各处理间的差异不显著(表2)。毛竹根系浸提液处理时,叶绿素a和叶绿素a+b均表现为低质量浓度促进高质量浓度抑制的效应,而叶绿素b和类胡萝卜素质量分数均有不同程度提高。新鲜枝叶浸提液处理时,叶绿素b和类胡萝卜素质量分数表现为“低促高抑”的双重效应,这与凋落物浸提液处理时趋同。土壤浸提液处理时,对光合色素参数均有不同程度的提升作用(除了类胡萝卜素表现为“低促高抑”),浙贝母光合色素质量分数随浸提液质量浓度的增加而降低。
表 2 毛竹不同浸提液对浙贝母光合色素参数的影响
Table 2. Effects of different extracts of Ph. edulis forest on the photosynthetic pigment of F. thunbergia
浸提液 叶绿素a ck/(mg·g−1) T1 T2 T3 T4 T5 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 根系 1.49±0.13 b 1.81±0.10 a 0.18 1.70±0.65 ab 0.13 1.68±0.23 ab 0.12 1.51±0.11 b 0.02 1.34±0.12 c −0.10 新鲜枝叶 1.49±0.13 d 1.76±0.02 b 0.15 1.93±0.02 a 0.23 1.63±0.02 c 0.09 1.57±0.01 cd 0.06 1.57±0.04 cd 0.05 凋落物 1.49±0.13 c 1.93±0.04 a 0.23 1.74±0.04 b 0.15 1.61±0.04 bc 0.08 1.58±0.01 bc 0.06 1.54±0.04 c 0.03 土壤 1.49±0.13 b 1.69±0.02 a 0.120 1.63±0.02 ab 0.09 1.58±0.03 ab 0.06 1.53±0.03 ab 0.05 1.55±0.06 ab 0.04 浸提液 叶绿素b ck/(mg·g−1) T1 T2 T3 T4 T5 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 根系 0.44±0.01 c 0.66±0.63 ab 0.34 0.75±0.54 a 0.42 0.62±0.64 ab 0.20 0.59±0.11 ab 0.26 0.50±0.06 bc 0.13 新鲜枝叶 0.44±0.01 b 0.68±0.01 a 0.36 0.73±0.01 a 0.40 0.50±0.01 b 0.13 0.47±0.01 ab 0.06 0.38±0.01 e −0.13 凋落物 0.44±0.01 c 0.75±0.02 b 0.42 0.81±0.01 a 0.46 0.47±0.01 c 0.07 0.45±0.01 c 0.03 0.43±0.01 c −0.01 土壤 0.44±0.01 c 0.67±0.01 a 0.35 0.63±0.01 a 0.31 0.53±0.01 b 0.18 0.51±0.01 bc 0.14 0.49±0.19 bc 0.12 浸提液 叶绿素a/b ck T1 T2 T3 T4 T5 数值 IR 数值 IR 数值 IR 数值 IR 数值 IR 根系 3.46±0.72 a 2.77±0.13 a −0.20 2.27±0.23 a −0.34 2.72±0.26 a −0.21 2.62±0.36 a −0.24 2.74±0.59 a −0.21 新鲜枝叶 3.46±0.72 ab 2.57±0.01 b −0.26 2.64±0.01 b −0.24 3.24±0.01 b −0.06 3.37±0.01 ab −0.03 4.16±0.04 a 0.12 凋落物 3.46±0.72 a 2.57±0.01 b −0.26 2.16±0.02 b −0.38 3.45±0.01 a −0.01 3.51±0.01 a 0.02 3.58±0.01 a 0.03 土壤 3.46±0.72 a 2.51±0.01 a −0.28 2.57±0.03 a −0.26 3.02±0.01 a −0.13 3.16±0.01 a −0.11 3.46±0.79 a −0.09 浸提液 叶绿素a+b ck/(mg·g−1) T1 T2 T3 T4 T5 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 根系 1.92±0.09 c 2.47±0.16 a 0.22 2.45±0.03 a 0.22 2.30±0.08 ab 0.16 2.10±0.21 bc 0.08 1.84±0.06 c −0.04 新鲜枝叶 1.92±0.09 e 2.44±0.02 b 0.21 2.66±0.03 a 0.28 2.13±0.02 c 0.01 2.04±0.01 d 0.06 1.95±0.04 e 0.01 凋落物 1.92±0.09 d 2.68±0.05 a 0.28 2.54±0.05 b 0.24 2.08±0.05 c 0.08 2.04±0.01 cd 0.06 1.97±0.06 cd 0.02 土壤 1.92±0.09 d 2.35±0.02 a 0.19 2.26±0.03 b 0.15 2.11±0.04 c 0.09 2.07±0.03 c 0.07 2.05±0.03 c 0.06 浸提液 类胡萝卜素 ck/(mg·g−1) T1 T2 T3 T4 T5 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 根系 0.52±0.01 a 0.63±0.04 a 0.17 0.62±0.03 a 0.16 0.60±0.04 a 0.13 0.56±0.03 a 0.06 0.55±0.01 a 0.05 新鲜枝叶 0.52±0.01 b 0.60±0.01 a 0.13 0.59±0.01 a 0.12 0.53±0.01 b 0.02 0.45±0.01 c −0.15 0.43±0.01 c −0.17 凋落物 0.52±0.01 b 0.61±0.01 a 0.14 0.59±0.01 a 0.12 0.52±0.01 b −0.01 0.50±0.01 b −0.05 0.47±0.02 c −0.10 土壤 0.52±0.01 d 0.61±0.01 a 0.14 0.59±0.01 b 0.12 0.54±0.01 c 0.03 0.48±0.01 e −0.08 0.44±0.01 f −0.15 说明:同行不同小写字母表示处理间差异显著(P<0.05);表中数值为平均值±标准差。 除根系浸提液外,其他3种浸提液处理对浙贝母的最大净光合速率基本表现为促进作用,均提高浙贝母的表观量子效率和降低光补偿点,表明毛竹根系、枝叶、凋落物和土壤浸提液处理影响了浙贝母的光合代谢速率,提升了其对环境的生长适应能力(表3)。根系浸提液处理时,T5处理的光饱和点与光补偿点分别比ck降低了53%和50%,化感指数分别为−0.530和−0.500。新鲜枝叶浸提液处理时,浙贝母的光饱和点随浸提液质量浓度的增加呈现出先升高后降低的趋势,光补偿点与ck差异不显著。凋落物浸提液处理时,T1处理的光饱和点显著(P<0.05)高于ck,T2~T4处理均显著(P<0.05)低于ck。土壤浸提液处理时,表观量子效率随着浸提液质量浓度升高而降低,而光饱和点和光补偿点的值均在T1处理时最低。
表 3 毛竹不同浸提液对浙贝母光响应特征参数的影响
Table 3. Effects of different extracts of Ph. edulis forest on photoresponse characteristic parameters of F. thunbergii
浸提液 表观量子效率 ck T1 T2 T3 T4 T5 数值 IR 数值 IR 数值 IR 数值 IR 数值 IR 根系 0.048±0.013 de 0.071±0.005 b 0.324 0.065±0.008 cd 0.262 0.063±0.004 cd 0.238 0.049±0.004 e 0.020 0.096±0.010 a 0.500 新鲜枝叶 0.048±0.013 a 0.067±0.011 a 0.284 0.067±0.009 a 0.284 0.059±0.004 a 0.186 0.050±0.003 a 0.040 0.053±0.004 a 0.094 凋落物 0.048±0.013 b 0.054±0.008 b 0.111 0.084±0.012 a 0.429 0.072±0.011 ab 0.333 0.053±0.006 b 0.094 0.059±0.011 b 0.186 土壤 0.048±0.013 a 0.074±0.026 a 0.351 0.062±0.006 a 0.226 0.053±0.007 a 0.094 0.054±0.007 a 0.111 0.050±0.008 a 0.040 浸提液 最大净光合速率 ck/
(μmol·m−2·s−1)T1 T2 T3 T4 T5 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 根系 4.31±0.83 c 7.31±1.06 b 0.41 8.83±1.99 b 0.51 9.02±2.41 a 0.55 10.57±2.01 ab 0.59 3.99±0.68 c −0.08 新鲜枝叶 4.31±0.83 a 6.65±1.04 a 0.35 7.15±2.31 a 0.40 6.19±1.65 a 0.30 4.49±0.67 a 0.04 4.68±1.01 a 0.08 凋落物 4.31±0.83 b 6.52±0.42 a 0.34 6.52±0.82 a 0.34 5.32±1.21 ab 0.19 4.51±0.70 b 0.04 5.48±1.12 ab 0.21 土壤 4.31±0.83 a 4.92±0.61 a 0.12 4.78±0.59 a 0.10 4.763±0.52 a 0.10 4.58±0.66 a 0.06 4.52±0.70 a 0.05 浸提液 光饱和点 ck/
(μmol·m−2·s−1)T1 T2 T3 T4 T5 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 根系 110.67±10.00 c 116.92±16.63 bc 0.05 151.25±19.04 b 0.27 240.38±26.52 a 0.54 236.20±23.33 a 0.53 51.97±7.26 d −0.53 新鲜枝叶 110.67±10.00 a 114.18±12.30 a 0.03 121.60±16.16 a 0.09 121.81±20.48 a 0.09 109.84±12.00 a −0.01 107.09±12.52 a −0.03 凋落物 110.67±10.00 b 139.20±13.21 a 0.21 89.50±8.01 c −0.19 87.79±10.36 c −0.21 97.23±9.27 c −0.12 109.78±12.84 bc −0.01 土壤 110.67±10.00 a 80.00±7.32 b −0.23 93.23±10.25 ab −0.16 108.74±11.00 a −0.02 103.30±9.40 a −0.07 110.44±6.55 a −0.00 浸提液 光补偿点 ck/
(μmol·m−2·s−1)T1 T2 T3 T4 T5 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 根系 20.88±4.22 a 14.09±3.26 ab −0.32 15.38±3.02 ab −0.26 17.86±4.63 ab −0.14 20.41±4.10 a −0.02 10.42±2.15 b −0.50 新鲜枝叶 20.88±4.22 a 14.91±2.11 a −0.28 14.92±2.69 a −0.28 16.95±1.65 a −0.19 20.00±3.21 a −0.04 18.87±2.91 a −0.09 凋落物 20.88±4.22 a 18.52±2.08 a −0.11 11.91±0.67 b −0.43 13.89±1.33 b −0.33 18.86±0.90 a −0.09 16.95±2.15 ab −0.19 土壤 20.88±4.22a 13.51±1.90 b −0.35 16.13±1.44 ab −0.23 18.70±2.61 a −0.09 18.52±1.55 a −0.11 20.00±2.71 a −0.04 说明:同行不同小写字母表示处理间差异显著(P<0.05);表中数值为平均值±标准差。 -
综合化感效应表明:除根系浸提液外,其他3种浸提液对浙贝母的化感效应均表现为不同程度的促进作用,浸提液质量浓度越高促进作用越弱(表4)。根系浸提液对浙贝母的化感效应则表现为“低促高抑”,T5有一定的抑制效应,这与其生长指标和光合生理指标的研究结果一致。根系浸提液对浙贝母的综合平均化感效应指数为0.103,土壤浸提液对其化感效应最弱,平均化感效应指数为0.056。4种浸提液的综合化感效应指数从大到小依表现为根系浸提液、新鲜枝叶浸提液、凋落物浸提液、土壤浸提液。
表 4 毛竹不同浸提液对浙贝母的综合化感效应
Table 4. Synthesis effects of different extracts of Ph. edulis forest on F. thunbergia
处理 不同浸提液的综合化感效应指数 处理 不同浸提液的综合化感效应指数 根系 新鲜枝叶 凋落物 土壤 根系 新鲜枝叶 凋落物 土壤 T1 0.136 0.106 0.148 0.035 T4 0.104 0.039 0.020 0.041 T2 0.200 0.154 0.106 0.107 T5 −0.108 0.011 0.016 0.016 T3 0.180 0.102 0.053 0.081 平均值 0.103 0.082 0.069 0.056 -
毛竹根系、新鲜枝叶、凋落物和土壤浸提液对过氧化氢酶的影响表现为随着浸提液质量浓度的增加,呈现先升高后降低的趋势,表明中低质量浓度的4种浸提液提高了浙贝母叶片的过氧化氢酶活性(图1)。根系浸提液处理时,T2和T3的过氧化氢酶活性显著(P<0.05)高于ck。新鲜枝叶和凋落物浸提液的过氧化氢酶活性在T3时显著(P<0.05)高于ck。土壤浸提液处理时,T2、T3、T4的过氧化氢酶活性显著(P<0.05)高于ck。
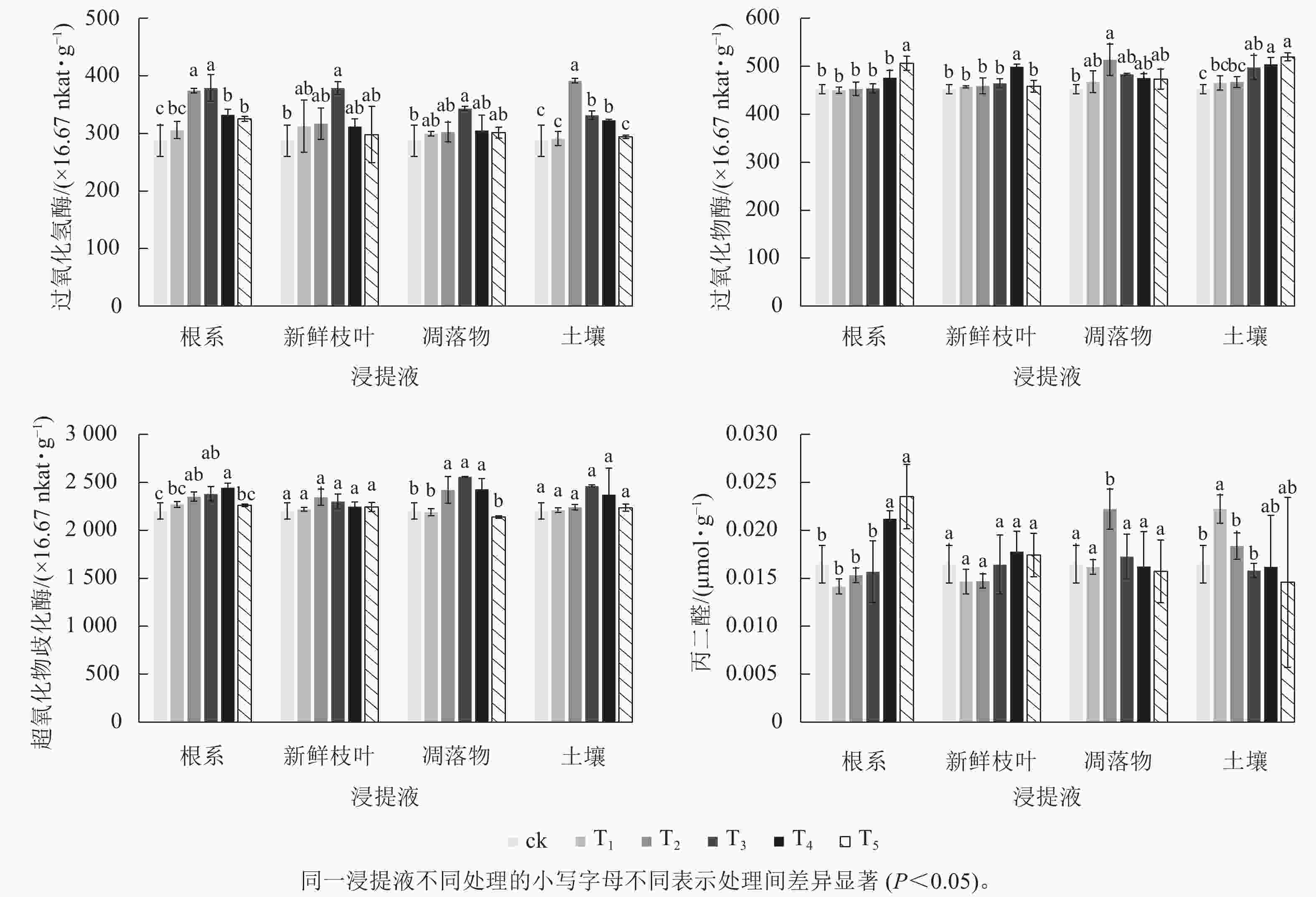
图 1 毛竹不同浸提液对浙贝母抗氧化酶活性和丙二醛的影响
Figure 1. Effects of different extracts of Ph. edulis forest on the activities of antioxidant enzymes and MDA content of F. thunbergii
根系浸提液处理时,T5显著(P<0.05)增加了过氧化物酶活性。新鲜枝叶浸提液处理时,过氧化物酶活性随浸提液质量浓度的增加表现为先升高后降低,其中T4显著(P<0.05)高于ck。凋落物浸提液处理时,T2的过氧化物酶活性显著(P<0.05)高于ck。土壤浸提液处理时,过氧化物酶活性随浸提液质量浓度的增加而增加,T3、T4、T5显著(P<0.05)高于ck。
毛竹不同浸提液对超氧化物歧化酶活性的影响表现为随着浸提液质量浓度的增加呈现先升高后降低的趋势,这与过氧化氢酶类似。根系和凋落物浸提液处理时,T2、T3、T4的超氧化物歧化酶活性显著(P<0.05)高于ck。新鲜枝叶和土壤浸提液处理时,各处理组与ck的差异不显著。
毛竹不同浸提液处理对丙二醛质量摩尔浓度的影响有差异。根系浸提液处理时,丙二醛质量摩尔浓度随浸提液质量浓度的增加而增加,T4、T5显著(P<0.05)高于ck。新鲜枝叶和凋落物浸提液处理时,各处理组的丙二醛质量摩尔浓度与ck差异不显著。土壤浸提液处理时,丙二醛质量摩尔浓度随浸提液质量浓度的增加表现为先增加后降低,T1显著(P<0.05)高于ck。
-
浙贝母的贝母素甲和贝母素乙是其主要生物碱药效成分。随着毛竹根系、新鲜枝叶、凋落物及土壤浸提液质量浓度的增加,贝母素甲和贝母素乙质量分数表现为先升高后下降(表5)。除根系浸提液处理外,其他浸提液对贝母素甲和贝母素乙质量分数的影响均表现为促进效应。贝母素甲和贝母素乙质量分数分别在根系浸提液的T3和T4时显著(P<0.05)小于ck。
表 5 毛竹不同浸提液对贝母素甲和贝母素乙质量分数的影响
Table 5. Effects of different extracts of Ph. edulis forest on the contents of fritillarin A and fritillarin B
浸提液 贝母素甲/(mg·kg−1) ck T1 T2 T3 T4 T5 根系 65.15±1.84 b 87.15±1.53 a 88.77±0.27 a 58.30±0.30 c 40.12±0.12 d 39.79±3.29 d 新鲜枝叶 65.15±1.84 d 95.56±1.06 b 108.58±3.58 a 86.99±1.99 b 82.75±0.25 c 71.76±1.26 d 凋落物 65.15±1.84 e 113.94±3.00 a 91.22±1.22 b 87.75±0.25 c 83.26±0.26 d 81.89±1.35 d 土壤 65.15±1.84 d 95.21±3.01 bc 100.56±0.51 a 96.65±1.50 b 92.78±0.50 c 91.57±1.40 c 浸提液 贝母素乙/(mg·kg−1) ck T1 T2 T3 T4 T5 根系 29.10±1.10 b 41.93±0.40 a 42.15±0.15 a 27.92±0.60 b 22.45±2.20 c 16.70±1.20 d 新鲜枝叶 29.10±1.10 d 47.33±0.30 b 62.34±2.04 a 46.23±1.02 b 40.15±0.15 b 35.13±0.10 c 凋落物 29.10±1.10 c 45.45±1.30 a 43.47±3.40 a 39.07±1.07 b 38.42±1.96 b 38.04±1.04 b 土壤 29.10±1.10 d 41.75±1.50 b 52.23±2.20 a 51.88±1.50 a 40.26±0.20 b 38.41±1.20 c 说明:同行不同小写字母表示处理间差异显著(P<0.05);数值为平均值±标准差。 -
植物的株高、生物量和叶面积等生长参数是反映化感作用最直观的指标[6, 13]。研究表明:化感作用强度与化感物质的种类、来源、含量以及目标植物对其的敏感程度有关[5, 14−15]。本研究发现:毛竹新鲜枝叶、凋落物及土壤浸提液对浙贝母的生长有积极作用,这与毛竹根系、新鲜枝叶、凋落物及土壤浸提液对块茎类草本药用植物延胡索Corydalis yanhusuo株高、地上部分、地下部分和叶面积影响表现为“低促高抑”的结果不同[7],也有别于毛竹浸提液对苦槠Castanopsis sclerophylla幼苗的株高和地径的试验结果[5],本研究中高质量浓度毛竹新鲜枝叶、凋落物和土壤浸提液抑制浙贝母高生长的同时能促进地上、地下生物量的积累。
光合色素是光合作用过程中的重要物质,叶绿素质量分数的变化是植物对化感作用响应的最直接的表现形式之一[16]。本研究发现:毛竹根系、新鲜枝叶、凋落物和土壤浸提液对浙贝母光合色素的影响均随浸提液质量浓度的增加先升后降,除根系浸提液T5外,其他处理的所有光合色素均值都大于ck。这与黄永杰等[16]用水花生Alternanthera philoxeroides浸提液处理马尼拉草Zoysia matrella的结果不同,与张瑞等[7]用毛竹根系、新鲜枝叶、凋落物和土壤浸提液处理延胡索的结果亦有差异。本研究中,浙贝母叶绿素a、叶绿素b增加且叶绿素b的增量超过了叶绿素a,表明浸提液处理提高了浙贝母直射光吸收的同时亦大大提高了漫射光(蓝紫光)的吸收,增加其能量的积累,有利于浙贝母生长;而叶绿素a/b表明浙贝母具备中性植物的特点,在将来的复合经营体系中能较好地适应和利用毛竹林下(林窗)环境。
光合作用是化感物质影响植物生长的重要途径[17]。本研究发现:毛竹新鲜枝叶、凋落物和土壤浸提液处理使浙贝母对光能的利用能力和吸收能力增强;同时,毛竹根系、新鲜枝叶、凋落物和土壤浸提液不同程度提高了浙贝母的表观量子效率,降低了光补偿点,且在高质量浓度浸提液处理下降低光饱和点,表明毛竹根系、新鲜枝叶、凋落物和土壤浸提液促进了浙贝母对弱光的吸收,使之适应了光环境的变化。浙贝母在适应弱光环境的同时增加最大光合速率,可以在光合生理生化过程中最大程度地利用自身可塑性适应环境,最优化摄取环境资源。这与浸提液处理后浙贝母的生长指标、光合色素变化以及化感综合效应值的结果一致。本研究的结果与陈娟等[5]利用不同毛竹浸提液降低了苦槠对光能的利用效率的结果不同,原因可能是化感作用依赖于浸提液质量浓度、测试物种和化感物质的来源[3]。浙贝母在毛竹根系、新鲜枝叶、凋落物和土壤浸提液处理下的这一光合特性十分重要。毛竹属于典型的大型克隆植物,处于抛荒和自然发育的毛竹林更是具有强大的入侵扩张能力,能建立高郁闭度的单优群落。浙贝母属于浅根系的早春植物,通过吸收由毛竹叶片淋溶、凋落物分解和土壤微生物发育等方式释放到环境中的化感物质,来提高毛竹林隙和林下弱光的利用率,以利于生存、生长和发育。这是浙贝母与毛竹建立复合经营体系的优势。
植物抗氧化能力的提高是植物在胁迫环境下生存的重要保障。在本研究中,毛竹根系、新鲜枝叶、凋落物和土壤浸提液对抗氧化酶的影响基本表现为先升高后下降,表明毛竹浸提液在一定质量浓度范围内可以提升浙贝母的抗氧化能力。这可能与毛竹根系、新鲜枝叶、凋落物和土壤浸提液具有抗氧化性、清除自由基的能力有关[18],亦有可能是其含有激活过氧化氢酶相关基因表达的物质[19],同时,中低质量浓度毛竹根系浸提液可以促进过氧化氢酶活性,提高浙贝母的抗逆性。亦有研究表明,不同物种在不同胁迫类型的影响下,其过氧化氢酶活性表现出提升、无影响和下降的现象[19],因此植物在应对胁迫时有多种途径和策略可以选择[20]。高质量浓度毛竹根系浸提液处理时,增加了浙贝母丙二醛质量摩尔浓度,说明高质量浓度毛竹根系浸提液对浙贝母产生了一定的伤害,限制了浙贝母生长,这与其生长指标的研究结果一致。土壤浸提液处理对浙贝母丙二醛质量摩尔浓度影响不一致。T1处理时浙贝母丙二醛质量摩尔浓度显著高于ck,表明T1胁迫程度在其承受范围之内,所以浙贝母的抗氧化系统能迅速清除其体内过多的活性氧自由基,保护浙贝母的生理功能免受伤害。新鲜枝叶和凋落物浸提液处理时,浙贝母丙二醛质量摩尔浓度与ck之间没有显著差异,这与陈昱等[20]在芥菜Brassica juncea浸提液对豇豆Vigna unguiculata幼苗的抗氧化酶活性的影响结果相似。可见,毛竹林化感物质对浙贝母丙二醛的影响不大,但提高了浙贝母叶片的抗氧化酶活性,从而促进了浙贝母的生长。
在毛竹根系、新鲜枝叶、凋落物和土壤处理下,浙贝母的主要药效成分贝母素甲和贝母素乙的变化与其生长指标、光合生理、抗性生理的表现趋同,所有浸提液(中、高质量浓度的根系浸提液除外)均有增加药效成分的效应,这种效应为竹药复合经营提供了基础。高质量浓度毛竹根系浸提液对浙贝母生长有一定的抑制作用亦体现在其药效成分上,而其他3种浸提液特别是新鲜枝叶浸提液对药效成分的提升较为明显,原因可能是竹叶具有丰富的黄酮类化合物、酚酸类化合物、蒽醌类化合物等活性成分[18]。
-
浙贝母具备中性植物的特性,可适应0.005~0.100 kg·L−1的毛竹新鲜枝叶、凋落物和土壤浸提液浇灌处理。上述3种浸提液提高了浙贝母的生物量、叶面积、光合色素、弱光环境适应能力和药效成分等,但高质量浓度毛竹根系浸提液对浙贝母有一定的限制作用。在实际生产经营中,可以在毛竹林中适当开辟林窗和林隙,整地挖除根鞭后栽培浙贝母。
Allelopathic effects of Phyllostachys edulis extracts on Fritillaria thunbergii
-
摘要:
目的 探讨毛竹Phyllostachys edulis根系、新鲜枝叶、凋落物及土壤浸提液对浙贝母Fritillaria thunbergii的化感作用,筛选毛竹-药用植物复合经营体系的适生经济物种。 方法 选择药用植物浙贝母作为目标植物,开展不同质量浓度(0.005、0.010、0.020、0.050和0.100 kg·L−1)毛竹(根系、新鲜枝叶、凋落物和0~20 cm土壤浸提液)的化感作用试验。 结果 ①根系浸提液对浙贝母的生长性状(株高、生物量和叶面积)、光合色素(叶绿素a、叶绿素b、叶绿素a+b)和药效成分的影响表现为“低促高抑”的效应。②新鲜枝叶、凋落物和土壤浸提液对浙贝母生长性状、光合色素和药效成分表现为促进作用,提高了叶面积的同时亦可提升直射光和漫射光的吸收能力,有利于浙贝母在弱光环境下生长;浙贝母最大净光合速率、光饱和点在这3种浸提液处理下,随着浸提液质量浓度增加表现为先升高后下降,同时增加了表观量子效率,降低了光补偿点,表明毛竹浸提液改变了浙贝母对光能的利用率和光强吸收范围。③根系浸提液对浙贝母的化感综合效应最强,土壤浸提液最弱。④高质量浓度根系浸提液处理时,浙贝母丙二醛质量摩尔浓度增加,表明浙贝母受到一定的环境胁迫。 结论 浙贝母可适应除高质量浓度根系浸提液外的其他浸提液浇灌,且可提升生物量和药效成分。建议开展整地作业,清理毛竹林死根鞭,有利于浙贝母的优质生长。图1表5参20 Abstract:Objective The purpose is to explore the allelopathic effects of forest extract of Phyllostachys edulis on Fritillaria thunbergii, so as to screen the suitable economic species for compound management of Ph. edulis and medicinal plants. Method F. thunbergii was selected as the target plant to carry out the allelopathy experiments of different extracts of Ph. edulis forest (roots, fresh branches and leaves, litter and 0~20 cm soil) at different concentrations (0.005, 0.010, 0.020, 0.050 and 0.100 kg·L−1). Result (1) The effects of root extract on the growth characters (plant height, biomass and leaf area), photosynthetic pigments (chlorophyll a, chlorophyll b and chlorophyll a+b) and active medicinal components (fritillarin A and fritillarin B) of F. thunbergii showed promotion at lower extract concentration while inhabitation at higher concentration. (2) Fresh branches and leaves, litter and soil extracts promoted the growth traits, photosynthetic pigments and active components, increased the leaf area and absorption capacity of direct and diffuse light, which was conducive to the growth of F. thunbergii under low light condition. The maximum net photosynthetic rate and light saturation point also increased under the treatment of these three extracts, which first increased and then decreased with the increase of the extract concentration. At the same time, the apparent quantum efficiency increased and the light compensation point decreased, indicating that Ph. edulis extracts changed the utilization rate of light energy and the absorption range of light intensity. (3) The comprehensive allelopathic effect of root extract on F. thunbergii was the strongest, while that of the soil extract was the weakest. (4) The MDA content increased when the root extract was in high concentration, indicating that F. thunbergii was under certain environmental stress. Conclusion F. thunbergii can adapt to the irrigation of other extracts except root extract of high concentration, and can improve biomass and active medicinal components. Land preparation and cleaning up the dead root of Ph. edulis forest is conducive to the high-quality growth of F. thunbergii. [Ch, 1 fig. 5 tab. 20 ref.] -
Key words:
- Fritillaria thunbergii /
- photosynthesis /
- allelopathy /
- under-forest economy /
- compound management
-
表 1 毛竹不同浸提液对浙贝母株高、生物量和叶面积的影响
Table 1. Effects of different extracts of Ph. edulis forest on height of F. thunbergia
浸提液 浙贝母株高 ck/cm T1 T2 T3 T4 T5 数值/cm IR 数值/cm IR 数值/cm IR 数值/cm IR 数值/cm IR 根系 42.75±2.31c 57.93±0.86 a 0.26 53.20±3.43 b 0.20 52.27±2.75 b 0.18 43.30±0.85 c 0.01 37.78±3.12 d −0.12 新鲜枝叶 42.75±2.31 a 46.80±3.89 a 0.09 46.00±2.73 a 0.07 45.50±3.51 a 0.06 44.55±5.39 a 0.04 42.50±1.84 a −0.01 凋落物 42.75±2.31 a 44.03±3.89 a 0.03 44.47±3.42 a 0.04 42.75±6.04 a 0.00 41.58±10.41 a −0.03 38.43±6.84 a −0.10 土壤 42.75±2.31 ab 46.47±3.78 a 0.08 43.97±1.08 a 0.03 42.02±3.99 ab −0.02 38.13±4.11 b −0.11 37.90±3.65 b −0.11 浸提液 浙贝母地上生物量 ck/g T1 T2 T3 T4 T5 数值/g IR 数值/g IR 数值/g IR 数值/g IR 数值/g IR 根系 0.85±0.03 b 1.02±0.09 a 0.17 1.09±0.11 a 0.22 1.08±0.15 a 0.21 0.81±0.03 b −0.05 0.75±0.10 b −0.12 新鲜枝叶 0.85±0.03 c 1.10±0.02 bc 0.15 1.16±0.04 ab 0.27 1.27±0.04 a 0.33 1.09±0.17 b 0.22 0.86±0.01 c 0.02 凋落物 0.85±0.03 b 0.90±0.07 b 0.05 1.04±0.10 a 0.18 0.93±0.04 b 0.09 0.90±0.02 b 0.06 0.85±0.06 b 0.00 土壤 0.85±0.03 b 0.87±0.04 b 0.02 1.15±0.06 a 0.26 0.10±0.17 ab 0.15 0.97±0.07 ab 0.12 0.87±0.04 b 0.02 浸提液 浙贝母地下生物量 ck/g T1 T2 T3 T4 T5 数值/g IR 数值/g IR 数值/g IR 数值/g IR 数值/g IR 根系 1.16±0.20 c 1.41±0.10 bc 0.18 2.21±0.01 a 0.48 1.59±0.29 b 0.27 1.16±0.11 c 0.00 1.05±0.01 c −0.10 新鲜枝叶 1.16±0.20 a 1.29±0.06 a 0.10 1.43±0.03 a 0.19 1.46±0.36 a 0.20 1.40±0.10 a 0.17 1.34±0.07 a 0.13 凋落物 1.16±0.20 b 1.51±0.05 a 0.23 1.55±0.10 a 0.25 1.46±0.06 a 0.20 1.23±0.16 b 0.06 1.18±0.05 b 0.02 土壤 1.16±0.20 a 1.58±0.40 a 0.27 1.87±0.64 a 0.38 1.66±0.21 a 0.30 1.42±0.01 a 0.18 1.30±0.28 a 0.14 浸提液 浙贝母叶面积 ck/cm2 T1 T2 T3 T4 T5 数值/cm2 IR 数值/cm2 IR 数值/cm2 IR 数值/cm2 IR 数值/cm2 IR 根系 5.29±1.35 a 7.03±2.39 a 0.25 7.37±0.41 a 0.28 6.50±4.31 a 0.19 5.92±0.26 a 0.11 3.18±1.17 a −0.40 新鲜枝叶 5.29±1.35 a 6.21±1.16 a 0.15 7.28±2.35 a 0.27 6.08±4.20 a 0.13 5.77±1.03 a 0.08 5.60±1.72 a 0.06 凋落物 5.29±1.35 a 7.19±0.32 a 0.27 6.91±0.82 a 0.24 6.65±0.97 a 0.21 5.58±0.21 a 0.05 5.57±0.45 a 0.05 土壤 5.29±1.35 a 6.52±0.88 a 0.19 8.89±2.40 a 0.41 7.55±2.90 a 0.30 6.30±1.28 a 0.16 5.43±1.54 a 0.03 说明:同行不同小写字母表示处理间差异显著(P<0.05);表中数值为平均值±标准差。 表 2 毛竹不同浸提液对浙贝母光合色素参数的影响
Table 2. Effects of different extracts of Ph. edulis forest on the photosynthetic pigment of F. thunbergia
浸提液 叶绿素a ck/(mg·g−1) T1 T2 T3 T4 T5 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 根系 1.49±0.13 b 1.81±0.10 a 0.18 1.70±0.65 ab 0.13 1.68±0.23 ab 0.12 1.51±0.11 b 0.02 1.34±0.12 c −0.10 新鲜枝叶 1.49±0.13 d 1.76±0.02 b 0.15 1.93±0.02 a 0.23 1.63±0.02 c 0.09 1.57±0.01 cd 0.06 1.57±0.04 cd 0.05 凋落物 1.49±0.13 c 1.93±0.04 a 0.23 1.74±0.04 b 0.15 1.61±0.04 bc 0.08 1.58±0.01 bc 0.06 1.54±0.04 c 0.03 土壤 1.49±0.13 b 1.69±0.02 a 0.120 1.63±0.02 ab 0.09 1.58±0.03 ab 0.06 1.53±0.03 ab 0.05 1.55±0.06 ab 0.04 浸提液 叶绿素b ck/(mg·g−1) T1 T2 T3 T4 T5 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 根系 0.44±0.01 c 0.66±0.63 ab 0.34 0.75±0.54 a 0.42 0.62±0.64 ab 0.20 0.59±0.11 ab 0.26 0.50±0.06 bc 0.13 新鲜枝叶 0.44±0.01 b 0.68±0.01 a 0.36 0.73±0.01 a 0.40 0.50±0.01 b 0.13 0.47±0.01 ab 0.06 0.38±0.01 e −0.13 凋落物 0.44±0.01 c 0.75±0.02 b 0.42 0.81±0.01 a 0.46 0.47±0.01 c 0.07 0.45±0.01 c 0.03 0.43±0.01 c −0.01 土壤 0.44±0.01 c 0.67±0.01 a 0.35 0.63±0.01 a 0.31 0.53±0.01 b 0.18 0.51±0.01 bc 0.14 0.49±0.19 bc 0.12 浸提液 叶绿素a/b ck T1 T2 T3 T4 T5 数值 IR 数值 IR 数值 IR 数值 IR 数值 IR 根系 3.46±0.72 a 2.77±0.13 a −0.20 2.27±0.23 a −0.34 2.72±0.26 a −0.21 2.62±0.36 a −0.24 2.74±0.59 a −0.21 新鲜枝叶 3.46±0.72 ab 2.57±0.01 b −0.26 2.64±0.01 b −0.24 3.24±0.01 b −0.06 3.37±0.01 ab −0.03 4.16±0.04 a 0.12 凋落物 3.46±0.72 a 2.57±0.01 b −0.26 2.16±0.02 b −0.38 3.45±0.01 a −0.01 3.51±0.01 a 0.02 3.58±0.01 a 0.03 土壤 3.46±0.72 a 2.51±0.01 a −0.28 2.57±0.03 a −0.26 3.02±0.01 a −0.13 3.16±0.01 a −0.11 3.46±0.79 a −0.09 浸提液 叶绿素a+b ck/(mg·g−1) T1 T2 T3 T4 T5 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 根系 1.92±0.09 c 2.47±0.16 a 0.22 2.45±0.03 a 0.22 2.30±0.08 ab 0.16 2.10±0.21 bc 0.08 1.84±0.06 c −0.04 新鲜枝叶 1.92±0.09 e 2.44±0.02 b 0.21 2.66±0.03 a 0.28 2.13±0.02 c 0.01 2.04±0.01 d 0.06 1.95±0.04 e 0.01 凋落物 1.92±0.09 d 2.68±0.05 a 0.28 2.54±0.05 b 0.24 2.08±0.05 c 0.08 2.04±0.01 cd 0.06 1.97±0.06 cd 0.02 土壤 1.92±0.09 d 2.35±0.02 a 0.19 2.26±0.03 b 0.15 2.11±0.04 c 0.09 2.07±0.03 c 0.07 2.05±0.03 c 0.06 浸提液 类胡萝卜素 ck/(mg·g−1) T1 T2 T3 T4 T5 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 数值/(mg·g−1) IR 根系 0.52±0.01 a 0.63±0.04 a 0.17 0.62±0.03 a 0.16 0.60±0.04 a 0.13 0.56±0.03 a 0.06 0.55±0.01 a 0.05 新鲜枝叶 0.52±0.01 b 0.60±0.01 a 0.13 0.59±0.01 a 0.12 0.53±0.01 b 0.02 0.45±0.01 c −0.15 0.43±0.01 c −0.17 凋落物 0.52±0.01 b 0.61±0.01 a 0.14 0.59±0.01 a 0.12 0.52±0.01 b −0.01 0.50±0.01 b −0.05 0.47±0.02 c −0.10 土壤 0.52±0.01 d 0.61±0.01 a 0.14 0.59±0.01 b 0.12 0.54±0.01 c 0.03 0.48±0.01 e −0.08 0.44±0.01 f −0.15 说明:同行不同小写字母表示处理间差异显著(P<0.05);表中数值为平均值±标准差。 表 3 毛竹不同浸提液对浙贝母光响应特征参数的影响
Table 3. Effects of different extracts of Ph. edulis forest on photoresponse characteristic parameters of F. thunbergii
浸提液 表观量子效率 ck T1 T2 T3 T4 T5 数值 IR 数值 IR 数值 IR 数值 IR 数值 IR 根系 0.048±0.013 de 0.071±0.005 b 0.324 0.065±0.008 cd 0.262 0.063±0.004 cd 0.238 0.049±0.004 e 0.020 0.096±0.010 a 0.500 新鲜枝叶 0.048±0.013 a 0.067±0.011 a 0.284 0.067±0.009 a 0.284 0.059±0.004 a 0.186 0.050±0.003 a 0.040 0.053±0.004 a 0.094 凋落物 0.048±0.013 b 0.054±0.008 b 0.111 0.084±0.012 a 0.429 0.072±0.011 ab 0.333 0.053±0.006 b 0.094 0.059±0.011 b 0.186 土壤 0.048±0.013 a 0.074±0.026 a 0.351 0.062±0.006 a 0.226 0.053±0.007 a 0.094 0.054±0.007 a 0.111 0.050±0.008 a 0.040 浸提液 最大净光合速率 ck/
(μmol·m−2·s−1)T1 T2 T3 T4 T5 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 根系 4.31±0.83 c 7.31±1.06 b 0.41 8.83±1.99 b 0.51 9.02±2.41 a 0.55 10.57±2.01 ab 0.59 3.99±0.68 c −0.08 新鲜枝叶 4.31±0.83 a 6.65±1.04 a 0.35 7.15±2.31 a 0.40 6.19±1.65 a 0.30 4.49±0.67 a 0.04 4.68±1.01 a 0.08 凋落物 4.31±0.83 b 6.52±0.42 a 0.34 6.52±0.82 a 0.34 5.32±1.21 ab 0.19 4.51±0.70 b 0.04 5.48±1.12 ab 0.21 土壤 4.31±0.83 a 4.92±0.61 a 0.12 4.78±0.59 a 0.10 4.763±0.52 a 0.10 4.58±0.66 a 0.06 4.52±0.70 a 0.05 浸提液 光饱和点 ck/
(μmol·m−2·s−1)T1 T2 T3 T4 T5 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 根系 110.67±10.00 c 116.92±16.63 bc 0.05 151.25±19.04 b 0.27 240.38±26.52 a 0.54 236.20±23.33 a 0.53 51.97±7.26 d −0.53 新鲜枝叶 110.67±10.00 a 114.18±12.30 a 0.03 121.60±16.16 a 0.09 121.81±20.48 a 0.09 109.84±12.00 a −0.01 107.09±12.52 a −0.03 凋落物 110.67±10.00 b 139.20±13.21 a 0.21 89.50±8.01 c −0.19 87.79±10.36 c −0.21 97.23±9.27 c −0.12 109.78±12.84 bc −0.01 土壤 110.67±10.00 a 80.00±7.32 b −0.23 93.23±10.25 ab −0.16 108.74±11.00 a −0.02 103.30±9.40 a −0.07 110.44±6.55 a −0.00 浸提液 光补偿点 ck/
(μmol·m−2·s−1)T1 T2 T3 T4 T5 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 数值/
(μmol·m−2·s−1)IR 根系 20.88±4.22 a 14.09±3.26 ab −0.32 15.38±3.02 ab −0.26 17.86±4.63 ab −0.14 20.41±4.10 a −0.02 10.42±2.15 b −0.50 新鲜枝叶 20.88±4.22 a 14.91±2.11 a −0.28 14.92±2.69 a −0.28 16.95±1.65 a −0.19 20.00±3.21 a −0.04 18.87±2.91 a −0.09 凋落物 20.88±4.22 a 18.52±2.08 a −0.11 11.91±0.67 b −0.43 13.89±1.33 b −0.33 18.86±0.90 a −0.09 16.95±2.15 ab −0.19 土壤 20.88±4.22a 13.51±1.90 b −0.35 16.13±1.44 ab −0.23 18.70±2.61 a −0.09 18.52±1.55 a −0.11 20.00±2.71 a −0.04 说明:同行不同小写字母表示处理间差异显著(P<0.05);表中数值为平均值±标准差。 表 4 毛竹不同浸提液对浙贝母的综合化感效应
Table 4. Synthesis effects of different extracts of Ph. edulis forest on F. thunbergia
处理 不同浸提液的综合化感效应指数 处理 不同浸提液的综合化感效应指数 根系 新鲜枝叶 凋落物 土壤 根系 新鲜枝叶 凋落物 土壤 T1 0.136 0.106 0.148 0.035 T4 0.104 0.039 0.020 0.041 T2 0.200 0.154 0.106 0.107 T5 −0.108 0.011 0.016 0.016 T3 0.180 0.102 0.053 0.081 平均值 0.103 0.082 0.069 0.056 表 5 毛竹不同浸提液对贝母素甲和贝母素乙质量分数的影响
Table 5. Effects of different extracts of Ph. edulis forest on the contents of fritillarin A and fritillarin B
浸提液 贝母素甲/(mg·kg−1) ck T1 T2 T3 T4 T5 根系 65.15±1.84 b 87.15±1.53 a 88.77±0.27 a 58.30±0.30 c 40.12±0.12 d 39.79±3.29 d 新鲜枝叶 65.15±1.84 d 95.56±1.06 b 108.58±3.58 a 86.99±1.99 b 82.75±0.25 c 71.76±1.26 d 凋落物 65.15±1.84 e 113.94±3.00 a 91.22±1.22 b 87.75±0.25 c 83.26±0.26 d 81.89±1.35 d 土壤 65.15±1.84 d 95.21±3.01 bc 100.56±0.51 a 96.65±1.50 b 92.78±0.50 c 91.57±1.40 c 浸提液 贝母素乙/(mg·kg−1) ck T1 T2 T3 T4 T5 根系 29.10±1.10 b 41.93±0.40 a 42.15±0.15 a 27.92±0.60 b 22.45±2.20 c 16.70±1.20 d 新鲜枝叶 29.10±1.10 d 47.33±0.30 b 62.34±2.04 a 46.23±1.02 b 40.15±0.15 b 35.13±0.10 c 凋落物 29.10±1.10 c 45.45±1.30 a 43.47±3.40 a 39.07±1.07 b 38.42±1.96 b 38.04±1.04 b 土壤 29.10±1.10 d 41.75±1.50 b 52.23±2.20 a 51.88±1.50 a 40.26±0.20 b 38.41±1.20 c 说明:同行不同小写字母表示处理间差异显著(P<0.05);数值为平均值±标准差。 -
[1] QIN Fangcuo, LIU Shu, YU Shixiao. Effects of allelopathy and competition for water and nutrients on survival and growth of tree species in Eucalyptus urophylla plantations [J]. Forest Ecology and Management, 2018, 424(15): 387 − 395. [2] INDERJIT, WARDLE D, KARBAN R, et al. The ecosystem and evolutionary contexts of allelopathy [J]. Trends in Ecology and Evolution, 2011, 26(12): 655 − 663. [3] HU Lingfei, ROBERT C A M, CADOT S, et al. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota [J/OL]. Nature Communications, 2018, 9: 2738[2022-06-07]. doi: 10.1038/s41467-018-05122-7. [4] BONANOM G, ZOTTI M G, IDBELLA M, et al. Microbiota modulation of allelopathy depends on litter chemistry: mitigation or exacerbation? [J/OL]. Science of the Total Environment, 2021, 776: 145942[2022-06-17]. doi: 10.1016/j.scitotenv.2021.145942. [5] 陈娟, 白尚斌, 周国模, 等. 毛竹浸提液对苦槠幼苗生长的化感效应[J]. 生态学报, 2014, 34(16): 4499 − 4507. CHEN Juan, BAI Shangbin, ZHOU Guomo, et al. Allelopathic effects of Phyllostachys edulis extracts on Castanopsis sclerophylla [J]. Acta Ecologica Sinica, 2014, 34(16): 4499 − 4507. [6] 刘姚姚, 张瑞, 沈晓飞, 等. 毛竹林不同浸提液对浙江楠幼苗生长的影响研究[J]. 西部林业科学, 2020, 49(3): 99 − 108. LIU Yaoyao, ZHANG Rui, SHEN Xiaofei, et al. Study on the effects of different extracts from Phyllostachys edulis forest on the growth of Phoebe chekiangensis seedlings [J]. Journal of West China Forestry Science, 2020, 49(3): 99 − 108. [7] 张瑞, 詹卉, 刘姚姚, 等. 毛竹林不同浸提液对延胡索生长指标和光合特征的影响[J]. 西南林业大学学报(自然科学), 2020, 40(3): 59 − 67. ZHANG Rui, ZHAN Hui, LIU Yaoyao, et al. Effects of different extracts from Phyllostachys edulis on the growth index and photosynthesis characteristics of Corydalis yanhusuo [J]. Journal of Southwest Forestry University (Natural Sciences), 2020, 40(3): 59 − 67. [8] 李欣欣, 赖金莉, 岳建华, 等. 毛竹各器官和根际土浸提液对杉木种子萌发的化感作用[J]. 生态学报, 2018, 38(22): 8149 − 8157. LI Xinxin, LAI Jinli, YUE Jianhua, et al. Allelopathy of Phyllostachys pubescens extract on the seed germination of Chinese fir [J]. Acta Ecologica Sinica, 2018, 38(22): 8149 − 8157. [9] 徐琳煜, 刘守赞, 白岩, 等. 不同光强处理对三叶青光合特性的影响[J]. 浙江农林大学学报, 2018, 35(3): 467 − 475. XU Linyu, LIU Shouzan, BAI Yan, et al. Effects of light intensity treatments on photosynthetic characteristics in Tetrastigma hemsleyanum [J]. Journal of Zhejiang A&F University, 2018, 35(3): 467 − 475. [10] 王文文, 杨飞, 杨中, 等. 超高效液相色谱-串联质谱法分析贝母药材中5种生物碱[J]. 分析测试学报, 2019, 38(4): 461 − 465. WANG Wenwen, YANG Fei, YANG Zhong, et al. Determination of 5 alkaloids in Fritillaria by ultrahigh performance liquid chromatography-tandem mass spectrometry [J]. Journal of Instrumental Analysis, 2019, 38(4): 461 − 465. [11] 车朋, 刘久石, 齐耀东, 等. UPLC-ELSD同时测定贝母类药材中6种生物碱的含量[J]. 中国中药杂志, 2020, 45(6): 1393 − 1398. CHE Peng, LIU Jiushi, QI Yaodong, et al. Simultaneous determination of six major isosteroidal alkaloids in Beimu by UPLC-ELSD [J]. China Journal of Chinese Materia Medica, 2020, 45(6): 1393 − 1398. [12] WILLIAMSON G B, RICHARDSON D. Bioassays for allelopathy: measuring treatment responses with independent controls [J]. Journal of Chemical Ecology, 1988, 14(1): 181 − 187. [13] 曾任森. 化感作用研究中的生物测定方法综述[J]. 应用生态学报, 1999, 10(1): 125 − 128. ZENG Rensen. Review on bioassay methods for allelopathy research [J]. Chinese Journal of Applied Ecology, 1999, 10(1): 125 − 128. [14] INDERJIT. Soil microorganisms: an important determinant of allelopathic activity [J]. Plant and Soil, 2005, 274(1): 227 − 236. [15] DAI Zhicong, WANG Xiaoying, QI Shanshan, et al. Effects of leaf litter on inter-specific competitive ability of the invasive plant Wedelia trilobata [J]. Ecological Research, 2016, 31(3): 367 − 374. [16] 黄永杰, 周会, 张丹丹, 等. 水花生及其根际土浸提液对马尼拉幼苗生长生理特性的影响[J]. 水土保持学报, 2015, 29(1): 285 − 291. HUANG Yongjie, ZHOU Hui, ZHANG Dandan, et al. Effects of extracts of Alternanthera philoxeroides and rhizospheric soil on growth and physiological characteristics of Zoysia matrella seedlings [J]. Journal of Soil and Water Conservation, 2015, 29(1): 285 − 291. [17] 阎飞, 杨振明, 韩丽梅. 植物化感作用(Allelopathy)及其作用物的研究方法[J]. 生态学报, 2000, 20(4): 692 − 696. YAN Fei, YANG Zhenming, HAN Limei. Review on research methods for allelopathy and allelochemicals in plants [J]. Acta Ecologica Sinica, 2000, 20(4): 692 − 696. [18] WU Di, CHEN Jianyang, LU Baiyi, et al. Application of near infrared spectroscopy for the rapid determination of antioxidant activity of bamboo leaf extract [J]. Food Chemistry, 2012, 135: 2147 − 2156. [19] 刘云芬, 王薇薇, 祖艳侠, 等. 过氧化氢酶在植物抗逆中的研究进展[J]. 大麦与谷类科学, 2019, 36(1): 5 − 8. LIU Yunfen, WANG Weiwei, ZU Yanxia, et al. Research progress on the effects of catalase on plant stress tolerance [J]. Barley and Cereal Sciences, 2019, 36(1): 5 − 8. [20] 陈昱, 张福建, 杨有新, 等. 芥菜浸提液对豇豆连作土壤性质及幼苗生理指标的影响[J]. 核农学报, 2019, 33(5): 1038 − 1047. CHEN Yu, ZHANG Fujian, YANG Youxin, et al. Effect of aqueous extract of mustard on soil properties of the continuous cropping cowpea and seedling physiological indexes [J]. Journal of Nuclear Agricultural Sciences, 2019, 33(5): 1038 − 1047. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220471






 下载:
下载: