-
碳(C)、氮(N)、磷(P)是植物细胞结构组成和功能代谢中重要的元素,参与植物生长发育的多个生理过程[1],C、N、P含量及其化学计量比可反映植物的生长策略和环境适应性[2],是判断土壤营养元素限制的重要工具[3]。非结构性碳水化合物(NSC)主要由可溶性糖和淀粉组成,两者在一定条件下相互转化,能有效反映植物碳吸收和碳消耗的关系[4]。植物NSC、C、N、P单独和交互效应可以影响植物的生存和生长策略[5−6]。
植物的生态化学计量特征和NSC含量与物种、发育阶段、环境、器官等因素有关[7−8]。研究表明:林龄的变化可能引起森林组成结构、土壤性质的改变,进而影响养分的分配格局[9]。杉木Cunninghamia lanceolata各器官中养分含量随着林分年龄的增加而降低[10],刺槐Robinia pseudoacacia叶片NSC含量随林龄的增加先增加后减小,枝、干和根NSC含量则逐渐增加[11]。植物的各器官能根据不同生长阶段的养分需求调整NSC、C、N、P的分配。任鹏等[12]发现:生长季内水曲柳Fraxinus mandshurica叶片N、P含量逐渐降低,C/N和C/P相反。章异平等[13]对栓皮栎Quercus variabilis研究发现:枝条NSC含量随季节波动较小,叶片NSC含量存在明显的季节波动。在不同林龄林分中开展NSC及各组分、C、N、P化学计量特征的动态研究有利于了解林分在1 a中的生长状态及生态策略。
红松Pinus koraiensis是东北温带地带性顶级群落阔叶红松林的建群种,具有重要的经济价值和生态价值,属半阳性树种。目前,有学者对红松群落特征、速生技术、环境适应性等方面开展了研究[14],然而对生长季不同林龄红松枝叶的养分与光合产物分配的研究较少。因此,本研究以中、幼龄红松人工林为研究对象,分析其针叶和枝C、N、P的化学计量特征及NSC合成规律,以期为揭示辽东地区针叶树种的养分循环特征,提升红松产量提供理论依据。
-
研究区位于辽宁省本溪市草河口镇辽宁省森林经营研究所实验林场(40°85′N, 123°92′E)。该区平均海拔为645 m,地带性土壤为山地棕色森林土,pH为5.3~6.3。属于温带大陆性季风气候,年平均气温为6.5 ℃,最高气温为32.0 ℃,最低气温为−33.0 ℃,年均降水量约900.0 mm,年均无霜期约127.0 d。
-
按照《主要树种龄级与龄组划分》(LY/T 2908—2017)[15],≤40 年生红松人工林为幼龄林,41~60年生红松人工林为中龄林。本研究选择辽宁省本溪市草河口镇15年生红松人工林(幼龄林)、50年生红松人工林(中龄林)为研究对象,每个林龄内选择长势良好、分布均匀的地段分别设置3个20 m×20 m的样方,对样方内胸径≥5 cm的红松进行每木检尺,同时记录样地的基本信息(表1)。
表 1 样地基本特征
Table 1. Basic characteristics of sample plots
林分类型 林龄/a 土壤类型 坡向 坡位 平均树高/m 平均胸径/cm 土壤全氮/(g·kg−1) 土壤全磷/(g·kg−1) 土壤全钾/(g·kg−1) 幼龄林 15 棕壤 南 中 8.23 14.93 2.53 0.61 14.70 中龄林 50 棕壤 南 中 27.80 30.76 2.32 0.54 15.62 根据样方调查结果,每个样方内选择3株长势相似、生长健康、光照条件良好的红松标准木作为样树,于2023年春季(5月中旬)、夏季(7月中旬)、秋季(9月初)采集南向红松的1年生针叶和枝,每次采集36份样品,共108份样品。采集的样品用纯净水清洗后,于105 ℃杀青30 min,65 ℃烘干至恒量。粉碎后过100目筛进行可溶性糖、淀粉、C、N、P的测定。采用蒽酮硫酸法[16]测定可溶性糖和淀粉,全碳、全氮用碳氮分析仪(Elementar High TOCⅡ+N)测定,全磷经浓硫酸-过氧化氢消煮后用流动分析仪(San++System)测定。
-
使用SPSS 25.0中双因素方差分析检验月份、器官和林龄对NSC及其组分、C、N、P质量分数及生态化学计量比的影响,单因素方差分析比较中、幼龄红松人工林各月份可溶性糖、淀粉、NSC、C、N、P质量分数及生态化学计量比的差异,同时用Dunch进行多重比较。采用Pearson相关分析法,对各项数据进行相关性分析,Origin 2021和Excel 2021进行绘图和表格制作。
-
由图1可见:中、幼龄林红松针叶可溶性糖、淀粉及NSC质量分数生长季变化趋势相同,枝的生长季变化趋势略有差异。中、幼龄林红松针叶可溶性糖质量分数均为7月下降,9月回升;中、幼龄林红松枝的可溶性糖质量分数在各月份差异不显著。红松中龄林针叶可溶性糖质量分数在9月较幼龄林显著提高了15.82%(P<0.01),红松中龄林枝的可溶性糖质量分数在7、9月较幼龄林分别显著提高了8.84%(P<0.05)和24.18%(P<0.01)。5月红松中、幼龄林针叶淀粉质量分数显著高于7月和9月(P<0.05);中、幼龄枝的淀粉质量分数变化趋势存在差异。9月红松幼龄林针叶淀粉质量分数较中龄林显著提高了9.93%(P<0.05);5月红松中龄林枝的淀粉质量分数显著高于幼龄林(P<0.05),7月则相反(P<0.01)。中、幼龄林红松针叶NSC质量分数呈7月下降、9月回升趋势;红松中龄林5月、9月枝的NSC质量分数显著高于7月(P<0.05),幼龄林各月份枝的NSC质量分数差异不显著。中、幼龄林针叶NSC质量分数差异不显著,7、9月中、幼龄林间枝的淀粉质量分数差异显著(P<0.05)。
-
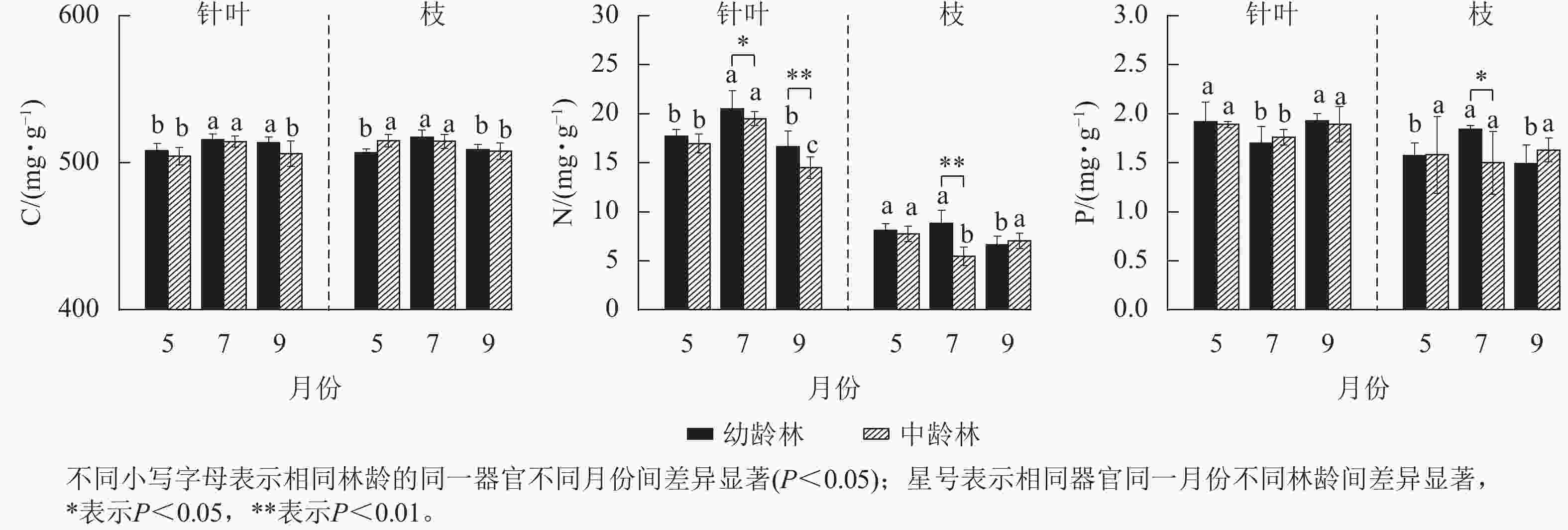
由图2可见:红松C、N质量分数基本呈7月上升,9月下降的趋势。中、幼龄林红松针叶C质量分数均表现为7月>9月>5月,7月针叶C质量分数显著高于5月(P<0.05);7月中、红松幼龄林枝的C质量分数显著高于9月(P<0.05)。中、幼龄林红松C的质量分数间无显著差异。7月红松幼龄林针叶N质量分数显著高于5和9月(P<0.05);5、7月红松幼龄林枝的N质量分数显著高于9月(P<0.05),5、9月红松中龄林枝的N质量分数显著高于7月(P<0.05)。7、9月红松幼龄林针叶N质量分数较中龄林分别显著提高了5.13%和14.62%(P<0.05);7月幼龄林枝的N质量分数较中龄林极显著提高了61.17%(P<0.01)。中、幼龄林红松生长季针叶N质量分数均高于枝。5和9月红松针叶P质量分数显著高于7月(P<0.05);幼龄林7月枝的P质量分数显著高于5和9月(P<0.05),中龄林枝各月份的P质量分数无显著差异。7月幼龄林枝的P质量分数较中龄林显著提高了22.67%(P<0.05)。
-
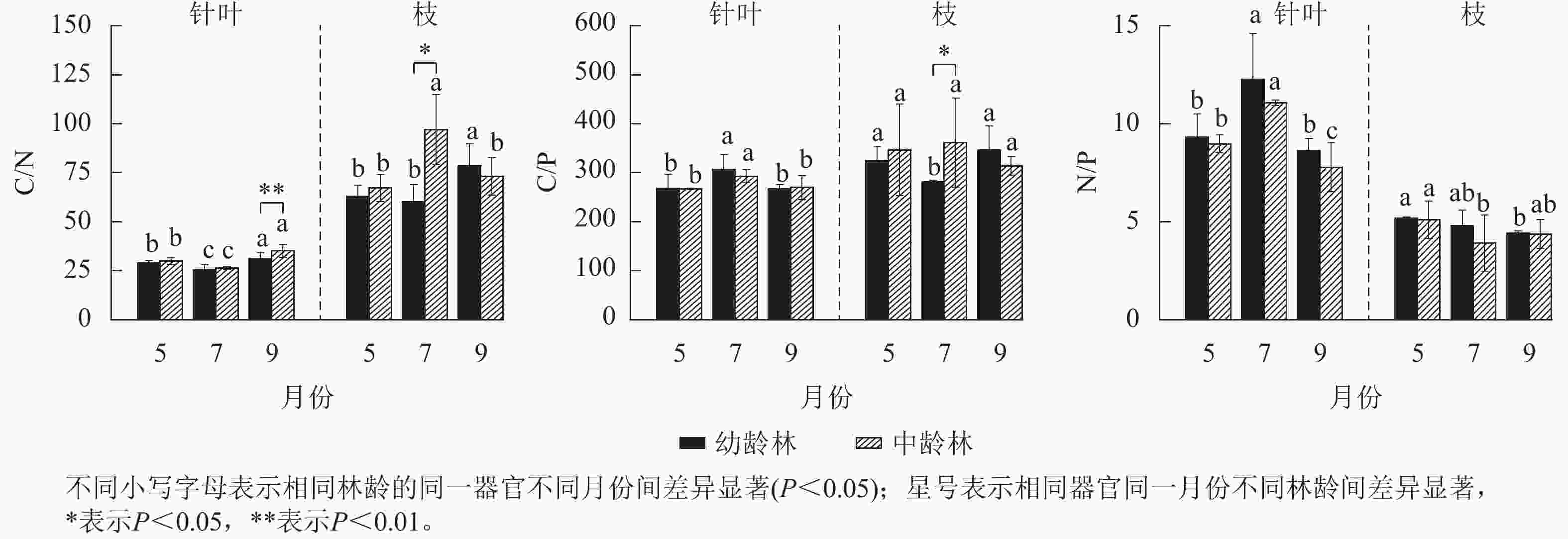
由图3可见:中、幼龄林红松针叶C/N均呈7月降低,9月上升趋势,9月中龄林针叶C/N较幼龄林极显著提高了12.64%(P<0.01)。中、幼龄林红松枝的C/N季节性变化趋势相反,7月红松中龄林枝的C/N显著高于幼龄林(P<0.05)。红松幼、中龄林7月针叶C/P、N/P显著高于5和9月(P<0.05)。7月红松幼龄林枝的C/P显著低于5和9月(P<0.05),中龄林枝的C/P季节性差异不显著,7月幼龄林C/P较中龄林显著提高了28.31%(P<0.05)。红松中、幼龄林枝的N/P呈现不同的月变化趋势,红松中幼龄林间枝叶N/P差异不显著。
-
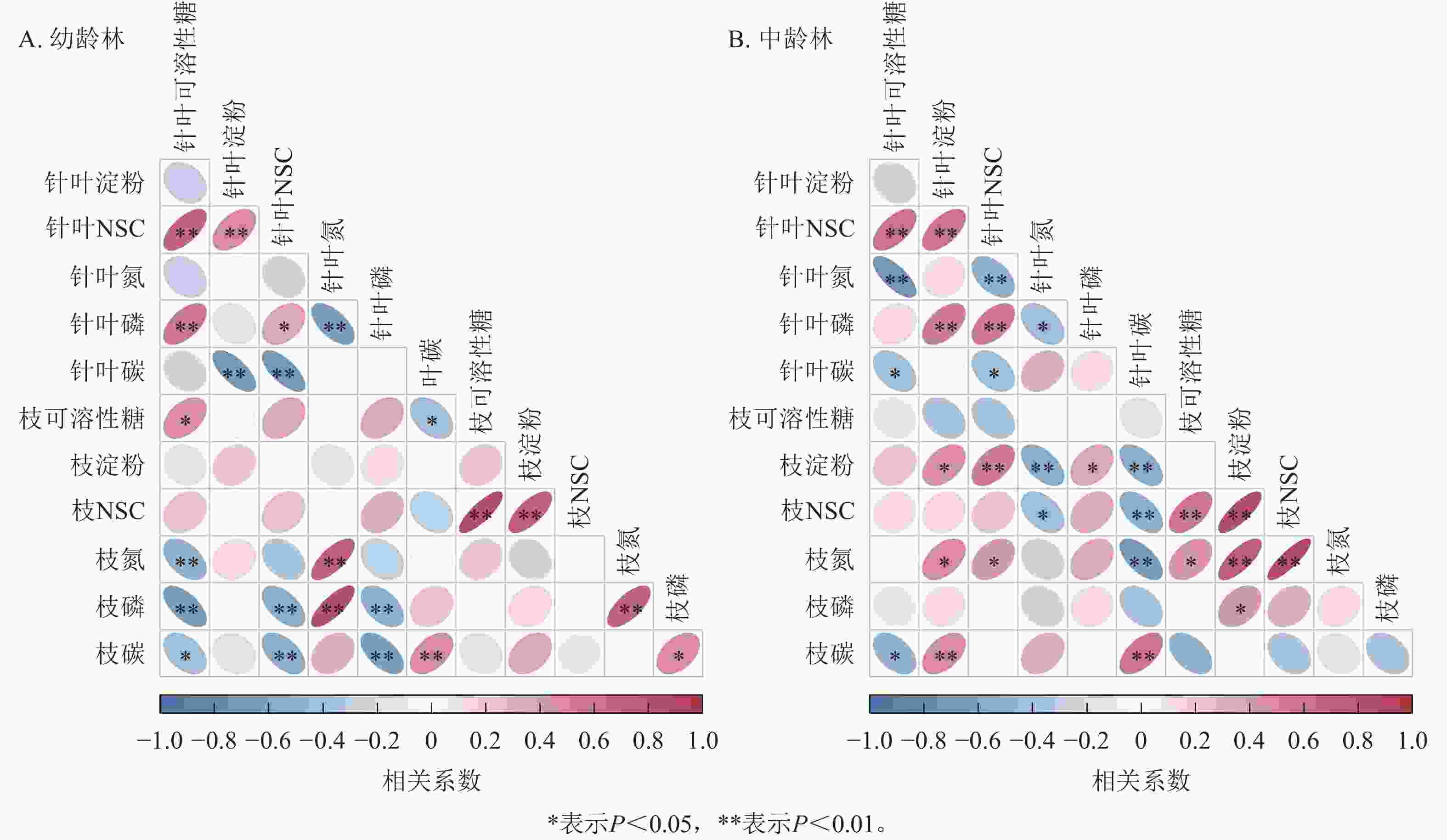
由图4可见:红松中、幼龄林NSC及其组分与C、N、P的相关性存在差异,枝和叶的部分指标间存在相关性。红松幼龄林针叶可溶性糖质量分数与枝的可溶性糖质量分数存在显著正相关(P<0.05);中龄林针叶与枝的淀粉质量分数存在显著正相关(P<0.05),针叶的NSC与枝的淀粉质量分数呈极显著正相关(P<0.01)。红松幼龄林针叶的N质量分数与枝的N、P质量分数呈极显著正相关(P<0.01),针叶的P质量分数与枝的C、P质量分数呈极显著负相关(P<0.01),针叶与枝的C质量分数呈极显著负相关(P<0.05);红松中龄林针叶与枝的C质量分数呈极显著正相关(P<0.01),与N呈极显著负相关(P<0.01)。
-
由表2可见:林龄对可溶性糖和NSC质量分数及C/N、N/P有极显著影响(P<0.01),对淀粉和N质量分数有显著影响(P<0.05);除了C和淀粉质量分数,器官对其他测定指标有极显著影响(P<0.01),月份对淀粉、NSC、N、C质量分数及C/N、N/P有极显著影响(P<0.01),对可溶性糖质量分数有显著影响(P<0.05)。林龄×器官的交互作用只对C质量分数、C/N有极显著影响(P<0.01);林龄×季节只对淀粉、NSC和N质量分数有极显著影响(P<0.01),对C质量分数有显著影响(P<0.05);器官×季节的交互作用对淀粉、N、P质量分数及C/N、N/P均有极显著影响(P<0.01)。
表 2 林龄、器官、月份及交互作用对红松林C、N、P化学计量特征与NSC质量分数的影响
Table 2. Effects of stand age, organ, month, and interaction on C, N, and P stoichiometric characteristics and NSC content of P. koraiensis plantation
变量 F 林龄 器官 月份 林龄×器官 林龄×季节 器官×季节 可溶性糖 26.89** 49.23** 6.39* 0.03 2.09 2.66 淀粉 5.57* 6.40* 43.10** 0.25 13.21** 7.56** NSC 8.67** 56.89** 24.05** 0.03 9.11** 0.59 C 1.75 2.13 21.62** 9.67** 3.78* 3.04 N 33.00* 2417.70 **44.12** 0.11 5.46** 36.12** P 0.78 43.46** 0.56 0.71 2.44 5.97** C/N 22.98** 837.43** 8.86** 12.04** 15.11 10.37** C/P 1.23 34.67** 0.80 2.50 2.77 2.82 N/P 8.38** 626.88** 24.94** 1.14 1.46 30.94** 说明:*表示P<0.05,**表示P<0.01。 -
非结构性碳水化合物的动态变化与植物的新陈代谢、防御、渗透保护和调节等密切相关[17]。本研究红松中龄林针叶的可溶性糖、NSC质量分数高于幼龄林,淀粉质量分数低于幼龄林。产生差异的原因可能是由于中龄林针叶光合能力增强,光合产物量增加,有利于提高红松中龄林在不良环境中的抵抗能力;另一方面,针叶中储存的淀粉转化为可溶性糖,以维持其旺盛的生命活动。中龄林枝的7月可溶性糖质量分数显著高于幼龄林,淀粉和NSC质量分数则相反,说明中龄林在生长旺盛期,为维持针叶的光合速率,保证红松的碳固定量,枝中可溶性糖可能向叶中转移[18]。
NSC及其组分的变化与物种、物候、生活型等因素有关[19−20]。本研究2个林龄红松针叶NSC和可溶性糖质量分数在生长季呈先下降后上升的趋势,这与SONG等[21]、SCHOONMAKER等 [22]的结论一致。在红松速生期,光合产物积累能力虽然增强,但物质能量消耗大于积累,导致速生期可溶性糖和NSC的损耗;生长初期和末期,生长损耗减少,NSC开始积累,以抵御冬季的寒冷气候。红松针叶可溶性糖和NSC质量分数均高于枝,针叶作为碳源通常具有较高的可溶性糖和NSC储量,这是植物应对贫瘠环境的重要生存机制[23]。
-
不同林龄林分在林分结构、土壤的理化性质等方面存在差异,导致养分利用策略产生变化[24]。本研究中林龄对N质量分数的影响显著,幼龄林速生期的枝叶N质量分数显著高于中龄林,这可能是红松中龄林具有较高的生长速率,植物的生理活动加强,物质合成增多,对N的消耗升高[9]。赵敏等[25]对刺槐的研究也发现:不同林龄刺槐N含量随着林龄增加有先降低后升高的趋势。C/N和C/P与植物生长速率和碳同化能力有关[26]。本研究红松中龄林9月针叶C/N、7月枝的C/N、C/P显著大于幼龄林,说明中龄林N同化能力可能大于幼龄林,50年生的红松中龄林仍具有很高的生长潜力。
N、P质量分数及C、N、P化学计量比的季节性变化差异较大,这与树种、环境等因素有关,同一地区的同种植物因年份、林龄差异也会呈现不同的变化规律[27]。N、P质量分数的升高与植物生长旺盛期需要合成大量的核酸和蛋白质导致养分积累有关[28],降低则与植物的养分稀释作用有关[4]。叶片是反映植物养分需求变化的重要器官。本研究中2个林龄红松针叶N质量分数呈先上升后下降趋势,P质量分数则相反,说明针叶P质量分数可能对养分稀释作用更敏感。本研究幼龄林枝中N质量分数和中龄林枝的P质量分数变化趋势与其针叶不同,而枝和针叶在C、N、P的利用间存在相关性,说明随着林木养分需求变化,N、P可能在枝叶间发生养分转移[29],以维持植物生长。
本研究中,2个林龄红松针叶和枝N、P质量分数差异较大,针叶N、P质量分数明显高于枝,这与对柠檬醛型樟Cinnamomum camphora[30]的研究结果一致。叶是光合作用的主要场所,是植物生命活动最活跃的部位,因此养分积累较高,枝是运输器官,养分积累少。枝中C/N和C/P大于针叶,这主要是由于枝叶间C质量分数差异不大,N、P质量分数差异是导致枝和叶的化学计量特征差异的主要原因。N/P是衡量生物体营养状况和判断植物群落受养分限制情况的重要指标。针叶中N/P可以判断养分限制,N/P临界值的阈值受到研究区域、生态系统以及植被类型等因素的影响。KOERSELMAN等[3]以N/P>16和N/P<14判断植物是否受氮磷限制,GÜSEWELL[31]则以N/P<10和N/P>20判断养分限制。本研究依据GÜSEWELL[31]的判断标准,本溪市草河口地区中、幼龄红松人工林主要表现为N限制,夏季N限制减缓。
-
本研究中、幼龄红松人工林的NSC、C、N、P的生态化学计量比存在差异,随着林龄增加,枝和叶中分配的可溶性糖质量分数增加、针叶分配的N质量分数减少。红松针叶可溶性糖、NSC和N质量分数大于枝。中、幼龄林红松针叶可溶性糖、NSC和P质量分数,C/N均在夏季较低,春、秋较高,N质量分数、C/P、N/P则相反;中、幼龄红松人工林生长季枝的季节变化趋势存在差异。可见,辽宁省本溪市草河口地区中、幼龄红松人工林均表现为N限制,可在5月前适量施用以氮肥为主的复合肥以供红松的生长需求。
Structural carbohydrate and carbon, nitrogen, phosphorus ecological stoichiometry in young and middle-aged Pinus koraiensis plantations during growing seasons
-
摘要:
目的 研究中、幼龄红松Pinus koraiensis人工林生长季非结构性碳水化合物和碳氮磷生态化学计量特征变化,以得到不同林龄针叶树种生长季的养分利用策略。 方法 以红松幼龄林(15 a)、红松中龄林(50 a)针叶、枝为研究对象,探究其非结构性碳水化合物(NSC)及其组分、碳(C)、氮(N)、磷(P)生态化学计量特征在生长季的变化。 结果 中、幼龄红松自春季到秋季针叶可溶性糖、NSC和P质量分数及C/N均呈先下降后上升的趋势,C和N质量分数、C/P、N/P则相反;中、幼龄红松人工林生长季枝的月变化趋势存在差异。红松针叶可溶性糖、NSC和N质量分数及N/P大于枝,C/N小于枝。红松中龄林枝、叶的可溶性糖质量分数高于幼龄林,针叶淀粉和N质量分数、N/P低于幼龄林,C/N、NSC质量分数略高于幼龄林。中、幼龄林枝叶间NSC和C、N、P质量分数的相关性存在差异。 结论 红松NSC及其组分、C、N、P质量分数存在季节性波动,中、幼龄红松人工林养分利用情况存在差异。辽宁省本溪市草河口地区中、幼龄红松人工林均表现为N限制,可在早春适量补充氮肥。图4表2参31 Abstract:Objective The study on the changes of ecological stoichiometric characteristics of non-structural carbohydrate, carbon, nitrogen and phosphorus in the growing season of middle-aged and young Pinus koraiensis plantations can further understand of the nutrient utilization strategies of conifer species at different ages during the growing season. Method The changes in non-structural carbohydrate (NSC), soluble sugar, starch, carbon (C), nitrogen (N) and phosphorus (P) stoichiometry in the needles and branches of young (15-year-old) and middle-aged (50-year-old) P. koraiensis were studied. Result (1) In the growing season, the contents of soluble sugar, NSC, P and C/N in the needles of middle-aged and young forests first decreased and then increased, while the contents of C and N, C/P and N/P showed the opposite trend; the seasonal changes in the branches of middle-aged and young P. koraiensis were different. (2) The contents of soluble sugar, NSC, N and N/P in the needles were greater than those in the branches, while C/N was smaller than that in the branches. (3) The soluble sugar content in middle-aged forests was higher than that in young forests, the starch, N and N/P in the needles were lower than those in young forests, the contents of NSC and C/N were slightly higher than those in young forests. (4) The correlations of NSC and C, N and P contents between the branches and needles of middle-aged and young forests were different. Conclusion The contents of NSC and its components, C, N and P contents have seasonal fluctuations, and the nutrient utilization of middle-aged and young P. koraiensis is different. In the Caohekou area of Benxi City, Liaoning Province, middle-aged and young P. koraiensis show N limitation, and could be supplemented with nitrogen fertilizer in early spring. [Ch, 4 fig. 2 tab. 31 ref.] -
Key words:
- Pinus koraiensis plantation /
- age /
- organs /
- non-structural carbohydrate /
- ecological stoichiometry
-
表 1 样地基本特征
Table 1. Basic characteristics of sample plots
林分类型 林龄/a 土壤类型 坡向 坡位 平均树高/m 平均胸径/cm 土壤全氮/(g·kg−1) 土壤全磷/(g·kg−1) 土壤全钾/(g·kg−1) 幼龄林 15 棕壤 南 中 8.23 14.93 2.53 0.61 14.70 中龄林 50 棕壤 南 中 27.80 30.76 2.32 0.54 15.62 表 2 林龄、器官、月份及交互作用对红松林C、N、P化学计量特征与NSC质量分数的影响
Table 2. Effects of stand age, organ, month, and interaction on C, N, and P stoichiometric characteristics and NSC content of P. koraiensis plantation
变量 F 林龄 器官 月份 林龄×器官 林龄×季节 器官×季节 可溶性糖 26.89** 49.23** 6.39* 0.03 2.09 2.66 淀粉 5.57* 6.40* 43.10** 0.25 13.21** 7.56** NSC 8.67** 56.89** 24.05** 0.03 9.11** 0.59 C 1.75 2.13 21.62** 9.67** 3.78* 3.04 N 33.00* 2417.70 **44.12** 0.11 5.46** 36.12** P 0.78 43.46** 0.56 0.71 2.44 5.97** C/N 22.98** 837.43** 8.86** 12.04** 15.11 10.37** C/P 1.23 34.67** 0.80 2.50 2.77 2.82 N/P 8.38** 626.88** 24.94** 1.14 1.46 30.94** 说明:*表示P<0.05,**表示P<0.01。 -
[1] 杨屹宇, 崔爽, 张芸香, 等. 油松人工林新生枝叶碳氮磷含量及化学计量比对氮添加的响应[J]. 广西林业科学, 2022, 51(1): 10−16. YANG Yiyu, CUI Shuang, ZHANG Yunxiang, et al. Responses of C, N and P contents and their stoichiometric ratios of new branches and leaves in Pinus tabulaeformis plantations to N addition[J]. Guangxi Forestry Science, 2022, 51(1): 10−16. [2] 原雅楠, 李正才, 王斌, 等. 不同林龄榧树根、枝、叶的C、N、P化学计量及内稳性特征[J]. 南京林业大学学报(自然科学版), 2021, 45(6): 135−142. YUAN Yanan, LI Zhengcai, WANG Bin, et al. Ecological stoichiometry in leaves, branches and roots of Torreya grandis with different forest ages and its stoichiometric homoeostasis[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2021, 45(6): 135−142. [3] KOERSELMAN W, MEULEMAN A F M. The vegetation N∶P ratio: a new tool to detect the nature of nutrient limitation[J]. Journal of Applied Ecology, 1996, 33(6): 1441−1450. [4] BLUM A. Osmotic adjustment is a prime drought stress adaptive engine in support of plant production[J]. Plant, Cell & Environment, 2017, 40(1): 4−10. [5] 刘元玺, 吴俊文, 赵志娟, 等. 云南松幼龄林和中龄林针叶非结构性碳水化合物与碳氮磷化学计量特征分析[J]. 西北农林科技大学学报(自然科学版), 2024, 52(3): 30−39. LIU Yuanxi, WU Junwen, ZHAO Zhijuan, et al. Characterization of non-structural carbohydrates and carbon, nitrogen and phosphorus stoichiometry of needles in young and middle-aged Pinus yunnanensis forests[J]. Journal of Northwest A&F University (Natural Science Edition), 2024, 52(3): 30−39. [6] MILLARD P, SOMMERKORN M, GRELET G A. Environmental change and carbon limitation in trees: a biochemical, ecophysiological and ecosystem appraisal[J]. New Phytologist, 2007, 175(1): 11−28. [7] 杜建会, 邵佳怡, 李升发, 等. 树木非结构性碳水化合物含量多时空尺度变化特征及其影响因素研究进展[J]. 应用生态学报, 2020, 31(4): 1378−1388. DU Jianhui, SHAO Jiayi, LI Shengfa, et al. Non-structural carbohydrate content of trees and its influencing factors at multiple spatial-temporal scales: a review[J]. Chinese Journal of Applied Ecology, 2020, 31(4): 1378−1388. [8] SARDANS J, RIVAS-UBACH A, PEÑUELAS J. Factors affecting nutrient concentration and stoichiometry of forest trees in Catalonia (NE Spain)[J]. Forest Ecology and Management, 2011, 262(11): 2024−2034. [9] 郑绍傑, 茶晓飞, 孙丽娟, 等. 不同林龄白枪杆及土壤生态化学计量及非结构性碳特征研究[J]. 核农学报, 2024, 38(2): 364−373. ZHENG Shaojie, CHA Xiaofei, SUN Lijuan, et al. Study on the characteristics of soil ecological stoichiometry and non-structural carbon in different forest ages of Fraxinus malacophylla[J]. Journal of Nuclear Agricultural Sciences, 2024, 38(2): 364−373. [10] 陈日升, 康文星, 周玉泉, 等. 杉木人工林养分循环随林龄变化的特征[J]. 植物生态学报, 2018, 42(2): 173−184. CHEN Risheng, KANG Wenxing, ZHOU Yuquan, et al. Changes in nutrient cycling with age in a Cunninghamia lanceolata plantation forest [J]. Chinese Journal of Plant Ecology, 2018, 42(2): 173−184. [11] ZHANG Qingyin, JIA Xiaoxu, SHAO Ming’an, et al. Unfolding non-structural carbohydrates from sapling to dying black locust on China’s Loess Plateau[J]. Journal of Plant Growth Regulation, 2018, 37(3): 794−802. [12] 任鹏, 伊怀虎, 韦自强, 等. 不同种源水曲柳叶片生态化学计量特征比较[J]. 森林工程, 2023, 39(5): 31−39. REN Peng, YI Huaihu, WEI Ziqiang, et al. Comparison of ecological stoichiometric characteristics of Fraxinus mandshurica leaves from different provenances[J]. Forest Engineering, 2023, 39(5): 31−39. [13] 章异平, 曹鹏鹤, 徐军亮, 等. 秦岭东段栓皮栎叶片非结构性碳水化合物含量的季节动态[J]. 生态学报, 2019, 39(19): 7274−7282. ZHANG Yiping, CAO Penghe, XU Junliang, et al. Seasonal dynamics of non-structural carbohydrate contents in leaves of Quercus variabilis growing in the east Qinling Mountain range[J]. Acta Ecologica Sinica, 2019, 39(19): 7274−7282. [14] 杨圆圆, 刘金义, 战金伟, 等. 辽东山区红松人工林生态系统多功能性研究[J]. 西北林学院学报, 2024, 39(2): 51−59, 209. YANG Yuanyuan, LIU Jinyi, ZHAN Jinwei, et al. Multifunctionality of Pinus koraiensis plantation ecosystem in eastern Liaoning mountainous area[J]. Journal of Northwest Forestry University, 2024, 39(2): 51−59, 209. [15] 王红春, 李国春, 栾国军, 等. 主要树种龄级与龄组划分: LY/T 2908—2017[S]. 北京: 中国标准出版社, 2017. WANG Hongchun, LI Guochun, LUAN Guojun, et al. Age Class and Age Group of Main Tree Species: LY/T 2908−2017 [S]. Beijing: Standards Press of China, 2017. [16] 李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理与技术[M]. 北京: 高教出版社, 2005. LI Hesheng, SUN Qun, ZHAO Shijie, et al. Experimental Principles and Techniques of Plant Physiology and Biochemistry [M]. Beijing: Higher Education Press, 2005. [17] 马玥, 苏宝玲, 韩艳刚, 等. 岳桦幼苗光合特性和非结构性碳水化合物积累对干旱胁迫的响应[J]. 应用生态学报, 2021, 32(2): 513−520. MA Yue, SU Baoling, HAN Yangang, et al. Response of photosynthetic characteristics and non-structural carbohydrate accumulation of Betula ermanii seedlings to drought stress[J]. Chinese Journal of Applied Ecology, 2021, 32(2): 513−520. [18] 王凯, 齐悦彤, 那恩航, 等. 基于器官-凋落叶-土壤生态化学计量特征的樟子松和赤松人工林养分利用策略[J]. 生态学杂志, 2023, 42(2): 274−281. WANG Kai, QI Yuetong, NA Enhang, et al. Nutrient use strategies of Pinus sylvestris var. mongolica and Pinus densifllora plantations based on ecological stoichiometry in organ-litter-soil systems[J]. Chinese Journal of Ecology, 2023, 42(2): 274−281. [19] 张海燕, 王传宽, 王兴昌. 温带12个树种新老树枝非结构性碳水化合物浓度比较[J]. 生态学报, 2013, 33(18): 5675−5685. ZHANG Haiyan, WANG Chuankuan, WANG Xingchang. Comparison of concentrations of non-structural carbohydrates between new twigs and old branches for 12 temperate species[J]. Acta Ecologica Sinica, 2013, 33(18): 5675−5685. [20] ZWIENIECKI M A, DAVIDSON A M, OROZCO J, et al. The impact of non-structural carbohydrates (NSC) concentration on yield in Prunus dulcis, Pistacia vera, and Juglans regia[J]. Scientific Reports, 2022, 12(1): 4360−4360. [21] SONG Xinzhang, PENG Changhui, ZHOU Guomo, et al. Dynamic allocation and transfer of non-structural carbohydrates, a possible mechanism for the explosive growth of Moso bamboo (Phyllostachys heterocycla)[J/OL]. Scientific Reports, 2016, 6: 25908[2024-08-01]. DOI: 10.1038/srep25908. [22] SCHOONMAKER A L, HILLABRAND R M, LIEFFERS V J, et al. Seasonal dynamics of non-structural carbon pools and their relationship to growth in two boreal conifer tree species[J]. Tree Physiology, 2021, 41(9): 1563−1582. [23] ZHANG Kerong, SONG Conghe, ZHANG Yulong, et al. Global-scale patterns of nutrient density and partitioning in forests in relation to climate[J]. Global Change Biology, 2018, 24(1): 536−551. [24] 王珂, 尹昀洲, 张明辉, 等. 林龄对红松人工林叶片-凋落物-土壤C、N、P生态化学计量特征的影响[J]. 西部林业科学, 2023, 52(2): 55−61, 74. WANG Ke, YIN Yunzhou, ZHANG Minghui, et al. Effects of stand age on ecological stoichiometric characteristics of C, N and P in leaves, litter and soil of Pinus koraiensis plantation[J]. Western Forestry Science, 2023, 52(2): 55−61, 74. [25] 赵敏, 马宝有, 赵江平, 等. 黄土丘陵沟壑区不同林龄刺槐叶片氮、磷重吸收特征[J]. 应用与环境生物学报, 2023, 29(2): 401−407. ZHAO Min, MA Baoyou, ZHAO Jiangping, et al. Characteristics of leaf nutrient resorption of Robinia pseudoacacia at different ages in hilly and Gully Regions[J]. Chinese Journal of Applied and Environmental Biology, 2023, 29(2): 401−407. [26] WANG Ning, FU Fengzhen, WANG Baitian, et al. Carbon, nitrogen and phosphorus stoichiometry in Pinus tabulaeformis forest ecosystems in warm temperate Shanxi Province, North China[J]. Journal of Forestry Research, 2018, 29(6): 1665−1673. [27] LIANG Siyi, TAN Tian, WU Danzi, et al. Seasonal variations in carbon, nitrogen, and phosphorus of Pinus yunnanenis at different stand ages[J/OL]. Frontiers in Plant Science, 2023, 14: 1107961[2024-08-01]. DOI: 10.3389/fpls.2023.1107961. [28] 孙建丽, 吴俊文, 赵娟钧, 等. 幼龄华山松不同部位碳氮磷生态化学计量的季节变化[J]. 植物营养与肥料学报, 2024, 30(3): 563−574. SUN Jianli, WU Junwen, ZHAO Juanjun, et al. Seasonal variation of C, N and P ecological stoichiometric characteristics in different organs of young Pinus armandii forest[J]. Journal of Plant Nutrition and Fertilizers, 2024, 30(3): 563−574. [29] TANG Zhiyao, XU Wenting, ZHOU Guoyi, et al. Patterns of plant carbon, nitrogen, and phosphorus concentration in relation to productivity in China’s terrestrial ecosystems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(16): 4033−4038. [30] 赵姣. 柠檬醛型樟枝叶氮磷钾含量生长季动态变化特征[J]. 中南林业科技大学学报, 2022, 42(1): 20−26. ZHAO Jiao. Analysis of nitrogen, phosphorus and potassium accumulation in leaves and branches of Cinnamomum spp. ct. citralifera Z. N. Jin[J]. Journal of Central South University of Forestry & Technology, 2022, 42(1): 20−26. [31] GÜSEWELL S. N∶P ratios in terrestrial plants: variation and functional significance[J]. New Phytologist, 2004, 164(2): 243−266. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20240482







 下载:
下载: