-
玻璃化冷冻保存技术对鱼类卵细胞的冷冻保存仍少见报道[1]。鱼类的卵与一般细胞相比由于其体积大,相对比表面积小,含水率高,卵黄多等特点,限制了水分的渗出和抗冻剂渗入的速率。同时由于卵细胞具有高度的冷冻敏感性,容易造成冷冻损伤[2]。因此,探索适合于鱼类卵细胞玻璃化冷冻保存技术,可为建立鱼卵细胞库提供技术与方法。本研究以鲫鱼Carassius cuvieri未成熟的卵细胞为材料,对几种毒性相对较低的渗透性抗冻剂的混合比例、玻璃化冻存对卵细胞存活率和琥珀酸脱氢酶(SDH)活性的影响进行研究,以期为鱼类卵细胞冷冻保存及损伤机制的研究提供实验依据。
HTML
-
选取性发育成熟的雌性鲫鱼,用体积分数为75%乙醇消毒,剪开腹部,取出两侧卵巢,置于D-hank’s液中。去除卵巢周围的脂肪、结缔组织及血块等,撕开卵巢外膜并轻轻抖动,用移液管轻轻吹打卵细胞5~10次至卵细胞单个分离。用D-hank’s 溶液洗涤分离好的卵细胞2~3次[6]。
-
实验根据本课题组已成功冻存胚脑[4]、软骨[5]等细胞的玻璃化溶液为基础进行改良。根据Plachinta等[6]、Zhang 等[7]的研究结果,选用了对鱼卵细胞毒性较低的1,2-丙二醇(PG)为主因子,辅以二甲基亚砜、甲醇、乙酰胺、蔗糖、海藻糖和聚乙二醇(平均分子量为4000)等保护剂成分,再根据章龙珍等[8]和 Zhang 等[9]研究的耐受极限浓度,通过预实验确定各组分的浓度范围,然后进行均匀设计,以是否含有海藻糖分成2 组,共11 种玻璃化溶液(表 1~2),并根据Guan等[1]、章龙珍等[10]和田永胜等[11]的方法进行玻璃化形成能力检测,各组均能形成玻璃化。
玻璃化溶液 渗透性保护剂 非渗透性保护剂 1,2-丙二醇/(g.L-1) 二甲基亚砜/(g.L-1) 甲醇/(g.L-1) 乙酰胺/(g.L-1) 蔗糖/(mol.L-1) 聚乙二醇/(g.L-1) VS1 100.0 120.0 140.0 150.0 0.4 50.0 VS2 120.0 160.0 120.0 140.0 0.7 20.0 VS3 140.0 200.0 100.0 130.0 0.3 60.0 VS4 160.0 100.0 150.0 120.0 0.6 30.0 VS5 180.0 140.0 130.0 110.0 0.2 70.0 VS6 200.0 180.0 110.0 100.0 0.5 40.0 Table 1. Vitrification solutions without trehalose
玻璃化溶液 渗透性保护剂 非渗透性保护剂 1,2-丙二醇/(g.L-1) 甲醇/(g.L-1) 海藻糖/(mol.L-1) 聚乙二醇/(g.L-1) VSa 120.0 140.0 0.05 60.0 VSb 140.0 130.0 0.15 20.0 VSc 160.0 120.0 0 80.0 VSd 180.0 110.0 0.10 40.0 VSe 200.0 150.0 0.20 100.0 Table 2. Vitrification solutions with trehalose
-
将鲫鱼卵细胞在0 ℃下进行预平衡,采用三步平衡法:取100粒卵在1∶2稀释的玻璃化液中平衡10 min,再在1∶1稀释的玻璃化液中,平衡10 min后,取出转入玻璃化液中平衡10 min,分装入2.0 mL冷冻保存管中。
-
将上述冷冻管进行标记,直接投入到液氮(-196 ℃)中保存,冻存时间为:1,2,3,4,6和8 d。
-
从液氮中取出的冷冻管直接投入37 ℃的水浴中,充分振荡使其快速复温融化。
-
复温融化后样品迅速转移到无菌离心管中。然后加入2倍体积的1.5 mol·L-1的蔗糖溶液,摇匀、静置10 min,去上清液,再加入2倍体积的0.5 mol·L-1的蔗糖溶液重悬浮,然后静置10 min,去上清液,加2倍体积的D-hank’s液重悬浮3次,去上清,加D-hank’s液摇匀备用。
-
以台盼蓝拒染法检测细胞存活率。计算公式为: 细胞的存活率=(洗脱后的活细胞数/洗脱后的细胞数)×100%。
-
根据Mosmann的方法[12]稍加改进,取冻存后洗脱的卵细胞于16孔无菌培养板中,加入1.0 mL 培养液,再加入5.0 g·L-1的 MTT溶液100 μL,放入37 ℃的50.0 mL·L-1二氧化碳培养箱中孵育240 min,使MTT充分被还原,然后加入1.0 mL二甲基亚砜,摇匀30 min,使结晶物充分溶解后,在酶标仪上测定570 nm处的吸光值。
-
以上方法均随机选取多个样本,每个样本多次重复。采用Excel和SPSS软件对数据进行处理,利用单因素方差分析(one-way ANOVA)进行分析,比较结果用字母a,b,c,d,e,f在图中标记,图中在表示标准误差的误差线上方的字母相同表示差异不显著(P>0.05),字母不同表示差异显著(P<0.05)。
1.1. 鲫鱼卵细胞的分离
1.2. 鲫鱼卵细胞玻璃化溶液的配方设计
1.3. 鲫鱼卵细胞的玻璃化冻存程序
1.3.1. 冷冻前的预平衡
1.3.2. 冻存
1.3.3. 复温
1.3.4. 冻存液的洗脱
1.4. 指标检测
1.4.1. 卵细胞存活率检测
1.4.2. MTT[3-(4,5)-dimethylthiahiazo(-z-y1)-2,5-diphenytetrazoliumromide]法检测卵细胞琥珀酸脱氢酶(SDH)活性
1.5. 统计学方法
-
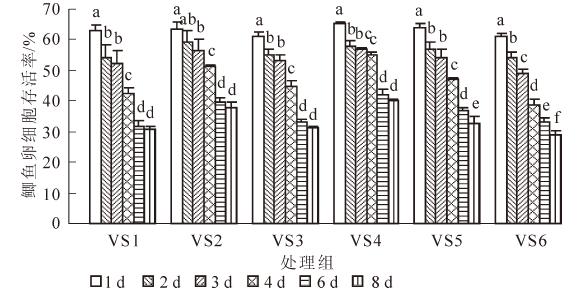
图 1所示为不含海藻糖组(VS1~VS6)玻璃化冻存液对鲫鱼卵细胞存活率的影响。经1~8 d的冻存后,各组卵细胞的存活率都随冻存天数的延长而呈下降趋势,6 d后下降趋势减弱。VS1组和VS3组在1~2及3~6 d的存活率下降幅度较大(P<0.05),在2~3 d和6~8 d之间变化不明显(P>0.05);VS2组的存活率在1,3,4和6 d之间存在显著性差异(P<0.05);VS4组的存活率在1,2,4和6 d之间存在显著性差异(P<0.05);VS5组的存活率除在2~3 d之间变化不明显外,在其他各天数之间都有显著变化(P<0.05);VS6组各天数之间均存在显著性差异(P<0.05)。比较各组存活率,VS4组的卵细胞存活率最高,经过1,2,3,4,6和8 d冻存后,卵细胞的存活率分别为65.49%±0.49%,57.97%±1.68%,56.79%±0.40%,54.89%±1.26%,41.82%±1.87%,39.96%±0.82%。
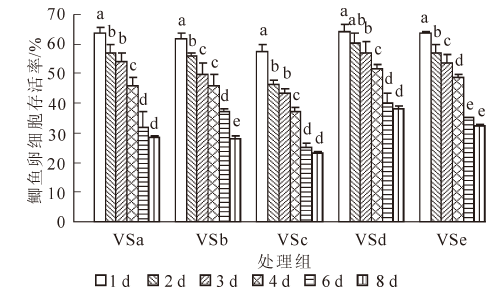
图 2所示为海藻糖组(VSa~VSe)玻璃化冻存液在经过1~8 d的冻存后,对卵细胞存活率的影响。各组卵细胞的存活率都随冻存天数的延长而呈下降趋势,6 d后下降趋势减弱。VSa组和VSc组的存活率在1,2,4和6 d之间存在显著性差异(P<0.05);VSb组的存活率除在3~4 d之间下降不明显(P>0.05)外,在其他各天数之间都有显著性下降(P<0.05);VSd组的存活率在1,3,4和6 d之间存在显著性差异(P<0.05);VSe组的存活率在前6 d下降较快(P<0.05),在6~8 d之间变化不明显(P>0.05)。在各组玻璃化液中,VSd组的卵细胞存活率要高于其他组,经过1,2,3,4,6和8 d冻存后,卵细胞的存活率分别为64.40%±2.12%,60.24%±3.36%,57.20%±3.55%,51.90%±1.14%,40.29%±3.14%,37.98%±1.13%。
-
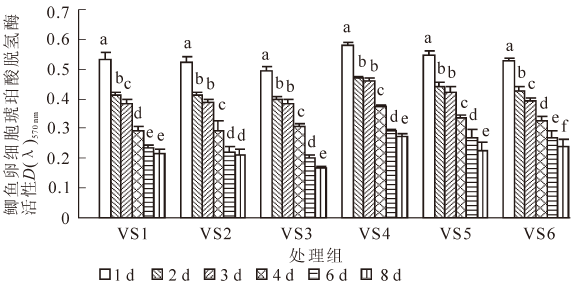
图 3所示为不含海藻糖组(VS1~VS6)玻璃化冻存液在经过不同时间的冻存后,对鲫鱼卵细胞内琥珀酸脱氢酶(SDH)活性的影响。随着冻存天数的延长,冻存后的细胞内SDH活性逐渐降低。VS1组的SDH活性在前6 d下降幅度较大(P<0.05),在6~8 d变化不明显(P>0.05);VS2组的SDH活性在1,2,4和6 d之间存在显著性差异(P<0.05);VS3,VS4和VS5的细胞经检测后发现,其吸光值在2~3 d之间无显著性变化(P>0.05)。VS6组各天数之间均存在显著下降(P<0.05)。从整体上来看,在各组玻璃化液中,VS4组冻存后卵细胞内的SDH活性要明显高于其他组,在经过1,2,3,4,6和8 d冻存后,MTT实验检测到的吸光值分别为0.581±0.010,0.469±0.006,0.462±0.007,0.373±0.006,0.291±0.008,0.272±0.011。
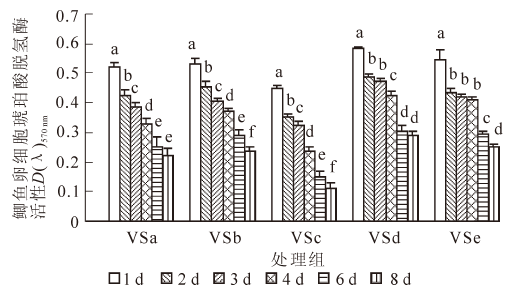
图 4为海藻糖组(VSa~VSe)玻璃化冻存液对卵细胞内琥珀酸脱氢酶(SDH)活性的影响。在冻存过程中,卵细胞内SDH活性逐渐降低。VSa组的SDH活性在前6 d下降幅度较大(P<0.05),在6~8 d变化不明显(P>0.05);VSb和VSc组各天数之间均存在显著性下降(P<0.05);VSd组的SDH活性在1,2,4和6 d之间存在显著性差异(P<0.05);VSe的细胞经检测后发现,其吸光值在2~4 d之间无显著性差别(P>0.05)。比较各组玻璃化冻存液,VSd组冻存后鲫鱼卵细胞内的SDH活性要明显高于其他组,在经过1,2,3,4,6和8 d冻存后,MTT实验检测到的吸光值分别为0.585±0.007,0.490±0.009,0.473±0.008,0.423±0.014,0.305±0.016,0.290±0.016。
2.1. 玻璃化冻存对鲫鱼卵细胞存活率的影响
2.2. 玻璃化冻存对鲫鱼卵细胞中琥珀酸脱氢酶(SDH)活性的影响
-
玻璃化溶液的组分和冷冻保护剂的配比是冻存获得成功的关键,玻璃化冻存液应具备低毒、高渗和高玻璃化形成能力等特征。大多数玻璃化冻存液在高浓度使用时,对卵细胞有较大毒性,容易造成细胞渗透损伤[13]。冷冻保护剂的混合使用可能使单独使用时的毒性得到部分中和。本研究根据Guan等[1]、Plachinta等[6]、Zhang等[7]和Zhang等[14]的研究结果,结合本课题组已有的研究成果[4-5],选用1,2-丙二醇、二甲基亚砜、甲醇和乙酰胺等为渗透性保护剂,海藻糖、蔗糖和聚乙二醇等为非渗透性保护剂,配制成玻璃化溶液。1,2-丙二醇具有较低毒性和较强玻璃化形成能力。二甲基亚砜在大量实验中被证明具有易玻璃化和高渗透性等特点。乙酰胺是一种具有较高渗透性及毒性中和能力的保护剂。甲醇已被证明在斑马鱼Danio rerio的胚胎以及几种鱼类精子的冷冻保存具有明显效果[6]。海藻糖对生物体或生物大分子具有抗脱水、抗冷冻、抗高渗等非特异性保护作用。结果表明:不含海藻糖组的玻璃化溶液VS4和海藻糖组的VSd 冻存鲫鱼卵细胞后的存活率较高,其组分分别为160.0 g·L-1 1,2-丙二醇,100.0 g·L-1 二甲基亚砜,150.0 g·L-1甲醇,120.0 g·L-1 乙酰胺,0.6 mol·L-1蔗糖,30.0 g·L-1 聚乙二醇以及180.0 g·L-1 1,2-丙二醇,110.0 g·L-1甲醇,0.1 mol·L-1 海藻糖,40.0 g·L-1 聚乙二醇。且发现在海藻糖的浓度明显低于蔗糖时,2组的存活率并没有显著差异。海藻糖可能比蔗糖更适合作为玻璃化冷冻保护剂。
卵细胞膜对冷冻非常敏感,容易在冷冻过程中损伤[15],影响卵细胞的进一步发育[16]及受精时精卵质膜的融合。当细胞处于过冷状态时,细胞膜上从液态转变为凝胶态,同时,细胞膜的不等收缩会导致机械性的膜破裂及膜表面结构的改变,从而导致细胞死亡[17-18]。本研究以台盼蓝拒染法来检测玻璃化冻存后鲫鱼卵细胞的存活率,发现随着冻存天数的延长,细胞存活率成下降趋势,在6 d后基本达到稳定。我们认为玻璃化冷冻保存过程中冻存液浓度变化以及冰晶形成等都会对膜造成损伤,加入混合冷冻保护剂可以减轻这种损伤。
线粒体是卵细胞中最丰富的细胞器之一,数量巨大[19],其主要功能是为卵细胞的成熟、受精及卵裂提供能量。线粒体对环境因素的作用非常敏感,许多环境因素的影响都能迅速引起线粒体发生变化[20]。琥珀酸脱氢酶(SDH)位于线粒体内膜上,它参与线粒体内多种与细胞生命活动相关的反应,如呼吸链的电子传递、三磷酸腺苷(ATP)的合成等[21]。因此,SDH 活性检测对评价冷冻前后线粒体功能具有重要意义[22]。卵细胞经玻璃化冻存后,SDH 活性显著下降。可能是细胞在冷冻与解冻后,线粒体部分损伤,使线粒体内的酶分布发生改变,甚至引起酶的释放。这些酶游离出来进入基质,影响了酶的稳定性和活性;也有可能是冷冻保护剂的高毒性引起酶复合蛋白体解聚,造成酶系结构和功能的变化。
-
从本研究结果分析,随着冻存天数的延长,鲫鱼卵细胞的存活率下降较为明显,但6 d后,存活率基本趋于稳定;而鲫鱼卵细胞的琥珀酸脱氢酶(SDH)活性则持续降低。玻璃化冻存液VSd组的配方及玻璃化冻存方法对保存鱼鲫鱼卵细胞有一定效果,但有待进一步研究和改进。













 DownLoad:
DownLoad: