-
雷竹Phyllostachys violascens是中国长江以南地区广泛分布的优良笋用竹种,自20世纪90年代初以来,以冬季覆盖和大量施肥为主要特征的集约栽培技术已在生产上大面积推广[1]。长期集约栽培导致土壤pH 值大幅下降、养分比例失调、酶活性异常、土壤微生物量碳和微生物区系发生改变等[2]。林地覆盖竹林由于环境条件的改变,尤其是土壤温度的变化和有机覆盖物及其腐解过程的吸引集聚作用,也使土壤真菌数量与比例明显提高[3-4]。真菌是土壤中重要的微生物资源,在分解纤维素、半纤维素、木质素、果胶及还原氮、溶解磷等生态过程中起重要作用。土壤真菌有着形态、基因以及功能上的多样性,且无法在地理上划分界限,因此,土壤真菌的研究对调查方法的依赖更大[5]。长期覆盖雷竹林地高碳氮比的有机覆盖物输入,有利于分解木质素纤维素能力强的微生物富集[6]。合成染料广泛应用于纺织印染和皮革处理等行业,由于能够抵抗光、水、许多化合物和生物攻击,很难被常规污水处理系统中的微生物所分解[7]。如果印染废水不加以处理就直接排放到河流,势必造成严重的环境污染。许多物理和化学方法虽然可以从废水中获得较好的染料脱色效果,但价格昂贵、需要耗费大量的能源,并且常常产生一些有毒的分解产物等,从而大大限制了这些方法在工业印染废水处理中的实际应用[8]。生物学方法去除染料颜色跟物理化学方法相比,有许多优势,比如成本低、生态友好等[9]。近年来,陆续报道了一些细菌、真菌能够去除不同种类染料的颜色[10-13]。细菌在无氧的条件下脱色通常只能去除一种类型的偶氮染料,同时又常常产生一些有害的分解产物,这些不利因素限制了细菌在处理混合种类染料工业废水中的应用。因此,越来越多的研究人员把注意力投向了真菌脱色研究,人们也已经从单一的研究白腐真菌开始转向对更多样的脱色真菌的研究[14-16]。包括白腐真菌、霉菌、酵母菌等大批真菌,业已被发掘出来用于染料的脱色与降解[17]。真菌降解染料主要是由于其具有非特异性和非选择性的胞外酶系[12]。白腐真菌是目前研究最多、染料脱色过程中最有效的真菌资源,其菌丝体靠降解木质素—纤维素材料的能力穿入木质细胞腔内,释放的木质素降解酶系为非底物专一性酶,分泌到细胞外对多种木质素成分和染料具有广谱的氧化降解作用[18]。由于合成染料的结构与木质素组分的结构相似,具有分解木质素能力的微生物同样具有分解染料的能力[9]。目前,已有从雷竹林土壤中分离并筛选到分解合成染料[6]和纤维素降解真菌[19]的报道,但前述研究中仅限于在固体培养基上进行分解染料测试或只测定酶活性,对雷竹林土壤染料降解真菌的筛选特别是脱色效果的研究报道较少。为此,本研究以不同种植年限的雷竹林土壤为材料,采用基于平板分离培养和内转录间隔区(internal transcribed spacers,ITS)序列分析的方法,解析雷竹林土壤真菌种群特征并筛选染料降解功能菌株,通过摇瓶发酵发掘具有染料脱色潜力的真菌资源,为印染废水的微生物降解奠定基础。
HTML
-
土壤样品采自浙江省临安市太湖源镇(30°16′N,119°34′E)。土壤为粉砂岩母质上发育的红壤土类。在研究区内选择立地条件基本一致,栽培历史分别为1,7,12,15 a的雷竹林样地。集约栽培模式为:雷竹定植后的第1~5 年基本不施肥或施少量复合肥,从雷竹栽培的第6年起开始实施集约栽培;每年11 月下旬至12 月上旬在雷竹林地表先覆盖15.0 cm 稻草作为发酵增温层,再覆盖20.0 cm的砻糠作为保温层以利于竹笋早发。自然出笋时撤去上层的覆盖物砻糠,而下层的稻草则已基本腐烂入土。不同年份雷竹林随机选取3个经营措施一致的重复样地,共建立12个20.0 m × 20.0 m的样地,各个样地用五点取样法采集0~20.0 cm土壤样品。同一样地新鲜土样充分混匀后,去除大的石块和植物残体,过2.0 mm钢筛后形成1个混合样品,共计12个土样装入密封袋,放入冰桶带回实验室。采集样品分为2份,1份冷藏于4 ℃用于真菌分离等;另外1份于室内自然风干,研磨过筛后用于土壤基本理化性质分析。土壤pH 值采用水浸提酸度计法[m(土)∶m(水)=1.0∶2.5];土壤有机碳用重铬酸钾外加热法测定;土壤全氮采用凯氏定氮法测定;有效磷采用Bray 法测定;速效钾先用乙酸铵浸提,后在火焰光度计上测定[20];土壤粒径分布用比重计法[21]。不同栽培年限雷竹林土壤的基本理化性质如表 1。
栽培年限/a pH值 有机碳/(g·kg-1) 全氮/(g·kg-1) 碳氮比 有效磷/(mg·kg-1) 速效钾/(mg·kg-1) 砂粒/% 粉粒/% 黏粒/% 1(-) 6.66 a 18.60 bc 1.71 a 11.03 b 39.87 b 74.67 c 38.49 a 25.64 a 35.88 a 7(1) 4.93 b 20.07 b 1.74 a 11.72 b 107.93 b 273.67 b 42.13 a 24.81 a 33.06 a 12(4) 4.40 bc 28.14 a 2.00 a 14.14 a 207.27 a 286.33 b 35.67 a 30.38 a 33.95 a 15(10) 4.01 c 29.09 a 2.03 a 14.20 a 211.00 a 346.00 a 44.12 a 23.37 a 32.51 a 说明:同列不同字母代表差异达显著水平(P <0.05)。 Table 1. Soil physical and chemical properties of Phyllostachys violascens stand with different culture years
-
采用稀释平皿法[22]在孟加拉红培养基上分离真菌。取10.0 g新鲜土壤样品加入到100.0 mL灭菌去离子水中,225 r·min-1,30 min摇匀倍比稀释制成土壤稀释液,吸取0.1 mL梯度稀释液(10-1~10-5)涂布于孟加拉红固体培养基上,3次重复,置于28 ℃避光培养5~7 d。培养过程中及时观察,挑取形态学特征不一致的单菌落接种于马铃薯葡萄糖琼脂(PDA)固体培养基上纯化,真菌形态学特征鉴别依据《真菌鉴定手册》。纯化后的真菌定期转接于PDA平板上,4 ℃ 保藏备用。
-
ITS分子鉴定具体过程参照 Schoch 等[23]的方法,聚合酶链式反应(PCR)扩增引物为:ITS5:5′-TCCTCCGCTTATTGATATGC-3′,ITS4:5′- GGAAGTAAAAGTCGTAACAAGG-3′。扩增产物利用pMD 18-T 载体进行克隆后测序(上海生工),将得到的序列输入GenBank,与已收录的真菌基因序列进行序列比对(BLAST)比较,找出其最高相似性序列。利用ClustalX 软件对供试菌株和参比菌株先进行ITS基因的多序列对齐,再利用Mega 4.0 软件,采用邻接法(neighbor-joining)构建系统发育树。分离真菌ITS序列的GenBank登录号为KP027644-KP027648。
-
使用打孔器(直径6.0 mm)沿真菌菌丝(菌落)边缘打孔,取直径6.0 mm的菌片接种到含有100.0 mg·L-1 苯胺蓝的PDA 固体培养基上,28 ℃ 避光培养观察各分离菌的脱色能力。能形成明显水解圈的真菌接种于含有100.0 mg·L-1 其他染料(刚果红、橙黄G、结晶紫、酸性品红、甲基橙)的PDA 固体培养基上,进一步观察对其他染料的脱色能力。对脱色染料的种类较多、能力较强的真菌进行形态学鉴别及ITS序列分子鉴定,并用于后续的脱色效果研究。
-
向250.0 mL 锥形瓶中加入100.0 mL纤维素钠-结晶紫液体培养基,实验设置3次重复,培养基具体配方为:磷酸二氢钾(KH2PO4) 1.0 g;氯化钠(NaCl) 0.1 g;七水合硫酸镁(MgSO4·7H2O) 0.3 g;硝酸钠(NaNO3) 2.5 g;氯化铁(FeCl3) 0.01 g;氯化钙(CaCl2) 0.1 g;结晶紫质量浓度梯度为0,100.0,200.0,300.0,400.0,500.0 mg·L-1共6个;每个结晶紫梯度的培养基最后用双蒸水(ddH2O)定容至1 000.0 mL。用棉塞和牛皮纸封装,121 ℃高温高压灭菌后备用。将筛选出的菌株平板培养4.0 d 后,刮取培养皿中的菌丝放入无菌水中匀浆(3 次,6~8 s·次-1),接种液体培养基,接种量为10.0 mL。空白对照加入10.0 mL 无菌水,不接菌。置于28 ℃,140 r·min-1振荡培养8.0 d,每天取样并检测各处理的吸光度D(λ)变化。绘制结晶紫的吸光度—质量浓度标准曲线,将记录的吸光度D(λ)值换算为相应浓度,统计一定时间内培养基中染料的浓度变化,同时观察菌体的生长情况。将每次检测样品的初始吸光度D(λ)值依照标准曲线换算成浓度c0,终浓度为c1,按如下公式计算脱色率。染料脱色率=[(c0-c1)/c0]×100%。
菌丝生物量测定参照袁海生等[13]的方法,在吸光度测量结束后,将培养液过滤并用蒸馏水冲洗数次,真空抽滤后放至烘箱烘干(140 ℃,100 min)至恒量,称量即为菌丝生物量。
1.1. 土壤样品采集
1.2. 土壤真菌的分离
1.3. 真菌种属特征鉴定
1.4. 真菌脱色能力测试
1.5. 不同的染料浓度对真菌脱色效果的影响
-
依据分离出真菌菌落的颜色、生长速度、孢子形态等特征,从竹林土壤中共分离得到形态特征明显不同的真菌分离物61株。将各真菌分离物归类后提取基因组DNA,PCR扩增获得约550~650 bp的ITS序列,通过BLAST比对进行初步的种属鉴定。结果表明:与真菌分离物ITS序列最为相似的种属,分别为木霉属Trichoderma sp.,绿木霉T. virens,T. crassum,棘孢木霉T. asperellum,钩状木霉T. hamatum,Hypocrea flaviconidia,Hypocrea cordyceps,黑酵母菌Aureobasidium pullulans,真菌1种,卷枝毛霉Mucor circinelloides等,分属于半知菌亚门Deuteromycotina,子囊菌亚门Ascomycotina和接合菌亚门Zygomycotina。
-
将上述真菌分离物以平皿培养的方式,接种到苯胺蓝培养基上进行初步筛选,发现有5株真菌分离物能形成明显的水解圈。进一步测试这5株真菌对5种结构不同的合成染料—刚果红/橙黄G(偶氮类)、结晶紫/酸性品红(三苯甲烷)、甲基橙等的分解能力。在固体培养基上,该5株分离物对结晶紫、橙黄G、刚果红、甲基橙脱色能力和速度均有差异(表 2)。对3种不同类型共5种合成染料脱色效果表明:5株真菌分离物对酸性品红脱色效果最好,其次是结晶紫,对刚果红、橙黄G和甲基橙脱色能力一般。由于结晶紫和酸性品红同属三苯甲烷类染料,说明这5株真菌分离物对三苯甲烷类染料有较好的脱色效果,但这些菌株起初筛选时接种到苯胺蓝培养基上都能形成明显的水解圈,也表明真菌脱色效果与生长时间有一定关系。
菌株 不同染料(20.0 mg·L-1)脱色效果 刚果红 橙黄G 结晶紫 酸性品红 甲基橙 P7-2-1 -(+) + + ++ + P7-2-2 - -(+) +++ +++ -(+) P1-2-2 + -(+) ++ + -(+) P7-2-3 +++ ++ + +++ -(+) P12-2-4 + + ++ ++ ++ 说明: -,无脱色现象或不确定;-( + ),几乎不脱色或微脱色;+,轻度脱色;++,中度脱色;++( + ),重度脱色;+++,完 全脱色。 Table 2. Decolorization screening of synthetic dyes by five isolate fungi in agar media
-
上述5株真菌分离物ITS序列BLAST比对结果表明:分离物P7-2-1,P7-2-3,P12-2-4分别与黑酵母菌Aureobasidium pullulans,卷枝毛霉Mucor circinelloides,木霉菌属Trichoderma sp.相似度最高,相似度为99%~100%;而P7-2-2和P1-2-2与真菌1种相似度较高,分别为97%和90%。
根据上述基因序列比对的结果,从GenBank 数据库中获取了8个参比菌株的序列,得到反映待测真菌菌株与参比菌株之间进化与发育关系的系统发育树(图 1)。由ITS序列所构成的系统发育树表明,P7-2-1,P7-2-3,P12-2-4与黑酵母菌、卷枝毛霉、木霉菌属位于同一个进化枝上,结合形态鉴定结果,该3株真菌可分别鉴定为黑酵母菌、卷枝毛霉菌、木霉菌属。而P7-2-2和P1-2-2菌株自身相似性较高,与草酸青霉菌Penicillium oxalicum亲缘关系相对较近,但分子种属特性不够明确尚需进一步鉴定,由此也暗示集约经营雷竹林土壤具有挖掘染料降解真菌资源的潜力。
-
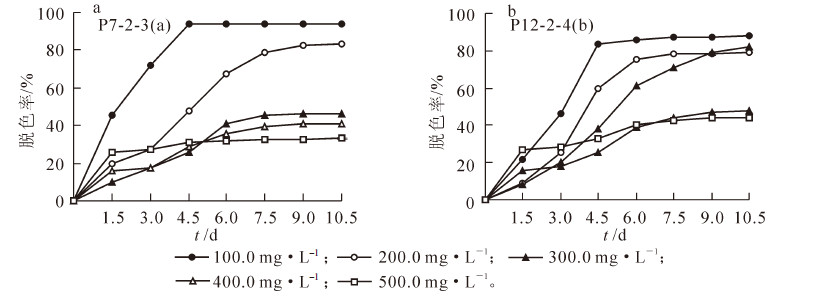
基于5株真菌分离物对合成染料脱色的效果,选择综合脱色能力较好的菌株P7-2-3和P12-2-4(图 2),分别接种到不同质量浓度梯度结晶紫染料中进行液体发酵脱色研究。菌株P7-2-3接种10.5 d内染料的脱色效果如图 3所示,接种4.5 d后,100.0 mg·L-1和200.0 mg·L-1质量浓度的脱色率明显高于其余3个浓度梯度,且100.0 mg·L-1和500.0 mg·L-1等2个质量浓度的脱色率基本趋于稳定(图 3a),显示低质量浓度染料条件下菌株呈现出较高的脱色率的趋势。接种10.5 d后菌株P7-2-3对100.0 mg·L-1和200.0 mg·L-1质量浓度梯度结晶紫染料的脱色率分别为94.1%和83.0%,而对300 mg·L-1,400 mg·L-1和500 mg·L-1质量浓度的脱色率分别只达到46.0%,41.0%和33.0%左右。由此可见:结晶紫染料质量浓度达到300.0 mg·L-1以上时对菌株P7-2-3的脱色能力起到明显的抑制作用,而质量浓度低于200.0 mg·L-1时其抑制作用并不明显。
菌株P12-2-4对不同质量浓度梯度的结晶紫染料脱色率随培养时间的延长而提高,接种4.5 d时对不同质量浓度梯度染料的脱色率表现出与菌株P7-2-3相似的趋势;但接种6.0 d后300.0 mg·L-1质量浓度梯度的染料脱色率随培养时长而不断提高,并在接种9.0 d时与200.0 mg·L-1质量浓度的脱色率接近,虽然接种10.5 d时脱色率略高于200.0 mg·L-1质量浓度的处理但并无显著差异(图 3b)。接种10.5 d后P12-2-4菌株对100.0,200.0和300.0 mg·L-1等3个质量浓度结晶紫染料脱色率分别达到88.1%,78.8%和82.0%,但对400.0 mg·L-1和500.0 mg·L-1质量浓度的染料脱色率分别只达到47.3%和44.3%,可见结晶紫染料浓度达到400.0 mg·L-1以上对菌株P12-2-4的脱色能力起到明显的抑制作用。
-
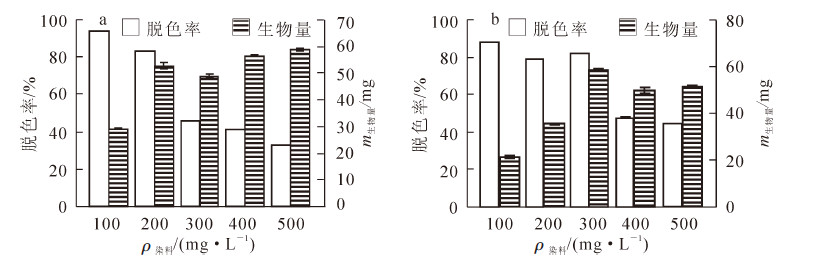
上述菌株液体发酵培养10.5 d后,对不同结晶紫染料质量浓度下的菌丝生物量进行测定,染料脱色率与菌株P7-2-3,P12-2-4生物量的关系如图 4所示。菌株P7-2-3经过10.5 d培养后脱色率随结晶紫质量浓度增加而下降(图 4a),菌丝生物量则呈现一定程度的上升。菌株P12-2-4经过10.5 d培养后脱色率在结晶紫浓度达到400.0 mg·L-1后明显下降(图 4b),而菌丝生物量在染料质量浓度达到300.0 mg·L-1时达到最大。为准确描述染料不同质量浓度下菌株脱色效果与菌丝生物量之间的关系,计算了每个质量浓度下最终降解结晶紫染料的总质量,并与对应质量浓度下菌丝生物量进行相关分析表明,菌株P7-2-3降解染料质量与对应菌丝生物量之间Pearson相关系数为0.972(P<0.01,n=15),而菌株P12-2-4两者之间Pearson相关系数为0.983(P<0.01,n=15),表明菌株降解结晶紫的质量与菌丝生物量之间存在显著的正相关关系。
2.1. 竹林土壤真菌分离物的基本种属特征
2.2. 染料脱色真菌筛选
2.3. 脱色真菌分子种属鉴定
2.4. 染料质量浓度对菌株脱色效果的影响
2.5. 染料脱色效果与菌丝生物量的关系
-
长期林地覆盖经营势必导致雷竹林表层土壤酸化和主要养分的过量积累,真菌数量总体上随林地覆盖年限的增加呈显著升高趋势[4]。而富含纤维素和木质素且高碳氮比的有机覆盖物,留存于雷竹林土壤中短期内难以自然腐解,也是导致林地土壤发生物理、化学和生物性劣变的重要原因之一[19]。本研究采集了4个年份的雷竹林表层土壤,理化性质分析表明,土壤pH随栽培年限的增加而显著下降,土壤有机碳、全氮、有效磷和速效钾随栽培年限延长而显著增加,同时集约栽培4 a(12 a)和10 a(15 a)后土壤碳氮比显著提高,印证了前人的研究结果。通过对真菌分离物初步的形态分类和分子种属鉴定表明,分离频次最高的真菌种类为木霉菌属。木霉菌属真菌广泛分布于土壤、植物根际、腐烂的木材和其他基质中,环境适应性强[24],易于分离纯化和培养,可利用各种简单或复杂的碳源和氮源生长繁殖[25]。目前,国内外对木霉属真菌功能的研究表明,木霉可产生拮抗物质和溶菌酶从而抑制其他病原菌的生长,还可产生纤维素酶和其他水解酶类[26-27]。长期覆盖经营雷竹林有机覆盖物残留和表层土壤碳氮比显著提高,也为筛选具有高效降解能力的真菌菌株奠定了基础。
微生物在自然界的纤维素降解过程中起关键和主要作用,其中真菌的贡献最大,典型代表有木霉属Trichoderma sp.[28]和青霉属Penicillium sp.[29]等。本研究对分离、纯化得到的真菌分离物进行降解合成染料的功能筛选。结果表明:5株真菌对3类共5种染料脱色能力和速度有所差异,对同属三苯甲烷类的酸性品红和结晶紫有较好的脱色效果。经形态与基于ITS序列的分子鉴定结果表明:对5种染料综合脱色效果较好的P7-2-3和P12-2-4菌株分别为卷枝毛霉菌Mucor circinelloides,木霉菌Trichoderma sp.。党宏波等[30]从大庆油田长期被石油污染的土壤中,分离出具有高效原油降解能力的丝状真菌卷枝毛霉菌。而以雷竹林覆盖材料砻糠、稻草及覆盖雷竹林土壤为材料,韩国民等[6]分离并筛选到1株冷杉附毛孔菌Trichaptum abietinum,该真菌能够在固体培养基上分解所测试的全部9 种合成染料。可晓等[19]分离出1株滤纸酶活力高的菌株,经菌落培养特征和显微结构特征观察属青霉属Penicillium,可见长期覆盖经营林地中的高效降解真菌具有多样性。系统发育分析表明:菌株P7-2-2和P1-2-2与草酸青霉菌Penicillium oxalicum亲缘关系相对较近,但其种属特性需要进一步鉴定。已有的研究表明:草酸青霉菌作为丝状真菌,对染料具有高效吸附作用[31],也为进一步深入发掘特定竹林生境中具有高效生物降解潜力的有益真菌提供了科学依据。
为定量验证所筛选到菌株的脱色能力,选择在培养平皿上对5种染料综合脱色能力较好的菌株P7-2-3和P12-2-4,进行10.5 d内不同质量浓度结晶紫染料液体发酵脱色研究。结果表明:菌株P7-2-3和P12-2-4分别接种200.0 mg·L-1和300.0 mg·L-1结晶紫染料,摇瓶10.5 d后脱色率分别可以达到83.0%和82.0%;而染料质量浓度分别达到300.0 mg·L-1和400.0 mg·L-1以上时,此2株菌的脱色能力明显被抑制。由此可见:结晶紫染料质量浓度对菌株P12-2-4抑制作用相对稍弱,也证实其脱色能力比菌株P7-2-3更强。相关分析表明:不同质量浓度下菌株降解结晶紫的总质量与菌丝生物量存在显著的正相关关系,这也证实了袁海生等[13]菌丝生物量与脱色率具有明显正相关性的结论。本研究中菌株对不同质量浓度结晶紫染料的脱色效果与菌丝生物量之间的关系,也说明培养基中染料过多是导致真菌对高质量浓度染料脱色率降低的原因之一。可以通过增加液体发酵脱色染料的种类和优化脱色条件等,将筛选获得菌株应用于环保废水处理等环保产业。














 DownLoad:
DownLoad: