-
雷竹Phyllostachys violascens是一种优良的笋用竹种,在浙江、安徽等省都有广泛的分布。近年来,以冬季地表覆盖和大量施肥为核心的雷竹集约栽培技术已在生产上大面积推广,为当地带来了显著的经济效益。但是,大量施肥对当地的生态环境也带来了较大风险,如氮磷养分流失、水体富营养化以及土壤污染等[1-2]。此外,雷竹林长期集约栽培也导致土壤养分大量积累、pH值大幅下降以及土壤生物学性质恶化等后果,使雷竹林提前退化,影响经济效益[3-4]。长期集约经营的雷竹林土壤微生物量碳、氮含量均显著下降[5]。对土壤微生物群落结构的分析结果表明,土壤细菌群落结构在长期集约经营后发生了较大程度的改变,且多样性指数大幅下降,其中pH值是主要的影响因子[6]。由于长期的单一经营,加上酸化严重,土壤真菌大量繁殖,土传病害也较严重。因此,施用土壤杀菌剂对于杀灭有害微生物、保护雷竹林健康可持续发展具有重要的意义。氰氨化钙又名石灰氮,是一种碱性肥料,可为土壤提供氮、钙等营养元素。因其具有较强的碱性,过去常作为酸性土壤改良剂。研究表明[7-9]:氰氨化钙可有效抑制、杀灭根结线虫,防治枯萎病、根肿病、菌核病等土传病害,解决连作障碍;补充作物生长过程中所需的钙素营养,提高作物抗逆性,改善品质[10]。作为一种具有无残留的农药和肥料双重功效的药肥,近年来氰氨化钙在设施菜地土壤的改良上已被推广使用[10]。目前,雷竹林地施用氰氨化钙改良土壤所采用的用量大多凭经验,尚没有较为合理的推荐用量。此外,施用氰氨化钙对雷竹林土壤微生物学性质,如土壤微生物生物量、土壤酶活性等的影响也没有相关报道。因此,针对退化雷竹林,研究不同施用量氰氨化钙对土壤理化性质及微生物学特性的影响,并提出建议施用量,对于评估氰氨化钙的功效和生态风险具有重要意义,同时也能为退化雷竹林改良提供重要的参考依据。
-
试验地点位于浙江省临安市锦城镇金马村(30°17.551′N,119°41.520′E)。该地属中纬度北亚热带季风气候,年降水量为1 420 mm,多年平均气温为15.8 ℃,无霜期234 d,土壤为粉砂岩母质上发育的红壤土类。选择1块集约经营10 a的已退化雷竹林,该雷竹林样地坡度小于2°,土壤pH 4.1,有机质质量分数为72.1 g·kg-1,全氮2.3 g·kg-1,速效磷187.0 mg·kg-1,速效钾107.0 mg·kg-1。
-
试验于2012年5月进行。供试氰氨化钙购自于宁夏大荣实业集团有限公司,商品名“荣宝”,含氮21%,氧化钙38%(质量分数)。试验设计4个氰氨化钙用量处理,即0,30,60,90,180 g · m-2。试验为随机区组设计,小区面积为2 m × 2 m,3次重复。小区之间用塑料板隔开,塑料板埋入深度为20 cm。将氰氨化钙均匀撒施于土壤表面,翻耕入土使它与表层土壤充分混合。试验期间采用常规管理。
试验开始后,在第1,3,7,14和28天进行土壤取样。采用直径为5 cm的不锈钢土钻,按照5点取样法采取各处理0~20 cm的表层土壤样品。样品采集后,立即装入自封袋带回实验室,去除大的植物残体和石块,过2 mm钢筛后,立即测定土壤微生物生物量以及土壤酶活性。
-
土壤微生物量碳采用氯仿熏蒸-直接提取法[11],对照土壤和熏蒸后土壤用0.5 mol · L-1 硫酸钾提取[m(土)∶m(水)=1∶ 5)],滤液中碳质量分数采用TOC-VCPH有机碳分析仪测定。土壤微生物量碳质量分数以熏蒸和未熏蒸土样0.5 mol ·L-1 硫酸钾提取液中碳质量分数之差乘以系数得到。BC=2.64EC,式中EC为熏蒸土样与未熏蒸土样提取液碳质量分数之差。所有测定3次重复。
-
土壤细菌及真菌呼吸比采用选择性抑制基质诱导呼吸法测定。细菌抑制剂为2 mg·g-1链霉素,真菌抑制剂为8 mg·g-1放线菌酮。在基质诱导呼吸的基础上,分别单独加入链霉素和放线菌酮以及两者同时加入,通过差减计算土壤细菌及真菌的呼吸速率[12]。基质诱导呼吸测定方法参照参考文献[13]。称取相当于10 g干土质量的鲜土,加入200 mg葡萄糖和500 mg滑石粉,充分混匀。置于22 ℃恒温培养箱中培养4~5 h后,隔1 h测定1次二氧化碳浓度,连续测定6 h,计算二氧化碳释放速率。重复3次·处理-1,气体测定不设重复。产生的二氧化碳采用气相色谱法测定。根据计算公式求得土壤微生物生物量碳质量分数(μg·g-1)参照文献[13]计算。
-
土壤酶活性参考文献[14]方法测定,其中土壤脱氢酶活性采用2,3,5-氯化三苯基四氮唑(TTC)还原法测定;土壤脲酶活性采用苯酚钠-次氯酸钠比色法测定;土壤酸性磷酸酶活性采用磷酸苯二钠比色法测定;土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法测定。
-
数据经Excel 2007整理,用SPSS 18.0软件处理试验数据,Duncun单因素方差分析比较各处理之间的差异显著性(P<0.05)。
-
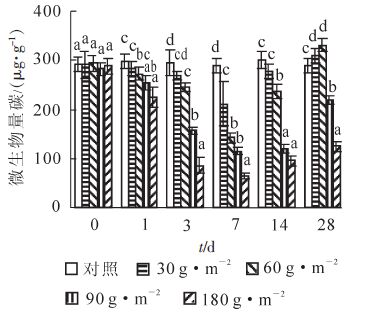
氰氨化钙对不同处理的表层土壤微生物量碳质量分数的影响如图 1所示。施用氰氨化钙1 d后,低施用量的处理与不施用的对照相比没有显著差异,而90 g · m-2及180 g · m-2施用量的2个处理其土壤微生物量碳质量分数显著降低(P<0.05),说明土壤微生物对高浓度的氰氨化钙反应非常快速。随着时间的延长,氰氨化钙处理的土壤微生物量碳急剧下降。在施用第7天时,所有处理土壤微生物量碳质量分数均显著低于对照土壤(P<0.05),其中180 g · m-2处理土壤微生物量碳下降幅度最大,显著低于其他处理,而60及90 g · m-2处理显著低于30 g · m-2处理(P<0.05)。在施用14 d后,除了90及180 g · m-2处理土壤微生物量质量分数仍然显著低于对照外(P<0.05),30 g · m-2施用量的处理土壤微生物量与对照相比已经没有显著差异。60 g · m-2施用量处理土壤微生物量虽然还显著低于对照(P<0.05),但是与7 d前相比有了较为明显的增加。结果说明,氰氨化钙对土壤微生物的影响主要是体现在施用第7天内,特别是高施用量,显著降低了土壤微生物生物量。施用28 d后,30及60 g · m-2施用量处理土壤微生物量碳质量分数显著高于对照,90与180 g · m-2施用量处理其微生物量碳也有了较大程度的提高。其中,90 g · m-2施用量处理显著高于180 g · m-2施用量处理(P<0.05)。
氰氨化钙在土壤中水解后会产生单氰胺或双氰胺,对土壤动物、微生物以及部分植物具有一定的毒害作用。虽然氰氨化钙能够有效控制多种作物的土传病害[15],但是在抑制土壤致病微生物的同时,氰氨化钙也能对其他的非致病性微生物产生影响[16]。Shi等[16]研究表明:施用氰氨化钙(>80 g · m-2)15 d后,尽管尖孢镰刀菌Fusarium oxysporum的数量被显著抑制,但是土壤细菌、真菌及放线菌数量也同时显著降低(P<0.05)。本研究中,土壤微生物量碳质量分数在施用氰氨化钙后快速降低,施用量越大,土壤微生物量碳降低的幅度也越大。然而,由于氰氨化钙又可以作为一种肥料,在经历了短期的分解中间产物阶段后,被继续分解成为尿素和钙,为土壤微生物提供养分。因此,施用7 d后,土壤微生物量碳质量分数逐渐回升,这与之前的结果相类似[16]。尽管180 g · m-2施用量处理中输入的氮源最多,但是推测由于前期土壤微生物受抑制程度较高,因此土壤微生物量恢复速度也相对较慢。同时,对于低施用量的处理(30 g · m-2和60 g · m-2),由于微生物受抑制程度较轻,且氰氨化钙分解后既改善了局部土壤pH值,又提供了额外的速效氮源和钙,因此土壤微生物量碳含量快速恢复并显著高于对照(28 d)(P<0.05)。
-
氰氨化钙的施用对土壤不同微生物的影响不同。通过选择性抑制基质诱导呼吸法分别测定土壤细菌及真菌生物量,并计算真菌与细菌生物量比值(真细比),结果如图 2所示。研究表明:不同施用量对土壤真细比的影响不同。氰氨化钙施用后1 d,各施用量处理土壤真细比显著低于对照(P<0.05),其中30 g ·m-2施用量处理土壤真细比显著高于其他施用量处理(P<0.05),而60,90和180 g · m-2施用量处理之间没有显著差异。随着施用时间的延长,30 g · m-2施用量处理土壤真细比快速回复,与对照总体没有显著差异。60 g · m-2施用量及以上处理土壤真细比在施用7 d的时间内继续显著下降(P<0.05),但随后缓慢回升。在第14 d时,除180 g · m-2施用量处理土壤真细比仍然显著低于其他施用量处理外,其他的处理之间没有显著差异。第28 天取样时,各施用量处理之间真细比没有显著差异,尽管60 g ·m-2和180 g ·m-2施用量处理仍然显著低于对照(P<0.05)。不同种类的土壤微生物对氰氨化钙的敏感性不同,其中氰氨化钙对细菌的影响并不明显,而真菌和放线菌对氰氨化钙的反应相对较为灵敏[17]。然而,并非所有的真菌对氰氨化钙都十分敏感。一些曲霉属Aspergillus sp.及青霉属Penicillium sp.的真菌不仅能抵抗氰氨化钙的毒害作用,甚至能够利用氰氨化钙作为其生长的碳源[18]。另有研究表明,氰氨化钙可以显著抑制很多病原真菌的生长及产生孢子的能力,起到防治植物病害的作用。本研究也表明:施用氰氨化钙后,土壤真细比下降的主要原因是真菌生长在施用的前14 d被显著抑制,而细菌生长在刚施用后被短暂抑制后,很快恢复活性。
-
土壤酶是土壤的重要组分,在自然界物质循环、土壤发生发育以及土壤肥力的形成过程中发挥着重要的作用。土壤酶活性作为表征土壤性质的生物活性指标,已经被广泛用于评价土壤养分物质循环状况以及各种人为措施对土壤生物学性质的影响[19]。本研究测定了氰氨化钙对土壤脱氢酶、转化酶、脲酶以及磷酸酶等活性的影响。结果如图 3所示。
土壤脱氢酶属于氧化还原酶系,它反映土壤微生物新陈代谢的总体活性。低施用量(30 g · m-2)的氰氨化钙对土壤脱氢酶活性没有显著影响。施用量60 g · m-2以上的处理,土壤脱氢酶活性在前3 d显著下降(P<0.05)。随着时间的延长,土壤脱氢酶活性也快速恢复,到7 d时,只有90 g · m-2和180 g · m-2施用量处理显著低于对照(P<0.05)。施用14 d及28 d的土壤脱氢酶活性结果表明,除180 g · m-2施用量处理与对照差异不显著外,其他处理均显著高于对照(P<0.05)。原因可能是因为氰氨化钙的施用在调节土壤微生物菌群的同时,还改善了pH值,增加了氮源的输入,在一开始的毒害作用过后反而表现出一定的促进作用。不同施用量的氰氨化钙,土壤脲酶的总体反应趋势与转化酶较为相似。刚开始施用时,仅高施用量处理受到影响,酶活性显著低于对照(P<0.05),但是随着时间的延长,90 g · m-2施用量处理迅速恢复,180 g · m-2施用量处理在施用的14 d时也已经恢复到未施用水平,说明土壤脲酶及转化酶活性受氰氨化钙施用影响较小。施用28 d后,60 g · m-2施用量以上的处理其土壤脲酶和转化酶均表现出增加的趋势,其中90 g · m-2和180 g · m-2施用量处理显著高于对照及30 g · m-2施用量处理(P<0.05)。虽然氰氨化钙的施用短期抑制了土壤微生物的活性,但是对土壤微生物群落能够起到很好的调节作用,最终迅速恢复,并表现出更强的代谢活性和养分循环能力。土壤磷酸酶测定结果表明,除了在施用大量氰氨化钙的刚开始几天内土壤酶活性与对照相比有显著降低外,磷酸酶在施用14 d后就回复原来的水平并保持相对稳定。磷酸酶是催化有机磷脂转化为无机磷的酶,对土壤无机磷的供应起着重要的作用[20]。由于雷竹林特殊的经营方式,土壤磷素,特别是无机磷大量积累[5],而之前的研究表明使用化肥会降低土壤磷酸酶活性[20]。本研究中土壤磷酸酶活性总体较低,且磷素质量分数很高,因此,氰氨化钙的施用对磷酸酶几乎没有影响。
综合来看,低施用量的氰氨化钙(30 g · m-2)对土壤微生物学性质影响并不明显,而高施用量(180 g · m-2)对土壤微生物数量及脱氢酶活性产生了较强的抑制作用,60 g · m-2及90 g · m-2施用量只对土壤微生物量及活性产生了短期的抑制效果,28 d后土壤微生物量及活性均恢复或高于施用前,因此该施用量在生产上较为合理。需要提出的是,土壤微生物量指标只能代表总体土壤微生物群落,土壤酶也只能指示土壤微生物总体活性或对某一种养分元素的转化活性,可以体现特定的微生物功能种群对氰氨化钙的响应,但是不能揭示物种水平上微生物群落结构的变化。不同用量的氰氨化钙如何影响土壤微生物的功能种群,继而影响土壤碳、氮循环等生态功能还有待于进一步研究。
-
不同氰氨化钙施用量对土壤微生物量碳的影响差异较大。尽管氰氨化钙施用降低了土壤微生物量碳,但是低施用量氰氨化钙处理土壤微生物量迅速恢复,并最终显著高于对照处理,而高施用量氰氨化钙处理对土壤微生物量碳影响较大,恢复速度较慢。土壤真菌对氰氨化钙较细菌更加敏感。不同施用量的氰氨化钙处理均显著降低土壤的真菌/细菌比值。尽管后期有所恢复,高施用量氰氨化钙处理土壤真细比仍然显著低于对照。土壤酶活性对不同氰氨化钙施用量及施用时间响应不同,但是都在短期内受到氰氨化钙的抑制。所有氰氨化钙处理均提高了土壤脱氢酶活性;高施用量氰氨化钙处理显著提高了土壤脲酶和转化酶活性;土壤磷酸酶活性总体上受氰氨化钙影响较小。
Effects of calcium cyanamide on soil microbial properties of intensively managed Phyllostachys violascens stands
-
摘要: 为确定氰氨化钙对土壤微生物学性质的影响和合理用量,采用随机区组试验方法进行田间原位试验,研究不同氰氨化钙施用量对退化雷竹Phyllostachys violascens林土壤微生物量碳、真菌/细菌比值以及土壤酶活性的影响。试验设置氰氨化钙施用量0,30,60,90,180 g·m-2,分别在施用后的第1,3,7,14,28 天采集0~20 cm土样,测定土壤微生物量以及土壤脱氢酶、转化酶、脲酶、磷酸酶活性。结果表明:①土壤中添加氰氨化钙在短期内对微生物产生强烈抑制,第7 天时所有处理均显著低于对照,其后又逐渐恢复,但90 g·m-2及180 g·m-2施用量处理土壤微生物量碳含量在第28天时仍显著低于对照及其他处理(P<0.05);②氰氨化钙对土壤真菌的影响大于土壤细菌,土壤真菌/细菌比值随着施用量的增加而显著降低,28 d后60 g·m-2及180 g·m-2施用量处理土壤真细比仍然显著低于对照(P<0.05);③施用氰氨化钙在前期显著抑制土壤酶活性,但施用28 d后,土壤脱氢酶、转化酶以及脲酶活性均显著高于对照(P<0.05),而磷酸酶活性与对照相比没有显著变化。低施用量氰氨化钙对土壤生物学性质的影响主要为短期效应,180 g·m-2施用量对土壤生物学性质的影响较大。在生产上建议采用60~90 g·m-2的施用量。Abstract: To study the effect of CaCN2 on soil microbial biomass carbon, the ratio of fungal to bacterial biomass,and soil enzyme activities,and to determine the optimum rate of calcium cyanamide(CaCN2)use in Phyllostachys violascens stands with intensive management,an experiment with a randomized complete block design was established. Soil CaCN2 treatments were 0(control),30,60,90,and 180 g·m-2,each with three replicates. Soil samples were taken 1,3,7,14,and 28 d after CaCN2 application. One-way ANOVA with Duncan's multiple range test was used to compare the difference between samples, and statistical significance was determined at the 5% level(P<0.05). Results indicated that the 90 and 180 g·m-2 CaCN2 treatments had significantly lower(P<0.05) soil microbial biomass. Other treatments were inhibited in the short term, but recovered gradually. Compared with bacteria, fungi were more sensitive to CaCN2 with the ratio of fungal to bacterial biomass decreasing significantly(P<0.05)as the CaCN2 rates increased. As with soil microbial biomass,CaCN2 also inhibited soil enzyme activities. Compared to the control, 28 d after application of CaCN2,soil dehydrogenase,urease,and invertase activities in each treatment were significantly higher(P<0.05);however, phosphatase activity showed no significant differences. Since low dose of CaCN2(30 g·m-2)had only a short-term effect on soil microbial properties and a high dose(180 g·m-2)had a strong influence,application of 60-90 g·m-2(CaCN2) should be recommended in bamboo stands.
-
[1] 吴家森,陈闻,姜培坤,等. 不同施肥对雷竹林土壤氮、磷渗漏流失的影响[J]. 水土保持学报,2012,26(2):33-44. WU Jiasen,CHEN Wen,JIANG Peikun,et al. Effects of different fertilization on seepage loses of nitrogen and phosphorus in the soil under Phyllostachys praecox stand[J]. J Soil Water Conserv,2012,26(2):33-44. [2] 姜培坤,叶正钱,徐秋芳. 高效栽培雷竹林土壤重金属含量的分析研究[J]. 水土保持学报,2003,17(4):61-74. JIANG Peikun,YE Zhengqian,XU Qiufang. Changes in heavy metal elements of soil in ecosystem of Phyllostachys praecox under intensive management[J]. J Soil Water Conserv,2003,17(4):61-74. [3] XU Qiufang,JIANG Peikun,XU Zhihong. Soil microbial functional diversity under intensively managed bamboo plantations in southern China[J]. J Soil Sediment,2008,8(3):177-183. [4] 孙达,黄芳,蔡荣荣,等. 集约经营雷竹林土壤磷素的时空变化[J]. 浙江林学院学报,2007,24(6):670-674. SUN Da,HUANG Fang,CAI Rongrong,et al. Temporal and spatial variation of soil phosphorus in Phyllostachys praecox stands under intensive cultivation management[J]. J Zhejiang For Coll,2007,24(6):670-674. [5] 秦华,徐秋芳,曹志洪. 长期集约经营条件下雷竹林土壤微生物量的变化[J]. 浙江林学院学报,2010,27(1):1-7. QIN Hua,XU Qiufang,CAO Zhihong. Soil microbial biomass in long-term and intensively managed Phyllostachys praecox stands[J]. J Zhejiang For Coll,2010,27(1):1-7. [6] 秦华,李国栋,叶正钱,等. 集约种植雷竹林土壤细菌群落结构的演变及其影响因素[J]. 应用生态学报, 2010,21(10):2645-2651. QIN Hua,LI Guodong,YE Zhengqian,et al. Evolvement of soil bacterial community in intensively managed Phyllostachys praecox stand and related affecting factors[J]. Chin J Appl Ecol,2010,21(10):2645-2651. [7] BLETSOS F A. Grafting and calcium cyanamide as alternatives to methyl bromide for greenhouse eggplant production[J]. Sci Hortic,2006,107:325-331. [8] CHOI H W,CHUNG I M,SIN M H,et al. The effect of spent mushroom sawdust compost mixes,calcium cyanamide and solarization on basal stem rot of the cactus Hylocereus trigonus caused by Fusarium oxysporum[J]. Crop Prot, 2007,26:162-168. [9] TREMBLAY N,BELEC C,COULOMBE J,et al. Evaluation of calcium cyanamide and liming for control of clubroot disease in cauliflower[J]. Crop Prot,2005,24:798-803. [10] 徐祖祥. 荣宝土壤消毒剂对西兰花、宝塔花菜等蔬菜产量及种植效益的影响[J]. 科技通报,2009,25(4):456-459. XU Zuxiang. The effect of soil decontaminant Ronbao on the yield and economic returns of Broccoli,Tower Cauliflower and Chinese cabbage[J]. Bull Sci Technol,2009,25(4):456-459. [11] VANCE E D,BROOKES P C,JENKINSON D C. An extraction method for measuring soil microbial biomass C[J]. Soil Biol Biochem,1987,19:703-707. [12] BAATH E,ANDERSON T H. Comparison of soil fungal/bacterial ratios in a pH gradient using physiological and PLFA-based techniques[J]. Soil Biol Biochem,2003,35(7):955-963. [13] ANDERSON J P E,DOMSCH K H. A physiological method for the quantitative measurement of microbial biomass in soil[J]. Soil Biol Biochem,1978,10:215-221. [14] 关松荫. 土壤酶及其研究法[M]. 北京:农业出版社,1986. [15] BOURBOS V A,SKOUDRIDAKIS M T, DARAKIS G A,et al. Calcium cyanamide and soil solarization for the control of Fusarium solani f. sp. cucurbitae in greenhouse cucumber[J]. Crop Prot,1997,16:383-386. [16] SHI Kai,WANG Li,ZHOU Yanhong,et al. Effects of calcium cyanamide on soil microbial communities and Fusarium oxysporum f. sp. cucumberinum[J]. Chemosphere,2009,75:872-877. [17] IBEKWE A M,PAPIERNIK S K,GAN J,et al. Impact of fumigants on soil microbial communities[J]. Appl Environ Microbiol,2001,67:3245-3257. [18] BLETESOS F A. Grafting and calcium cyanamide as alternatives to methyl bromide for greenhouse eggplant production[J]. Sci Hortic,2006,107:325-331. [19] 张华勇,尹睿,黄锦法,等. 稻麦轮作田改为菜地后生化指标的变化[J]. 土壤,2005,37(2):182-186. ZHANG Huayong,YIN Rui,HUANG Jingfa,et al. Changes in soil biochemical properties caused by cropping system alteration from rice-wheat rotation to vegetable cultivation[J]. Soils,2005,37(2):182-186. [20] 王俊华,尹睿,张华勇,等. 长期定位施肥对农田土壤酶活性及其相关因素的影响[J]. 生态环境,2007,16(1):191-196. WANG Junhua,YIN Rui,ZHANG Huayong,et al. Changes in soil enzyme activities,microbial biomass and soil nutrition status in response to fertilization regimes in a long-term field experiment[J]. Ecol Environ,2007,16(1):191-196. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2014.03.004







 下载:
下载: