-
氮素在森林生态系统的能量流动与物质循环过程中有着非常重要的作用[1-2]。长期氮沉降以及人类活动干扰等,造成全球氮(N)沉降的增加,对自然生态系统产生了一系列影响[2-3]。研究表明:即使在没有物理扰动的情况下,长期氮沉降也会通过降低碳周转率、改变氮的有效性和转化来影响温带森林生态系统的生物地球化学循环[4]。此外,也有研究表明:氮添加会通过改变凋落叶特性(碳、氮、磷变化)对其养分分解速率产生影响[3]。据报道,中国已成为全球第三大氮沉降地区,大气含氮化合物增长迅速[5]。在未来几十年中氮沉降继续增加的背景下,研究氮沉降对森林凋落物养分分解的影响显得尤为重要[6-7]。凋落物在森林生态系统组成中占据重要地位,它的分解也会对森林生态系统的生物地球化学循环产生相当大的影响[8-9]。凋落物分解不仅是林下土壤有机质形成所需碳源以及土壤养分的主要来源,而且对于土壤质地的构建、肥力的维持、微生物代谢的调控都起重大作用,并且通过这一系列作用进而影响微生物的群落结构[10-11]。大果木姜子Cinnamomum migao又名米槁,系樟科Lauraceae樟属Cinnamomum常绿乔木,主要分布于中国广西、云南、贵州三省交界的南北盘江、红水河流域,为中国特有种。其果实常常被苗族作为治疗胃肠道疾病的传统药物,并且疗效卓越。21世纪初,贵州省科学技术厅以及贵州省民族医药研究所确定大果木姜子为贵州省的道地药材[12]。近年来,随着其药用价值的提高,大果木姜子野生资源受到极大破坏,在《中国生物多样性红色名录——高等植物卷》(2013版)已将其列为近危种,野外资源储量极其有限。目前,相关学者对大果木姜子的研究报道还不是很全面,主要集中在果实精油、脂肪油、挥发油化学成分分析[13]、药用成分的药理作用与生物活性[14-15]、栽培技术与病虫害防治[12]、地理分布[15]、生物生理特性[16-17]等方面。大果木姜子凋落叶的分解对氮沉降增加的响应规律还未见报道。本研究通过野外模拟氮沉降的试验,探讨不同施氮处理对大果木姜子凋落叶养分分解的影响,以期探讨大果木姜子凋落叶分解对外源氮添加的响应机制,且为其物质循环机理研究提供理论依据。
HTML
-
贵州省罗甸县位于云贵高原和丘陵过渡的斜坡地带,四季呈现春早、夏长、秋迟、冬短的特点,因其特殊的地势与优良的自然环境被称为大果木姜子生长的典型生境。试验样地设置于罗甸县逢亭镇西部的祥林村6年生大果木姜子药材种植基地,地处25°15′41′′N,106°31′03′′E,海拔524 m。属于亚热带季风气候,年平均气温20.6 ℃,≥10 ℃年积温为6 125.0 ℃,年降水量1200.0 mm,无霜期335.0~349.5 d,年均日照时数1 448.9 h。试验区土壤为酸性黄壤,土层厚度≥40 cm。于2017年1月初在试验地设置12块大小为3 m×5 m的样地进行试验。
-
以2010年中国大气氮沉降特征分析中贵州的氮沉降总和低于15 g·m−2·a−1为依据,本研究从低到高设置4个氮处理,即对照(ck,0 g·m−2·a−1)、低氮(N1,5 g·m−2·a−1)、中氮(N2,15 g·m−2·a−1)和高氮(N3,30 g·m−2·a−1),每处理重复3次。为消除环境异质性的影响,各样地之间间隔5 m。按照试验设计要求,每个处理设定样方面积为3 m×5 m,将各样方每次所需喷施的NH4NO3溶解于20 L自来水中,采用按压式喷壶来回均匀喷洒至样地,ck组喷洒等量的水。于试验2017年1月进行首次施氮试验,共喷洒3次,分别于1、5、9月取样完成,重新放置尼龙袋后进行等量施氮。
-
凋落叶分解试验于2017年1月开始进行,采用尼龙网袋分解方法。准备540个25 cm × 25 cm的分解袋,每个样地放置45袋。试验前于罗甸县大果木姜子林种植基地收集大果木姜子凋落叶带回实验室,清洗风干后装入分解袋中,10.00 g·袋−1。试验期间放置在12个施氮处理样地中(分解袋放置前修整空地表面枯枝落叶层,平铺网袋,使其尽可能接近自然分解状态。每次放置好尼龙袋后立即喷施氮源)。每隔2个月于各样地随机收取3袋分解袋,用刷子清除每次取回分解袋表面的泥垢后,置于75 ℃烘箱烘干至质量恒定,称其质量用于计算凋落叶质量损失率。然后研磨过孔径0.5 mm尼龙筛,保存备用。质量损失率(W):W=Xt/X0×100%。其中:X0为凋落叶初始质量,Xt为分解t时间后凋落叶质量。
-
凋落叶全氮质量分数采用H2SO4-H2O2 靛酚蓝比色法测定,全磷质量分数采用钼锑抗显色法测定,全钾质量分数采用HClO4+HNO3消煮-原子吸收分光光度法测定,碳质量分数采用浓硫酸-重铬酸钾法测定。凋落叶各元素的残留率按照下式计算。元素残留率(R):R=XtCt/X0C0×100%。其中:X0为凋落叶初始质量,Xt为分解t时间后凋落叶的质量,C0为凋落叶初始养分质量分数,Ct为t采样时间凋落叶养分质量分数。
-
运用Excel和SPSS 18.0软件进行初步统计分析,采用最小显著差法(LSD)多重方差显著性检验凋落叶质量损失率、残留率和养分质量分数与不同施氮处理间的差异显著性,利用Olson 负指数衰减模型(y=ae−Kt)对质量残留率与时间的关系进行拟合,其中:y为质量残留率(%),a为拟合参数,K为分解系数,t为时间(a)。利用Origin 2018绘制图表。
2.1. 试验设计
2.2. 凋落叶的收集与处理
2.3. 凋落叶养分质量分数的测定
2.4. 数据处理与分析
-
图1显示:1−9月各处理凋落叶质量损失率随着时间的推移表现为迅速递增趋势,其中ck凋落叶质量损失率大于其他处理;9月以后各处理凋落叶分解速率趋于平缓。整个分解试验过程中,N3处理凋落叶质量损失率为0~53.35%,且始终低于其他处理。9月以前,N1、N2处理凋落叶质量损失率显著高于N3处理(P<0.05),即凋落叶质量损失率从大到小依次为N2、N1、N3;分解结束时(11月),各处理凋落叶质量损失率从大到小依次为N2、ck、N1、N3。
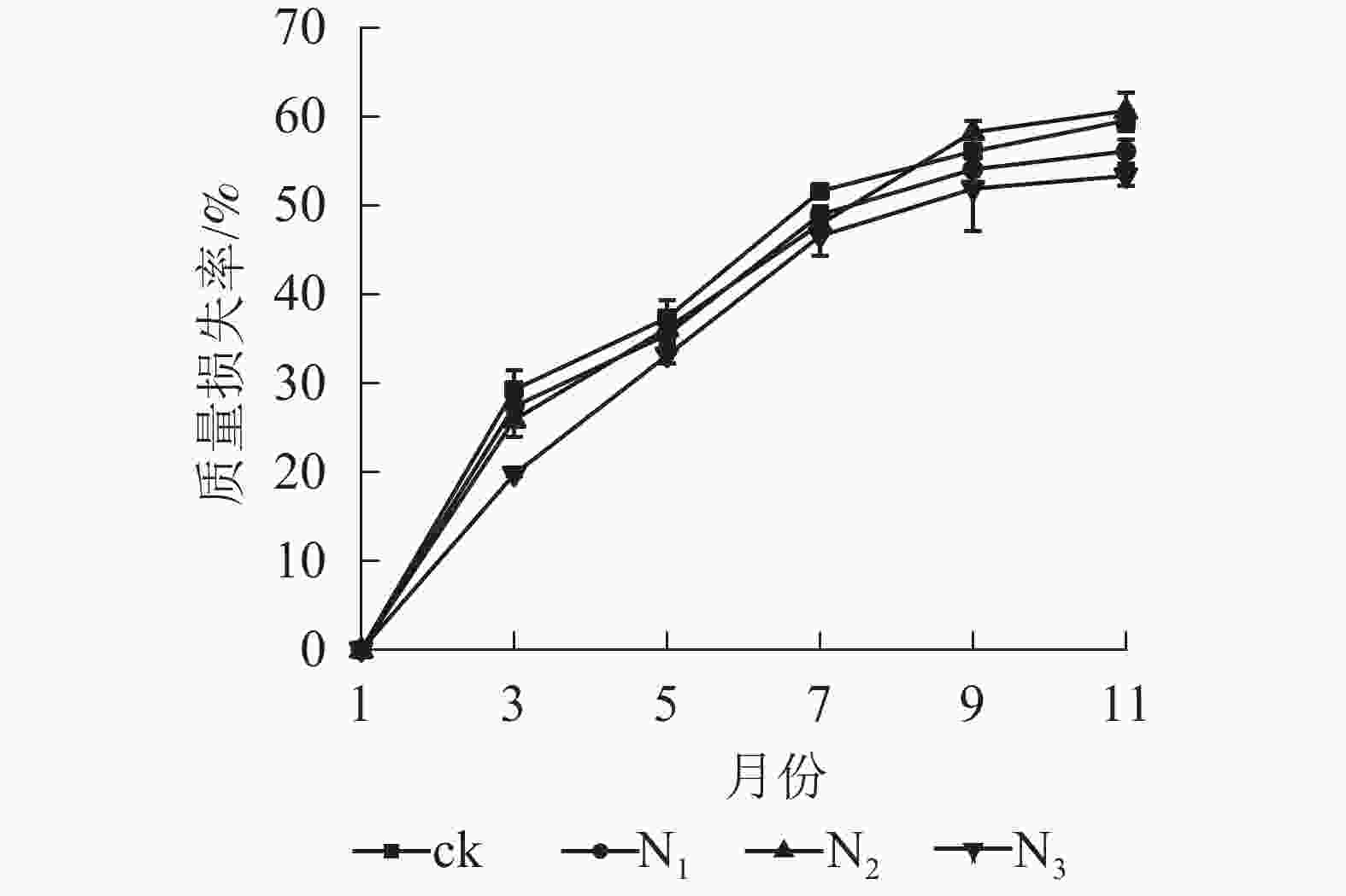
Figure 1. Change of mass loss rate and residual rate of leaf litter of C. migao under the condition of different treatments
从表1可以看出:4个处理的拟合模型R2均大于0.9000,且达到显著水平(P<0.05),其中N3处理Olson模型的拟合效果最佳。ck处理的凋落叶质量分解系数最大(K=0.085),N3处理最小(K=0.060)。N1、N2、N3处理凋落叶分解95%所需时间分别比ck长0.653、0.312、0.698 a,其中N3处理下凋落叶分解时间所需最长。综合表明:氮添加延缓了大果木姜子凋落叶的分解。
处理 分解方程 分解系数(K) 决定系数(R2) 相关系数(r) 显著性 凋落叶分解50%所需时间/月 凋落叶分解95%所需时间/a ck y=81.727e−0.085x 0.085 0.970 −0.944 0.005 8.155 2.973 N1 y=81.666e−0.067x 0.067 0.948 −0.940 0.005 10.045 3.626 N2 y=87.461e−0.076x 0.076 0.907 −0.963 0.002 9.120 3.285 N3 y=87.319e−0.068x 0.060 0.977 −0.951 0.004 10.193 3.671 Table 1. Decomposition rate model of litter residue rate (y) with time (x) under different treatments
-
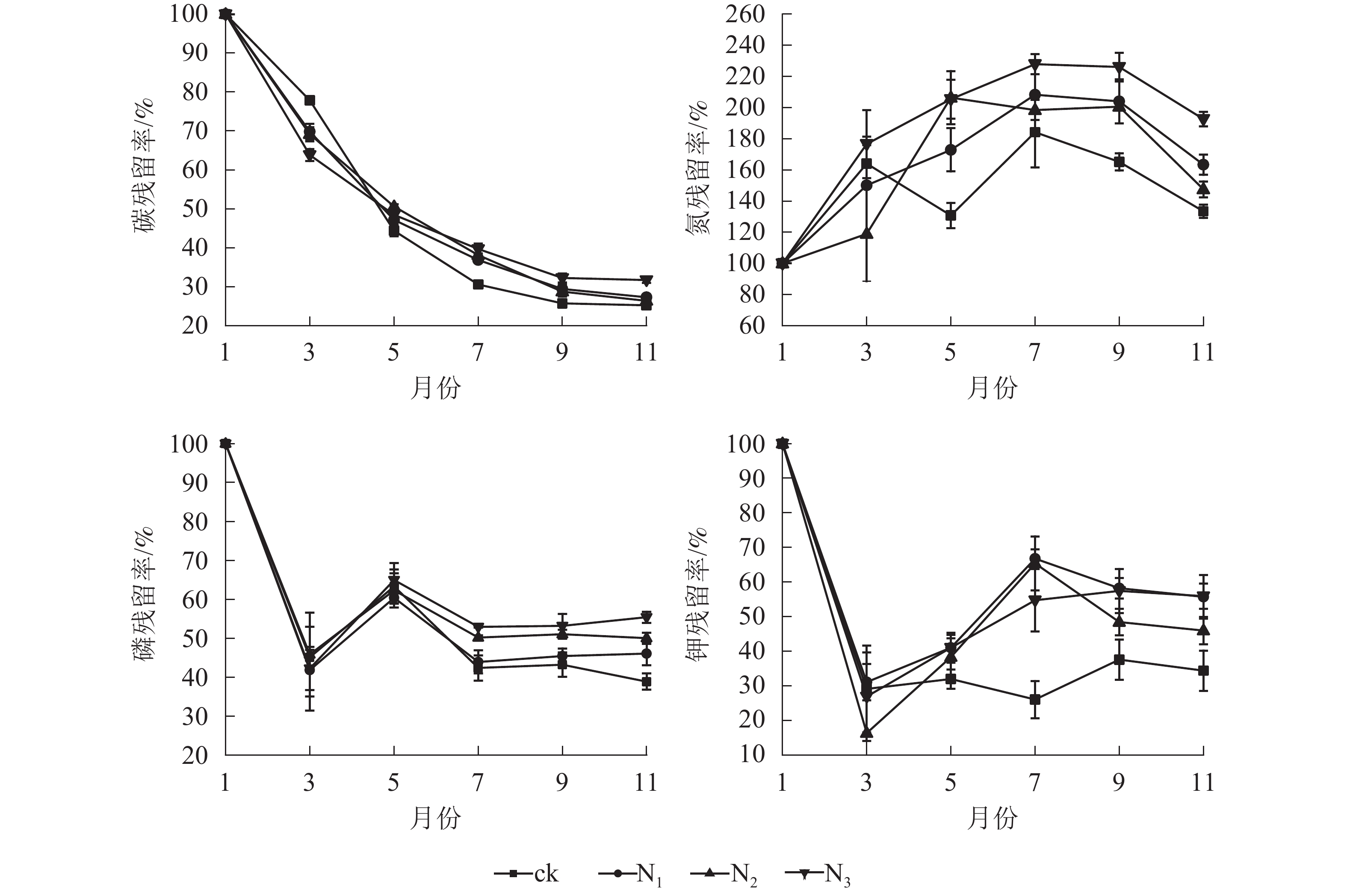
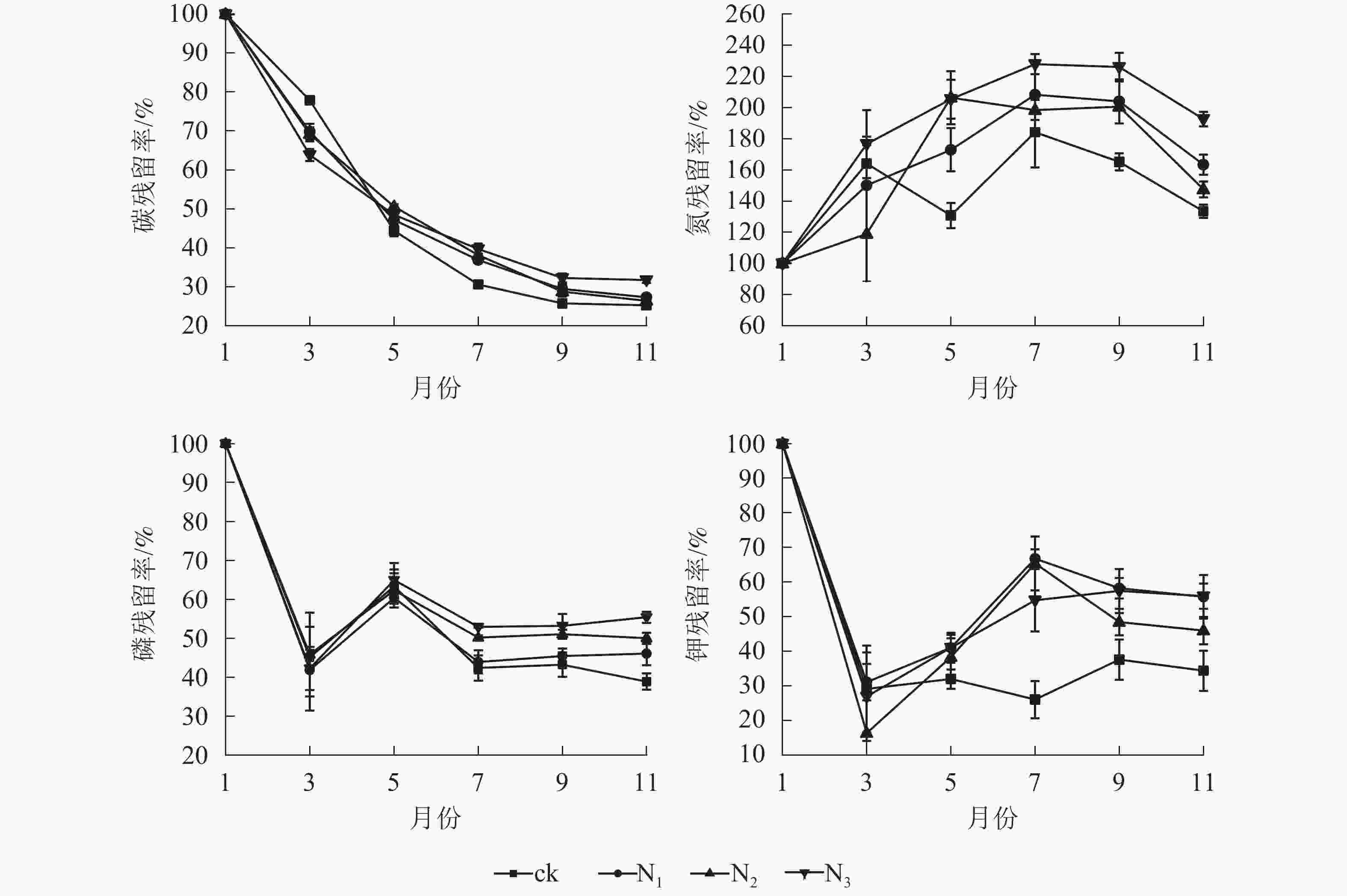
由图2可知:各处理凋落叶碳质量数总体均呈下降趋势,且分解前期(1−5月)下降较快,后期(5−11月)下降较慢。各处理凋落叶全氮质量分数变化趋势基本相同,整体上均呈先增加后降低的趋势,其中9月最高。各处理凋落叶全磷与全钾质量分数变化趋势相似,即在分解初期下降,之后整体上升,最后趋于平稳。
-
由图3可以看出:由于碳元素主要以有机形式存在于凋落叶中,受淋溶影响,各处理碳残留率呈降低趋势,其中分解各时段3个施氮处理碳残留率整体上显著高于ck(P<0.05)。ck的全氮残留率整体上呈先上升后下降再上升后下降趋势,各施氮处理的全氮残留率整体上呈先上升后下降趋势;1−7月,各处理全磷残留率呈先下降后升高再下降的趋势;7月之后,N1、N2、N3处理全磷的残留率趋于稳定,ck处理全磷残留率呈先上升后下降趋势。1−3月,各处理全钾残留率迅速降低,3月之后各处理全钾残留率总体呈增加趋势,整体表现为淋溶—富集—释放模式。
-
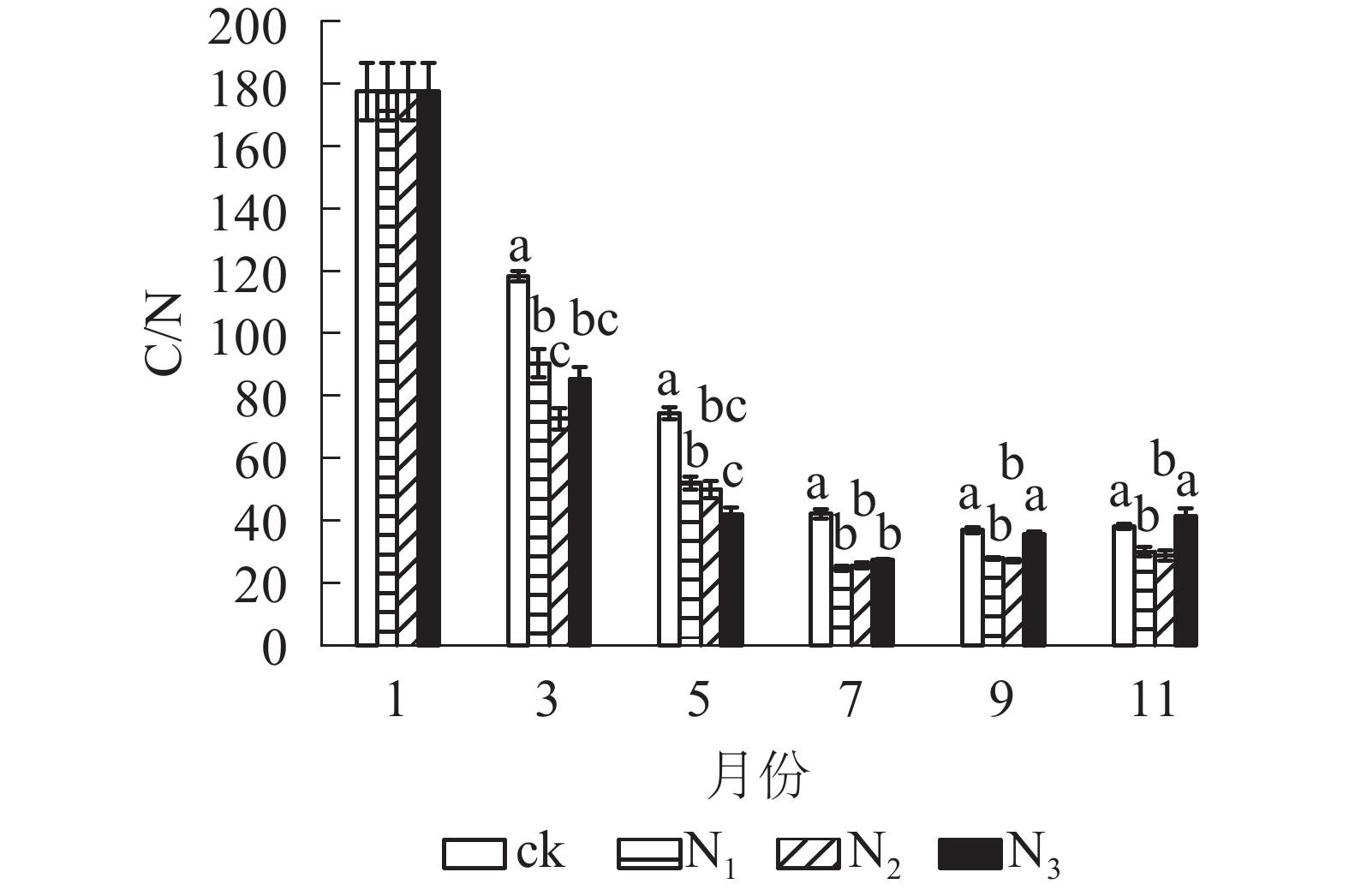
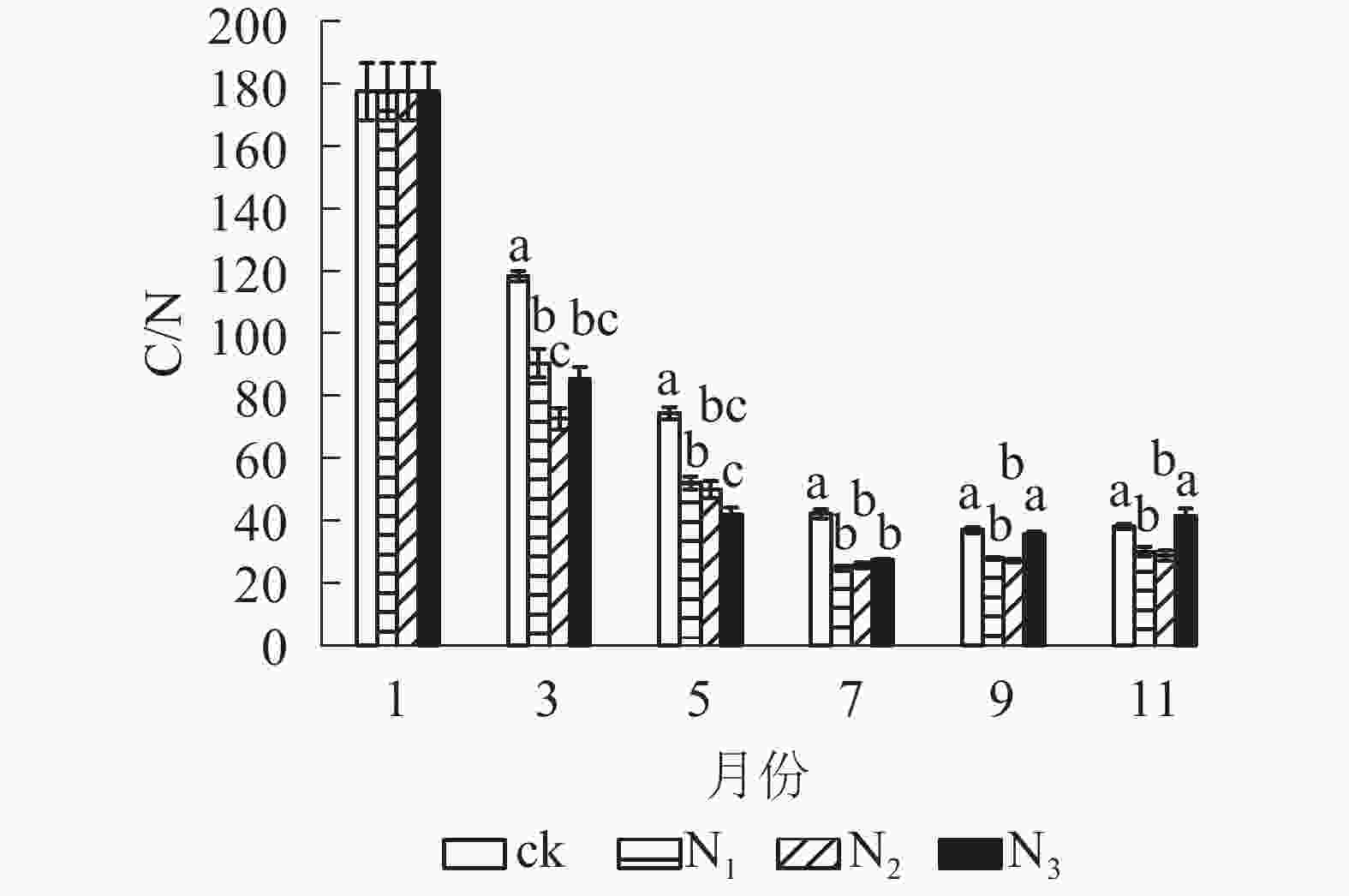
从图4可以看出:试验期间各处理C/N为24.60~177.51,整体表现出下降趋势。分解前期(1−7月) C/N下降速度较快,后期(7−11月)变化总体上比较平稳。在分解各时间段,ck的C/N基本高于其他各施氮处理。在试验前期(1−7月) ck处理与各施氮处理间有显著差异(P<0.05);试验后期(7−11月) ck组与N1、N2处理差异显著(P<0.05),与N3差异不显著(P>0.05)。总体来看,添加氮降低了大果木姜子凋落叶的C/N。
3.1. 不同处理对大果木姜子凋落叶质量残留率的影响
3.2. 不同处理对大果木姜子凋落叶分解过程中碳、氮、磷、钾的影响
3.3. 不同处理对大果木姜子凋落叶分解过程中元素残留率的影响
3.4. 不同处理对大果木姜子凋落叶分解过程中碳氮比(C/N)的影响
-
凋落叶分解速率的大小受到气候、凋落叶分解质量、微生物类型及作用等条件的影响[8]。目前,关于氮添加对凋落物分解速率的影响主要分为促进、抑制和无影响3种,这主要取决于施氮量的高低及施氮时间的长短。O’ CONNELL[18]分析了施加外源氮对桉树Eucalyptus凋落物分解及养分含量变化的影响。研究结果表明:施氮处理下凋落物分解释放速率变慢。郑欣颖等[19]模拟外源氮添加对火力楠Michelia macclurei凋落叶分解影响,结果显示:氮添加会促进凋落叶的分解。樊后保等[20]通过对杉木Cunninghamia lanceo-lata人工林凋落物施加外源氮,结果出现了“低促高抑”现象。文海燕等[21]对长芒草Stipa bungeana和阿尔泰狗娃花Heteropappus altaicus进行凋落叶模拟氮沉降试验。结果发现:氮添加对2种植物凋落叶分解无影响。
本研究结果显示:氮添加对大果木姜子凋落叶分解具有一定的抑制作用。大果木姜子凋落叶质量年损失率表现为ck高于各施氮处理,其中N3处理质量损失率最低。这是因为试验过程中施加外源氮的量超过了试验样地土壤所需氮的阈值,从而使凋落叶分解过程中起主要作用的微生物分解效率降低,进而对凋落叶的分解表现出抑制作用[22-23]。凋落叶分解本身具有的养分特性也会使凋落叶在不同分解阶段表现出不同规律,通常为前期分解较快,后期变慢。这是因为分解初期凋落物自身养分含量较高,可通过养分流失调控分解速率;随着养分的流失,后期则通过难分解的木质素和纤维来调控养分分解,所以分解速率表现为前期大于后期,且随着时间推移逐渐变慢[21-23]。在本研究前期(3−9月),大果木姜子凋落叶质量损失率迅速增加,主要是因为此时凋落叶的质量大,易分解物质含量高,导致凋落叶分解速率随着易分解物质的分解而加快;试验后期(9−11月)分解速率缓慢且质量损失率趋于平缓,这与后期凋落叶中易分解物质减少,难分解物质含量升高有关[24-25]。
-
土壤是植被生长过程中主要矿质营养的来源,而凋落物分解释放的养分归还是土壤肥力的重要来源(植物生长发育过程中从土壤中吸收的养分70%~90%得益于凋落物的分解释放)[26],因此,在森林生态系统中,凋落物的分解在植被养分循环过程中起着至关重要的作用。碳元素作为地球一切生命的基本单元,既是植物生长发育的基础又是维持植物生活的能量来源,氮和磷元素是氨基酸、核苷酸的重要组成元素,钾元素是调节细胞内外适宜渗透压和体液酸碱平衡,参与胞内糖和蛋白质代谢的重要阳离子。4种元素都是植物生命过程中不可缺少的[27-28]。研究表明:植物生长过程所需的养分分别有70%~80%的氮、65%~80%的磷和30%~40%的钾来自凋落物的分解释放[29]。
本研究中,5−11月各施氮处理碳质量分数显著低于ck(P<0.05),而氮质量分数表现相反。这是因为外源氮的添加使凋落叶中碳氮转化酶活性发生改变而影响两者的质量分数,且氮添加抑制了纤维素等物质的降解从而使凋落叶分解过程出现“碳封存”状态。凋落叶分解过程中,外界氮源的输入以及原生质素伴随自身固氮菌的侵入逐渐增加使氮质量分数增加[20],因此,C/N随着分解时间变长而总体下降。试验期间,凋落叶中全磷、全钾变化不稳定,各处理差异显著。11月凋落叶全磷质量分数表现为N1、N2、N3处理高于ck,且N2、N3差异显著(P<0.05),说明氮添加促进了大果木姜子凋落叶中全磷质量分数的积累,且施加氮的量越大表现出的差异越显著(P<0.05)。这与国内外多数研究结果相同,如BERG等[30]模拟氮沉降对樟子松Pinus sylvestris凋落叶养分分解影响研究表明:氮添加促进了凋落叶中全氮、全磷质量分数的积累。肖银龙等[31]模拟氮沉降对苦竹Pleioblastus amarus林凋落叶养分分解的研究同样表明:氮添加促进全氮、全磷的积累。本研究中,11月N1和N2处钾质量分数高于ck,而N3处理低于ck,说明添加过多的氮对凋落叶中全钾具有抑制作用,这是因为氮添加到土壤后,大量的氮以NO3−的形式淋失,为了达到土壤中养分电荷平衡,必然会带走等量的盐基离子(K+)[32-33]。
凋落物中的C/N一般比较高,不利于微生物的活动,而增施氮肥后有利于微生物数量的增加,从而促进凋落物的分解。本研究中土壤本身氮质量分数较高,再增施氮肥使其超过了“临界值”,打破了土壤中养分平衡,从而氮添加对大果木姜子凋落叶分解表现出抑制作用[22]。
综上所述,在氮添加的情况下,不利于大果木姜子凋落叶分解及养分的释放,其中N3处理作用更显著。凋落物分解后养分归还于土壤,再次作用于植物,但土壤养分输入对氮添加作何响应,还需进一步进行模拟探究。










 DownLoad:
DownLoad: