-
在当前中国水土流失严重、生态平衡危机频发、栽培药材品质备受质疑的大背景下,尤其是2020年初新冠病毒的突然来袭,金银花Lonicera japonica、内蒙黄芪Astragalus membranaceus var. mongholicus等传统中药材的品质和产量需求大增。发展药用植物的生态种植在合理利用土地资源、防治病虫害、改良土壤肥力、增强作物对自然灾害的抗逆能力等方面都有重要的作用。传统药用植物多为单一栽培模式,土地生产力和使用率低,对产业持续性发展不利[1]。相比而言,混播栽培是提高作物产量的有效措施。研究表明[2-3]:混播有助于防止水土流失,有利于病虫害治理和增强作物对自然灾害的抵抗力,在调节土壤生物养分有效性及生态系统资源合理配置等方面也至关重要。目前,混播多在豆科Leguminosae植物(如紫花苜蓿Medicago sativa、豌豆Pisum sativum等)-禾本科Gramineae植物(如燕麦Avena sativa、小麦Triticum aestivum等)间采用[4-5]。豆科植物根系的固氮能力不仅可以维持自身的氮素营养需求,还可通过根系间的相互作用为与其混播的作物提供养分,满足后者生长过程中的生理需求。近年来药用植物的研究主要聚焦在土壤施用肥料数量和不同质地土壤对药用植物生产量的影响[6-9]上,对不同播种模式下,土壤中有机碳、氮质量分数及土壤酶活性的研究较少;少有豆科植物与与药用植物的混播研究。本研究在不施氮磷钾肥的情况下,以忍冬科Caprifoliaceae金银花、菊科Compositae杭白菊Chrysanthemum morifolium和豆科内蒙黄芪为研究对象,采用大田实验随机区组设计,以沙化裸地(ck)为对照,研究金银花单播(LJT)、杭白菊单播(CMR)、黄芪单播(AMB)、金银花/内蒙黄芪混播(LJT/AMB)、杭白菊/内蒙黄芪混播(CMR/AMB) 5种模式下土壤碳、氮质量分数和酶活性的变化,旨在为人工药用草地建植及土壤治理保护提供科学依据。
HTML
-
研究区位于河南省新乡市洪门镇(35°16′N,113°57′E),海拔120 m,大陆性季风气候,四季分明,昼夜温差大,年平均气温为14.2 ℃,全年平均日光辐射时数约2 400 h,年平均降水量为573.4 mm,年际间降水分布不均,主要集中在7、8月,年平均相对湿度为68.0%,无霜期220 d[10]。供试土壤为砂壤土,供试土壤0~40 cm土层基本养分状况见表1。
土层/cm 全氮/(g·kg−1) 全磷/(g·kg−1) 全钾/(g·kg−1) 碱解氮/(mg·kg−1) 速效磷/(mg·kg−1) 速效钾/(mg·kg−1) 有机碳/(g·kg−1) pH 0~20 1.28 0.77 13.13 73.75 15.39 107.69 9.44 7.87 20~40 0.69 0.59 11.25 42.68 10.60 66.28 6.10 7.83 Table 1. Soil nutrient characteristics (0−40 cm)
-
2016−2019年连续4 a进行随机区组试验。共设6个处理,即:以沙化裸地为对照(ck),设LJT、CMR、AMB、LJT/AMB、CMR/AMB等5种不同的播种模式,各处理重复3次,共18个小区,各小区面积为30 m2 (5 m×6 m)。杭白菊、金银花均为南北行种植,株距60 cm,行距60 cm。内蒙黄芪为条播,行距为33 cm,播种量为15 kg·hm−2,混播模式下金银花与内蒙黄芪的行间距为40 cm,杭白菊与内蒙黄芪的行间距为40 cm。不施用任何肥料,采用免耕处理,定期浇水及除草。
-
2019年10月,清除土壤表面的枯枝落叶及地表碎石,五点法取样采集土壤样品装入自封袋带回实验室。自然风干后研磨,过筛,检测土壤各指标。采用有机碳分析仪(Elementar,德国)测定土壤有机碳质量分数(g·kg−1),采用碱解扩散法测定土壤碱解氮质量分数(g·kg−1)[11]。采用常规测定方法检测分析土壤酶活性[12]。采用靛酚蓝比色法测定脲酶活性,以24 h后1.0 g土样中铵态氮质量分数(mg·g−1)表示;采用3,5-二硝基水杨酸比色法测定蔗糖酶活性,以24 h后1.0 g土样中葡萄糖质量分数(mg·g−1)表示;采用磷酸苯二钠比色法测定碱性磷酸酶活性,以24 h后1.0 g土样中释放的酚的质量分数(mg·g−1)表示;采用邻苯二酚比色法测定多酚氧化酶活性,以2 h后1.0 g土样中紫色没食子素的质量(mg)表示。
-
数据以3次平行测定的平均值±标准误表示,经Excel 2007和SPSS 19.0软件统计分析。采用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)进行分析,Pearson相关系数法进行相关性分析。
1.1. 研究区概况
1.2. 试验设计
1.3. 样品采集及测定
1.4. 数据处理与分析
-
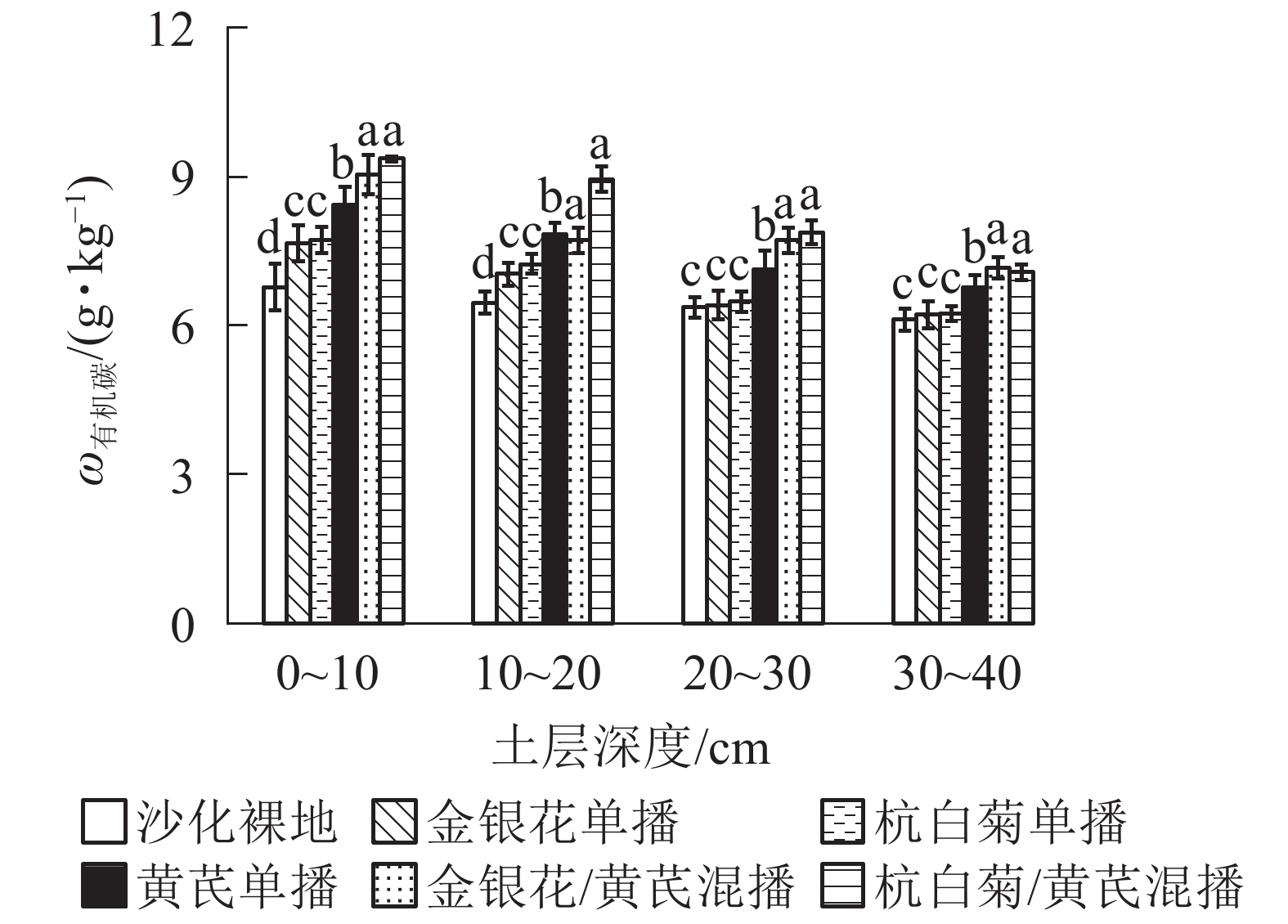
由图1可知:相比于ck,5种播种模式下不同土层土壤有机碳质量分数均显著增加(P<0.05),且同一土壤深度土壤有机碳质量分数从大到小均依次为CMR/AMB、LJT/AMB、AMB、CMR、LJT、ck。与3种单播模式相比,2种混播模式下土壤有机碳质量分数均显著增加(P<0.05),其中CMR/AMB模式有机碳质量分数略高于LJT/AMB(P>0.05)。LJT和CMR模式下土壤表层(0~20 cm)有机碳质量分数较ck显著增加(P<0.05),而在土壤亚表层(20~40 cm)无显著性差异(P>0.05)。此外,不同种植模式下土壤有机碳质量分数均呈表聚性现象,即土壤有机碳质量分数随着土壤垂直剖面加深而逐渐降低。
-
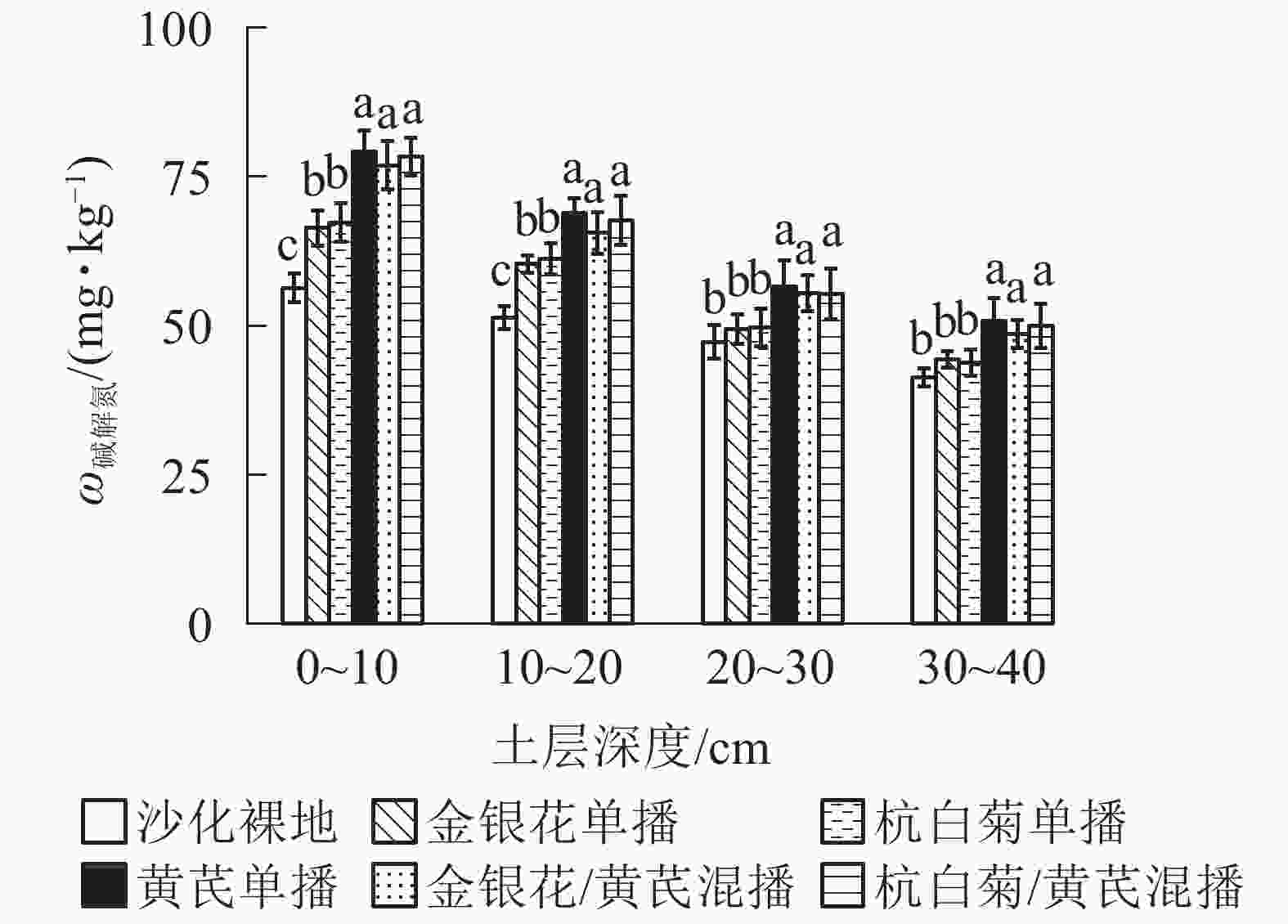
由图2可知:AMB、CMR/AMB和LJT/AMB播种模式下土壤碱解氮质量分数最高,分别为63.89,62.87和61.66 mg·kg−1,3种播种模式间无显著差异(P>0.05);但显著高于LJT和CMR模式(P<0.05)。在土壤表层(0~20 cm)5种播种模式下碱解氮质量分数均显著高于ck (P<0.05),但在土壤亚表层(20~40 cm)无显著差异(P>0.05)。说明不同播种模式下土壤碱解氮质量分数也呈现表聚性现象。
-
与ck相比(表2),5种播种模式下4种土壤酶(脲酶、蔗糖酶、碱性磷酸酶和多酚氧化酶)活性均显著增加(P<0.05)。20~40 cm土层,单播和混播模式之间蔗糖酶和碱性磷酸酶活性差异显著(P<0.05),5种播种模式下土壤脲酶活性差异显著(P<0.05),土壤氧化酶活性差异不显著(P>0.05)。从土壤酶活性的各土层平均值来看,各个播种模式下土壤脲酶活性较ck的增幅最大。LJT/AMB的脲酶活性(0.789 9 mg·g−1)和多酚氧化酶活性(1.077 6 mg·g−1)最高,CMR/AMB下的蔗糖酶活性(8.289 6 mg·g−1)和碱性磷酸酶活性(0.644 8 mg·g−1)最高。LJT/AMB下脲酶、蔗糖酶、碱性磷酸酶和多酚氧化酶活性对比ck分别增加201.82%、56.95%、77.05%和70.85%,CMR/AMB下脲酶、蔗糖酶、碱性磷酸酶和多酚氧化酶活性对比ck分别增加192.63%、58.37%、78.75%和59.36%,AMB模式下脲酶、蔗糖酶、碱性磷酸酶和多酚氧化酶活性对比ck分别增加140.62%、44.57%、52.86%和57.90%,CMR模式下脲酶、蔗糖酶、碱性磷酸酶和多酚氧化酶活性对比ck分别增加106.74%、38.42%、49.06%和55.25%,LJT模式下脲酶、蔗糖酶、碱性磷酸酶和多酚氧化酶活性对比ck分别增加67.69%、33.80%、23.63%和55.81%。此外,从土壤的垂直分布来看,不同播种模式下土壤酶活性也呈表聚性特征。
土层/cm 种植方式 脲酶/(mg·g−1) 蔗糖酶/(mg·g−1) 碱性磷酸酶/(mg·g−1) 多酚氧化酶/(mg·g−1) 0~10 ck 0.342 5±0.021 8 d 6.358 2±0.265 0 d 0.417 6±0.020 6 d 0.754 8±0.046 9 b LJT 0.624 2±0.056 4 c 7.947 8±0.645 6 c 0.617 6±0.043 2 c 1.116 4±0.074 6 a CMR 0.606 7±0.046 5 c 7.847 8±0.241 8 c 0.655 6±0.034 5 c 1.103 1±0.072 6 a AMB 0.844 7±0.062 6 b 8.720 9±0.468 9 b 0.732 5±0.052 6 b 1.127 3±0.089 5 a LJT/AMB 1.108 3±0.061 3 a 9.466 5±0.532 5 a 0.843 2±0.067 8 a 1.275 3±0.084 2 a CMR/AMB 1.036 7±0.055 8 a 9.217 4±0.204 1 a 0.800 4±0.057 2 a 1.134 3±0.067 0 a 10~20 ck 0.310 3±0.018 7 d 5.575 0±0.344 7 d 0.387 5±0.025 3 d 0.697 9±0.037 0 b LJT 0.473 0±0.057 5 c 7.443 8±0.245 9 c 0.490 3±0.053 7 c 1.075 2±0.063 5 a CMR 0.578 1±0.032 1 c 7.143 8±0.443 0 c 0.587 9±0.047 6 c 1.052 2±0.068 7 a AMB 0.639 3±0.052 4 b 8.039 8±0.352 6 b 0.585 8±0.036 2 b 1.068 2±0.070 1 a LJT/AMB 0.843 2±0.064 7 a 8.732 1±0.231 9 a 0.665 4±0.054 7 a 1.182 6±0.096 4 a CMR/AMB 0.798 2±0.045 1 a 8.798 4±0.234 7 a 0.696 3±0.047 3 a 1.093 6±0.074 3 a 20~30 ck 0.222 5±0.015 3 d 4.754 6±0.125 4 c 0.332 7±0.022 3 c 0.563 7±0.026 4 b LJT 0.357 2±0.043 6 c 6.764 5±0.538 6 b 0.355 0±0.023 1 b 0.931 6±0.065 3 a CMR 0.489 7±0.030 7 c 6.994 5±0.364 8 b 0.453 6±0.036 1 b 0.880 7±0.057 0 a AMB 0.553 6±0.038 7 b 7.184 6±0.342 1 b 0.472 2±0.032 7 b 0.952 5±0.085 4 a LJT/AMB 0.667 1±0.059 8 a 7.648 7±0.452 3 a 0.551 2±0.166 0 a 0.994 3±0.073 2 a CMR/AMB 0.663 3±0.043 7 a 7.957 2±0.102 5 a 0.575 4±0.048 9 a 0.926 6±0.088 5 a 30~40 ck 0.171 6±0.013 4 d 4.248 9±0.247 5 c 0.304 9±0.019 7 c 0.506 4±0.022 7 b LJT 0.301 0±0.016 7 c 5.856 4±0.448 7 b 0.320 8±0.003 8 b 0.807 5±0.042 0 a CMR 0.489 7±0.030 7 c 6.994 5±0.364 8 b 0.453 6±0.036 1 b 0.8807±0.057 0 a AMB 0.481 2±0.034 2 b 6.323 1±0.476 8 b 0.415 0±0.025 4 b 0.835 4±0.067 3 a LJT/AMB 0.540 9±0.043 4 a 7.013 2±0.189 7 a 0.494 7±0.113 7 a 0.858 0±0.067 6 a CMR/AMB 0.565 0±0.038 1 a 7.185 4±0.114 6 a 0.506 9±0.036 1 a 0.865 9±0.064 0 a 说明:不同字母表示同一土层不同播种模式间差异显著(P<0.05) Table 2. Soil enzyme activities in each soil layer under different planting patterns
-
由Pearson相关系数(表3)可知:土壤有机碳与碱解氮、4种酶呈极显著相关(P<0.01),土壤碱解氮与4种酶呈极显著相关(P<0.01)。4种土壤酶彼此之间呈极显著相关(P<0.01)。其中脲酶与碱性磷酸酶之间相关系数达0.965,有机碳与碱性磷酸酶之间相关系数达0.949,蔗糖酶与多酚氧化酶之间相关系数达0.948,说明土壤碳、氮与酶之间关系极为紧密。
参数 有机碳 碱解氮 脲酶 蔗糖酶 碱性磷酸酶 多酚氧化酶 有机碳 1 0.893** 0.943** 0.897** 0.949** 0.808** 碱解氮 1 0.848** 0.844** 0.917** 0.835** 脲酶 1 0.949** 0.965** 0.871** 蔗糖酶 1 0.931** 0.948** 碱性磷酸酶 1 0.875** 多酚氧化酶 1 说明:**表示在0.01水平(双侧)上显著相关 Table 3. Correlations analysis of soil carbon, available nitrogen and enzyme activities
2.1. 不同播种模式下土壤有机碳质量分数
2.2. 不同播种模式下土壤碱解氮质量分数
2.3. 不同播种模式下土壤酶活性
2.4. 相关性分析
-
与单播相比,混播不仅可以增加土壤碳、氮总量,更利于土壤有机碳库的稳定[13-14],还能增加土壤速效养分含量,提高土壤养分的有效性。本研究发现:LJT/AMB模式下,土壤有机碳和碱解氮质量分数(0~40 cm土层平均值)较LJT分别提高了19.41%和11.80%,CMR/AMB模式下,土壤有机碳和碱解氮质量分数较CMR分别提高了20.16%和13.24%,这与包兴国等[15]、郑伟等[16]发现混播更有助于改善土壤有机碳、碱解氮的结论一致。作为生物固氮植物,混播模式下内蒙黄芪在向金银花/杭白菊转移土壤氮素的同时,也能通过氮素根际沉积为金银花/杭白菊提供一定的氮素,减缓土壤氮素消耗,土壤速效氮质量分数明显高于LJT和CMR。土壤脲酶通过水解土壤中的尿素形成铵态氮提供氮源,其活性直接表征氮素转化率[17-19];土壤蔗糖酶通过水解土壤有机质生成葡萄糖提供碳源,表征有机碳的积累转化和土壤熟化程度[20-21];土壤碱性磷酸酶通过加速有机磷的脱磷速度直接参与土壤磷素循环,表征磷元素生物转化方向和强弱[22];土壤多酚氧化酶参与土壤芳香族化合物循环,通过分子氧氧化酚或多酚形成醌,醌与土壤中蛋白质、糖、矿质元素等反应生成有机质,分解凋落物木质素获取碳、氮元素[23-24]。蔺芳[18]发现:土壤脲酶、蔗糖酶对土壤碳循环有直接贡献,脲酶、蔗糖酶和碱性磷酸酶对土壤氮循环有直接贡献,与本研究一致,说明土壤中不同种类酶之间、酶和土壤养分之间具有协同交互作用[25]。本研究混播模式下的4种土壤酶活性均显著均高于3种单播和ck (P<0.05),且相关性分析表明:土壤有机碳和碱解氮均与4种酶活性极显著相关(P<0.01)。说明在混播体系中,豆科植物的生物固氮作用及种间竞争作用促进了植物根系生长,大大增加根系种类、生物量和根系纵横分布,增加土壤孔隙度,提高蓄水保水能力,从而改变土壤理化性质。豆科植物根系周围的根瘤菌能促进根系分泌物、细根周转,改善菌根代谢,使得土壤微生物代谢旺盛,呼吸强度增强,促进蔗糖酶、脲酶活性,提高碳素、氮素转化效率,促进碱性磷酸酶和多酚氧化酶活性,对提高土壤肥力有重要作用[26-27]。不同种植模式下土壤有机碳、碱解氮和酶活性均在土壤剖面呈表聚性,表明土壤表层更有利于酶促反应形成有机质和有效氮。与TU等[25]、来幸樑等[28]结果一致。土壤表层凋落物、腐殖质容易积累,微生物代谢旺盛,植物根系集中,有利于物质积累和酶促反应的进行;随着土壤深度的加深,土壤中的水、汽、热状况变差,微生物生境变差,数量急剧减少,酶促反应底物也不如表层,碳氮积累和酶活均随着土层剖面下降。
混播模式充分利用豆科植物内蒙黄芪的生物固氮作用,使金银花/杭白菊在没有氮肥的条件下获取氮源,提高植物氮素吸收利用效率,减少土壤无机氮的累积,降低种植地氮素污染的风险。杭白菊/黄芪混播和金银花/黄芪混播模式下土壤有机碳、碱解氮质量分数、土壤脲酶、蔗糖酶和碱性磷酸酶活性均显著高于杭白菊或金银花单播(P<0.05),而彼此之间差异不显著(P>0.05)。相较于单播,2种混播模式对土壤有机碳、碱解氮的积累和土壤酶活性的促进作用更强,更有利于改良土壤肥力,是适合在豫北地区推广的可持续发展的生态农业模式。









 DownLoad:
DownLoad:
