-
辣椒Capscum annuum 为茄科Solanaceae辣椒属Capsicum 1年生或多年生植物[1],是深受喜爱的蔬菜和调味品,也是提炼辣椒素的工业原料,具有重要的经济价值[2]。辣椒果实中的辣椒素类物质能引起辛辣味,主要有辣椒素、二氢辣椒素、降二氢辣椒素、高二氢辣椒素以及高辣椒素等[3-4];其中辣椒素和二氢辣椒素占辣椒素类物质总量的90%左右,也提供了90%以上的辣感和热感[5],是评价辣椒品质的重要指标之一[6]。辣椒素类化合物在辣椒采收期内不断变化。BARBERO等[7]发现:辣椒素在果实发育早期开始积累,随后一直增加,直到果实完全成熟时达到最高,可能受过氧化物酶的降解作用[8],之后略有降低。也有研究认为部分品种果实的辣椒素在采收期内并不会降低[7];辣椒素的积累受生长环境的影响,如在干旱环境下,虽然辣椒产量下降,但辣椒素含量显著提升[9]。而在肥料胁迫条件下,果实的辣椒素含量会增加[10]。采收期内,辣椒果实中维生素C总量呈增长趋势,青熟果中最低,红熟果中最高[11]。不同品种辣椒干物质积累受基因型的控制,随外部环境条件、栽植密度、整枝方式[12]以及后期栽培中肥料使用等因素的变化[13-16]而不尽相同。杭椒(‘杭州鸡爪’‘Hangzhou Jizhua’ב吉林早椒’‘Jilin Zaojiao’)是一种在浙江杭州栽培成功的微辣型辣椒[17],因辣度低,维生素C含量较高,肉质厚,口感好,栽植效益高,栽植规模逐渐扩大[18-19]。随着市场对杭椒需求的不断增加,研究并确定最佳采收期、获得不同辣度杭椒果实等工作意义重大。目前,国内对于杭椒果实辣椒素含量研究较少,尤其是对于其不同采收期辣椒素含量及变化规律的研究几乎空白,关于杭椒果实发育过程中维生素C含量的变化尚未有公开研究报道。本研究以不同采收期杭椒果实中辣椒素类物质、维生素C和干物质相对含量动态变化作为研究内容,旨在确定杭椒果实最佳采收期,为杭椒采收计划制定提供基础理论指导。
-
4个杭椒品种‘杭椒12号’‘Hangjiao No.12’、‘杭椒206’‘Hangjiao206’、‘杭椒2号’‘Hangjiao No.2’和‘杭椒2731’‘Hangjiao2731’的果实由杭州市农业科学研究院提供。选择不同采收期大小均匀、无机械损伤、成熟度一致的杭椒果实进行采收。
-
各品种杭椒在开花后14、21、28、35、42、49、56 d进行采收。果实采收后冲洗擦干,去梗后对半剖开,放入塑料网袋,浸没于液氮中预冻15~30 s,放入真空冷冻干燥机(Christ Beta 1-8 LD,德国Christ公司)中冷冻干燥,粉碎,过50目筛,置于−20 ℃冰箱中暂存待用。
-
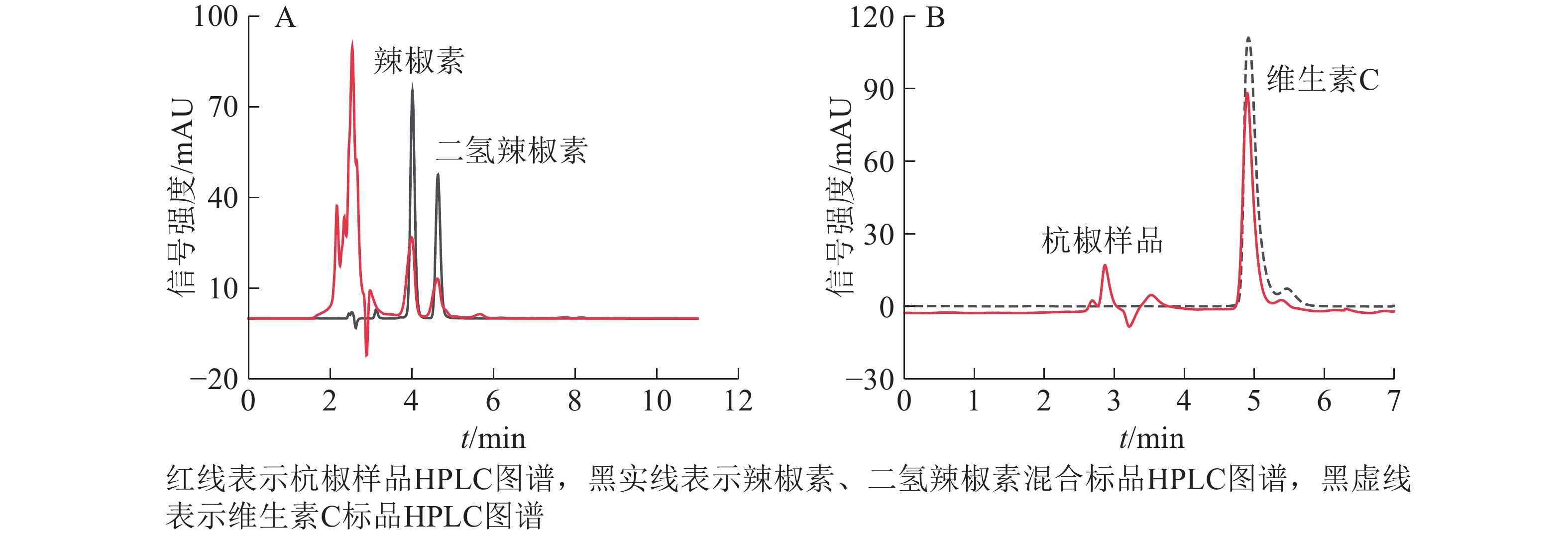
辣椒素和二氢辣椒素参考GB/T 21266−2007《辣椒及辣椒制品中辣椒素类物质测定及辣度表示方法》[20]改良优化后测定,通过加标回收实验确定方法可行性。绘制辣椒素和二氢辣椒素标品的高效液相色谱(HPLC)图谱(图1A)。
-
精确称取杭椒粉末2.000 0 g,置于10 mL离心管中,加入4 mL甲醇(色谱纯,美国TEDIA公司)-四氢呋喃(色谱纯,美国TEDIA公司) (体积比为1∶1)溶液,振荡混匀,40 kHz下超声提取20 min,10 000 r·min−1离心10 min,转移上清液;所得沉淀再用3 mL甲醇-四氢呋喃溶液提取2次,离心后将上清液合并,并用甲醇-四氢呋喃溶液定容。随后将所得溶液置于(60.0±0.5) ℃恒温水浴中浓缩至2 mL,过0.45 μm微孔滤膜待用。
-
采用外标法用高效液相色谱仪(安捷伦1200,美国Agilent公司)测定并分析提取液中的辣椒素和二氢辣椒素。色谱柱(250.0 mm×4.6 mm,5 μm,Hypersil ODS2,大连伊利特)柱温30 ℃;设定紫外检测器波长280 nm;流动相选用体积分数为80%的甲醇,流速0.8 mL·min−1;进样量10 μL。绘制杭椒样品HPLC图谱(图1A)。
-
称取2.000 0 g杭椒冻干样品,加入1.000 0 g·L−1辣椒素标准溶液150 μL,按照1.3.1方法提取,重复5次取平均值;同时称取3份2.000 0 g相同的杭椒冻干样品用作平行分析。称取2.000 0 g杭椒冻干样品,加入1.000 0 g·L−1二氢辣椒素标准溶液120 μL,按照1.3.1方法提取,重复5次取平均值;同时称取3份2.000 0 g相同的杭椒冻干样品用作平行分析。
-
参考GB/T 21266−2007《辣椒及辣椒制品中辣椒素类物质测定及辣度表示方法》[20],计算干样中辣椒素质量分数(mg·g−1):W辣椒素=C1V/m;二氢辣椒素质量分数(mg·g−1):W二氢辣椒素=C2V/m;辣椒素类物质总量(mg·g−1):W总=(W辣椒素+W二氢辣椒素)/0.9。其中:C1、C2分别为标准曲线上对应的辣椒素和二氢辣椒素质量浓度(g·L−1);V为样品浓缩后体积(mL),m为干样质量(g),0.9为辣椒素与二氢辣椒素折算为辣椒素类物质总量的系数。
-
杭椒果实采收后,清洗擦干,用电子天平称得鲜样质量;随后用真空冷冻干燥机冷冻干燥至恒质量即为样品干样质量。果实干物质相对含量=干样质量/鲜样质量×100%。
-
参考GB/T 21266−2007《辣椒及辣椒制品中辣椒素类物质测定及辣度表示方法》[20],计算杭椒斯科维尔指数(SHU):X=Wf×0.9×(16.1×103)+Wf×0.1×(9.3×103)。其中Wf为鲜样中辣椒素类物质质量分数(mg·g−1);0.9为辣椒素类物质总量的折算系数;16.1×103为辣椒素或二氢辣椒素转换为斯科维尔指数的系数;0.1为其余辣椒素类物质含量的折算系数;9.3×103为其余辣椒素类物质转换斯科维尔指数的系数。斯科维尔指数与辣度的换算关系为:150 SHU=1度。辣度四舍五入取整数。
-
采用Excel 2007整理数据,使用SPSS 22.0进行显著性分析,使用Origin 2018作图。
-
将配制好的不同浓度梯度的辣椒素和二氢辣椒素混合标样,高效液相色谱仪检测,用纵坐标(y)表示峰面积(mAU·s),用横坐标(x)表示质量浓度(g·L−1),得到辣椒素和二氢辣椒素的回归方程和相关系数(表1)。
表 1 2种辣椒素的回归方程、相关系数
Table 1. Regression equation and correlation of two capsaicinoids
组分 回归方程 相关系数 辣椒素 y=8 745.4x+17.858 0.999 8 二氢辣椒素 y=5 795.5x+13.288 0.999 8 说明:y表示峰面积,x表示质量浓度 -
平行分析可知:样品辣椒素平均值为0.065 0 mg·g−1,二氢辣椒素平均值为0.067 5 mg·g−1。加标回收结果显示:2种辣椒素组分平均回收率为99.186%~99.580%,相对标准误为1.076%~1.562%(表2)。说明加标回收方法重复性好,准确度高。
表 2 2种辣椒素类物质成分加标回收率
Table 2. Recovery of two capsaicinoids
组分 样品质量/mg 加标量/mg 测得量/mg 回收率/% 辣椒素 0.130±0.005 0.150 0.278±0.002 99.186±1.076 二氢辣椒素 0.135±0.003 0.120 0.255±0.002 99.580±1.562 说明:数据为平均值±标准误(n=5) -
由表3可以看出:采收期内不同品种干物质相对含量不同。花后14~28 d,‘杭椒2号’果实干物质相对含量稳定,花后28~49 d,干物质迅速增加,之后增速变缓,花后56 d时达到最大值(14.452%)。‘杭椒2731’果实干物质相对含量在花后14~35 d波动不大,35~42 d和49~56 d迅速增加,花后56 d时达到最大值(13.598%)。‘杭椒206’果实干物质相对含量在花后21~42 d缓慢增加,42~49 d迅速增加,花后56 d达最大值(12.553%)。‘杭椒12号’果实在花后14~28 d干物质相对含量稳定,之后平稳增加,56 d时达最大值(13.571%)。
表 3 4个杭椒品种果实在采收期内的干物质相对含量
Table 3. Content of dry matter in fruits of four Hangzhou pepper cultivars during harvest period
花后时间/d 干物质相对含量/% ‘杭椒12号’ ‘杭椒2号’ ‘杭椒206’ ‘杭椒2731’ 14 7.618±0.392 e 9.015±0.675 d 7.901±0.675 d 8.937±0.420 c 21 7.836±0.189 e 8.391±0.056 d 7.969±0.271 d 8.061±0.149 c 28 8.350±0.217 e 8.352±0.228 d 8.531±0.409 cd 9.052±0.241 c 35 9.365±0.073 d 10.361±0.050 c 9.458±0.302 bc 9.123±0.810 c 42 10.171±0.082 c 12.110±0.309 b 10.095±0.261 b 10.987±0.026 b 49 12.259±0.383 b 14.164±0.070 a 12.023±0.199 a 11.223±0.099 b 56 13.571±0.081 a 14.452±0.070 a 12.553±0.338 a 13.598±0.055 a 说明:数据为平均值±标准误(n=3)。同列不同小写字母表示差异显著(P<0.05) -
由图2可以看出:4种杭椒果实辣椒素类物质总量在采收期内变化趋势不同。花后14 d,4个品种辣椒素类物质总量均较低。14~21 d,‘杭椒2号’辣椒素类物质迅速增长,28 d时达到最大值(2.520 0 mg·g−1),随后开始下降。‘杭椒12号’辣椒素类物质总体呈增长趋势,花后21 d迅速增长至0.600 0 mg·g−1,之后变化较小,56 d时达最大(0.880 0 mg·g−1)。‘杭椒2731’辣椒素类物质在花后14~49 d呈增加趋势,之后下降。‘杭椒206’在整个采收期均处于较低水平。

图 2 采收期4个品种辣椒素类物质总量及变化
Figure 2. Content of capsaicinoids in four Hangzhou pepper cultivars during the harvest period
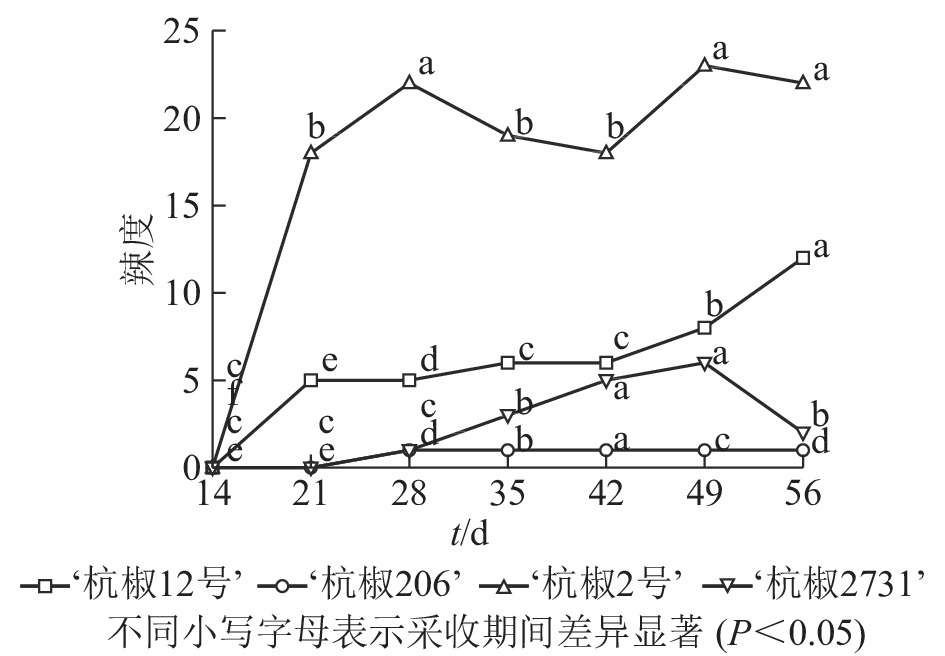
辣度作为直观呈现果实辣感的一项指标,有助于消费者选择合适品种。由图3可以看出:4个杭椒品种辣度大小依次为‘杭椒2号’‘杭椒12号’‘杭椒2731’‘杭椒206’,采收期内其变化趋势与辣椒素类物质变化总体一致。比较图2和图3发现:‘杭椒2号’辣度变化曲线与辣椒素类物质总量变化曲线存在较大差异,这是由于辣度还与果实内辣椒素类物质质量和干物质质量有关;采收期内‘杭椒2号’鲜果中干物质相对含量增加迅速,而干物质中辣椒素类物质质量分数变化不大,造成单位质量鲜果中辣椒素类物质总量较高,因而鲜果辣度较高。
-
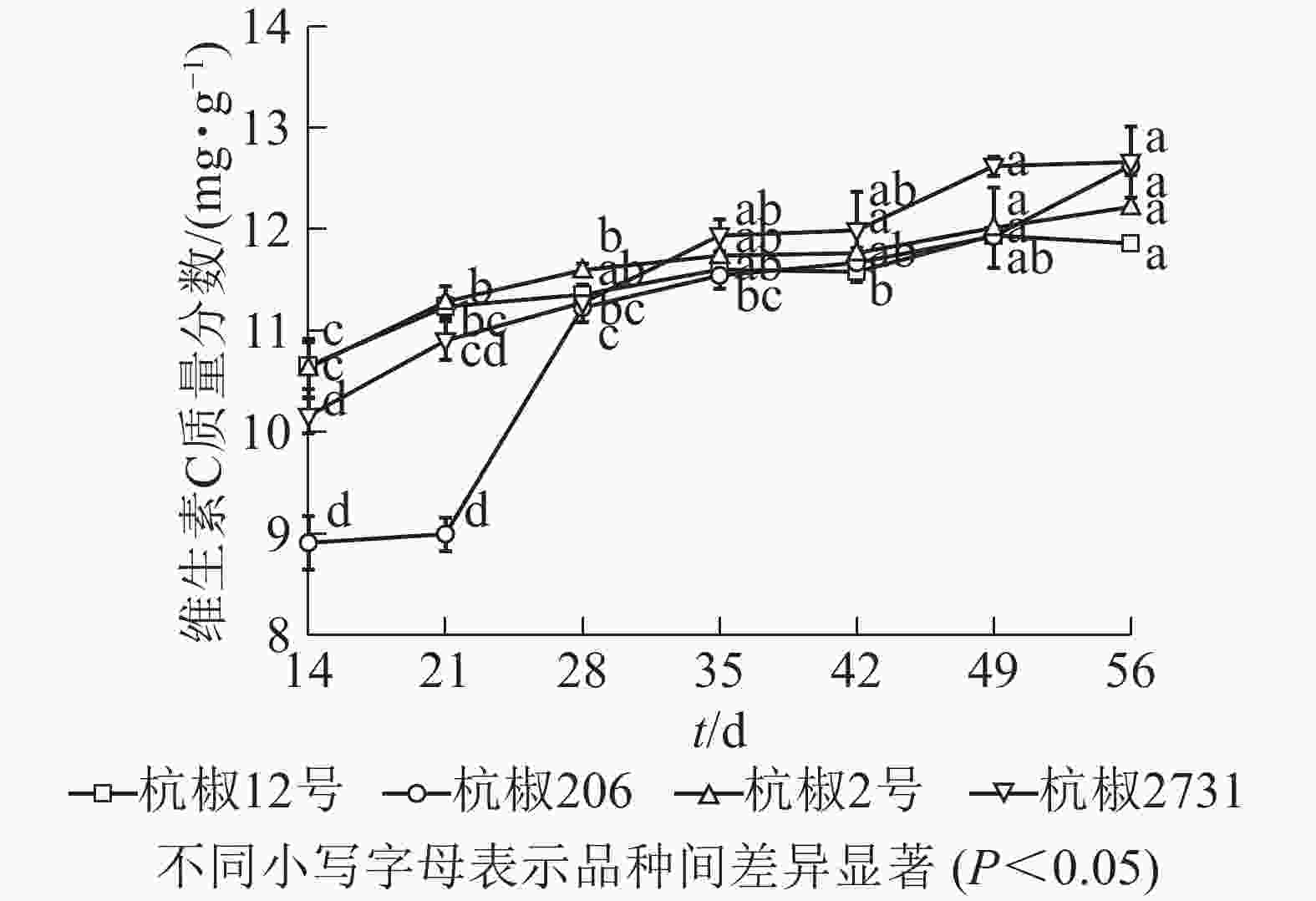
由图4可以看出:采收期内,4个杭椒品种维生素C质量分数呈增长趋势。其中‘杭椒2号’在花后14~35 d平稳增加,35 d后趋于稳定,至56 d时达最大(12.220 0 mg·g−1)。‘杭椒2731’在花后14~49 d呈增长趋势,49 d后趋于稳定,56 d时达最大值(12.660 0 mg·g−1)。‘杭椒206’在花后14~21 d变化较小,21~28 d迅速增加,35 d后趋于稳定,56 d时达最大值(12.620 0 mg·g−1)。‘杭椒12号’在整个采收期内平稳增加,花后49 d达最大值(11.940 0 mg·g−1)。总的来说,采收期内4个杭椒品种果实维生素C质量分数动态变化与大部分辣椒品种基本相同[22-23]。
-
4个杭椒品种维生素C质量分数和干物质相对含量在采收期内均随果实成熟度的增加而升高,但是辣椒素类物质总量和辣度在采收期内的变化差异较大。花后14 d,辣椒素类物质合成相关的基因还未开始表达[24],各品种辣椒素类物质和辣度均处于较低水平。‘杭椒12号’和‘杭椒2号’一样,果实辣椒素类物质均在花后14~21 d迅速增加,不同的是‘杭椒12号’在49~56 d时再次迅速增加至高点(0.880 0 mg·g−1),由此推断该品种可能是晚熟品种。‘杭椒2731’果实辣椒素类物质在花后28 d前一直处于较低水平,28 d后略有上升,42~49 d迅速增加并达到最大值(0.520 0 mg·g−1);而‘杭椒206’果实在整个采收期内均处于较低水平(0.037 0~0.120 0 mg·g−1)。从整体上看,4个辣椒品种中‘杭椒2号’的辣度最高,‘杭椒206’的辣度最低。辣椒素类物质的合成积累受多方面因素影响[24]。一方面,辣椒素类物质的合成积累与辣椒素合成基因的表达有关,KEYHANINEJAD等[25]发现辣椒素合成途径中关键基因在花后16~20 d强表达,使得采收期内辣椒素类物质呈先升高后降低的趋势;另一方面辣椒素类物质快速增加和达到高峰的时期还与品种有关[26],同时受到环境因素的影响[27]。
综上所述,不同杭椒品种在采收期内辣椒素类物质变化差异较大,采收时需要根据不同品种生长特性,同时结合市场需求制定不同采收计划。对‘杭椒2号’(相对高辣品种)而言,花后49 d时辣椒素类物质质量分数较高,果实辣感最强,此时采收能获得成熟度合适、干物质相对含量和维生素C质量分数较高的果实。‘杭椒12号’(相对中辣品种)于花后56 d辣椒素类物质质量分数达到高值,辣感最强,维生素C质量分数和干物质相对含量也较高,但此时果实过于成熟,不利于长途运输和储存,因当根据实际情况进行果实采收。‘杭椒206’和‘杭椒2731’属于相对低辣品种,整个采收期辣椒素类物质均较低,辣感弱,结合维生素C质量分数和干物质相对含量变化,此2品种的最适采收期为花后49 d,此时果实成熟度好,有利于储存和运输。
Dynamic changes of capsaicinoids and vitamin C contents in Hangzhou pepper during the harvesting period
-
摘要:
目的 研究杭椒Capsicum annuum ‘Hangzhou Jizhua’בJilin Zaojiao’果实辣椒素、维生素C等物质在采收期的动态变化,以确定最佳采收期。 方法 选取4个常见杭椒品种,采用高效液相色谱法分别测定开花后14、21、28、35、42、49、56 d采收的果实中辣椒素、二氢辣椒素和维生素C以及干物质质量分数。 结果 采收期内4个杭椒品种果实辣椒素类物质质量分数不同,品种间差异显著(P<0.05);维生素C质量分数和干物质相对含量随果实成熟度增加而升高。 结论 花后49 d是杭椒果实最佳采收期,此时果实成熟度好,辣椒素类物质、维生素C质量分数和干物质相对含量均较高。采收期内不同品种辣椒素类物质质量变化差异大,具体采收计划应综合种植品种、市场需求和供求关系等多方面因素考虑。图4表3参27 Abstract:Objective This study is aimed to determine the dynamic changes of capsaicinoids, vitamin C and dry matter contents in the fruit of Hangzhou pepper (Capsicum annuum ‘Hangzhou Jizhua’בJilin Zaojiao’) during the harvest period. Method Contents of capsaicin, dihydrocapsaicin, vitamin C and dry matter in the fruit of four common cultivars of Hangzhou pepper harvested at different times (14, 21, 28, 35, 42, 49, 56 days after flowering) were measured by HPLC. Result Content of capsaicinoids fluctuated during the harvest period and varied among four cultivars, while the contents of vitamin C and dry matter increased with fruit ripening. Conclusion Around 49 days after flowering is the best pepper harvest time in terms of fruit maturity, and the contents of capsaicinoids, vitamin C and dry matter. Since the dynamic changes of capsaicinoids content varied among cultivars, the optimum harvesting planning should take into consideration various factors such as pepper varieties, market demand and supply-demand relationship. [Ch, 4 fig. 3 tab. 27 ref.] -
Key words:
- Hangzhou pepper /
- harvest period /
- capsaicinoids /
- vitamin C /
- dry matter /
- dynamic change
-
表 1 2种辣椒素的回归方程、相关系数
Table 1. Regression equation and correlation of two capsaicinoids
组分 回归方程 相关系数 辣椒素 y=8 745.4x+17.858 0.999 8 二氢辣椒素 y=5 795.5x+13.288 0.999 8 说明:y表示峰面积,x表示质量浓度 表 2 2种辣椒素类物质成分加标回收率
Table 2. Recovery of two capsaicinoids
组分 样品质量/mg 加标量/mg 测得量/mg 回收率/% 辣椒素 0.130±0.005 0.150 0.278±0.002 99.186±1.076 二氢辣椒素 0.135±0.003 0.120 0.255±0.002 99.580±1.562 说明:数据为平均值±标准误(n=5) 表 3 4个杭椒品种果实在采收期内的干物质相对含量
Table 3. Content of dry matter in fruits of four Hangzhou pepper cultivars during harvest period
花后时间/d 干物质相对含量/% ‘杭椒12号’ ‘杭椒2号’ ‘杭椒206’ ‘杭椒2731’ 14 7.618±0.392 e 9.015±0.675 d 7.901±0.675 d 8.937±0.420 c 21 7.836±0.189 e 8.391±0.056 d 7.969±0.271 d 8.061±0.149 c 28 8.350±0.217 e 8.352±0.228 d 8.531±0.409 cd 9.052±0.241 c 35 9.365±0.073 d 10.361±0.050 c 9.458±0.302 bc 9.123±0.810 c 42 10.171±0.082 c 12.110±0.309 b 10.095±0.261 b 10.987±0.026 b 49 12.259±0.383 b 14.164±0.070 a 12.023±0.199 a 11.223±0.099 b 56 13.571±0.081 a 14.452±0.070 a 12.553±0.338 a 13.598±0.055 a 说明:数据为平均值±标准误(n=3)。同列不同小写字母表示差异显著(P<0.05) -
[1] 赵红, 曹亚从, 张正海, 等. 我国辣椒核心种质资源园艺性状多样性的分析和评价[J]. 中国蔬菜, 2018(1): 25 − 34. ZHAO Hong, CAO Yacong, ZHANG Zhenghai, et al. Analysis and evaluation of genetic diversity of pepper (Capsicum spp.) core germplasm resources in China [J]. China Veg, 2018(1): 25 − 34. [2] KHAN F A, MAHMOOD T, ALI M, et al. Pharmacological importance of an ethnobotanical plant: Capsicum annuum L. [J]. Nat Prod Res, 2014, 28(16): 1267 − 1274. [3] 孔学, 陈贯虹, 郑立稳, 等. 辣椒碱合成方法的改进[J]. 广州化工, 2012, 40(3): 50 − 51, 69. KONG Xue, CHEN Guanhong, ZHENG Liwen, et al. Improvement on synthesis method of capsaicin [J]. Guangzhou Chem Ind, 2012, 40(3): 50 − 51, 69. [4] FAYOS O, de AGUIAR A C, JIMÉNEZ-CANTIZANO A, et al. Ontogenetic variation of individual and total capsaicinoids in malagueta peppers (Capsicum frutescens) during fruit maturation [J]. Molecules, 2017, 22(5): 736. [5] GOVINDARAJAN V S. Capsicum: production, technology, chemistry, and quality, Part II. Processed products, standards, world production and trade [J]. Crit Rev Food Sci Nutr, 1986, 23(3): 207 − 288. [6] ALOTHMAN Z A, AHMED Y B H, HABILA M A, et al. Determination of capsaicin and dihydrocapsicum in Capsicum fruit samples using high performance liquid chromatography [J]. Molecules, 2012, 16(10): 8919 − 8929. [7] BARBERO G F, de AGUIAR A C, CARRERA C, et al. Evolution of capsaicinoids in peter pepper (Capsicum annuum var. annuum) during fruit ripening [J]. Chem Biodiversity, 2016, 13(8): 1068 − 1075. [8] BERNAL M A, CALDERÓN A A, PEDREÑO M A, et al. Dihydrocapsaicin oxidation by Capsicum annuum (var. annuum) peroxidase [J]. J Food Sci, 2006, 58(3): 611 − 613. [9] JEEATID N, TECHAWONGSTIEN S, SURIHARN B, et al. Influence of water stresses on capsaicinoid production in hot pepper (Capsicum chinense Jacq.) cultivars with different pungency levels [J]. Food Chem, 2018, 245: 792 − 797. [10] GURUNG T, TECHAWONGSTIEN S, SURIHARN B, et al. Growth, yield and capsaicinoid contents of 14 cultivars of hot pepper (Capsicum spp.) at two elevations of Thailand [J]. SABRAO J Breed Genet, 2011, 43(2): 130 − 143. [11] 刘金兵, 赵华仑, 孙洁波, 等. 辣椒果实成熟过程中维生素C、辣椒素及干物质含量的变化[J]. 江苏农业学报, 2000, 16(2): 61 − 62. LIU Jinbing, ZHAO Hualun, SUN Jiebo, et al. Contents of Vc, capsaicine and dry matter during the ripening of hot pepper [J]. Jiangsu J Agric Sci, 2000, 16(2): 61 − 62. [12] 侯超, 陶承光, 王丽萍, 等. 不同密度和整枝方式对辣椒光合特性、干物质分配及产量的影响[J]. 西北农业学报, 2010, 19(3): 159 − 162. HOU Chao, TAO Chengguang, WANG Liping, et al. Effect of different density and training methods on photosynthetic charateristics, dry matter distribution and yield of Capsicum annuum L. [J]. Acta Agric Boreali-Occident Sin, 2010, 19(3): 159 − 162. [13] 李辉, 康健, 赵耕毛, 等. 盐胁迫对菊芋干物质和糖分积累分配的影响[J]. 草业学报, 2014, 23(2): 160 − 170. LI Hui, KANG Jian, ZHAO Gengmao, et al. Effects of salinity on accumulation and distribution mode of dry matter and soluble sugar of Jerusalem artichoke (Helianthus tuberosus) [J]. Acta Prataculturae Sin, 2014, 23(2): 160 − 170. [14] 孟亮. 水肥一体化技术对设施辣椒产量形成和养分吸收与分配规律的影响[D]. 兰州: 甘肃农业大学, 2017. MENG Liang. Effects of Fertigation Technology on Yield, Nutrient Accumulation and Distribution Regulationgs in Pepper[D]. Lanzhou: Gansu Agricultural University, 2017. [15] 曹永康. 钾肥水平对辣椒生长生理和养分利用的影响[D]. 兰州: 甘肃农业大学, 2018. CAO Yongkang. Effect of Potassium Fertilizer Levels on Growth Physiology and Nutrient Utilization of Pepper[D]. Lanzhou: Gansu Agricultural University, 2018. [16] 潘玉娇. 不同水分条件下辣椒生长发育与干物质积累模拟模型的研究[D]. 长春: 吉林农业大学, 2007. PAN Yujiao. Study on the Simulation Model of Growth and Dry Matter Accumulation of Pepper under Different Irrigation Quarity[D]. Changchun: Jilin Agricultural University, 2007. [17] 吕晓菡, 杨静, 陈建瑛, 等. 冻干浓缩对高效液相色谱法测定杭椒类辣椒中辣椒素类物质的影响[J]. 安徽农业科学, 2019, 47(22): 196 − 199, 223. LÜ Xiaohan, YANG Jing, CHEN Jianying, et al. Effect of freeze drying and concentration on determination of capsaicinoids in capsicum by high peformance liquid chromatography [J]. J Anhui Agric Sci, 2019, 47(22): 196 − 199, 223. [18] 张胜. 早春杭椒高产栽培管理技术[J]. 园艺与种苗, 2018(6): 27 − 28. ZHANG Sheng. High-yielding cultivation management techniques of hang pepper in early spring [J]. Hortic Seed, 2018(6): 27 − 28. [19] 杨玲. 早熟辣椒新品种‘杭椒一号’高产栽培技术[J]. 中国果菜, 2017, 37(8): 61 − 63. YANG Ling. Characteristics and high-yield cultivation techniques of a new early-maturing pepper variety named ‘Hangjiao No. 1’ [J]. China Fruit Veg, 2017, 37(8): 61 − 63. [20] 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会. 辣椒及辣椒制品中辣椒素类物质测定及辣度表示方法: GB/T 21266−2007[S]. 北京: 中国标准出版社, 2008. [21] 胡应杰, 潘康标, 陈昌云, 等. 高效液相色谱法测定辣椒中维生素C的含量[J]. 南京晓庄学院学报, 2008(6): 30 − 32. HU Yingjie, PAN Kangbiao, CHEN Changyun, et al. Determination of Vc in hot pepper by high performance liquid chromatography [J]. J Nanjing Xiaozhuang Univ, 2008(6): 30 − 32. [22] 赵海燕, 赵尊练, 巩振辉, 等. 线辣椒果实中几种营养物质和CAT、POD活性的变化规律[J]. 中国农业大学学报, 2008, 13(4): 35 − 40. ZHAO Haiyan, ZHAO Zunlian, GONG Zhenhui, et al. Changes in nuritional quality and anti-oxidant exzyme acticity in line pepper fruit [J]. J China Agric Univ, 2008, 13(4): 35 − 40. [23] 高怀春. 辣椒果实维生素C含量变化的研究[D]. 泰安: 山东农业大学, 2004. GAO Huaichun. Studies on Changes of VC Content in the Fruit of Pepper[D]. Tai’an: Shandong Agricultural University, 2004. [24] 雷建军, 朱张生, 孙彬妹, 等. 辣椒素类物质生物合成及其分子生物学机理研究进展[J]. 园艺学报, 2018, 45(9): 1739 − 1749. LEI Jianjun, ZHU Zhangsheng, SUN Binmei, et al. Progress in biosynthesis of capsaicinoids and its molecular mechanism [J]. Acta Hortic Sin, 2018, 45(9): 1739 − 1749. [25] KEYHANINEJAD N, CURRY J, ROMERO J, et al. Fruit specific variability in capsaicinoid accumulation and transcription of structural and regulatory genes in Capsicum fruit [J]. Plant Sci, 2014, 215/216: 59 − 68. [26] 陈俊琴. 辣椒果实中辣椒素生物合成相关物质及外源多胺调控的研究[D]. 沈阳: 沈阳农业大学, 2015. CHEN Junqin. Studies on Capsaicin Biosynthetic Related Substances and Polyamines Regulatory Mechanisms for Capsaicin in Pepper (Capsicum annuum L.)[D]. Shenyang: Shenyang Agricultural University, 2015. [27] 赵凯, 邓明华, 朱海山. 辣椒素积累生理研究的最新进展[J]. 长江蔬菜, 2009(20): 18 − 22. ZHAO Kai, DENG Minghua, ZHU Haishan. Progress of physiology research of capsaicin accumulation [J]. J Changjiang Veg, 2009(20): 18 − 22. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20190577







 下载:
下载: