-
植物挥发性有机化合物(VOCs)是植物体通过次生代谢途径合成的低沸点、小分子一类化合物[1],在植物与环境因子、微生物和动物互作中起着重要作用[2],特别对改善空气质量和提高人类身体健康有积极意义[3]。植物在生长过程中,会产生大量的空气负离子。植物进行光合作用利用二氧化碳(CO2)产生氧气(O2)过程中会形成空气负离子[4];树叶和树木尖端放电也能产生空气负离子,针叶树比阔叶树更容易产生负离子[5]。空气负离子既能降低PM2.5浓度,也能有效抑制细菌和真菌的生长[6];同时也是治疗多种慢性疾病的良药[7],不仅可以缓解人体心血管的舒张压和提高内分泌的稳定性,还能有效降低情绪和血清素含量[8]。FATEMI等[9]在研究植物VOCs对猕猴桃Actinidia chinensis防腐作用时发现:黑香芹Petroselinum crispum和茴香Foeniculum vulgare精油能够完全抑制猕猴桃果实灰霉病Botrytis cinerea的生长;ZHENG等[10]研究发现:反式肉桂醛对水稻Oryza sativa稻曲病病菌Ustilaginoidea virens感染具有较强的抑制作用。受害植物经(E)-2-己烯醛和(Z)-3-乙酸己酯处理后能释放更多的萜烯类化合物[11];萜烯类物质不仅具有增强植物的抗病能力[12],还能够抑制真菌生长[13]。同时萜烯类化合物具有重要的药用价值,如紫杉醇具有抗肿瘤效果,青蒿素具有抗疟疾特效[14]。植物释放的挥发物不仅是天然的“防腐剂”“保健品”,也是天然的空气“清洁剂”。林富平等[15]研究金桂Osmanthus fragrans ‘Thunbergii’挥发物对空气微生物的作用时发现:金桂对空气中细菌、真菌和放线菌具有较强的抑制作用;谢慧玲等[16]研究发现:皂荚Gleditsia sinensis和五角枫Acer truncatum等8种植物挥发物单体对细菌和放线菌有明显的抑制效果。目前,已有研究者在植物VOCs的抑菌活性[17]和林分空气负离子[18]的研究等方面取得了较大进展。但关于杨梅Myrica rubra、青梅Vatica mangachapoi、茶Camellia sinensis植物VOCs对环境的研究尚未见报道。本研究以杨梅、青梅和茶为对象,测定了3种植物VOCs组分和含量、园内空气负离子和微生物含量,探讨植物VOCs的抑菌和净化空气作用,为选择良好的经济林环境提供理论依据。
-
样地设在杭州市临安区浙江农林大学东湖校区杨梅园、青梅园和茶园(纯园无其他树种)教学实习基地(30°15′25″N,119°43′39″E),该研究区属中亚热带季风气候,温暖湿润,四季分明,雨热同期,有梅雨季节,空气湿润,年日照时数为1 939.0 h。年均气温为16.4 ℃,1月最低,平均为−0.4~5.5 ℃,极端最低为−13.1 ℃;7月最高,平均为24.4~30.8 ℃,极端最高为41.2 ℃。全年降水量为1 628.6 mm,年平均相对湿度在70%以上。空旷地为园外环境(无树木的影响);杨梅树高约6.0 m,胸径15.0 cm;青梅树高约5.0 m,胸径10.0 cm;茶树长势均匀,高约0.5 m。无病虫害,树木生长健康。2018年5月选择晴朗无风的天气,气温约30 ℃的条件下开展实验。
-
采用QC-2型大气采样仪(北京市劳动保护科学研究所),在距地面1.5 m(人正常呼吸的平均身高)处,对空旷地(对照)、杨梅、青梅、茶的树木VOCs以及园内空气VOCs进行采集,采集时间为9:00−11:00。气体循环流量为100 mL·min−1,采气时间为1 h,采样重复5次,采集后采摘3种树木叶片称量。3种树木及空气VOCs分析参照GAO等[19]的方法,采用动态顶空气体循环热脱附/气相色谱/质谱联用分析技术(TDS-GC-MS)。通过TDS-GC-MS技术分析,获得VOCs的总离子流量色谱图,利用NIST2008谱库查询,色谱峰面积进行定量分析,并计算相对含量。
-
采用ITC-201A 型(Andes公司生产,日本)空气负离子测定仪,在高度为1.5 m处测定空旷地(对照)、杨梅、青梅和茶园内的空气负离子数。选择5个采样点,采样点的距离为2棵树之间距离取平均值,采样时间为7:00、10:00、13:00、16:00和19:00。
-
按照周德庆[20]的方法配制细菌培养基(牛肉膏蛋白胨培养基)、真菌培养基(马丁式培养基)和放线菌培养基(高式1号培养基)。按照GAO等[19]方法分别配制了体积分数为0.1%、0.5%、1.0% 的罗勒烯、柠檬烯、壬醛和癸醛4种单体的培养基。
-
采用自然沉降法[16],在空旷地(对照)、杨梅、青梅和茶园内均设5个采样点,采集微生物。将3种不同培养基的培养皿分别置于离地面1.5 m高的平板支架上,距树干水平距离1.0 m,采集空气中自然漂浮的微生物(细菌、真菌和放线菌)。采样时间为7:00、10:00、13:00、16:00和19:00,培养基在空气中暴露10 min后,用保鲜膜包好后带回实验室置于25 ℃恒温培养箱中培养。接菌的培养皿在25 ℃培养箱培养24 h后进行细菌菌落统计,培养72 h后进行真菌菌落统计,培养96 h后进行放线菌菌落统计。根据微生物计算公式处理微生物数[15],计算公式为:菌数(个·m−3)=50 000N/(AT)。其中:N为培养皿中菌落平均数(个);A为培养皿的面积(cm2);T为打开培养皿皿盖的时间(min)。抑菌率=(对照菌数−处理菌数)/对照菌数×100%。
-
所有数据均为5次重复的平均值±标准差,利用Origin 9.0进行统计分析和作图。统计方法采用One-Way ANOVA,进行Tukey多重比较(P<0.05)。
-
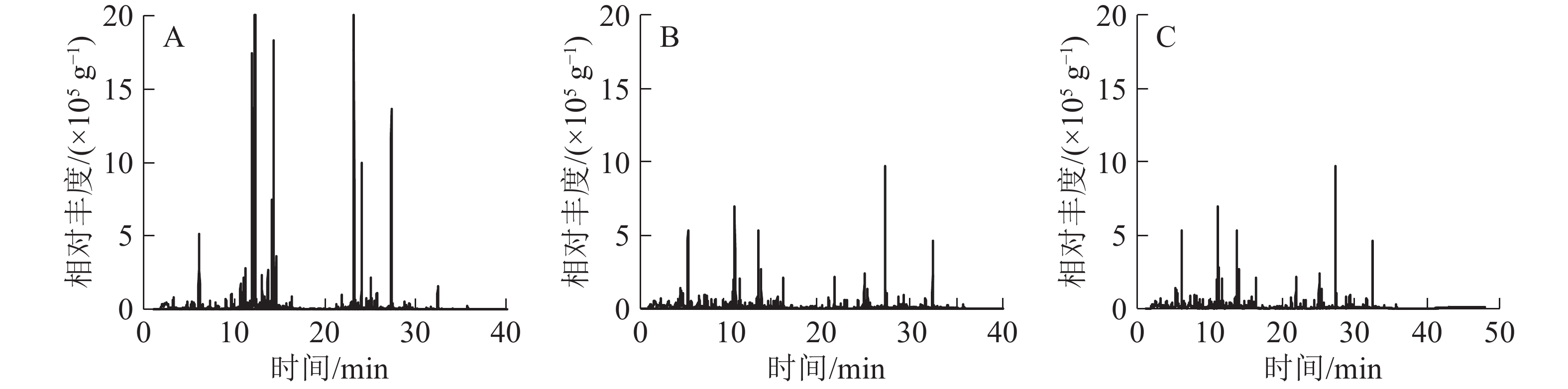
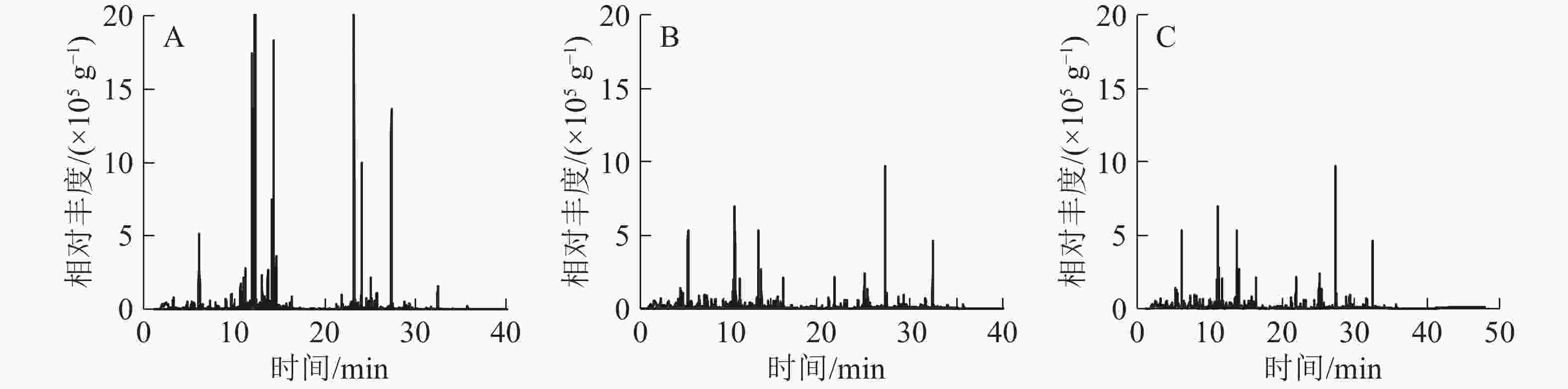
3种常绿树VOCs总离子流图共有41种化合物(图1和表1),主要有萜烯类、酯类、醛类、醇类、酮类和苯类。杨梅检测到22种化合物,其中:萜类有15种,占总量的78.5%,主要有α-草烯、香芹醇、罗勒烯、柠檬烯、石竹烯;4种醇类占总量的19.7%;1种醛类占总量的1.2%。青梅共检测到17种化合物,其中:3种酯类占总量的54.1%,主要有乙酸叶醇酯、丁酸辛酯;萜烯类有5种,占总量的11.1%;4种醛类占总量的12.9%;2种醇类占总量的8.6%。茶检测到26种化合物,其中:5种酯类占总量的40.8%,主要有乙酸叶醇酯、丁酸辛酯、丁酸庚酯;萜类有8种,占总量的17.9%;4种醛类占总量的13.0%;3种醇类占总量的5.2%;2种酮类占总量的5.1%。
表 1 3种常绿树VOCs成分分析
Table 1. VOCs components of 3 evergreen plants
序号 保留时间/min 挥发性有机物 化学式 峰面积/(×105 g−1) 杨梅 青梅 茶 1 6.941 己烯醛2-hexenal C6H10O − 2.24±0.52 − 2 7.113 顺式-3-己烯醇cis-hex-3-en-1-ol C6H10O − 14.03±3.02 − 3 7.913 壬烯nonene C9H18 − − 5.57±0.76 4 8.232 庚醛heptanal C7H14O − − 2.68±0.45 5 8.652 苯甲醚anisole C7H8O − − 21.64±3.38 6 8.655 茴香醚anisole C7H8O − 1.66±0.34 − 7 9.070 α-蒎烯α-pinene C10H16 4.57±1.56 4.32±0.26 2.10±0.73 8 9.711 1,4-环己二烯1,4-cyclohexadiene C10H14 0.47±0.07 − 5.96±0.66 9 10.708 月桂烯myrcene C10H16 5.99±3.59 3.34±0.31 − 10 11.023 辛醛octyl aldehyde C8H16O − 3.39±0.88 5.76±0.37 11 11.150 乙酸叶醇酯cis-3-hexenyl acetate C8H14O2 − 90.40±8.80 59.16±4.67 12 11.230 对二氯苯para-dichlorobenzene C6H4Cl2 0.49±0.01 13.98±1.44 9.94±0.55 13 11.586 邻伞花烃0-cymene C10H14 − − 2.15±0.76 14 11.693 柠檬烯limonene C10H16 38.07±2.00 3.34±0.97 5.64±0.26 15 12.228 罗勒烯ocimene C10H16 43.46±1.54 4.65±3.77 6.70±0.22 16 13.478 紫苏烯perillene C10H14O 2.86±0.86 − 2.07±0.24 17 13.596 里哪醇linalool C10H18O 7.07±2.04 − 2.69±4.00 18 13.695 壬醛nonanal C9H18O 4.02±0.89 12.90±4.36 11.34±0.18 19 13.999 松香芹酮pinocarvone C10H14O 1.64±0.36 8.97±2.46 8.70±1.19 20 14.144 杜烯durene C10H14O 7.90±0.90 − − 21 14.357 香芹醇(-)-carveol C10H16O 55.35±4.55 1.70±0.37 − 22 14.652 别罗勒烯allo-ocimene C10H16 4.01±1.49 − − 23 14.754 莰酮cmaphenone C10H16O − − 1.50±0.39 24 15.467 薄荷醇menthol C10H20O − − 2.17±0.57 25 15.744 甘氨酰肌氨酸glycinosinine C5H10N2O3 − − 4.39±0.80 26 16.083 水杨酸甲酯methyl salicylate C8H8O3 − 2.82±0.28 6.17±1.02 27 16.353 癸醛decanal C10H20O − 5.09±1.58 6.18±1.03 28 21.249 丁酸庚酯heptyl butyrate C11H22O2 − − 4.36±0.40 29 21.878 丁酸辛酯octyl butyrate C12H24O2 − 5.73±0.68 8.56±1.47 30 22.983 α-柏木烯α-cedrene C15H24 − 4.64±0.34 2.35±1.35 31 23.183 石竹烯caryophyllene C15H24 17.83±2.17 − 3.35±0.65 32 23.458 别香橙烯allo-aromadendrene C15H24 5.73±0.23 − − 33 24.085 α-草烯α-humulene C15H24 98.08±1.92 − − 34 25.074 花柏烯chamigrene C15H24 13.86±1.14 − − 35 25.093 β-瑟林烯β-selinene C15H24 6.63±1.13 − − 36 25.265 蛇床烯selinene C15H24 11.57±1.64 − − 37 26.515 桉叶醇eudesmol C15H26O 1.22±0.11 − − 38 27.497 雪松醇cedar camphor C15H26O − − 5.48±1.11 39 28.263 斯巴醇spathulenol C15H24O 4.35±0.72 − − 40 28.675 石竹烯氧化物caryophyllene oxide C15H24O 9.72±0.33 − − 41 31.655 肉豆蔻酸异丙酯isopropyl myristate C17H34O2 − − 3.28±1.79 说明:“−”表示未测到化合物 比较3种常绿树释放的VOCs成分,杨梅释放VOCs总量最大,其次为茶、青梅。杨梅释放的VOCs主要是α-草烯;青梅和茶释放VOCs均以乙酸叶醇酯为主,但是茶特有的醛类VOCs是庚醛,而青梅特有的醛类是己烯醛。
-
从图2和表2可以看出:空气中的VOCs总量从高到低分别为青梅园、茶园、杨梅园、空旷地。空气中主要是以苯类为主,也有少量的萜烯类,这些萜烯类化合物在植物中也存在。空旷地检测出12种物质,其中:5种苯类占总量的74.2%,2种萜烯类占总量的10.3%,3种烷烃类占总量的11.9%,2种醛类占总量的3.6%。杨梅园空气中VOCs共检测出10种物质,4种苯类占总量的54.8%,3种萜烯类占总量的35.6%。青梅园空气中VOCs共检测出9种物质,3种苯类占总量的35.4%,4种萜烯类占总量的52.2%,1种醛类占总量的3.1%。茶园空气中检测出13种化合物,包括4种苯类占总量的50.1%,5种萜烯类占总量的36.5%。
表 2 3种常绿树园空气VOCs成分分析
Table 2. Air VOCs composition in three evergreen plants gardens
序号 保留时间/min 有机挥发物 化学式 峰面积/(×105 g−1) 空旷地 杨梅园 青梅园 茶园 1 7.116 乙苯ethylbenzene C8H10 13.98±5.26 59.43±7.27 − 57.85±1.59 2 7.326 对二甲苯p-xylene C8H10 21.01±7.82 107.81±8.90 131.51±6.62 98.27±2.25 3 7.914 苯乙烯styrene C8H8 11.32±6.19 125.71±4.70 58.61±2.11 128.58±2.48 4 8.125 壬烷nonane C9H20 1.83±0.77 − − − 5 9.080 α-蒎烯pinene C10H16 4.64±1.36 190.60±4.80 245.10±12.45 143.96±5.53 6 9.484 莰烯camphene C10H16 − 19.33±6.35 25.54±8.06 18.48±2.82 7 9.875 3-乙基甲苯3-ethyltoluene C9H12 4.68±1.32 − − − 8 9.916 枯烯cumene C9H12 − − − 34.70±4.54 9 10.254 蒈烯3-carene C10H16 − − 48.49±4.29 − 10 10.265 桧烯sabinene C10H16 3.11±2.20 − − 17.35±3.25 11 10.625 2,6-二甲基辛烷dimethyloctane C10H22 2.64±0.57 19.15±1.80 − 21.86±4.05 12 11.246 对二氯苯para-dichlorobenzene C6H4Cl2 4.90±1.08 47.35±1.06 40.95±5.09 30.52±0.93 13 11.580 间伞花烃m-cymene C10H14 − 22.59±2.85 − 25.55±3.43 14 11.703 柠檬烯limonene C10H16 − 11.00±7.78 21.68±1.07 15.11±2.16 15 13.695 壬醛nonanal C9H18O 1.58±0.37 − 19.98±4.13 − 16 16.339 癸醛decanal C10H20O 1.17±0.83 − − − 17 21.886 丁酸辛酯butyric acid, octyl ester C12H24O2 − − − 22.61±1.12 18 25.089 十五烷pentadecane C15H32 4.49±2.62 17.66±3.33 61.14±3.69 14.03±9.92 说明:“−”表示未测到化合物 比较3种常绿树园和空旷地空气的VOCs发现:青梅园VOCs总量最高,其次为茶园、杨梅园。杨梅园、青梅园和茶园萜烯类化合物均高于35%。从萜烯类化合物总量从高到低依次为青梅园、茶园、杨梅园,苯类化合物总量从高到低依次为空旷地、杨梅园、茶园、青梅园。
-
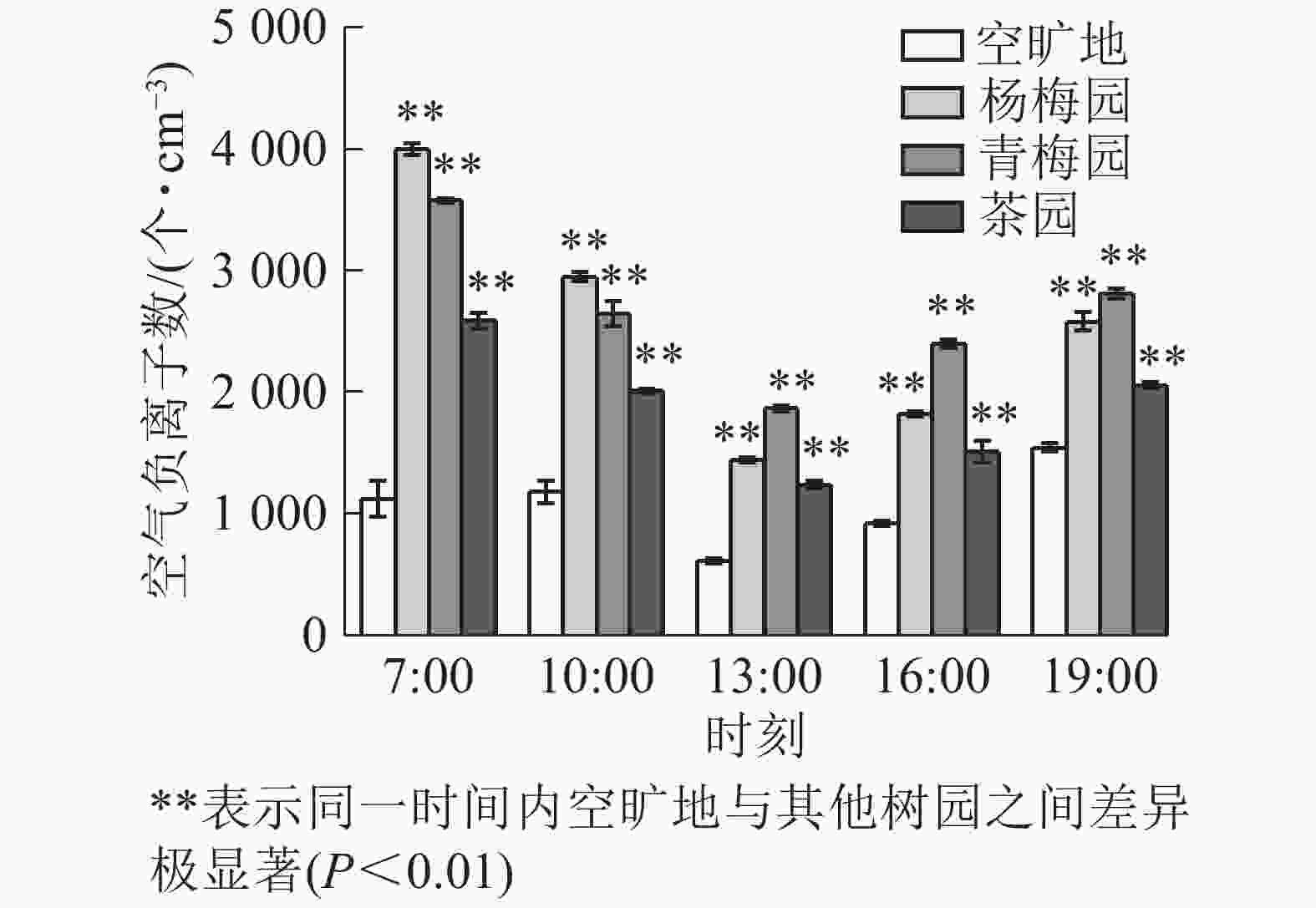
由图3可知:空气负离子数在13:00最低,在7:00和19:00最高。杨梅、青梅、茶园内、空旷地日平均值分别为2 559.2、2 660.0、1 878.4、1 078.8个·cm−3。杨梅园中在7:00空气负离子数最高,13:00比7:00减少了63.9%,19:00比13:00增加了44.0%;青梅园中的负离子数,13:00比7:00减少了47.8%,19:00比7:00减少了21.4%;茶园中的负离子数7:00比13:00多51.6%,比19:00多19.9%。
-
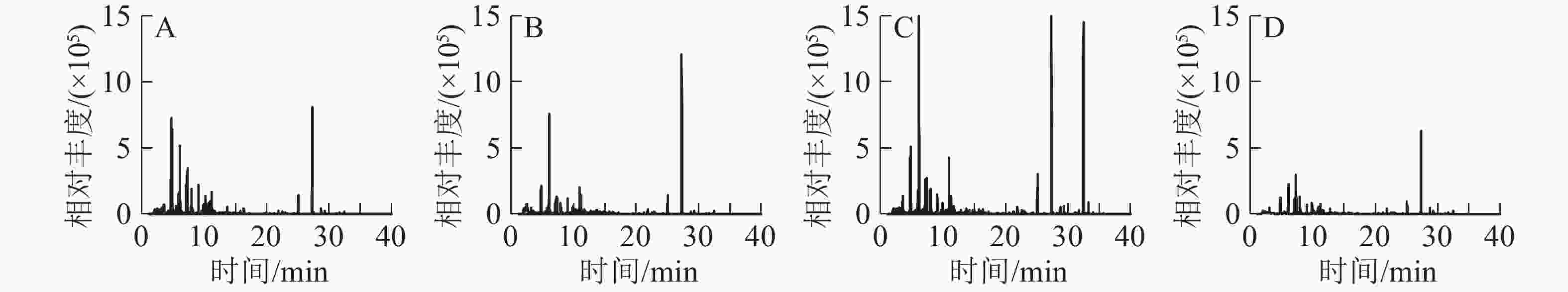
从图4A可以看出:空旷地细菌数量明显高于杨梅园、青梅园和茶园。杨梅园、青梅园和茶园均在13:00降幅最大,分别比空旷地降低了53.1%、55.5%和46.9%。茶园细菌数量高于杨梅园和青梅园。在7:00、10:00、13:00、16:00、19:00,茶园细菌数量比空旷地明显下降,分别下降了27.3%、41.3%、46.9%、43.8%和37.4%(P<0.01),表明不同园子内随着时间的变化,细菌数量明显不同。从图4B可以看出:杨梅园、青梅园和茶园真菌的数量低于空旷地。各园真菌数量在13:00降幅最大,杨梅园、青梅园和茶园比空旷地分别降低了46.2%、41.7%、38.6%。13:00−19:00空气中的微生物数量明显高于7:00−13:00。从图4C可以看出:空旷地放线菌数量高于杨梅园、青梅园和茶园。杨梅园在13:00抑制率最大,青梅园在10:00降幅最大,茶园在16:00降幅最大,分别降低了50.0%、51.7%、48.5%。各园放线菌降幅程度在16:00−19:00明显高于7:00−13:00。
-
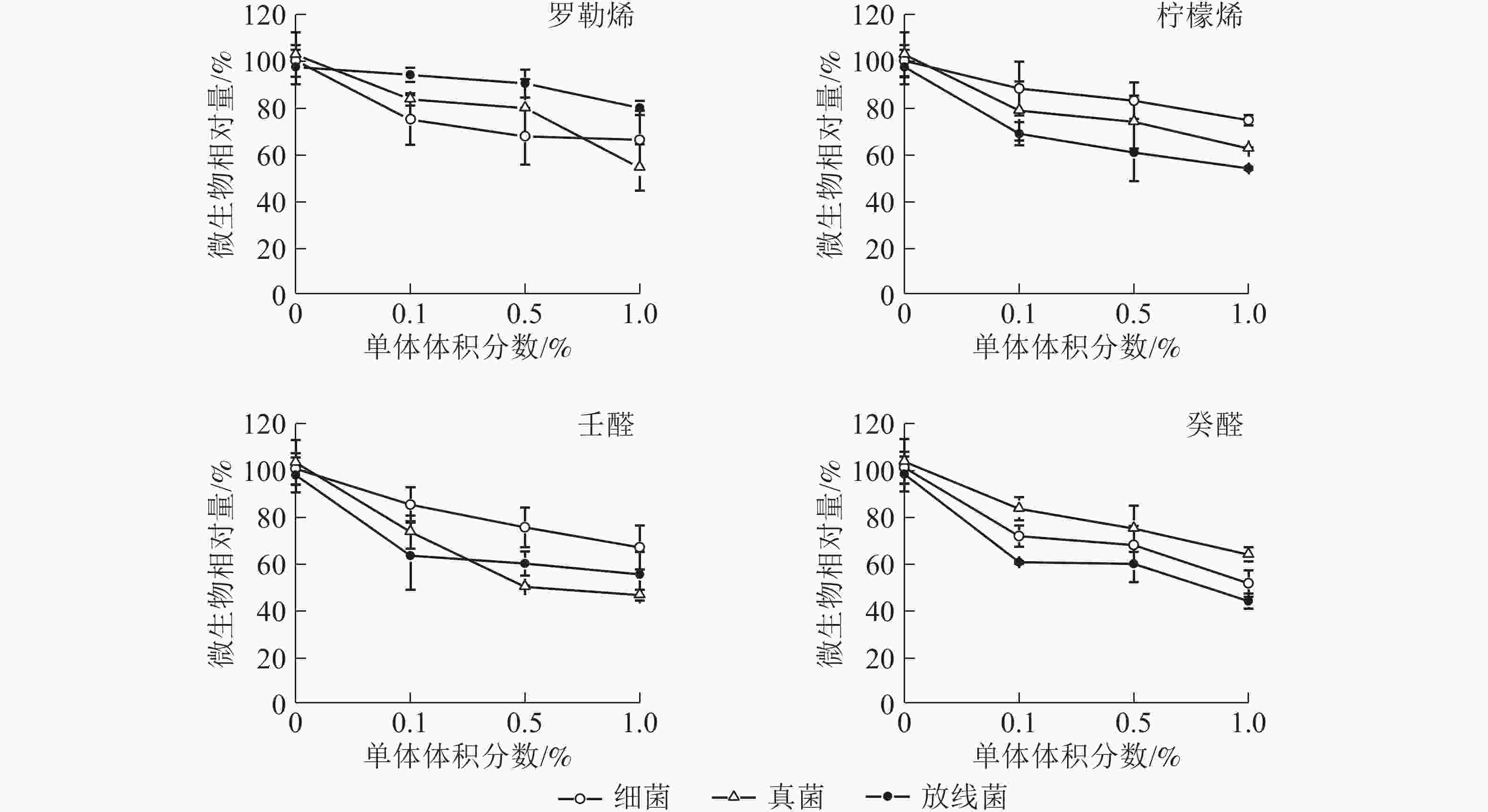
在单体体积分数为0.1%~0.5%的水平下,罗勒烯抑制细菌的生长效果比柠檬烯明显,在体积百分比为1.0%的水平下,罗勒烯抑制真菌生长的效果比柠檬烯更有效,而柠檬烯抑制放线菌的作用比罗勒烯更强(图5)。2种单体醛对空气微生物具有明显的抑制作用,体积分数为1.0%的壬醛对细菌、真菌和放线菌的抑制率分别为33.1%、43.4%和54.5%;体积分数为1.0%的癸醛对细菌、真菌和放线菌的抑制率分别为48.6%、37.4%和56.1%。在4种单体中,醛类比萜烯类抑制速率更大,醛对细菌、真菌和放线菌生长有明显的抑制作用。
-
植物基因型是决定VOCs种类和含量的重要因素,植物种属间的差异导致释放出的VOCs物质种类与比例具有明显的差异[21]。吴章文等[22]研究发现:8种柏科Cupressaceae(崖柏Thuja sutchuenensis、日本扁柏Chamaecyparis obtusa、干香柏Cupressus duclouxiana、柏木Cupressus funebris、西藏柏木Cupressus torulosa、侧柏Platycladus orientalis、圆柏Sabina chinensis、叉子圆柏Sabina vulgaris)植物释放的VOCs以萜烯类物质为主;迷迭香Rosmarinus officinalis[23]和雪松Cedrus deodara[24]释放的VOCs虽然都是萜烯类物质,但是种类和含量各不相同。本研究显示:茶叶片VOCs是以乙酸叶醇酯为主,与乔如颖等[25]的研究一致,因为白茶叶片富有茸毛,而茸毛是储存、合成VOCs的场所,叶表面附着大量的己烯醛和己烯醇,它们都是合成乙酸叶醇酯的前体,所以乙酸叶醇酯最高。MIYAZAWA等[26]研究发现:青梅果实在未成熟时以醛类物质为主,而成熟期时以酯类物质为主,这与本研究结果相同。杨梅叶片VOCs以萜烯类物质为主,主要是α-草烯,与尹洁等[27]发现杨梅叶中的VOCs主要是α-葎草烯的研究结果一致。
植物能够产生大量的空气负离子是由于存在植物叶片“尖端放电”[28]和“光电效应”[9]的现象。白保勋等[29]研究发现:年均空气负离子数量从高到低依次为森林、果园、农田、绿地;王洪俊[30]发现:乔灌草复层结构、灌草结构、草坪空气负离子数量依次递减。本研究表明:杨梅园、茶园和青梅园的空气负离子日平均数量明显高于空旷地。植物VOCs能够促进空气电离,有助于形成空气负离子,从而增加空气负离子的数量,萜烯类化合物有重要促进作用。3种树园中的空气负离子数量日变化呈早晚较高,中午低的趋势,可能原因是早晚湿度大、温度低影响了空气负离子数量,中午温度和光照强度逐渐增高,植物为了减少蒸腾作用,关闭气孔,植物VOCs释放的速率下降,从而空气负离子数量减少。
植物释放的VOCs具有重要的生态学功能,参与植物直接与间接防御反应,同时防止病菌及微生物的感染。SALEM等[31]和BEHBAHANI等[32]分别研究发现:桉树Eucalyptus robusta油和橄榄Canarium album精油对细菌具有较强的抑菌作用。GAO等[19]研究发现:醛类物质也具有抑菌作用。本研究显示:杨梅园、青梅园和茶园中都有α-蒎烯、莰烯、柠檬烯和壬醛,且细菌、真菌和放线菌的相对含量明显低于空旷地,说明植物VOCs对微生物的生长有抑制作用。同时采用植物VOCs较高的罗勒烯、柠檬烯、壬醛和癸醛对空气微生物的抑制作用发现:随着单体体积分数的增加,抑制效果也逐渐增强,在高体积分数时抑菌效果最明显;醛类物质抑制细菌、真菌和放线菌的效果比萜烯类更明显。杨梅园、青梅园、茶园的空气微生物相对含量低于空旷地,说明罗勒烯、柠檬烯、壬醛和癸醛在植物中可能是抑菌的主要物质[19, 33]。
植物VOCs和空气负离子是森林康养的重要组成部分,森林康养是依托植物释放对人有益的VOCs和杀菌素,能够增加空气负离子[34]和提高人的免疫力[35],是改善人类身心健康的一种疗养方式[36]。同时能够降低促炎细胞因子和应激激素的水平[36],无论是生理上还是心理上都能得到放松[37]。空气负离子能够调节人的内循环系统,对气管炎、冠心病、脑血管等疾病具有一定的疗效[38]。杨梅园中存在对人有益的VOCs,如α-草烯、罗勒烯、柠檬烯、花柏烯和石竹烯;茶园存在对人有益的VOCs有α-派烯、罗勒烯、柠檬烯,还有抑制微生物生长的庚醛、苯甲醛、辛醛、壬醛;青梅园中有对人有益的VOCs有α-柏木烯、罗勒烯、柠檬烯,也存在壬醛、癸醛和辛醛。总的来说,3种常绿树园在早晚时空气负离子达到最高状态,微生物的抑制效果亦是最强的。
综上所述,杨梅释放的VOCs主要以萜烯类为主,青梅和茶均以酯类为主;3种常绿树园都能释放出对人体有益的VOCs组分,它能够抑制空气微生物的生长,同时具有促进空气负离子形成和改善空气质量的作用。青梅园内的空气负离子比其他园林高,3种常绿树园内的空气质量在7:00和19:00较好,中午最差;园内微生物中细菌相对含量最高,真菌次之,放线菌最少。茶园的微生物(细菌、真菌、放线菌)相对含量居首位,从7:00−19:00呈逐渐增加的趋势。细菌抑制率最高的是青梅园,真菌和放线菌抑制率最高的是杨梅园。
Effects of volatile components of three evergreen plants on air anion and microorganism
-
摘要:
目的 研究3种常绿植物挥发性有机化合物(VOCs)抑制空气微生物和净化空气的作用。 方法 采用热脱附/气相色谱/质谱技术,对杨梅Myrica rubra、青梅Vatica mangachapoi、茶Camellia sinensis单株以及空旷地VOCs组成和含量进行了分析,采用自然沉降法研究了VOCs对空气微生物的影响,同时测定了空气负离子数。 结果 杨梅VOCs主要成分有α-草烯、香芹醇、罗勒烯、柠檬烯、壬醛等,萜烯类化合物占总量的78.5%;青梅VOCs主要成分有乙酸叶醇酯、丁酸辛酯、顺式-3-己烯醇、松香芹酮、壬醛、癸醛、辛醛,酯类化合物占总量的54.1%;茶VOCs主要成分有乙酸叶醇酯、丁酸辛酯、水杨酸甲酯、壬醛、癸醛、柠檬烯等,酯类化合物占总量的40.8%。空旷地主要成分为苯类物质,占总量的74.2%;杨梅园内苯类占总量的54.8%,萜烯类占总量的35.6%;青梅园内苯类占总量的35.4%,萜烯类占总量的52.2%;茶园内苯类占总量的50.1%,萜烯类占总量的36.5%。杨梅园、青梅园、茶园、空旷地空气负离子日平均数分别为2 559.2、2 660.0、1 878.4、1 078.8个·cm−3。杨梅园、青梅园和茶园细菌日平均抑制率分别为45.5%、48.7%和39.3%;真菌日平均抑制率分别为39.0%、35.8%和34.6%;放线菌日平均抑制率分别为42.3%、42.2%和39.7%。 结论 植物VOCs对空气微生物的生长有抑制作用,同时具有促进空气负离子形成和改善空气质量的作用。图5表2参38 Abstract:Objective The objective is to study the effects of volatile organic compounds (VOCs) from three evergreen plants on air microorganism inhibition and air purification. Method The composition and content of VOCs in Myrica rubra, Vatica mangachapoi, Camellia sinensis in single tree and open field were analyzed using thermal desorption system/gas chromatography/mass spectrometry (TDS-GC-MS) technique. The effect of VOCs on airborne microorganism was investigated by natural sedimentation method, and the number of air anion was measured. Result The main VOCs of M. rubra were α-oxalene, parsley alcohol, rolene, limonene and nonaldehyde, in which terpenes accounted for 78.5% of the total. The main VOCs of V. mangachapoi were acetyl acetate, octyl butyrate, cis-3-hexenol, pinocarvone, nonanal, decanal, and octanal, in which ester compounds accounted for 54.1% of the total. Acetyl acetate, octyl butyrate, methyl salicylate, nonanal, decanal, limonene were the main VOCs of C. sinensis, and ester compounds accounted for 40.8% of the total. The VOCs in open space were benzene, accounting for 74.2% of the total. The VOCs in M. rubra garden were benzene and terpene, accounting for 54.8% and 35.6%, respectively. The VOCs in V. mangachapoi garden were benzene and terpene, accounting for 35.4% and 52.2%, respectively. The VOCs in C. sinensis garden were benzene and terpene, accounting for 50.1% and 36.5%, respectively. The daily average number of air anion in M. rubra garden, V. mangachapoi garden, C. sinensis garden, and the open space was 2 559.2, 2 660.0, 1 878.4, 1 078.8 per cubic centimeter, respectively. In M. rubra garden, V. mangachapoi garden, and C. sinensis garden, daily average bacterial inhibition rate was 45.5%, 48.7% and 39.3%, respectively, daily average inhibition rate of fungi was 39.0%, 35.8% and 34.6%, respectively, and that of actinomycetes was 42.3%, 42.2% and 39.7%, respectively. Conclusion Plant VOCs can inhibit the growth of airborne microorganism, promote the formation air anion and improve the air quality. [Ch, 5 fig. 2 tab. 38 ref.] -
Key words:
- botany /
- Myrica rubra /
- Vatica mangachapoi /
- Camellia sinensis /
- volatile organic compounds(VOCs) /
- air anion /
- microorganism
-
表 1 3种常绿树VOCs成分分析
Table 1. VOCs components of 3 evergreen plants
序号 保留时间/min 挥发性有机物 化学式 峰面积/(×105 g−1) 杨梅 青梅 茶 1 6.941 己烯醛2-hexenal C6H10O − 2.24±0.52 − 2 7.113 顺式-3-己烯醇cis-hex-3-en-1-ol C6H10O − 14.03±3.02 − 3 7.913 壬烯nonene C9H18 − − 5.57±0.76 4 8.232 庚醛heptanal C7H14O − − 2.68±0.45 5 8.652 苯甲醚anisole C7H8O − − 21.64±3.38 6 8.655 茴香醚anisole C7H8O − 1.66±0.34 − 7 9.070 α-蒎烯α-pinene C10H16 4.57±1.56 4.32±0.26 2.10±0.73 8 9.711 1,4-环己二烯1,4-cyclohexadiene C10H14 0.47±0.07 − 5.96±0.66 9 10.708 月桂烯myrcene C10H16 5.99±3.59 3.34±0.31 − 10 11.023 辛醛octyl aldehyde C8H16O − 3.39±0.88 5.76±0.37 11 11.150 乙酸叶醇酯cis-3-hexenyl acetate C8H14O2 − 90.40±8.80 59.16±4.67 12 11.230 对二氯苯para-dichlorobenzene C6H4Cl2 0.49±0.01 13.98±1.44 9.94±0.55 13 11.586 邻伞花烃0-cymene C10H14 − − 2.15±0.76 14 11.693 柠檬烯limonene C10H16 38.07±2.00 3.34±0.97 5.64±0.26 15 12.228 罗勒烯ocimene C10H16 43.46±1.54 4.65±3.77 6.70±0.22 16 13.478 紫苏烯perillene C10H14O 2.86±0.86 − 2.07±0.24 17 13.596 里哪醇linalool C10H18O 7.07±2.04 − 2.69±4.00 18 13.695 壬醛nonanal C9H18O 4.02±0.89 12.90±4.36 11.34±0.18 19 13.999 松香芹酮pinocarvone C10H14O 1.64±0.36 8.97±2.46 8.70±1.19 20 14.144 杜烯durene C10H14O 7.90±0.90 − − 21 14.357 香芹醇(-)-carveol C10H16O 55.35±4.55 1.70±0.37 − 22 14.652 别罗勒烯allo-ocimene C10H16 4.01±1.49 − − 23 14.754 莰酮cmaphenone C10H16O − − 1.50±0.39 24 15.467 薄荷醇menthol C10H20O − − 2.17±0.57 25 15.744 甘氨酰肌氨酸glycinosinine C5H10N2O3 − − 4.39±0.80 26 16.083 水杨酸甲酯methyl salicylate C8H8O3 − 2.82±0.28 6.17±1.02 27 16.353 癸醛decanal C10H20O − 5.09±1.58 6.18±1.03 28 21.249 丁酸庚酯heptyl butyrate C11H22O2 − − 4.36±0.40 29 21.878 丁酸辛酯octyl butyrate C12H24O2 − 5.73±0.68 8.56±1.47 30 22.983 α-柏木烯α-cedrene C15H24 − 4.64±0.34 2.35±1.35 31 23.183 石竹烯caryophyllene C15H24 17.83±2.17 − 3.35±0.65 32 23.458 别香橙烯allo-aromadendrene C15H24 5.73±0.23 − − 33 24.085 α-草烯α-humulene C15H24 98.08±1.92 − − 34 25.074 花柏烯chamigrene C15H24 13.86±1.14 − − 35 25.093 β-瑟林烯β-selinene C15H24 6.63±1.13 − − 36 25.265 蛇床烯selinene C15H24 11.57±1.64 − − 37 26.515 桉叶醇eudesmol C15H26O 1.22±0.11 − − 38 27.497 雪松醇cedar camphor C15H26O − − 5.48±1.11 39 28.263 斯巴醇spathulenol C15H24O 4.35±0.72 − − 40 28.675 石竹烯氧化物caryophyllene oxide C15H24O 9.72±0.33 − − 41 31.655 肉豆蔻酸异丙酯isopropyl myristate C17H34O2 − − 3.28±1.79 说明:“−”表示未测到化合物 表 2 3种常绿树园空气VOCs成分分析
Table 2. Air VOCs composition in three evergreen plants gardens
序号 保留时间/min 有机挥发物 化学式 峰面积/(×105 g−1) 空旷地 杨梅园 青梅园 茶园 1 7.116 乙苯ethylbenzene C8H10 13.98±5.26 59.43±7.27 − 57.85±1.59 2 7.326 对二甲苯p-xylene C8H10 21.01±7.82 107.81±8.90 131.51±6.62 98.27±2.25 3 7.914 苯乙烯styrene C8H8 11.32±6.19 125.71±4.70 58.61±2.11 128.58±2.48 4 8.125 壬烷nonane C9H20 1.83±0.77 − − − 5 9.080 α-蒎烯pinene C10H16 4.64±1.36 190.60±4.80 245.10±12.45 143.96±5.53 6 9.484 莰烯camphene C10H16 − 19.33±6.35 25.54±8.06 18.48±2.82 7 9.875 3-乙基甲苯3-ethyltoluene C9H12 4.68±1.32 − − − 8 9.916 枯烯cumene C9H12 − − − 34.70±4.54 9 10.254 蒈烯3-carene C10H16 − − 48.49±4.29 − 10 10.265 桧烯sabinene C10H16 3.11±2.20 − − 17.35±3.25 11 10.625 2,6-二甲基辛烷dimethyloctane C10H22 2.64±0.57 19.15±1.80 − 21.86±4.05 12 11.246 对二氯苯para-dichlorobenzene C6H4Cl2 4.90±1.08 47.35±1.06 40.95±5.09 30.52±0.93 13 11.580 间伞花烃m-cymene C10H14 − 22.59±2.85 − 25.55±3.43 14 11.703 柠檬烯limonene C10H16 − 11.00±7.78 21.68±1.07 15.11±2.16 15 13.695 壬醛nonanal C9H18O 1.58±0.37 − 19.98±4.13 − 16 16.339 癸醛decanal C10H20O 1.17±0.83 − − − 17 21.886 丁酸辛酯butyric acid, octyl ester C12H24O2 − − − 22.61±1.12 18 25.089 十五烷pentadecane C15H32 4.49±2.62 17.66±3.33 61.14±3.69 14.03±9.92 说明:“−”表示未测到化合物 -
[1] 陈晓亚, 王凌健, 毛颖波, 等. 植物萜类生物合成与抗虫反应[J]. 生命科学, 2015, 27(7): 813 − 818. CHEN Xiaoya, WANG Lingjian, MAO Yingbo, et al. Biosynthesis and insect resistance of plant mites [J]. Life Sci, 2015, 27(7): 813 − 818. [2] TURLINGS T C J, ERB M. Tritrophic interactions mediated by herbivore-induced plant volatiles: mechanisms, ecological relevance, and application potential [J]. Annu Rev Entomol, 2018, 63(1): 433 − 452. [3] ILMBERGER J, HEUBERGER E, MAHRHOFER C, et al. The influence of essential oils on human attention. I: alertness [J]. Chem Senses, 2001, 26(3): 239 − 245. [4] 郭二果, 王成, 郄光发, 等. 城市森林生态保健功能表征因子之间的关系[J]. 生态学杂志, 2013, 32(11): 2893 − 2903. GUO Erguo, WANG Cheng, SHU Guangfa, et al. Relationship between urban forest ecological health function characterization factors [J]. Chin J Ecol, 2013, 32(11): 2893 − 2903. [5] WANG Jun, LI Shuhua. Changes in negative air ions concentration under different light intensities and development of a model to relate light intensity to directional change [J]. J Environ Manage, 2009, 90(8): 2746 − 2754. [6] ZHAO Xinglei, LI Yuyao, HUA Ting, et al. Low-resistance dual-purpose air filter releasing negative ions and effectively capturing PM2.5 [J]. ACS Appl Mater Interfaces, 2017, 9(13): 12054 − 12063. [7] FLORY R, AMETEPE J, BOWERS B. A randomized, placebo-controlled trial of bright light and high-density negative air ions for treatment of Seasonal Affective Disorder [J]. Psychiatry Res, 2010, 177(1/2): 101 − 108. [8] JIANG Shuye, ALI M A, RAMACHANDRAN S. Negative air ions and their effects on human health and air quality improvement [J]. Int J Mol Sci, 2018, 19(10): 2966 − 2985. [9] FATEMI H, AMINIFARD M H, MOHAMMADI S. Efficacy of plant essential oils on post-harvest control of rot caused by Botrytis cinerea on kiwi fruits [J]. Arch Phytopathol Plant Prot, 2013, 46(5): 536 − 547. [10] ZHENG Jingge, LIU Tingting, GUO Zhixin, et al. Fumigation and contact activities of 18 plant essential oils on Villosiclava virens, the pathogenic fungus of rice false smut [J]. Sci Rep, 2019, 9(1): 2045 − 2322. [11] FROST C J, MESCHER M C, DERVINIS C, et al. Priming defense genes and metabolites in hybrid poplar by the green leaf volatile cis-3-hexenyl acetate [J]. New Phytol, 2008, 180(3): 722 − 734. [12] 付佳, 王洋, 阎秀峰. 萜类化合物的生理生态功能及经济价值[J]. 东北林业大学学报, 2003, 31(6): 59 − 61. FU Jia, WANG Yang, YAN Xiufeng. Physiological and ecological functions and economic value of terpenoids [J]. J Northeast For Univ, 2003, 31(6): 59 − 61. [13] BENNETT R N, WALLSGROVE R M. Secondary metabolites in plant defence mechanisms [J]. New Phytol, 2010, 127(4): 617 − 633. [14] 王凌健, 方欣, 杨长青, 等. 植物萜类次生代谢及其调控[J]. 中国科学: 生命科学, 2013, 43(12): 1030 − 1046. WANG Lingjian, FANG Xin, YANG Changqing, et al. Secondary metabolism and regulation of plant mites [J]. Chin Sci Life Sci, 2013, 43(12): 1030 − 1046. [15] 林富平, 周帅, 马楠, 等. 4个桂花品种叶片挥发物成分及其对空气微生物的影响[J]. 浙江农林大学学报, 2013, 30(1): 15 − 21. LI Fuping, ZHOU Shuai, MA Nan, et al. Volatile components in leaves of four Osmanthus osmanthus varieties and their effects on air microorganisms [J]. J Zhejiang A&F Univ, 2013, 30(1): 15 − 21. [16] 谢慧玲, 李树人, 袁秀云, 等. 植物挥发性分泌物对空气微生物杀灭作用的研究[J]. 河南农业大学学报, 1999, 33(2): 127 − 133. XIE Huiling, LI Shuren, YUAN Xiuyun, et al. Study on the killing effect of plant volatile secretions on air microbes [J]. J Henan Agric Univ, 1999, 33(2): 127 − 133. [17] 杨敏, 梅馨月, 廖静静, 等. 3种葱属作物挥发物和提取液对植物病原真菌和卵菌的抑菌活性[J]. 植物保护, 2013, 39(3): 36 − 44. YANG Min, MEI Xinyue, LIAO Jingjing, et al. Antibacterial activity of volatiles and extracts from three Allium crops against phytopathogenic fungi and oomycetes [J]. Plant Prot, 2013, 39(3): 36 − 44. [18] 赵怡宁, 史常青, 许荡飞, 等. 崇礼区典型林分空气负离子浓度及影响因素[J]. 林业科学研究, 2018, 31(3): 127 − 135. ZHAO Yining, SHI Changqing, XU Dangfei, et al. Air anion concentration and influencing factors of typical stands in Chongli District [J]. For Sci Res, 2018, 31(3): 127 − 135. [19] GAO Yan, JIN Youju, LI Haidong, et al. Volatile organic compounds and their roles in bacteriostasis in five conifer species [J]. J Integrative Plant Biol, 2005, 47(4): 499 − 507. [20] 周德庆. 微生物学实验教程[M]. 2版. 北京: 高等教育出版社, 2006: 372 − 374. [21] 郭阿君, 王志英, 邹丽. 樟子松挥发性有机物释放动态及其抑菌作用[J]. 东北林业大学学报, 2014, 42(4): 115 − 118. GUO Ajun, WANG Zhiying, ZOU Li. Volatile organic matter release dynamics and its antibacterial activity of Pinus sylvestris var. mongolica [J]. J Northeast For Univ, 2014, 42(4): 115 − 118. [22] 吴章文, 吴楚材, 陈奕洪, 等. 8种柏科植物的精气成分及其生理功效分析[J]. 中南林业科技大学学报, 2010, 30(10): 1 − 9. WU Zhangwen, WU Chucai, CHEN Yihong, et al. Analysis of the essential components and physiological effects of eight species of Cypress plants [J]. J Cent South Univ For Technol, 2010, 30(10): 1 − 9. [23] 刘芳, 左照江, 许改平, 等. 迷迭香对干旱胁迫的生理响应及其诱导挥发性有机化合物的释放[J]. 植物生态学报, 2013, 37(5): 454 − 463. LIU Fang, ZUO Zhaojiang, XU Gaiping, et al. Physiological response of rosemary to drought stress and its induction of release of volatile organic compounds [J]. Chin J Plant Ecol, 2013, 37(5): 454 − 463. [24] 宋秀华, 李传荣, 许景伟, 等. 元宝枫、雪松挥发物释放的昼夜节律[J]. 林业科学, 2015, 51(4): 141 − 147. SONG Xiuhua, LI Chuanrong, XU Jingwei, et al. Circadian rhythm of the release of volatiles from Acer truncatum and Cedrus deodara [J]. For Sci, 2015, 51(4): 141 − 147. [25] 乔如颖, 郑新强, 李清声, 等. 茶叶挥发性香气化合物研究进展[J]. 茶叶, 2016, 42(3): 135 − 142. QIAO Ruying, ZHENG Xinqiang, LI Qingsheng, et al. Research progress on volatile aroma compounds in tea [J]. Tea, 2016, 42(3): 135 − 142. [26] MIYAZAWA M, SHIRAKAWA N, UTSUNOMIYA H, et al. Comparision of the volatile components of unripe and ripe Japanese apricot (Prunus mume Sieb. et Zucc.) [J]. Nat Prod Res, 2009, 23(17): 1567 − 1571. [27] 尹洁, 蒋健, 刘文静, 等. GC-O和GC-MS结合鉴定杨梅叶精油中的关键香气成分[J]. 中国南方果树, 2017, 46(3): 64 − 71. YIN Jie, JIANG Jian, LIU Wenjing, et al. GC-O and GC-MS combined to identify the key aroma components in the essential oil of bayberry leaves [J]. South China Fruit Tree, 2017, 46(3): 64 − 71. [28] TIKHONOV V P, TSVETKOV V D, LITVINOVA E G, et al. Generation of negative air ions by plants upon pulsed electrical stimulation applied to soil [J]. Russ J Plant Physiol, 2004, 51(3): 414 − 419. [29] 白保勋, 陈东海, 徐婷婷, 等. 河南中北部不同植被区空气负离子浓度变化分析[J]. 生态环境学报, 2016, 25(10): 1629 − 1637. BAI Baoxun, CHEN Donghai, XU Tingting, et al. Analysis of air anion concentration changes in different vegetation areas in central and northern Henan Province [J]. J Eco-Environ, 2016, 25(10): 1629 − 1637. [30] 王洪俊. 城市森林结构对空气负离子水平的影响[J]. 南京林业大学学报(自然科学版), 2004, 28(5): 96 − 98. WANG Hongjun. Influence of urban forest structure on air anion level [J]. J Nanjing For Univ Nat Sci Ed, 2004, 28(5): 96 − 98. [31] SALEM M Z M, ASHMAWY N A, ELANSARY H O, et al. Chemotyping of diverse Eucalyptus species grown in Egypt and antioxidant and antibacterial activities of its respective essential oils [J]. Nat Prod Res, 2015, 29(7): 681 − 685. [32] BEHBAHANI B A, YAZDI F T, VASIEE A, et al. Oliveria decumbens essential oil: chemical compositions and antimicrobial activity against the growth of some clinical and standard strains causing infection [J]. Microb Pathog, 2018, 114(1): 449 − 452. [33] FARRÉ-ARMENGOL G, FILELLA I, LLUSIA J, et al. Bidirectional interaction between phyllospheric microbiotas and plant volatile emissions [J]. Trends Plant Sci, 2016, 21(10): 854 − 860. [34] 张清杉, 贺延梅, 赵建民, 等. 森林公园小气候空气负离子保健浓度分级评价[J]. 西北林学院学报, 2006, 21(3): 48 − 49. ZHANG Qingshan, HE Yanmei, ZHAO Jianmin, et al. Evaluation of microclimate air anion health concentration in forest park [J]. J Northwest For Univ, 2006, 21(3): 48 − 49. [35] OCHIAI H, IKEI H, SONG C, et al. Physiological and psychological effects of a forest therapy program on middle-aged females [J]. Int J Environ Res Public Health, 2015, 12(12): 15222 − 15232. [36] 赵庆, 钱万惠, 唐洪辉, 等. 广东省云勇森林公园6种林分保健功能差异比较[J]. 浙江农林大学学报, 2018, 35(4): 750 − 756. ZHAO Qing, QIAN Wanhui, TANG Honghui, et al. Differences of health care functions of six forest stands in Yunyong Forest Park, Guangdong [J]. J Zhejiang A&F Univ, 2018, 35(4): 750 − 756. [37] 蒋冬月, 李永红, 沈鑫. 芸香叶片和花瓣释放挥发性有机物成分及其变化规律[J]. 浙江农林大学学报, 2018, 35(3): 572 − 580. JIANG Dongyue, LI Yonghong, SHEN Xin. Components and variations of volatile organic compounds released from leaves and flowers of Ruta graveolens [J]. J Zhejiang A&F Univ, 2018, 35(3): 572 − 580. [38] 邵海荣, 贺庆棠. 森林与空气负离子[J]. 世界林业研究, 2000, 13(5): 19 − 23. SHAO Hairong, He Qingtang. Forest and air negative ions [J]. World For Res, 2000, 13(5): 19 − 23. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20190521






 下载:
下载: