-
土壤微生物是陆地生态系统的重要组分,是连接植物和土壤的重要因子,在获取资源构建自身生物量的同时,驱动生态系统物质循环和能量流动,调控碳和养分在土壤-植物-大气连续体之间的循环,对生态系统的结构和功能有重要影响[1-2]。土壤微生物生物量能够指示生态系统功能的变化,被用于评价土壤质量和反映微生物群落状态与功能变化[3]。生态化学计量学是研究生物系统能量平衡和多重化学元素平衡的科学,是生物地球化学循环与食物网结构和过程之间的内在联系,对于探索不同生态系统不同层次组分之间的相互联系和内在机制具有重要意义,因而被广泛应用到微生物驱动的生态过程研究中[4]。研究表明,土壤微生物群落组成随植物年龄及发育阶段而发生变化[5-6],由林龄引起的林分环境和土壤环境的变异会间接影响土壤微生物参与养分循环[7-10]。养分状况的差异会对土壤微生物形成不同程度的养分限制,影响微生物群落结构及酶活性,对养分在根系、土壤和微生物之间的循环和转化同样会产生不确定的影响,进而影响土壤生态系统的结构与功能[11]。因此,研究土壤养分与土壤微生物生物量及其生态化学计量特征间的相互作用关系对理解陆地生态系统养分循环十分重要。另外,土壤微生物对碳氮磷循环的调控机制也是生物地球化学循环研究的重要内容之一。桉树Eucalyptus spp. 是世界三大速生丰产树种之一,因具有良好的经济、生态和社会效益而被广泛引种和种植,截至2015年底,中国桉树人工林面积已达4.5×106 hm2[12]。非科学的经营措施(如超短轮伐期、连栽等)造成的地力衰退等问题[13],成为制约人工林生产力的主要原因[14]。目前,对桉树人工林生态化学计量特征研究主要集中在器官、凋落物和土壤等尺度[12, 15-16],对土壤-微生物生态化学计量特征研究较少。本研究以雷州半岛不同生长阶段尾巨桉E. urophylla × E. grandis人工林为研究对象,探讨其土壤-微生物碳、氮、磷化学计量特征,以期为桉树高效可持续经营养分管理提供数据支持。
-
本研究样地雷州半岛北部广东湛江桉树人工林生态系统定位研究站(21°15′53.5″N,110°05′39.2″E),地处北热带湿润大区雷琼区北缘,为海洋性季风气候。最高海拔220.8 m,最低海拔80.0 m。年平均气温23.1 ℃,最热月(7月)平均气温28.8 ℃,最冷月(1月)平均气温15.6 ℃,≥10 ℃的活动积温8 373.0 ℃。年平均降水量1 567 mm,年相对湿度80.4%,年均日照时数1 937 h。样地土壤类型为玄武岩发育的砖红壤,土壤肥力中等,土层厚度达84 cm。
-
依据国家林业和草原局2017年发布的林业行业标准《主要树种龄级与龄组》,将南方山地丘陵区桉树工业原料林划分为:幼龄林(1~2 a)、中龄林(3~4 a)、近熟林(5 a)、成熟林(6~7 a)和过熟林(≥8 a),2017年7月以空间换时间的方法在研究区选取立地条件、土壤类型较一致的幼龄林(2 a)、成熟林(6 a)、过熟林(9 a)等3个尾巨桉人工林,各林龄林分内随机设置20 m×20 m样地,每个样地3个重复,进行每木检尺调查。样地基本概况见表1。
表 1 样地基本概况
Table 1. Basic situation of sample plots
龄级 样地 林龄/a 海拔/m 平均胸
径/cm平均树
高/m林分密度/
(株·hm−2)叶面积
指数0~60 cm土壤
容重/(g·cm−3)pH 幼龄林 1 2 116 8.06 12.20 1575 0.829 1.05 4.6 2 2 120 7.85 11.93 1450 0.732 0.96 5.0 3 2 117 8.14 12.33 1586 0.916 1.03 5.2 成熟林 1 6 104 14.63 12.48 857 0.793 1.08 4.8 2 6 108 13.97 15.37 986 1.039 1.07 4.8 3 6 103 11.97 15.15 1174 1.184 1.08 5.0 过熟林 1 9 113 22.84 25.40 725 1.117 1.07 4.5 2 9 119 20.14 24.97 714 1.101 1.04 4.7 3 9 125 19.74 22.58 675 0.884 0.97 4.7 -
2018年6月在各样地内随机设置5个样点,分别挖取土壤剖面(距离树干100 cm以外),环刀法(100 cm3)采集0~20、20~40和40~60 cm层次土壤;同层土壤混合均匀装袋标记后置于含冰袋的保温箱中,带回实验室。一部分风干,研磨,过筛,用于测定土壤有机碳、全氮、全磷质量分数,另一部分置于4 ℃冰箱中冷藏保存,用于测定土壤微生物生物量碳、氮、磷质量分数[17]。土壤有机碳采用高温外热重铬酸钾氧化-容量法测定,土壤全氮采用凯氏定氮法测定,土壤全磷采用氢氧化钠熔融,钼锑抗比色法测定[18];微生物碳采用三氯甲烷熏蒸-重铬酸钾容量法测定[19],微生物氮采用三氯甲烷熏蒸-蒸馏-盐酸(HCl)滴定法测定[20],微生物磷采用三氯甲烷熏蒸-全磷法测定[21]。
-
采用SPSS 19.0进行数据处理与分析。采用单因素方差法(one-way ANOVA)对不同生长阶段土壤有机碳、全氮、全磷和微生物碳、氮、磷质量分数及碳氮比(C/N)、碳磷比(C/P)、氮磷比(N/P)进行方差分析和显著性检验(P<0.05)。Pearson相关检验分析土壤有机碳、全氮、全磷和微生物碳、氮、磷质量分数及C/N、C/P、N/P关系。采用Canoco 5进行冗余分析(RDA)。采用SigmaPlot 14.0制作图形。
-
由图1所示:从碳、氮、磷的平均质量分数看,幼龄林土壤分别为17.88、1.32、0.72 g·kg−1,土壤微生物分别为493.04、52.45、13.54 mg·kg−1;成熟林土壤分别为14.99、1.45、0.78 g·kg−1,土壤微生物分别为436.41、49.83、10.62 mg·kg−1;过熟林土壤分别为20.15、1.47、0.88 g·kg−1,土壤微生物分别为583.09、55.20、28.03 mg·kg−1。不同生长阶段尾巨桉林同一土层土壤碳(Csoil)质量分数从大到小依次为过熟林、幼龄林、成熟林,成熟林的0~20和20~40 cm土层显著低于其他生长阶段(P<0.05),垂直分布均为随土层加深而递减,各土层间差异显著(P<0.05)。土壤氮(Nsoil)质量分数在不同生长阶段无明显差异,垂直分布表现与碳垂直分布一致。土壤磷(Psoil)质量分数从大到小依次为过熟林、成熟林、幼龄林,不同生长阶段差异显著(P<0.05),不同土层间无明显差异。
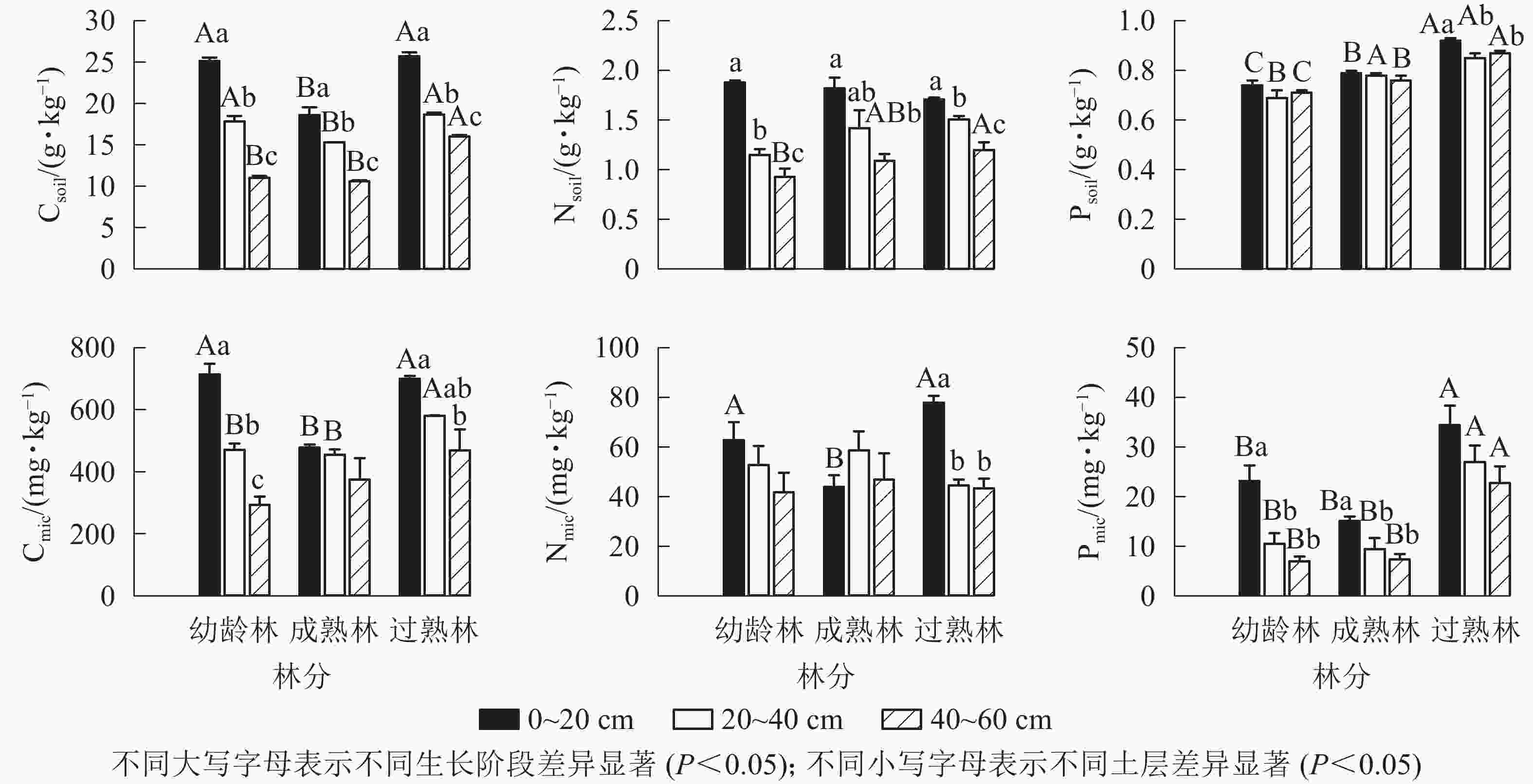
图 1 不同生长阶段土壤与土壤微生物碳、氮、磷质量分数
Figure 1. Carbon, nitrogen and phosphorus contents of soil and soil microbial biomass in different growth stages
土壤微生物碳(Cmic)质量分数在0~20 cm土层表现为成熟林显著低于幼龄林和过熟林(P<0.05),20~40 cm土层过熟林Cmic质量分数显著高于幼龄林和成熟林(P<0.05)。土壤微生物氮(Nmic)质量分数在0~20 cm土层均表现为过熟林、幼龄林显著高于成熟林(P<0.05)。土壤微生物磷(Pmic)质量分数各土层均表现为过熟林显著高于其他阶段(P<0.05)。幼龄林Cmic质量分数随土层加深递减,各土层间差异显著(P<0.05)。过熟林中0~20 cm土层Cmic质量分数显著高于40~60 cm土层(P<0.05)。幼龄林、成熟林不同土层间Nmic质量分数无显著差异,过熟林中0~20 cm土层显著高于其他土层(P<0.05)。幼龄林、成熟林中Pmic质量分数0~20 cm土层显著高于其他土层(P<0.05),过熟林中各土层间无显著差异。
-
由图2所示:从碳氮比(C/N)、碳磷比(C/P)、氮磷比(N/P)均值看,幼龄林土壤分别为13.51、24.87、1.84,土壤微生物分别为9.42、41.89、4.85;成熟林土壤分别为10.52、19.25、1.86,土壤微生物分别为9.21、46.37、5.48;过熟林土壤分别为13.63、22.83、1.68,土壤微生物分别为10.97、21.25、2.00。Csoil/Nsoil以成熟林最小,幼龄林和过熟林仅在20~40 cm土层差异显著(P<0.05)。Csoil/Psoil在0~20和20~40 cm土层从大到小依次为幼龄林、过熟林、成熟林。同一生长阶段Csoil/Psoil随土层加深递减,两两之间差异显著(P<0.05)。Nsoil/Psoil仅过熟林的0~20 cm土层显著低于幼龄林和成熟林(P<0.05),其他无显著差异。Cmic/Nmic在20~40 cm土层均表现为过熟林显著高于其他阶段(P<0.05),40~60 cm土层表现为过熟林显著高于幼龄林(P<0.05),与成熟林无显著差异。Cmic/Pmic在0~20 cm和40~60 cm表现为过熟林显著低于幼龄林和成熟林(P<0.05)。Nmic/Pmic在0~20 cm无显著差异,20~40和40~60 cm均以过熟林最小。
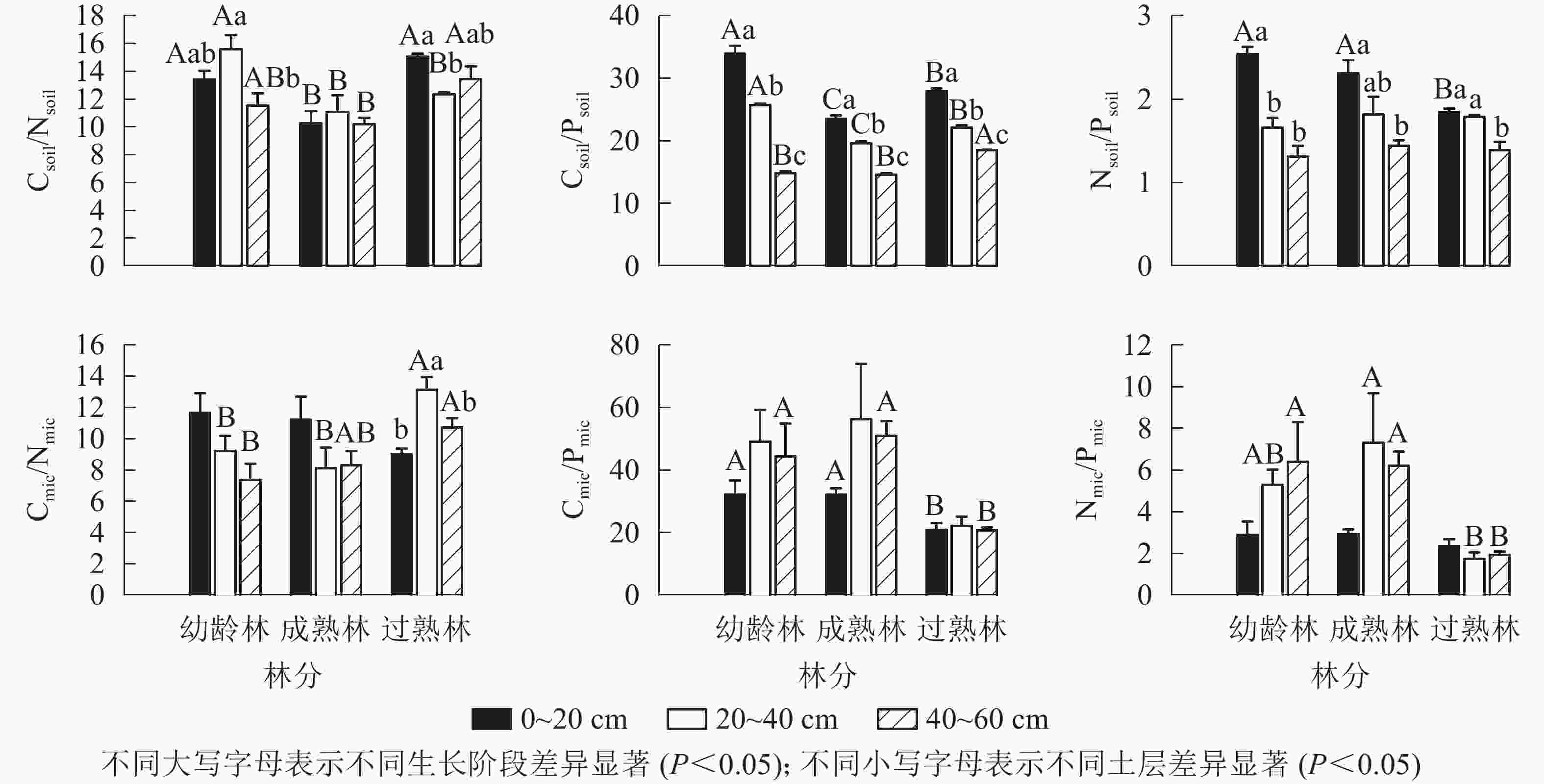
图 2 不同生长阶段土壤与土壤微生物碳、氮、磷化学计量比
Figure 2. Carbon, nitrogen and phosphorus stoichiometric ratios of soil and soil microbial biomass with different growth stages
不同生长阶段Cmic/Csoil、Nmic/Nsoil、Pmic/Psoil分别为2.58%~3.40%、2.44%~4.61%、0.97%~3.72% (图3)。不同阶段和不同土层Cmic/Csoil均无显著差异。过熟林0~20 cm土层Nmic/Nsoil显著高于其他阶段(P<0.05)。各土层的Pmic/Psoil均以过熟林最大,仅0~20 cm土层与幼龄林差异不显著,其他均具有显著差异(P<0.05)。
-
由图4可知:幼龄林第1轴和第2轴的解释变量分别为99.08%和0.65%,Csoil、Csoil/Psoil、Nsoil、Nsoil/Psoil和Pmic/Psoil是土壤微生物及其化学计量比的显著影响因子;成熟林第1轴和第2轴的解释变量分别为91.68%和6.36%,Csoil/Psoil是土壤微生物的主要影响因子;过熟林第1轴和第2轴的解释变量分别为99.07%和0.72%,Nsoil、Nsoil/Psoil、Csoil/Psoil、Csoil和Pmic/Psoil是土壤微生物及其化学计量比的显著影响因子。说明在林分不同生长阶段,土壤微生物生物量的主要影响因子及其影响程度具有差异。相比之下,成熟林阶段土壤化学性质对微生物影响较小,对于3个阶段平均而言,第1轴和第2轴的解释变量分别为96.97%和1.29%,Csoil、Csoil/Psoil、Pmic/Psoil、Nsoil、Nsoil/Psoil、Psoil和Csoil/Nsoil是尾巨桉人工林土壤微生物的显著影响因子。
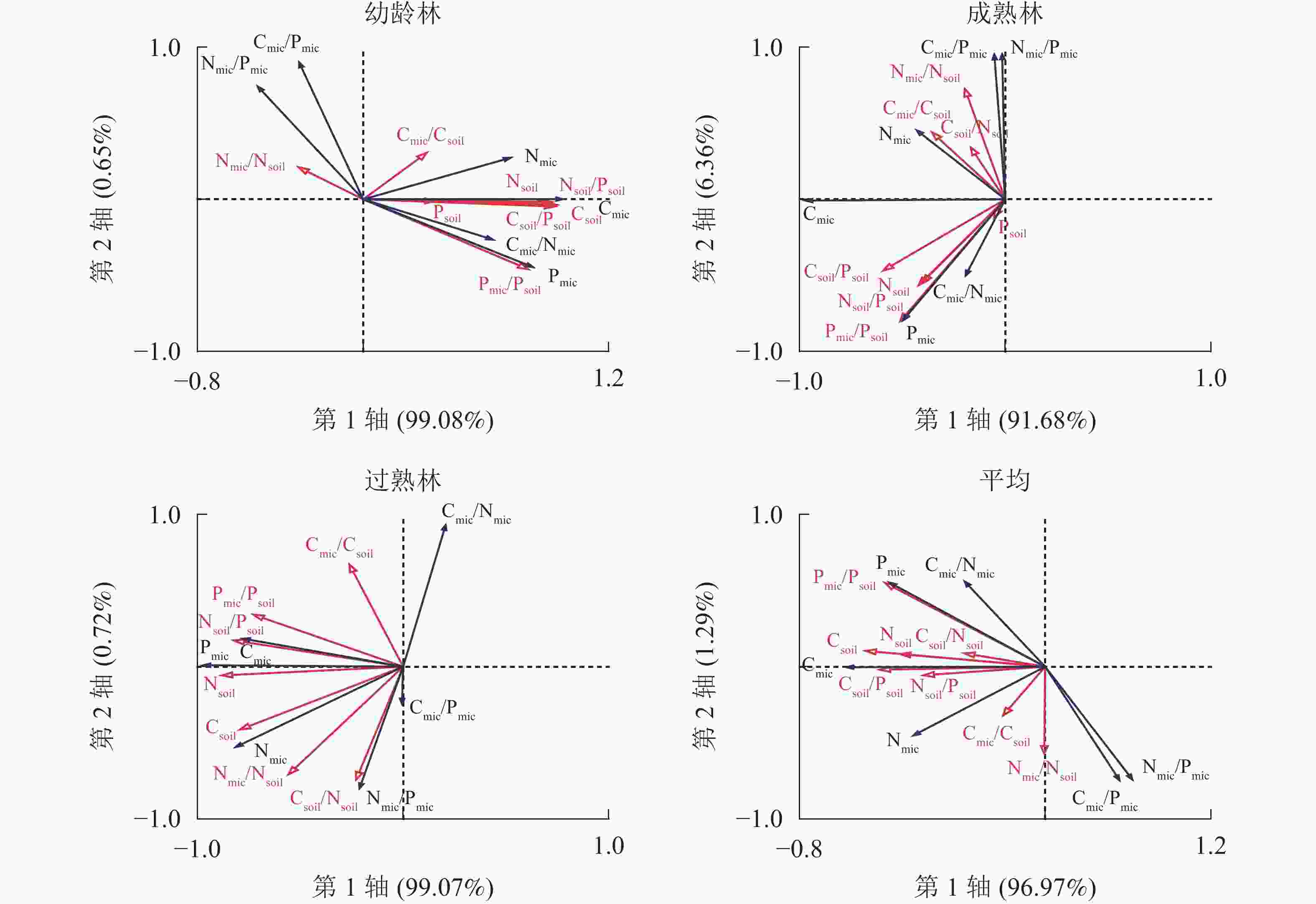
图 4 不同生长阶段土壤与土壤微生物碳、氮、磷及化学计量比的冗余分析
Figure 4. Carbon, nitrogen and phosphorus contents and stoichiometric ratios of soil and soil microbial biomass with different growth stages
由相关性分析(表2)可知:幼龄林的Cmic、Pmic、Cmic/Nmic受土壤养分及其化学计量比的影响较为一致,均与Csoil、Nsoil、Csoil/Psoil、Nsoil/Psoil、Pmic/Psoil呈显著(P<0.05)或极显著(P<0.01)正相关。成熟林中仅Pmic与土壤养分关系较为密切,Pmic与Csoil、Nsoil、Csoil/Psoil、Nsoil/Psoil、Pmic/Psoil呈显著(P<0.05)或极显著(P<0.01)正相关。过熟林中各指标与土壤化学性质及其化学计量比的关系表现差异较大,Cmic与Csoil、Nsoil、Csoil/Psoil 、Nsoil/Psoil呈极显著(P<0.01)正相关性,与Pmic/Psoil呈显著(P<0.05)正相关;Nmic与Csoil、Nsoil、Psoil、Csoil/Psoil、Nmic/Nsoil存在显著(P<0.05)或极显著(P<0.01)正相关;Cmic/Nmic与Psoil、Csoil/Nsoil、Nmic/Nsoil呈极显著(P<0.01)负相关。
表 2 土壤和土壤微生物碳、氮、磷及化学计量比的相关性
Table 2. Correlation of soil and microbe biomass C, N, P content and their stoichiometry
阶段 指标 Csoil Nsoil Psoil Csoil/Nsoil Csoil/Psoil Nsoil/Psoil Cmic/Csoil Nmic/Nsoil Pmic/Psoil 幼龄林 Cmic 0.969** 0.941** 0.383 0.290 0.960** 0.923** 0.314 −0.324 0.825** Nmic 0.581 0.610 0.101 0.102 0.595 0.623 0.746* 0.330 0.432 Pmic 0.853** 0.854** 0.271 0.202 0.863** 0.856** 0.137 −0.445 0.995** Cmic/Nmic 0.785** 0.710* 0.341 0.327 0.775* 0.689* −0.361 −0.842** 0.743* Cmic/Pmic −0.308 −0.290 −0.099 −0.130 −0.302 −0.294 0.071 0.148 −0.681* Nmic/Pmic −0.611 −0.497 −0.291 −0.411 −0.606 −0.475 0.375 0.508 −0.753* 成熟林 Cmic 0.580 0.417 0.072 0.741 0.615 0.435 0.363 0.191 0.532 Nmic −0.009 0.040 −0.001 −0.096 −0.018 0.034 0.455 0.738* −0.098 Pmic 0.810** 0.744* 0.374 −0.119 0.830** 0.753* −0.336 −0.544 0.997** Cmic/Nmic 0.419 0.347 0.108 0.073 0.444 0.363 −0.274 −0.719* 0.450 Cmic/Pmic −0.402 −0.553 −0.188 0.440 −0.418 −0.573 0.434 0.664 −0.790* Nmic/Pmic −0.437 −0.498 −0.122 0.260 −0.467 −0.524 0.445 0.795* −0.785* 过熟林 Cmic 0.812** 0.906** 0.458 0.226 0.833** 0.850** 0.274 0.565 0.751* Nmic 0.922** 0.785* 0.776* 0.630 0.882** 0.605 −0.163 0.882** 0.463 Pmic 0.645 0.653 0.350 0.263 0.658 0.607 0.226 0.389 0.977** Cmic/Nmic −0.578 −0.224 −0.864** −0.805** −0.458 0.050 0.595 −0.846** 0.146 Cmic/Pmic 0.001 0.120 0.050 −0.140 0.002 0.118 0.003 0.083 −0.612 Nmic/Pmic 0.465 0.293 0.571 0.501 0.409 0.128 −0.410 0.675* −0.404 说明:*表示显著相关(P<0.05);**表示极显著相关(P<0.01) -
按照中国第2次土壤普查养分分级标准[22],本研究中0~60 cm土层Csoil质量分数均值,幼龄林(17.88 g·kg−1)和成熟林(14.99 g·kg−1)达到中下(4级)水平,过熟林(20.15 g·kg−1)达到中上(3级)水平;Nsoil质量分数均值,幼龄林(1.32 g·kg−1)、成熟林(1.45 g·kg−1)和过熟林(1.47 g·kg−1)均达到中上(3级)水平;Psoil质量分数,幼龄林(0.72 g·kg−1)和成熟林(0.78 g·kg−1)达到中上(3级)水平,成熟林(0.88 g·kg−1)达到高(2级)水平。本研究中,尾巨桉人工林Csoil质量分数从大到小依次为过熟林、幼龄林、成熟林,与以往研究相同[23]。这可能是由于成熟林阶段属桉树人工林速生生长阶段,林木生长需要消耗大量养分,原有有机质的分解大于外界输入,从而使土壤有机碳质量分数下降;当进入过熟林阶段后,林木生长趋缓,对养分吸收减少,而凋落物和植物根系不断积累,分解产生有机碳输入土壤,使得土壤有机碳质量分数升高。土壤Nsoil和Psoil质量分数均为从幼龄林、成熟林到过熟林增加的趋势,与XU等[23]研究结果一致。可能是随着林龄的增加,林分郁闭度降低,林下植被生物多样性增加,凋落物分解速度加快[24],使得土壤养分在过熟林阶段得到积累。
土壤微生物生物量既是土壤有机质和土壤养分转化与循环的动力,又可作为土壤中植物有效养分的储备库,在土壤肥力和植物营养中具有重要作用。本研究中,土壤微生物Cmic、Nmic、Pmic质量分数(504.18、52.49、17.40 mg·kg−1)均低于全球土壤(680.4、105.0、40.3 mg·kg−1)和森林土壤(629、98、32 mg·kg−1)的平均水平。可能原因是短轮伐期人工林土壤扰动频繁,对土壤微生物群落结构产生较大影响[25-26],不利于土壤微生物繁殖和生长,具体影响机制有待进一步研究。本研究中,微生物Cmic、Nmic、Pmic质量分数均值均以过熟林最高,与时伟伟等[27]研究结果一致。易桂田等[28]对1、6、11 a生尾叶桉E. urophylla人工林的研究发现:土壤微生物碳质量分数随林龄降低,11 a生植株中仅为56.912 mg·kg−1;这与本研究结果不同。可能原因是①桉树人工林土壤微生物主要集中在0~20 cm土层[29],本研究对0~60 cm土层进行了取样分析,相比于0~10 cm土层取样更具代表性;②研究区桉树过熟林凋落物量积累较大,具有较高的养分归还量[30],土壤养分含量也处于3个阶段的最高水平,使得土壤微生物可利用底物含量较高,因而生物量增加;③土壤微生物碳、氮、磷化学计量具有环境可塑性,会因土壤资源状况、气候条件、植被组成、土壤理化性质等的不同而产生差异[31-33]。
3个生长阶段土壤Csoil和Nsoil质量分数随土层加深递减,且差异显著。原因是土壤碳、氮主要来源于土壤表面枯落物的分解归还,在土壤表层积累后经淋溶作用向下迁移,从而被植物吸收利用。Psoil主要集中在0~20 cm土层,随土层变化幅度较小,呈“表层聚集性”特点[34];可能是由于林分凋落物周转较快,分解的林下凋落物、死亡的植物和腐败的枯草向表层土壤补充大量养分所致[35];此外,土壤磷主要来源于土壤母质风化,而风化是一个漫长的过程,风化程度在0~60 cm土层中无明显差异,因而土壤磷在土壤剖面上的变化幅度较小。土壤微生物Cmic、Nmic、Pmic质量分数基本表现为表层土壤高于深层土壤,这与前人研究结果相符[9, 36]。表层土壤富集了大多数功能根系,有利于提高微生物生物量[37],其微生物活性显著高于深层土壤[38];而深层土壤生境条件较差,抑制微生物活性,因此生物量也较低。
土壤微生物主要由异养型的细菌和真菌组成,土壤中可利用养分资源是调节土壤微生物生物量增长的驱动因子,因此微生物生物量通常与土壤养分变化趋势基本一致[39]。本研究中过熟林Cmic、Nmic与土壤Csoil、Nsoil均表现出显著或极显著相关性,幼龄林Cmic与Csoil、Nsoil表现出极显著相关性,与以往研究结果一致[7, 36]。幼龄林Nmic及成熟林Cmic、Nmic与Csoil、Nsoil未表现出显著相关性,与王薪琪等[9]和LITTON等[40]发现:土壤微生物碳、氮与土壤有机碳、氮相关性不显著的结果相近。可能原因是①植物(草本和木本)根系的生理活性或土壤有机质的活性组分(轻组碳)对微生物生物量碳的影响较大[41];②成熟林处于速生生长期,地上生物量随林龄增加趋势明显[42-43],地上植被的生长与土壤微生物碳的固定可能存在竞争关系。
-
土壤碳氮磷比值是土壤有机质组成和质量程度的一个重要指标。TIAN等[44]研究发现中国土壤Csoil/Nsoil、Csoil/Psoil、Nsoil/Psoil均值分别为11.9、61.0、5.2。本研究中,Csoil/Nsoil、Csoil/Psoil、Nsoil/Psoil的均值分别为12.55、22.32、1.79;较高的Csoil/Nsoil表明本研究土壤有机质矿化作用较慢,较低的Csoil/Psoil说明微生物在矿化土壤有机质释放磷的潜力较大[45],提示研究地Psoil质量分数处于较高水平。
XU等[46]研究表明:全球土壤微生物Cmic/Nmic、Cmic/Pmic、Nmic/Pmic的均值分别为7.6、42.4、5.6;李品等[47]发现:亚热带阔叶林分别为5.8、53.4、9.1。本研究中,Cmic/Nmic、Cmic/Pmic、Nmic/Pmic的均值分别为9.87、36.50、4.11,其中Cmic/Nmic高于全球和亚热带阔叶林均值,Cmic/Pmic、Nmic/Pmic低于全球土壤和亚热带阔叶林均值,结合研究区土壤理化性质发现:Nsoil质量分数处于中上水平,而低的土壤氮素有效性会影响微生物的利用。研究[48]表明:土壤微生物碳氮比、碳磷比与土壤有机质质量相关,土壤中有效氮、有效磷越丰富,则土壤微生物碳氮比、碳磷比值越低。本研究过熟林Cmic/Nmic高于幼龄林和成熟林,而Cmic/Pmic低于幼龄林和成熟林,表明随着森林植物生长和土壤环境条件的改变,土壤中有效养分资源对土壤微生物生长限制程度也在改变。相关研究[49]表明:土壤微生物C/N可以反映土壤微生物种类和区系,细菌和真菌的C/N一般为3~5和4~15,土壤中Cmic/Nmic越大,真菌比例越高[50]。本研究中过熟林Cmic/Nmic最大,说明过熟林土壤真菌含量相对丰富。相关性分析表明:幼龄林中Cmic/Nmic与Csoil/Nsoil相关系数为0.327,成熟林中为0.073,过熟林中为−0.805,表明Cmic/Nmic随着Csoil/Nsoil的改变是微生物适应土壤养分变化的重要机制[51]。
Cmic/Csoil、Nmic/Nsoil、Pmic/Psoil可以反映土壤养分向微生物的转化效率和土壤养分的流失状况,比单独使用微生物生物量或土壤养分来表征土壤质量变化更加有效[52-53]。本研究中,3个阶段Cmic/Csoil无显著差异,Cmic与Cmic/Csoil均无显著相关性,说明土壤微生物Cmic的周转速度在3个阶段差异可能并不明显。0~20 cm 土层的Nmic/Nsoil、Pmic/Psoil均表现为成熟林最高,且分别与Nmic、Pmic存在极显著正相关,可能是由于过熟林土壤微生物Nmic、Pmic比幼龄林和成熟林具有更快的周转速度,其增加幅度高于Nsoil、Psoil,这与吴建平等[54]研究结果类似。
-
尾巨桉人工林土壤和微生物碳、氮、磷质量分数均为过熟林最高,垂直变化呈现出“表层聚集性”特征。土壤微生物生物量与土壤化学性质关系密切,在林分的不同生长阶段土壤微生物受土壤影响的指标和程度具有差异性,幼龄林、成熟林和过熟林土壤微生物的主要影响因子分别为Csoil、Csoi/Psoil和Nsoil。土壤Csoi/Nsoil和微生物Cmic/Nmic偏高,Csoi/Psoil、Nsoi/Psoil及Cmic/Pmic、Nmic/Pmic均处于较低水平,Psoil质量分数充足,表明尾巨桉人工林土壤微生物可能存在氮素有效性限制,生长后期应注重养分有效性对土壤微生物生长繁殖的影响。
Soil-microbial stoichiometry of Eucalyptus urophylla × E. grandis plantation at different growth stages
-
摘要:
目的 研究幼龄林、成熟林和过熟林阶段尾巨桉Eucalyptus urophylla × E. grandis人工林土壤化学性质及土壤微生物化学计量特征,以丰富桉树林生态系统生态化学计量学领域的基础研究。 方法 以雷州半岛3个处于不同生长阶段的尾巨桉人工林为研究对象,测定0~20、20~40和40~60 cm土层土壤化学性质及土壤微生物碳、氮、磷质量分数,分析土壤及微生物化学计量关系特征。 结果 尾巨桉人工林土壤有机碳、全氮、全磷和土壤微生物碳、氮、磷质量分数均值均以过熟林最高,分别为20.15、1.47、0.88 g·kg−1和583.09、55.20、28.03 mg·kg−1,不同生长阶段差异性特征并不一致。土壤有机碳、全氮、全磷和土壤微生物碳、氮、磷质量分数的垂直变化呈现“表层聚集性”特征,不同生长阶段的土层间差异性元素类别表现不一。成熟林土壤碳氮比(Csoil/Nsoil)和碳磷比(Csoil/Psoil)均值分别为10.52和19.25,显著低于幼龄林和过熟林(P<0.05);过熟林氮磷比(Nsoil/Psoil)均值为1.67,显著低于幼龄林和成熟林(P<0.05)。过熟林土壤微生物碳磷比(Cmic/Pmic)、氮磷比(Nmic/Pmic)均值分别为21.25、2.00,均显著低于其他2个阶段(P<0.05)。不同生长阶段土壤微生物碳与土壤有机碳比值(Cmic/Csoil)无显著差异,土壤微生物氮与土壤全氮比(Nmic/Nsoil)和土壤微生物磷与土壤全磷比(Pmic/Psoil)均为过熟林显著低于其他阶段(P<0.05)。冗余分析表明:幼龄林、成熟林和过熟林土壤微生物的首要影响因子分别为Csoil、Csoil/Psoil和Nsoil。 结论 尾巨桉人工林土壤微生物生物量在过熟林阶段最高,土壤微生物生物量与土壤化学性质关系密切,林分不同生长阶段土壤微生物受土壤影响的指标和程度具有差异性,生长后期应注重养分有效性对土壤微生物生长繁殖的影响。图4表2参54 Abstract:Objective The present study aims to investigate the soil-microbial stoichiometry of Eucalyptus urophylla × E. grandis plantation at young, mature, and overmature stages in order to enrich the basic research in the field of ecological stoichiometry of Eucalyptus plantation ecosystem. Method Three E. urophylla × E. grandis plantations at different growth stages in Leizhou Peninsula were selected as the research objects. Soil samples were collected from 0−20, 20−40, 40−60 cm soil layers respectively for measuring soil organic carbon (Csoil), total nitrogen (Nsoil), total phosphorus (Psoil), soil microbial biomass carbon (Cmic), nitrogen (Nmic), and phosphorus (Pmic), and the ratio among them was estimated to analyze the relationship between soil and microbial biomass. Result The mean values of soil organic carbon, total nitrogen, total phosphorus and soil microbial carbon, nitrogen and phosphorus were the highest in overmature forest, which were 20.15, 1.47, 0.88 g·kg−1 and 583.09, 55.20, and 28.03 mg·kg−1, respectively. The differences in different stages were not consistent. The vertical changes of soil organic carbon, total nitrogen, total phosphorus and microbial biomass carbon, nitrogen and phosphorus showed the characteristics of "surface aggregation", and the differences among soil layers in different growth stages were different due to different element types. The average values of Csoil/Nsoil and Csoil/Psoil in mature forest were 10.52 and 19.25, respectively, which were significantly lower than those in young and overmature forests (P<0.05). The mean value of Nsoil/Psoil in overmature forest was 1.67, which was significantly lower than that in young and mature forests (P<0.05). The average values of Cmic/Pmic and Nmic/Pmic on overmature stage were 21.25 and 2.00, which were significantly lower than those in other two stages (P<0.05). The ratio of soil microbial biomass carbon to soil organic carbon (Cmic/Csoil) had no significant difference at three stages. The ratio of soil microbial biomass nitrogen to soil total nitrogen (Nmic/Nsoil) and the ratio of microbial biomass phosphorus to soil total phosphorus (Pmic/Psoil) in overmature forest were significantly lower than those in other two stages (P<0.05). Redundancy analysis showed that Csoil, Csoil/Psoil and Nsoil were the primary influencing factors of soil microbe in young forest, mature forest and overmature forest, respectively. Conclusion The soil microbial biomass of E. urophylla × E. grandis plantation is the highest in the overmature forest stage, and is closely related to the soil chemical properties. The index and degree of soil microbes affected by the soil are different at different growth stages of the stand. The effect of nutrient availability on the growth and reproduction of soil microbe should be paid attention to at the later growth stage. [Ch, 4 fig. 2 tab. 54 ref.] -
表 1 样地基本概况
Table 1. Basic situation of sample plots
龄级 样地 林龄/a 海拔/m 平均胸
径/cm平均树
高/m林分密度/
(株·hm−2)叶面积
指数0~60 cm土壤
容重/(g·cm−3)pH 幼龄林 1 2 116 8.06 12.20 1575 0.829 1.05 4.6 2 2 120 7.85 11.93 1450 0.732 0.96 5.0 3 2 117 8.14 12.33 1586 0.916 1.03 5.2 成熟林 1 6 104 14.63 12.48 857 0.793 1.08 4.8 2 6 108 13.97 15.37 986 1.039 1.07 4.8 3 6 103 11.97 15.15 1174 1.184 1.08 5.0 过熟林 1 9 113 22.84 25.40 725 1.117 1.07 4.5 2 9 119 20.14 24.97 714 1.101 1.04 4.7 3 9 125 19.74 22.58 675 0.884 0.97 4.7 表 2 土壤和土壤微生物碳、氮、磷及化学计量比的相关性
Table 2. Correlation of soil and microbe biomass C, N, P content and their stoichiometry
阶段 指标 Csoil Nsoil Psoil Csoil/Nsoil Csoil/Psoil Nsoil/Psoil Cmic/Csoil Nmic/Nsoil Pmic/Psoil 幼龄林 Cmic 0.969** 0.941** 0.383 0.290 0.960** 0.923** 0.314 −0.324 0.825** Nmic 0.581 0.610 0.101 0.102 0.595 0.623 0.746* 0.330 0.432 Pmic 0.853** 0.854** 0.271 0.202 0.863** 0.856** 0.137 −0.445 0.995** Cmic/Nmic 0.785** 0.710* 0.341 0.327 0.775* 0.689* −0.361 −0.842** 0.743* Cmic/Pmic −0.308 −0.290 −0.099 −0.130 −0.302 −0.294 0.071 0.148 −0.681* Nmic/Pmic −0.611 −0.497 −0.291 −0.411 −0.606 −0.475 0.375 0.508 −0.753* 成熟林 Cmic 0.580 0.417 0.072 0.741 0.615 0.435 0.363 0.191 0.532 Nmic −0.009 0.040 −0.001 −0.096 −0.018 0.034 0.455 0.738* −0.098 Pmic 0.810** 0.744* 0.374 −0.119 0.830** 0.753* −0.336 −0.544 0.997** Cmic/Nmic 0.419 0.347 0.108 0.073 0.444 0.363 −0.274 −0.719* 0.450 Cmic/Pmic −0.402 −0.553 −0.188 0.440 −0.418 −0.573 0.434 0.664 −0.790* Nmic/Pmic −0.437 −0.498 −0.122 0.260 −0.467 −0.524 0.445 0.795* −0.785* 过熟林 Cmic 0.812** 0.906** 0.458 0.226 0.833** 0.850** 0.274 0.565 0.751* Nmic 0.922** 0.785* 0.776* 0.630 0.882** 0.605 −0.163 0.882** 0.463 Pmic 0.645 0.653 0.350 0.263 0.658 0.607 0.226 0.389 0.977** Cmic/Nmic −0.578 −0.224 −0.864** −0.805** −0.458 0.050 0.595 −0.846** 0.146 Cmic/Pmic 0.001 0.120 0.050 −0.140 0.002 0.118 0.003 0.083 −0.612 Nmic/Pmic 0.465 0.293 0.571 0.501 0.409 0.128 −0.410 0.675* −0.404 说明:*表示显著相关(P<0.05);**表示极显著相关(P<0.01) -
[1] DEVI N B, YADAVA P S. Seasonal dynamics in soil microbial biomass C, N and P in a mixed-oak forest ecosystem of Manipur, North-east India [J]. Appl Soil Ecol, 2006, 31(3): 220 − 227. [2] LEFF J W, JONES S E, PROBER S M, et al. Consistent responses of soil microbial communities to elevated nutrient inputs in grasslands across the globe [J]. Proc Natl Acad Sci USA, 2015, 112(35): 10967 − 10972. [3] HE Z L, YANG X E, BALIGAR V C, et al. Microbiological and biochemical indexing systems for assessing quality of acid soils [J]. Adv Agron, 2003, 78(2): 89 − 138. [4] BUCHKOWSKI R W, SCHMITZ O J, BRADFORD M A. Microbial stoichiometry overrides biomass as a regulator of soil carbon and nitrogen cycling [J]. Ecology, 2015, 96(4): 1139 − 1149. [5] ADAIR K L, WRATTEN S, LEAR G. Soil phosphorus depletion and shifts in plant communities change bacterial community structure in a long-term grassland management trial [J]. Environ Microbiol Rep, 2013, 5(3): 404 − 413. [6] SHILLAM L, HOPKINS D W, BADALUCCO L, et al. Structural diversity and enzyme activity of volcanic soils at different stages of development and response to experimental disturbance [J]. Soil Biol Biochem, 2008, 40(9): 2182 − 2185. [7] 杨凯, 朱教君, 张金鑫, 等. 不同林龄落叶松人工林土壤微生物生物量碳氮的季节变化[J]. 生态学报, 2009, 29(10): 5500 − 5507. YANG Kai, ZHU Jiaojun, ZHANG Jinxin, et al. Seasonal dynamics of soil microbial biomass C and N in two larch plantation forests with different ages in Northeastern China [J]. Acta Ecol Sin, 2009, 29(10): 5500 − 5507. [8] 范媛媛, 李懿, 李启迪. 不同林龄油松土壤微生物、酶活性和养分特征[J]. 水土保持研究, 2019, 26(6): 58 − 64. FAN Yuanyuan, LI Yi, LI Qidi. Microbe, enzymatic activity and nutrient contents of soils in different stand ages of Pinus tabuliformis [J]. Res Soil Water Conserv, 2019, 26(6): 58 − 64. [9] 王薪琪, 韩轶, 王传宽, 等. 帽儿山不同林龄落叶阔叶林土壤微生物生物量及其季节动态[J]. 植物生态学报, 2017, 41(6): 597 − 609. WANG Xinqi, HAN Yi, WANG Chuankuan, et al. Soil microbial biomass and its seasonality in deciduous broadleaved forests with different stand ages in the Mao’ershan region, Northeast China [J]. Chin J Plant Ecol, 2017, 41(6): 597 − 609. [10] 牛小云, 孙晓梅, 陈东升, 等. 辽东山区不同林龄日本落叶松人工林土壤微生物、养分及酶活性[J]. 应用生态学报, 2015, 26(9): 2663 − 2672. NIU Xiaoyun, SUN Xiaomei, CHEN Dongsheng, et al. Soil microorganisms, nutrients and enzyme activity of Larix kaempferi plantation under different ages in mountainous region of eastern Liaoning Province, China [J]. Chin J Appl Ecol, 2015, 26(9): 2663 − 2672. [11] 王传杰, 王齐齐, 徐虎, 等. 长期施肥下农田土壤-有机质-微生物的碳氮磷化学计量学特征[J]. 生态学报, 2018, 38(11): 3848 − 3858. WANG Chuanjie, WANG Qiqi, XU Hu, et al. Carbon, nitrogen, and phosphorus stoichiometry characteristics of bulk soil, organic matter, and soil microbial biomass under long-term fertilization in cropland [J]. Acta Ecol Sin, 2018, 38(11): 3848 − 3858. [12] 竹万宽, 陈少雄, 王志超, 等. 不同林龄尾巨桉人工林凋落物和土壤C、N、P化学计量特征[J]. 热带亚热带植物学报, 2017, 25(2): 127 − 135. ZHU Wankuan, CHEN Shaoxiong, WANG Zhichao, et al. Ecological stoichiometric characteristrics of carbon, nitrogen and phosphorus in litter and soil of Eucalyptus urophylla × E. grandis plantation at different forest ages [J]. J Trop Subtrop Bot, 2017, 25(2): 127 − 135. [13] 黄国勤, 赵其国. 广西桉树种植的历史、现状、生态问题及应对策略[J]. 生态学报, 2014, 34(18): 5142 − 5152. HUANG Guoqin, ZHAO Qiguo. The history, status quo, ecological problems and countermeasures of Eucalyptus plantations in Guangxi [J]. Acta Ecol Sin, 2014, 34(18): 5142 − 5152. [14] 许宇星, 王志超, 竹万宽, 等. 雷州半岛3种速生人工林下土壤生态化学计量特征[J]. 浙江农林大学学报, 2018, 35(1): 35 − 42. XU Yuxing, WANG Zhichao, ZHU Wankuan, et al. Ecological stoichiometric characteristics of soil C, N, P, and K in three types of plantations on the Leizhou Peninsula [J]. J Zhejiang A&F Univ, 2018, 35(1): 35 − 42. [15] 许宇星, 王志超, 竹万宽, 等. 不同品种桉树林生活叶-凋落物-土壤碳氮磷化学计量特征[J]. 西北农林科技大学学报(自然科学版), 2018, 46(3): 94 − 100. XU Yuxing, WANG Zhichao, ZHU Wankuan, et al. Stoichiometric characteristics of C, N and P in leaf-litter-soil of different Eucalyptus varieties [J]. J Northwest A&F Univ Nat Sci Ed, 2018, 46(3): 94 − 100. [16] 陈亚梅, 刘洋, 张健, 等. 巨桉混交林不同树种C、N、P化学计量特征[J]. 生态学杂志, 2015, 34(8): 2096 − 2102. CHEN Yamei, LIU Yang, ZHANG Jian, et al. Stoichiometric characteristics of carbon, nitrogen and phosphorus of different tree species in Eucalyptus grandis mixed plantation [J]. Chin J Ecol, 2015, 34(8): 2096 − 2102. [17] GÜSEWELL S. N∶P ratios in terrestrial plants: variation and functional significance [J]. New Phytol, 2004, 164(2): 243 − 266. [18] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 133 − 135. [19] WU J, JOERGENSEN R G, POMMERENING B, et al. Measurement of soil microbial biomass C by fumigation-extraction: an automated procedure [J]. Soil Biol Biochem, 1990, 22(8): 1167 − 1169. [20] 黄懿梅, 安韶山, 曲东, 等. 两种测定土壤微生物量氮方法的比较初探[J]. 植物营养与肥料学报, 2005, 11(6): 830 − 835. HUANG Yimei, AN Shaoshan, QU Dong, et al. Comparison between two methods of determination soil microbial biomass nitrogen [J]. Plant Nutr Fert Sci, 2005, 11(6): 830 − 835. [21] 吴金水, 肖和艾, 陈桂秋, 等. 旱地土壤微生物磷测定方法研究[J]. 土壤学报, 2003, 40(1): 70 − 78. WU Jinshui, XIAO Heai, CHEN Guiqiu, et al. Measurement of microbial biomass-P in upland soils in China [J]. Acta Pedol Sin, 2003, 40(1): 70 − 78. [22] 全国土壤普查办公室. 中国土壤普查技术[M]. 北京: 农业出版社, 1992: 107 − 119. [23] XU Yuxing, DU Apeng, WANG Zhichao, et al. Effects of different rotation periods of Eucalyptus plantations on soil physiochemical properties, enzyme activities, microbial biomass and microbial community structure and diversity[J]. For Ecol Manage, 2020, 456: 117683. doi: 10.1016/j.foreco.2019.117683. [24] TROGISCH S, HE Jinsheng, HECTOR A, et al. Impact of species diversity, stand age and environmental factors on leaf litter decomposition in subtropical forests in China [J]. Plant Soil, 2016, 400(1/2): 337 − 350. [25] 胡亚林, 汪思龙, 颜绍馗. 影响土壤微生物活性与群落结构因素研究进展[J]. 土壤通报, 2006, 37(1): 170 − 176. HU Yalin, WANG Silong, YAN Shaokui. Research advances on the factors influencing the activity and community structure of soil microorganism [J]. Chin J Soil Sci, 2006, 37(1): 170 − 176. [26] 钟文辉, 蔡祖聪. 土壤管理措施及环境因素对土壤微生物多样性影响研究进展[J]. 生物多样性, 2004, 12(4): 456 − 465. ZHONG Wenhui, CAI Zucong. Effect of soil management practices and environmental factors on soil microbial diversity: a review [J]. Biodiv Sci, 2004, 12(4): 456 − 465. [27] 时伟伟, 彭晚霞, 宋同清, 等. 不同林龄尾巨桉人工林土壤养分与微生物的耦合关系[J]. 西北植物学报, 2013, 33(7): 1452 − 1458. SHI Weiwei, PENG Wanxia, SONG Tongqing, et al. Coupling relationships between soil microbe and soil nutrient in Eucalyptus urophylla × E. grandis plantation at different stand ages [J]. Acta Bot Boreal-Occident Sin, 2013, 33(7): 1452 − 1458. [28] 易桂田, 王晓丽, 刘占锋, 等. 亚热带地区不同人工林配置下土壤微生物量碳及微生物墒的年际动态[J]. 生态环境学报, 2018, 27(2): 224 − 231. YI Guitian, WANG Xiaoli, LIU Zhanfeng, et al. Interannual dynamics of soil microbial biomass carbon under different plantations in Subtropical China [J]. Ecol Environ Sci, 2018, 27(2): 224 − 231. [29] 冯健, 张健. 巨桉人工林地土壤微生物类群的生态分布规律[J]. 应用生态学报, 2005, 16(8): 1422 − 1426. FENG Jian, ZHAGN Jian. Ecological distribution patterns of soil microbes under artificial Eucalyptus grandis stand [J]. Chin J Appl Ecol, 2005, 16(8): 1422 − 1426. [30] 雍强, 陈彪, 林波, 等. 雷州半岛不同林龄尾巨桉人工林凋落物产量、养分归还及分解动态研究[J]. 桉树科技, 2019, 36(3): 16 − 21. YONG Qiang, CHEN Biao, LIN Bo, et al. Litter production, nutrient return and decomposition in Eucalyptus plantations of different ages in Leizhou Peninsula [J]. Eucalypt Sci Technol, 2019, 36(3): 16 − 21. [31] ZHOU Z H, WANG C K. Soil resources and climate jointly drive variations in microbial biomass carbon and nitrogen in China’s forest ecosystems [J]. Biogeosci Discuss, 2015, 12: 11191 − 11216. [32] LI Pin, YANG Yuanhe, HAN Wenxuan, et al. Global patterns of soil microbial nitrogen and phosphorus stoichiometry in forest ecosystems [J]. Global Ecol Biogeogr, 2014, 23(9): 979 − 987. [33] LI Yong, WU Jinshui, LIU Shoulong, et al. Is the C∶N∶P stoichiometry in soil and soil microbial biomass related to the landscape and land use in southern subtropical China? [J]. Global Biogeochem Cycles, 2012, 26(4): 4002. doi: 10.1029/2010GB004399. [34] 岑龙沛, 严友进, 戴全厚, 等. 喀斯特不同土地利用类型裂隙土壤有机碳及磷素赋存特征[J]. 生态学报, 2020, 40(21): 7567 − 7575. CEN Longpei, YAN Youjin, DAI Quanhou, et al. Occurrence characteristics of organic carbon and phosphorus in fissured soil under different land use types in karst area [J]. Acta Ecol Sin, 2020, 40(21): 7567 − 7575. [35] 吴艳宏, 周俊, 邴海健, 等. 贡嘎山海螺沟典型植被带总磷分布特征[J]. 地球科学与环境学报, 2012, 34(3): 70 − 74. WU Yanhong, ZHOU Jun, BING Haijian, et al. Characteristic of total phosphorus distribution in typical vegetation zones along Hailuogou of Gongga Mountain [J]. J Earch Sci Environ, 2012, 34(3): 70 − 74. [36] 刘宝, 吴文峰, 林思祖, 等. 中亚热带4种林分类型土壤微生物生物量碳氮特征及季节变化[J]. 应用生态学报, 2019, 30(6): 1901 − 1910. LIU Bao, WU Wenfeng, LIN Sizu, et al. Characteristics of soil microbial biomass carbon and nitrogen and its seasonal dynamics in four mid-subtropical forests [J]. Chin J Appl Ecol, 2019, 30(6): 1901 − 1910. [37] CHEN C R, XU Z H, ZHANG S L, et al. Soluble organic nitrogen pools in forest soils of subtropical Australia [J]. Plant soil, 2005, 277(1/2): 285 − 297. [38] TAYLOR J P, WILSON B, MILLS M S, et al. Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques [J]. Soil Biol Biochem, 2002, 34(3): 387 − 401. [39] WARDLE D A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil [J]. Biol Rev, 1992, 67(3): 321 − 358. [40] LITTON C M, RYAN M G, KNIGHT D H, et al. Soil-surface carbon dioxide efflux and microbial biomass in relation to tree density 13 years after a stand replacing fire in a lodgepole pine ecosystem [J]. Global Change Biol, 2003, 9(5): 680 − 696. [41] SONG Piao, REN Haibao, JIA Qi, et al. Effects of historical logging on soil microbial communities in a subtropical forest in southern China [J]. Plant Soil, 2015, 397(1/2): 115 − 126. [42] CHEN Yuanqi, LIU Zhanfeng, RAO Xingquan, et al. Carbon storage and allocation pattern in plant biomass among different forest plantation stands in Guangdong, China [J]. Forests, 2015, 6(3): 794 − 808. [43] CHEN Yuanqi, YU Shiqin, LIU Suping, et al. Reforestation makes a minor contribution to soil carbon accumulation in the short term: evidence from four subtropical plantations [J]. For Ecol Manage, 2017, 384: 400 − 405. [44] TIAN Hanqin, CHEN Guangsheng, ZHANG Chi, et al. Pattern and variation of C∶N∶P ratios in China’s soils: a synthesis of observational data [J]. Biogeochemistry, 2010, 98(1/3): 139 − 151. [45] 曹娟, 闫文德, 项文化, 等. 湖南会同3个林龄杉木人工林土壤碳、氮、磷化学计量特征[J]. 林业科学, 2015, 51(7): 1 − 8. CAO Juan, YAN Wende, XIANG Wenhua, et al. Stoichiometry characterization of soil C, N, and P of Chinese fir plantations at three different ages in Huitong, Hunan Province, China [J]. Sci Silv Sin, 2015, 51(7): 1 − 8. [46] XU Xiaofeng, THORNTON P E, POST W M. A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems [J]. Global Ecol Biogeogr, 2013, 22(6): 737 − 749. [47] 李品, 木勒德尔·吐尔汗拜, 田地, 等. 全球森林土壤微生物生物量碳氮磷化学计量的季节动态[J]. 植物生态学报, 2019, 43(6): 532 − 542. LI Pin, Muledeer Tuerhanbai, TIAN Di, et al. Seasonal dynamics of soil microbial biomass carbon, nitrogen and phosphorus stoichiometry across global forest ecosystems [J]. Chin J Plant Ecol, 2019, 43(6): 532 − 542. [48] CLEVELAND C C, LIPTZIN D. C∶N∶P stoichiometry in soil: is there a “Redfield ratio” for the microbial biomass? [J]. Biogeochemistry, 2007, 85(3): 235 − 252. [49] 黄昌勇. 土壤学[M]. 北京: 中国农业出版社, 2000: 50 − 64. [50] PAUL E A, CLARK F E. Soil Microbiology and Biochemistry[M]. San Diego: Academic Press, 1989: 131 − 146. [51] MOOSHAMMER M, WANEK W, ZECHMEISTER-BOLTENSTERN S, et al. Stoichiometric imbalances between terrestrial decomposer communities and their resources: mechanisms and implications of microbial adaptations to their resources[J]. Front Microbiol, 2014, 5(22): 22. doi: 10.3389/fmicb.2014.00022. [52] ANDERSON J P E, DOMSCH K H. A physiological method for the quantitative measurement of microbial biomass in soils [J]. Soil Biol Biochem, 1978, 10(3): 215 − 221. [53] VANCE E D, CHAPIN Ⅲ F S. Substrate limitations to microbial activity in taiga forest floors [J]. Soil Biol Biochem, 2001, 33(2): 173 − 188. [54] 吴建平, 韩新辉, 许亚东, 等. 黄土丘陵区不同植被类型下土壤与微生物C, N, P化学计量特征研究[J]. 草地学报, 2016, 24(4): 783 − 792. WU Jianping, HAN Xinhui, XU Yadong, et al. Ecological stoichiometry of soil and soil microbial biomass C, N, P under grain-to-green program in Loess Hilly Region [J]. Acta Agrestia Sin, 2016, 24(4): 783 − 792. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20200536






 下载:
下载:



