-
土壤盐碱化是当今世界性的资源和生态问题[1],是限制农林业发展的主要因素之一[2]。中国现有盐碱土面积3 600 万hm2,主要分为滨海盐碱土区、黄淮海平原盐碱土区、西北半干旱盐碱土区和干旱盐碱土区以及东北盐碱土区[3],其中滨海盐碱土区是中国重要的盐碱地土地类型,涵盖大部分沿海地区,分布范围较广[4]。滨海盐碱地土壤含盐量过高,盐分组成以氯化物为主[5],能够适应生存的植物种类较少,常选用木麻黄Casuarina equisetifolia、乌桕Sapium sebiferum等耐盐人工植被[6]和柽柳属Tamarix先锋树种[7]绿化造林,而深根、肉质根系、喜酸性土壤的木兰科Magnoliaceae植物较少应用。望春玉兰Magnolia biondii系木兰科木兰属Magnolia多年生落叶乔木,为木兰科植物中典型的春花乔木,园林绿化效果好,应用前景广阔。目前,对望春玉兰的研究主要侧重于抗寒性[8]、花色[9]及其花蕾“辛夷”的应用研究[10]上,而其耐盐性方面研究极少。为明确木兰科植物在滨海盐碱土种植的可能性,根据预试验的结果,选择望春玉兰为对象,采用水培法研究了氯化钠胁迫对1年生实生苗形态和生理指标的影响,并探讨了对氯化钠胁迫具有指示性的生理指标,为木兰科植物的耐盐性评价及耐盐树种或品种的筛选提供理论依据。
-
以望春玉兰1年生实生苗为材料,于2019年4月定植于上口径6 cm、下口径5 cm、高8 cm的塑料盆中,栽培基质为泥炭土、珍珠岩、蛭石(体积比1∶1∶1),每盆1株。定植后的苗木置于浙江农林大学平山基地温室中,进行常规管理。待幼苗高生长约10 cm时,挑选生长一致的幼苗转移至浙江农林大学风景园林与建筑学院智能温室中,温室培养条件为光照强度2 200~3 000 lx,光照14 h·d−1,白天温度28 ℃,夜间温度25 ℃,空气相对湿度68%~75%。幼苗经去土洗净根系后置于上口径6 cm、下口径6 cm、高14 cm的玻璃培养瓶中,每瓶1株,采用1/2 Hoagland营养液进行水培,水培过程中隔3 d更换1次1/2 Hoagland营养液,不通气。
-
待幼苗恢复正常生长后,选取叶片数为7~8片的幼苗,于2019年7月开始进行盐胁迫处理。根据预试验结果,选取盐胁迫下苗木有明显胁迫反应,又不至于生长明显受到抑制的临界浓度作为试验浓度,设置0(对照组)和200 mmol·L−1(试验组)2个氯化钠浓度处理,每处理5株,重复3次。在处理期间以设定的氯化钠浓度隔3 d更换1次培养液,于盐胁迫后的第1、3、5、7、9天清晨,采集各处理植株从下至上的第3位至第7位叶片,每处理5株植株的叶片混合后进行相应生理指标测定。
-
分别于盐胁迫后第1、3、5、7、9天观察植株叶片的受害程度,将盐害症状分为5个级别。①0级:叶片颜色和生长正常;②1级:少量叶尖、叶缘变黄;③2级:部分叶尖变黄萎蔫,少量叶片脱落;④3级:大部分叶片变黄,萎蔫干枯,有明显落叶;⑤4级:叶片脱落较(极)严重。
-
生理指标的测定参照李合生[11]的方法,叶绿素采用乙醇提取法测定,质膜相对透性采用电导率法测定,丙二醛采用硫代巴比妥酸法测定,可溶性糖采用蒽酮比色法测定,可溶性蛋白质采用考马斯亮蓝G-250染色法测定,脯氨酸采用酸性茚三酮法测定,超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定,过氧化物酶(POD)活性采用愈创木酚法测定。
-
采用Excel 2010处理数据、绘图,利用SPSS 22.0进行单因素方差分析、相关性分析和主成分分析。
-
观察望春玉兰幼苗叶片受伤害程度(图1)可知:随着盐胁迫时间的延长,望春玉兰的受害症状加重。在胁迫的第1天,叶片颜色和生长正常,在胁迫第3、5、7天时受害症状为1级,少量叶尖、叶缘变黄;在胁迫的第9天受害症状为2级,部分叶尖变黄萎蔫,少量叶片脱落。
-
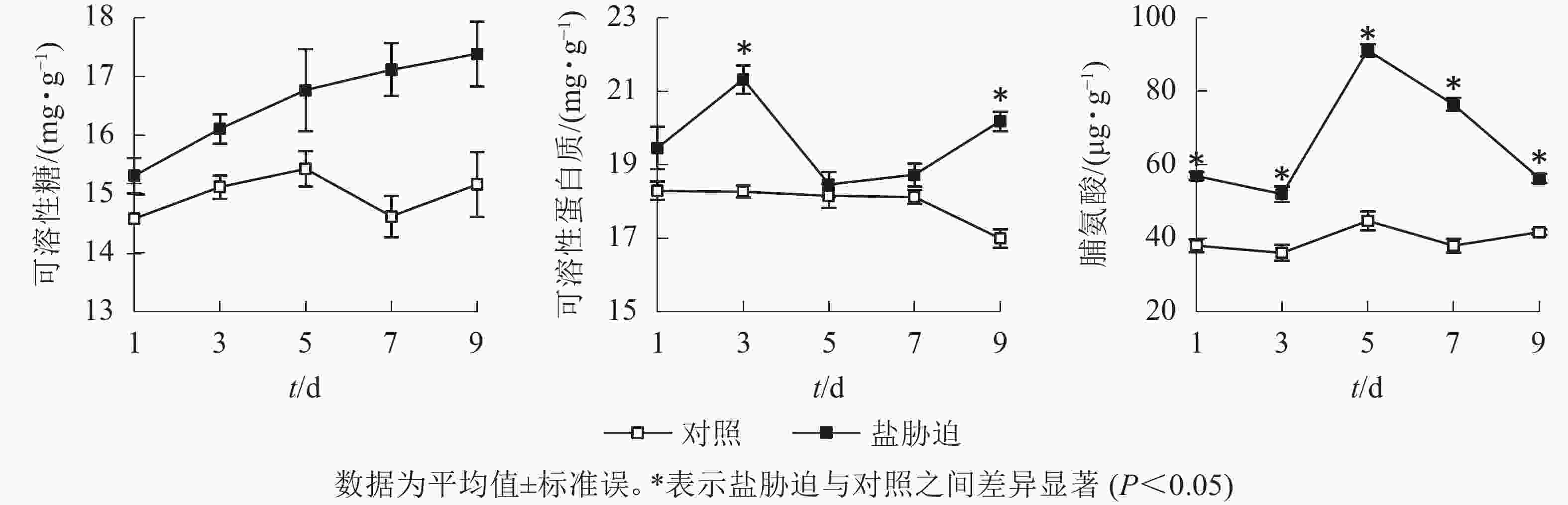
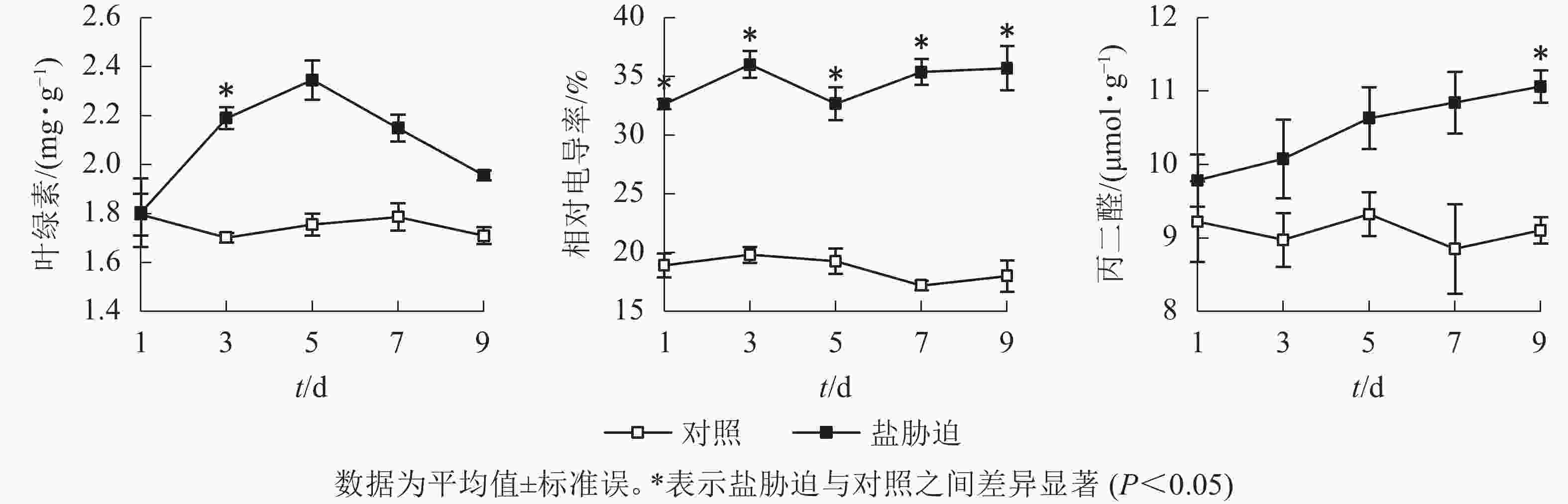
可溶性糖、可溶性蛋白质和脯氨酸等物质是植物体内重要的渗透调节物质,能减轻植物在胁迫条件下受到的伤害。由图2可以看出:盐胁迫下,望春玉兰叶片的可溶性糖质量分数呈逐渐上升趋势;可溶性蛋白质质量分数随着盐胁迫时间的延长,总体呈先上升后下降的趋势,在盐胁迫处理的第3、9天,与对照组相比,差异显著(P<0.05);脯氨酸质量分数随着胁迫时间的延长,总体呈先上升后下降的趋势,且在胁迫处理的时间范围内始终与对照组差异显著(P<0.05)。
-
从图3可见:盐胁迫下,望春玉兰叶片的叶绿素质量分数呈先上升后下降的趋势,在盐胁迫的第3天与对照组相比,差异显著(P<0.05)。望春玉兰叶片的相对电导率在盐胁迫下呈波动上升的趋势,在胁迫末期保持稳定,且在盐胁迫处理的时间范围内均与对照组差异显著(P<0.05)。望春玉兰叶片的丙二醛质量摩尔浓度随着盐胁迫时间的延长呈上升趋势,在盐胁迫的第9天与对照组差异显著(P<0.05)。
-
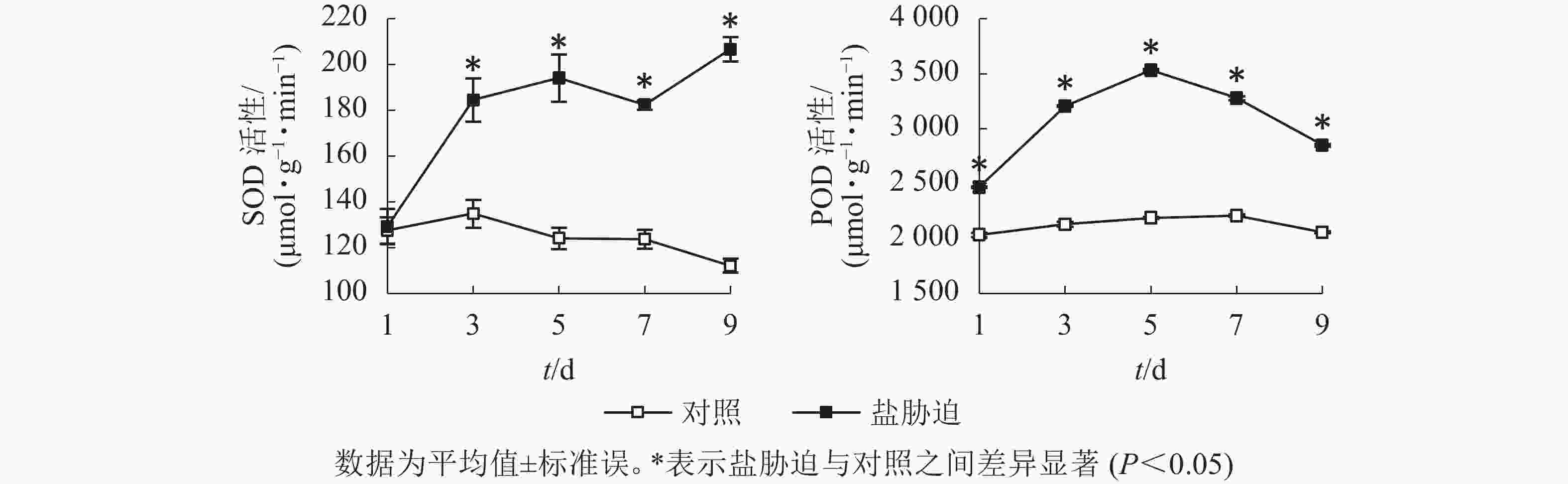
SOD是植物体内防御氧化逆境下自由基形成的关键酶,是植物防御体系的第1道防线[12],POD是植物体内酶促防御系统的重要保护酶类,用于清除植株体内过多的活性氧[13]。图4结果显示:望春玉兰叶片的SOD活性随着盐胁迫时间的延长呈逐渐上升的趋势,且在胁迫处理的第3、5、7、9天均与对照组差异显著(P<0.05);POD活性随着盐胁迫时间的延长呈先上升后下降的趋势,且在胁迫处理的时间范围内均与对照组差异显著(P<0.05)。
-
对望春玉兰的8个生理指标进行相关性分析(表1)表明:可溶性糖与相对电导率呈显著相关(P<0.05),与丙二醛呈极显著相关(P<0.01);叶绿素与POD活性呈极显著相关(P<0.01)。
表 1 盐胁迫下望春玉兰叶片生理指标的相关系数
Table 1. Correlation matrix of physiological indexes of M. biondii under NaCl stress
相对电导率 丙二醛 叶绿素 可溶性糖 可溶性蛋白 脯氨酸 SOD POD 相对电导率 1 丙二醛 0.868 1 叶绿素 −0.071 0.297 1 可溶性糖 0.906* 0.966** 0.100 1 可溶性蛋白 0.260 0.139 −0.090 0.002 1 脯氨酸 0.006 0.255 0.484 0.305 −0.873 1 SOD 0.502 0.818 0.460 0.680 0.356 0.047 1 POD 0.019 0.407 0.982** 0.238 −0.205 0.610 0.512 1 说明:*表示差异显著(P<0.05),**表示差异极显著(P<0.01) 对望春玉兰8个生理指标进行主成分分析(表2)可知:前2个主成分的累计贡献率达78.892%,可以概括原指标的绝大多数数据信息。望春玉兰的第1主成分主要为丙二醛、可溶性糖和超氧化物歧化酶,第2主成分主要为可溶性蛋白质和脯氨酸。
表 2 盐胁迫下望春玉兰叶片生理指标的主成分分析
Table 2. Principal component analysis of physiological indexes of M. biondii under NaCl stress
指标 主成分1 主成分2 指标 主成分1 主成分2 相对电导率 0.721 0.549 脯氨酸 0.425 −0.793 丙二醛 0.958 0.260 超氧化物歧化酶 0.837 0.207 叶绿素 0.549 −0.616 过氧化物酶 0.651 −0.640 可溶性糖 0.882 0.292 特征值 3.821 2.491 可溶性蛋白 0.023 0.759 贡献率/% 47.758 31.134 -
盐胁迫环境中盐分离子的浓度过高会导致植物根系吸收水分困难,引发渗透胁迫[14]。植物通过可溶性蛋白质、可溶性糖和脯氨酸等小分子有机物的合成和积累以降低水势,维持水分平衡。本研究中,望春玉兰叶片的可溶性糖质量分数随盐胁迫时间的延长呈逐渐上升的趋势,而可溶性蛋白质和脯氨酸质量分数总体呈先上升后下降的趋势,但始终高于对照。不同植物选择的主要有机渗透调节物质存在差异[15],本研究表明:盐胁迫后期望春玉兰主要是通过提高可溶性糖质量分数进行渗透调节的。
当盐胁迫超出细胞渗透调节作用的上限时,细胞膜会受到损伤。本研究中,随着胁迫时间的延长,望春玉兰叶片的叶绿素质量分数先升高后降低,说明胁迫初期植物通过促进自身叶绿素的合成以适应盐胁迫环境,但在长时间的盐胁迫下,过量的盐进入植物细胞,使叶绿素分解[16],这可能与细胞渗透调节能力下降有关。而叶片的相对电导率和丙二醛质量摩尔浓度均呈上升趋势,在胁迫结束时均较对照有显著的提高。说明在盐胁迫条件下,植物体膜结构不断膜脂过氧化,加剧细胞膜受损伤的程度。
盐胁迫下植物体内氧化还原体系的平衡被破坏,诱导产生对植物的生理功能具有破坏作用的活性氧,植物体通过提高超氧化物歧化酶、过氧化物酶等活性氧清除剂的活性以维持植物体内活性氧代谢平衡,维护膜结构完整性。本研究中,望春玉兰叶片的超氧化物歧化酶活性随胁迫时间的延长呈逐渐上升的趋势,过氧化物酶活性呈先升高后下降的趋势。表明在胁迫前期2种酶共同参与清除活性氧,缓解氧化伤害的活动,而到胁迫后期植物体主要通过增加超氧化物歧化酶活性以增强细胞内活性氧的清除能力,保护膜系统。
盐胁迫对植物叶片生理指标的伤害表现在形态上为叶形叶色的变化。在胁迫的第1天,望春玉兰正常生长,各项生理指标均呈上升趋势;在胁迫的第3天后,望春玉兰叶片开始变黄;在胁迫的第9天,即胁迫结束时,叶片开始脱落,此时叶绿素、可溶性蛋白质、脯氨酸、过氧化物酶较前期均有所下降。
植物的耐盐性是复杂的生理生化过程,其耐盐机制涉及多种生理生化的协调作用[17-19]。本研究主成分分析得出:盐胁迫下望春玉兰的丙二醛质量摩尔浓度、可溶性糖质量分数和超氧化物歧化酶活性具有绝对值较大的负荷系数。说明这3个指标可能是望春玉兰受到盐胁迫时起关键作用的生理指标,这3个指标在盐胁迫下的生理表现也一致。
由于植物耐盐性受多基因控制,不同生长发育阶段及生态环境条件下,基因表达存在差异,耐盐性强弱表现也不同。而本研究采用水培法对1年生幼苗进行盐胁迫处理,所用望春玉兰植株偏小,未进行不同大小植株的比较,因此结果不能完全代替成株期的抗盐性情况。且本研究选用的氯化钠浓度为望春玉兰的耐盐临界浓度,与各地滨海盐渍土的实际含盐量存在一定的差异。因此,还需在植物的各个生长阶段采用大田试验进一步验证,以获得更加客观的耐盐性评价结果。
-
望春玉兰体内的各项生理指标对盐胁迫均有一定的响应。盐胁迫下望春玉兰幼苗的相对电导率和丙二醛质量摩尔浓度持续增加,可溶性蛋白质、脯氨酸、叶绿素质量分数与过氧化物酶活性在短期胁迫下能有所上升以减缓盐害,而可溶性糖质量分数和超氧化物歧化酶活性在长时间的胁迫下仍能保持较高水平以进行渗透保护和清除活性氧等活动,从而减弱细胞膜损伤程度。对耐盐性生理指标的主成分分析发现:丙二醛质量摩尔浓度、可溶性糖质量分数、超氧化物歧化酶活性对望春玉兰的指示性最强,可以作为望春玉兰等木兰科植物盐胁迫耐性强弱的主要生理指标。
Effect of NaCl stress on the morphology and related physiological indexes of Magnolia biondii seedlings
-
摘要:
目的 探讨盐胁迫对望春玉兰Magnolia biondii幼苗形态和相关生理指标的影响,并筛选盐胁迫下的指示性生理指标,为木兰科Magnoliaceae植物的耐盐性评价与筛选优质种质资源提供理论依据。 方法 以望春玉兰1年生实生苗为材料,采用水培法,测定200 mmol·L−1氯化钠胁迫下叶片的相对电导率、丙二醛质量摩尔浓度、叶绿素质量分数、渗透调节物质质量分数和抗氧化酶活性,通过主成分分析筛选关键生理指标。 结果 随着盐胁迫时间的延长,可溶性糖质量分数、相对电导率、丙二醛质量摩尔浓度和超氧化物歧化酶(SOD)活性总体呈上升趋势;可溶性蛋白质质量分数、脯氨酸质量分数、叶绿素质量分数和过氧化物酶(POD)活性总体呈先上升后下降的趋势。利用主成分分析法筛选出3个指示性指标,分别为丙二醛质量摩尔浓度、可溶性糖质量分数和SOD活性。 结论 氯化钠胁迫引起望春玉兰幼苗叶片丙二醛质量摩尔浓度、可溶性糖质量分数和SOD活性显著变化,可作为指示性生理指标用于评价氯化钠胁迫下望春玉兰等木兰科植物的耐盐性强弱。图4表2参19 Abstract:Objective With an investigation conducted of the effects of NaCl stress on the morphology and related physiological indexes of Magnolia biondii seedlings and the physiological indexes indicating the NaCl stress screened, this paper is aimed to provide a theoretical basis for the evaluation of the salt tolerance of Magnoliaceae and the selection of high-quality germplasm resources. Method Firstly, the hydroponic culture experiment was done with M. biondii 1-year-old seedlings with the effects of NaCl stress under 200 mmol·L−1 on relative electrical conductivity, MDA contents, chlorophyll contents, osmotic substances and antioxidant enzyme activities in leaves tested, after which the principal component analysis was conducted to screen key physiological indexes. Result With the increase of treatment time, the soluble sugar content, relative electric conductivity, MDA content and SOD activity increased. The soluble protein content, Pro content, chlorophyll content and POD activity first increased and then decreased. The three indicative physiological indexes screened by principal component analysis were MDA content, soluble sugar content and SOD activity. Conclusion The MDA content, soluble sugar content and SOD activity underwent significant changes under NaCl stress, and they could be used as key physiological indexes in the evaluation of the salt tolerance of Magnoliaceae such as M. biondii. [Ch, 4 fig. 2 tab. 19 ref.] -
Key words:
- botany /
- Magnolia biondii /
- NaCl stress /
- physiology responses /
- principal component analysis /
- indicative indexes
-
表 1 盐胁迫下望春玉兰叶片生理指标的相关系数
Table 1. Correlation matrix of physiological indexes of M. biondii under NaCl stress
相对电导率 丙二醛 叶绿素 可溶性糖 可溶性蛋白 脯氨酸 SOD POD 相对电导率 1 丙二醛 0.868 1 叶绿素 −0.071 0.297 1 可溶性糖 0.906* 0.966** 0.100 1 可溶性蛋白 0.260 0.139 −0.090 0.002 1 脯氨酸 0.006 0.255 0.484 0.305 −0.873 1 SOD 0.502 0.818 0.460 0.680 0.356 0.047 1 POD 0.019 0.407 0.982** 0.238 −0.205 0.610 0.512 1 说明:*表示差异显著(P<0.05),**表示差异极显著(P<0.01) 表 2 盐胁迫下望春玉兰叶片生理指标的主成分分析
Table 2. Principal component analysis of physiological indexes of M. biondii under NaCl stress
指标 主成分1 主成分2 指标 主成分1 主成分2 相对电导率 0.721 0.549 脯氨酸 0.425 −0.793 丙二醛 0.958 0.260 超氧化物歧化酶 0.837 0.207 叶绿素 0.549 −0.616 过氧化物酶 0.651 −0.640 可溶性糖 0.882 0.292 特征值 3.821 2.491 可溶性蛋白 0.023 0.759 贡献率/% 47.758 31.134 -
[1] 张蓉蓉. 陕西渭北农田土壤盐碱化空间分布及影响因素[D]. 杨凌: 西北农林科技大学, 2017. ZHANG Rongrong. Spatial Distribution and Influencing Factors of Farm and Soil Salinization in Weibei Area of Shaanxi Province[D]. Yangling: Northwest A&F University, 2017. [2] 陈阳, 王贺, 张福锁, 等. 硅盐互作下小獐毛植物体内元素分布及生理特性的研究[J]. 植物生态学报, 2003, 27(2): 189 − 195. CHEN Yang, WANG He, ZHANG Fusuo, et al. The effects of silicon on ionic distribution and physiological characteristic of Aeluropus pungens under salinity conditions [J]. Chin J Plant Ecol, 2003, 27(2): 189 − 195. [3] 孙玉芳, 宋福强, 常伟, 等. 盐碱胁迫下AM真菌对沙枣苗木生长和生理的影响[J]. 林业科学, 2016, 52(6): 18 − 27. SUN Yufang, SONG Fuqiang, CHANG Wei, et al. Effect of arbuscular mycorrhizal fungi on growth and physiology of Elaeagnus angustifolia seedlings subjected to salinity stress [J]. Sci Silv Sin, 2016, 52(6): 18 − 27. [4] 薛腾笑. 3种连翘苗木抗盐性评价及生理生化特性研究[D]. 保定: 河北农业大学, 2018. XUE Tengxiao. Evaluation of Salt Tolerance and Physiological-biochemical Characteristics of Three Forsythia Seedlings[D]. Baoding: Hebei Agricultural University, 2018. [5] 赵名彦. 滨海盐碱地造林技术与效果研究[D]. 北京: 北京林业大学, 2011. ZHAO Mingyan. Study on Afforestation and its Effects in Coastal Saline-alkaline Land[D]. Beijing: Beijing Forestry University, 2011. [6] 张建锋, 张德顺, 陈光才, 等. 上海滨海滩涂盐生植物分布及其生物量调查研究[J]. 江西农业学报, 2015, 27(2): 26 − 29, 36. ZHANG Jianfeng, ZHANG Deshun, CHEN Guangcai, et al. Investigation on distribution and biomass of halophytes at beach in Shanghai [J]. Acta Agric Jiangxi, 2015, 27(2): 26 − 29, 36. [7] 魏凤巢, 夏瑞妹, 沈哲东. 上海市滨海盐渍土改良技术的研究与实践[J]. 中国园林, 2008, 24(2): 85 − 89. WEI Fengchao, XIA Ruimei, SHEN Zhedong. Research and practice on amelioration technologies of coastal saline soil in Shanghai [J]. Chin Landscape Archit, 2008, 24(2): 85 − 89. [8] 梁大伟, 马履一, 贾忠奎, 等. 自然降温对红花玉兰抗寒生理指标的影响[J]. 林业科技开发, 2010, 24(2): 23 − 26. LIANG Dawei, MA Lüyi, JIA Zhongkui, et al. Study on the influences of naturel cooling on the cold tolerance physiological indicators of Magnolia wufengensis [J]. China For Sci Technol, 2010, 24(2): 23 − 26. [9] 王宁杭. 望春玉兰花瓣类黄酮组成及转录组分析[D]. 杭州: 浙江农林大学, 2019. WANG Ninghang. The Flavonoid Components and Transcriptome Analysis of Magnolia biondii[D]. Hangzhou: Zhejiang A&F University, 2019. [10] 刘星, 单杨. 辛夷的提取、应用及其品质评价研究进展[J]. 食品工业科技, 2011, 32(11): 506 − 510. LIU Xing, SHAN Yang. Research of magnolia extraction, application and quality assessment [J]. Sci Technol Food Ind, 2011, 32(11): 506 − 510. [11] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. [12] 罗娅, 汤浩茹, 张勇. 低温胁迫对草莓叶片SOD和AsA-GSH循环酶系统的影响[J]. 园艺学报, 2007, 34(6): 1405 − 1410. LUO Ya, TANG Haoru, ZHANG Yong. Effect of low temperature stress on activities of SOD and enzymes of ascorbate-glutathione cycle [J]. Acta Hortic Sin, 2007, 34(6): 1405 − 1410. [13] 王玉萍, 于丹, 李成, 等. 壳聚糖对盐胁迫下小麦种子萌发及幼苗生理特性的影响[J]. 干旱地区农业研究, 2016, 34(1): 180 − 185. WANG Yuping, YU Dan, LI Cheng, et al. Effect of chitosan on seed germination and seedling physiological characters of wheat under salt stress [J]. Agric Res Arid Areas, 2016, 34(1): 180 − 185. [14] 陈闻, 王晶, 吴海平, 等. 5种海岛典型园林绿化植物的耐盐性[J]. 浙江农林大学学报, 2017, 34(2): 283 − 293. CHEN Wen, WANG Jing, WU Haiping, et al. Salt tolerance of 5 typical landscape plant species in Zhoushan Islands [J]. J Zhejiang A&F Univ, 2017, 34(2): 283 − 293. [15] 杨升, 张华新, 刘涛. 16个树种盐胁迫下的生长表现和生理特性[J]. 浙江农林大学学报, 2012, 29(5): 744 − 754. YANG Sheng, ZHANG Huaxin, LIU Tao. Morphological changes and physiological characteristics of seedlings from 16 tree species with salt stress [J]. J Zhejiang A&F Univ, 2012, 29(5): 744 − 754. [16] 朱金方, 刘京涛, 陆兆华, 等. 盐胁迫对中国柽柳幼苗生理特性的影响[J]. 生态学报, 2015, 35(15): 5140 − 5146. ZHU Jinfang, LIU Jingtao, LU Zhaohua, et al. Effects of salt stress on physiological characteristics of Tamarix chinensis Lour. seedlings [J]. Acta Ecol Sin, 2015, 35(15): 5140 − 5146. [17] 罗秋香, 管清杰, 金淑梅, 等. 植物耐盐性分子生物学研究进展[J]. 分子植物育种, 2006(增刊 2): 57 − 64. LUO Qiuxiang, GUAN Qingjie, JIN Shumei, et al. Advances on application of molecular biology on plant salt tolerance research [J]. Mol Plant Breed, 2006(suppl 2): 57 − 64. [18] 刘政, 胡孙田, 沈晓飞, 等. 外源褪黑素处理对月季幼苗盐胁迫的缓解效应[J]. 浙江农林大学学报, 2020, 37(5): 957 − 962. LIU Zheng, HU Suntian, SHEN Xiaofei, et al. Alleviation of exogenous melatonin on rose seedlings under salt stress [J]. J Zhejiang A&F Univ, 2020, 37(5): 957 − 962. [19] 刘翠玉, 闫明, 黄贤斌, 等. 石榴耐盐性研究与指标筛选[J]. 浙江农林大学学报, 2018, 35(5): 853 − 860. LIU Cuiyu, YAN Ming, HUANG Xianbin, et al. Salt tolerance and screening for identification indexes with pomegranate cuttings [J]. J Zhejiang A&F Univ, 2018, 35(5): 853 − 860. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20200449







 下载:
下载: