-
青藏高原生态系统脆弱,对全球气候变化非常敏感,高寒草甸是青藏高原极具代表性的生态系统和主要牧场[1]。放牧是高寒草甸的主要利用方式[2],但过度放牧已对高寒草甸生态系统产生较大影响,致使草地退化严重[3]。由于人类活动已影响到高寒草甸生态系统的可持续性,因此,探索放牧利用方式对高寒草甸的影响机制,成为迫切需要解决的问题[3]。
土壤酶是由植物根、微生物分泌和动植物残体分解释放的活性物质[4],能够调控和反映土壤微生物和植物对养分的需求[5−7]。土壤酶主要分为氧化还原酶、水解酶、转移酶、裂合酶、连接酶和异构酶共6类[4],其中土壤水解酶参与土壤养分的水解,在土壤微生物和植物养分供应上发挥着重要的作用[4, 8]。相较于土壤理化指标,土壤水解酶活性对外界环境的变化更为敏感,能较早地预警生态系统的改变[5]。土壤水解酶活性和土壤功能紧密相关[9],能够反映环境胁迫下土壤功能的退化程度[10−11]。
家畜采食是对高寒草甸影响面积最广、最主要的放牧行为[12−14]。现阶段,对家畜采食行为的研究集中在其对牧草品质、土壤有机碳储量、土壤养分、地上地下生物量的影响[15−16]等方面,并且研究对象主要在低海拔地区[17−18]。关于采食行为对土壤水解酶活性的影响存在较大争议[18],产生争议的原因可能是草地生态系统的不同,也可能是采食时间和采食强度上的不同。例如,在内蒙古草地生态系统中,家畜秋季采食对碳获取水解酶活性无显著影响[19];加拿大平原草原生态系统中,家畜在草地生长季采食会降低碳获取β-葡萄糖苷酶、纤维素酶活性,提高磷获取酸性磷酸酶活性[20];在高寒草甸生态系统生长季初期,家畜轻度采食会提高亮氨酸氨基肽酶、N-乙酰-β-D-氨基葡萄糖苷酶活性,但重度采食会降低N-乙酰-β-D-氨基葡萄糖苷酶活性[21]。但关于不同采食强度对高寒草甸土壤水解酶活性的系统性研究极为缺乏。
本研究以青藏高原东缘高寒草甸为研究对象,通过刈割留茬模拟家畜不同采食强度,研究3 a禁牧牧场夏季家畜采食行为对土壤水解酶活性的影响。研究的土壤水解酶包括:碳获取水解酶(蔗糖酶、β-葡萄糖苷酶、β-木糖苷酶、纤维二糖水解酶),氮获取水解酶(脲酶、亮氨酸氨基肽酶、N-乙酰-β-D-氨基葡萄糖苷酶)和酸性磷酸酶。通过分析生长季家畜不同采食强度下高寒草甸土壤水解酶活性和土壤理化性质的变化规律,阐明在家畜不同采食强度下土壤水解酶活性变化的主要控制因子,为指导高寒草甸合理有效利用提供理论依据。
-
研究区位于四川省阿坝藏族羌族自治州红原县若尔盖草原(32°58′08″N,102°37′08″E,海拔为3 500 m)。该草原处于青藏高原东缘,属于高寒温带湿润-半湿润季风气候,多年平均气温<1.0 ℃,最冷1月平均气温为−10.3 ℃,最热7月平均气温为10.9 ℃,年均降水量为690.0 mm,80%的降水发生在生长期(5—8月),年际波动较大[22]。草地类型为高寒草甸,土壤为高山草甸土。植被优势种是小嵩草Kobresia pygmaea、垂穗披碱草Elymus nutans和矮嵩草Kobresia humilis[23]。
-
高寒草甸生长季通常为每年5月初至9月底,当地夏季牧场放牧一般开始于7月,结束于9月。本研究选取禁牧3 a,生长状况良好且牲畜适口性高的草甸作为试验样地,开展不同采食强度的模拟试验。参照李晓刚等[24]和YAN等[25]的方法,本研究共设3个处理:未放牧(ck,不刈割),轻度采食(LD,刈割留茬3 cm),重度采食(HD,刈割留茬1 cm)。用剪刀刈割LD和HD小区的所有植被。因本试验不考虑地上凋落物分解的影响,在试验开展前将样地中未分解的凋落叶移出样地,刈割后的植物残体也移出样地。每个样地面积为2 m×2 m,间距1 m,每个处理重复4次,共12个样地。完全随机区组设计。模拟采食试验于2020年7月1日开始,之后每月1日刈割,到9月1日结束。土壤样品采集时间为每月刈割后的第7天,共采土样3次。在各样地随机选取5个土壤采样点,在0~10 cm土层,用土钻取土,混合得到1个样品,即每个处理每次采集土壤样品取得3个处理4次重复。去除样品中肉眼可见的植物残体,过2 mm筛后,将土样分为2份,一份置于−20 ℃保存用于测定土壤水解酶活性,另一份风干后用于测定土壤基本理化性质。
-
使用手持式土水仪(AZS-100,北京澳作生态仪器有限公司)测定采样时表层0~5 cm土壤含水量(SWC)和土壤温度(Ts)。用1 mol·L−1盐酸去除土壤样品中的无机碳[26],再用碳氮元素分析仪(vario MACRO cube)测定有机碳。土壤铵态氮(NH4 +-N)和硝态氮(NO3 −-N)均采用2 mol·L−1 盐酸浸提,采用靛酚蓝可见分光光度法测定铵态氮,采用氨基磺酸紫外分光光度法测定硝态氮,采用氯仿熏蒸法测土壤微生物量碳(MBC)和土壤微生物量氮(MBN)[27]。将土壤鲜样m(水)∶m(土)=5∶1以超纯水浸提,用TOC分析仪(Multi N/C 3100)测定土壤溶解性有机碳(DOC)和水溶性氮(WSN)。电极法测定土壤pH [m(水)∶m(土)=2.5∶1.0,pH酸度计]。
土壤酶活性的测定采用微孔板荧光法[28]。用荧光物质4-羟基甲-7-香豆素(4-methylumbelliferone,MUB)作为β-葡萄糖苷酶、β-木糖苷酶、纤维二糖水解酶、N-乙酰-β-D-氨基葡萄糖苷酶、酸性磷酸酶活性的标准对照物,用7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,MUC,AMC)作亮氨酸氨基肽酶标酶活性准对照物,具体步骤参考张海阔等[29]。将−20 ℃的土样置于4 ℃冰箱里放置5 d,取1.5 g鲜土,放入125 mL醋酸钠溶液中(pH为5.0),置于磁力搅拌器上均匀搅拌约1 min得到土壤浆液,用8通道移液器吸取200 μL土壤浆液置于96孔微孔板上的样品组,加上对应酶的反应底物50 μL,对照组分别为醋酸、标准对照物和特定底物,将加样微孔板放置于25 ℃的培养箱,培养3 h,迅速用酶标仪(Synergy H1)在365和 450 nm激发光下测定读数。用铵态氮释放法和靛酚蓝比色法测定脲酶活性[27]。用水浴加热比色法测定蔗糖酶活性[30]。
-
采用Excel 2019进行数据整理,用R 3.6.2进行数据正态检验(S—W 检验),对不正态的数据进行数据转换优化数据,进行单因素方差分析(one-way ANOVA)、双因素方差分析(two-way ANOVA)和最小显著差数法(LSD)分析,模拟采食强度和采样时间对土壤理化性质和土壤酶活性的影响,各指标均在0.05的水平下检测差异显著性。采用Pearson相关分析探索土壤水解酶和土壤理化性质的关系。用R语言中vegan数据包以土壤酶活性为响应变量,以土壤理化指标、微生物量碳和微生物量氮为环境因子进行冗余分析(RDA)。用Origin 9.0和Canoco 5.0作图。图表中的数据为平均值±标准误。
-
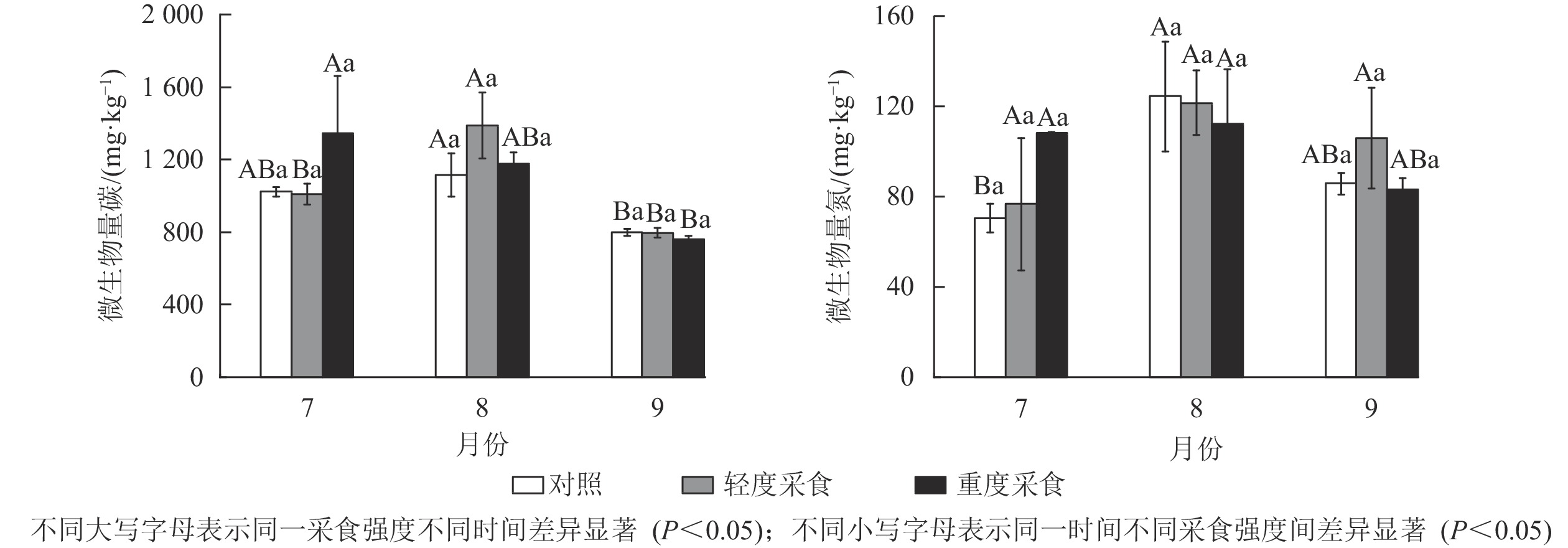
双因素方差分析显示:模拟采食对土壤溶解性有机碳和硝态氮有显著影响(P<0.05),但是这种影响在不同采样时间下存在显著差异(P<0.05)(表1和表2)。总体上,采食行为主要影响9月土壤的理化性质,并且会显著提高土壤溶解性有机碳和硝态氮的质量分数(P<0.05),不同采食强度对高寒草甸土壤有机碳质量分数有不同影响,LD处理显著提高土壤有机碳质量分数,而HD处理显著降低土壤有机碳质量分数(P<0.05);高寒草甸土壤温度、pH、有机碳、溶解性有机碳、铵态氮、全氮、水溶性氮和微生物量碳存在显著的时间波动,但是这些指标在不同采食强度下差异不显著,其中土壤有机碳、溶解性有机碳、硝态氮质量分数在采食强度和时间共同作用下存在显著交互效应(P<0.05)(表1、表2和图1)。
表 1 不同采样时间和采食强度下的土壤理化性质
Table 1. Soil physical and chemical properties under different defoliation intensity and sampling time
月份 采食
行为土壤含
水量/%土壤温
度/℃pH 土壤有机碳/
(g·kg−1)可溶性有机碳/
(mg·kg−1)铵态氮/
(mg·kg−1)硝态氮/
(mg·kg−1)全氮/
(g·kg−1)水溶性氮/
(mg·kg−1)7 ck 17.98±0.98 Aa 23.60±2.50 Aa 5.71±0.02 Ba 63.84±3.90 Ab 67.78±6.35 Aa 36.33±3.42 Aa 10.68±0.69 Ba 7.07±0.15 Aa 17.66±1.11 Aa LD 17.18±1.41 Ba 23.13±2.65 Aa 5.56±0.05 Ba 54.57±1.34 Cc 63.63±4.11 Ba 35.67±2.90 ABa 9.59±0.56 Ba 7.02±0.26 Aa 19.54±0.82 Ba HD 19.40±1.10 Aa 23.05±2.81 Aa 5.72±0.04 Aa 71.68±0.70 Aa 75.59±1.47 Aa 39.74±4.67 ABa 8.93±1.42 Ca 7.51±0.23 Aa 15.69±1.61 Ca 8 ck 19.18±0.63 Aa 18.20±1.22 ABa 5.81±0.03 Aa 70.14±2.73 Aa 53.45±6.51 Aab 16.37±1.14 Ba 14.54±2.60 Ba 6.26±0.15 Ba 32.17±3.87 Ba LD 15.90±1.07 Ba 18.13±0.89 ABa 5.82±0.03 Aa 71.35±2.39 Ba 46.10±3.75 Cb 27.37±2.23 Ba 13.90±1.52 Ba 6.27±0.14 Ba 33.83±1.99 Aa HD 18.35±1.28 Aa 18.33±0.78 ABa 5.73±0.03 Aa 73.14±1.54 Aa 68.53±6.35 Aa 22.36±6.03 BCa 10.87±1.76 Ba 6.09±0.11 Ba 33.82±3.66 Aa 9 ck 18.20±2.24 Aa 13.25±0.69 Ba 5.42±0.03 Ca 72.57±0.45 Ab 55.81±4.70 Ab 7.25±1.66 Ca 24.54±2.90 Ab 5.30±0.12 Cab 20.93±1.20 Ba LD 22.33±0.98 Aa 13.20±0.74 Ba 5.49±0.03 Ca 77.64±1.01 Aa 79.62±1.48 Aa 10.18±2.57 Ca 25.15±1.42 Aab 5.54±0.11 Ca 21.69±1.96 Ba HD 20.00±0.82 Aa 13.33±0.80 Ba 5.47±0.05 Ba 66.98±0.53 Bc 75.78±2.99 Aa 12.93±2.49 Ca 32.93±3.06 Aa 5.22±0.05 Cb 25.51±1.65 Ba 说明:不同大写字母表示同一采食强度不同时间差异显著(P<0.05);不同小写字母表示同一时间不同采食强度间差异显著(P<0.05) 表 2 双因素方差分析检验采食强度和采样时间对土壤理化性质的影响
Table 2. Two-way ANOVA of the effects of defoliation intensity and sampling time on soil physicochemical properties
因素 土壤含水量 土壤温度 pH 土壤有机碳 可溶性有机碳 铵态氮 硝态氮 全氮 水溶性氮 微生物量碳 微生物量氮 采食强度 0.404 0.003 0.175 1.511 7.711** 1.345 0.385 0.171 0.406 0.830 0.188 采样时间 3.131 24.117** 62.138** 19.465** 8.957** 38.195** 69.507** 101.126** 38.269** 9.595** 3.170 采食强度×采样时间 2.523 0.033 1.330 12.816** 4.009* 1.648 3.232* 2.104 0.863 1.864 0.873 说明:数值为方差分析的F值;*表示P<0.05;**表示P<0.01 -
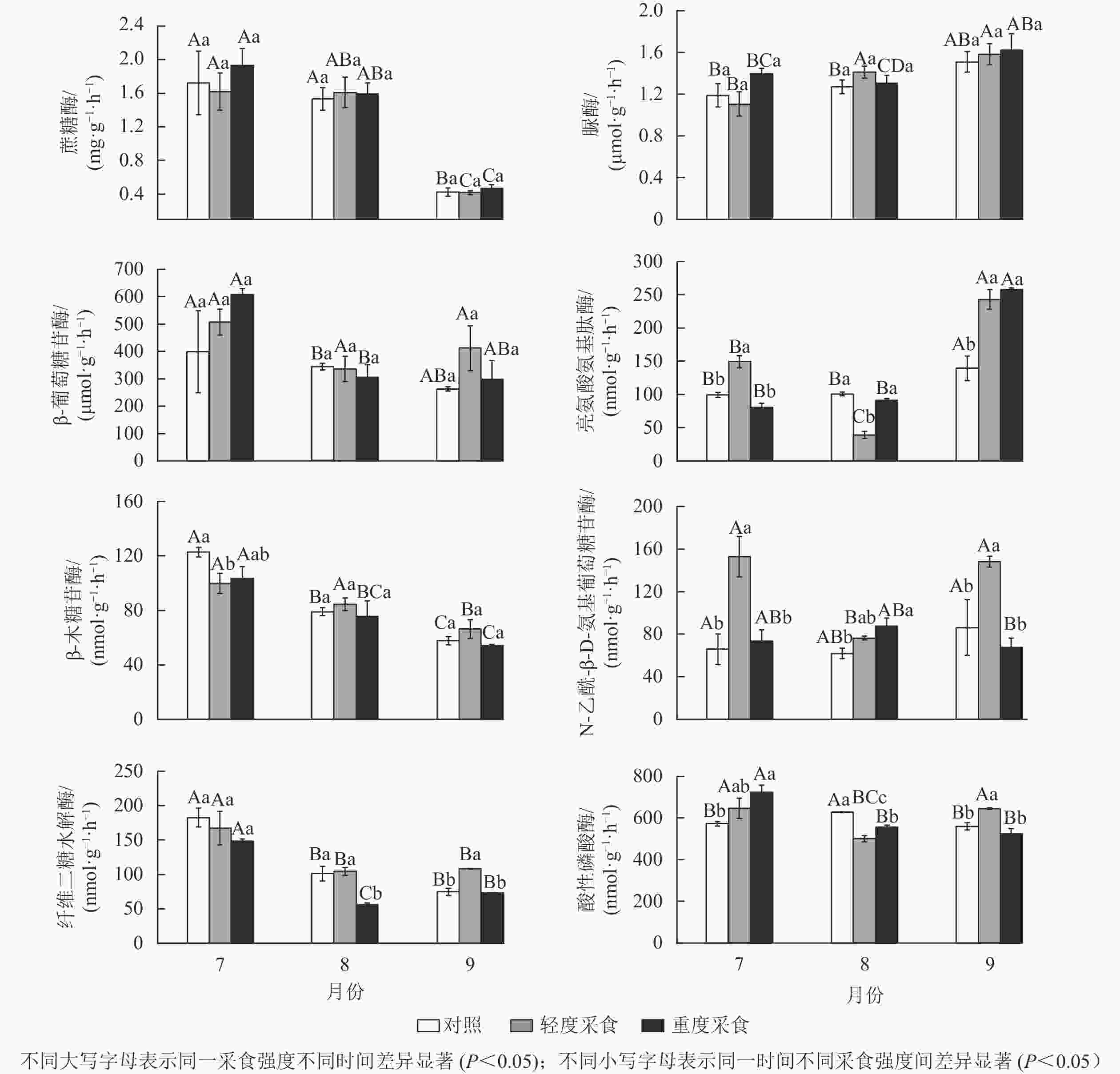
由表3和图2可以看出:土壤水解酶活性在不同采样时间下均存在显著的时间变异(P<0.05),并且采食强度对土壤碳获取水解酶纤维二糖水解酶和氮获取水解酶亮氨酸氨基肽酶、N-乙酰-β-D-氨基葡萄糖苷酶活性有显著影响(P<0.05)。其中:LD处理会增加碳获取纤维二糖水解酶的活性(9月)(P<0.05),而HD处理会降低碳获取酶纤维二糖水解酶的活性(8月)(P<0.05);采食行为(特别是LD处理)总体上会增加土壤氮获取酶亮氨酸氨基肽酶、N-乙酰-β-D-氨基葡萄糖苷酶以及磷获取酶酸性磷酸酶的活性(P<0.05)。
表 3 双因素方差分析检验采食强度和采样时间对土壤胞外酶活性的影响
Table 3. Two-way ANOVA of the effects of defoliation intensity and sampling time on soil extracellular enzyme activities
因素 蔗糖酶 β-葡萄糖苷酶 β-木糖苷酶 纤维二糖水解酶 脲酶 亮氨酸氨基肽酶 N-乙酰-β-D-氨基葡萄糖苷酶 酸性磷酸酶 采食强度 1.749 0.435 1.534 9.232** 1.108 12.470** 32.906** 0.324 采样时间 94.212** 24.420** 46.811** 59.608** 9.623** 358.530** 6.536** 11.718** 采食强度×采样时间 0.759 1.920 1.898 2.117 1.028 50.590** 8.497** 12.521** 说明:数值为方差分析的F值;**表示P<0.01 -
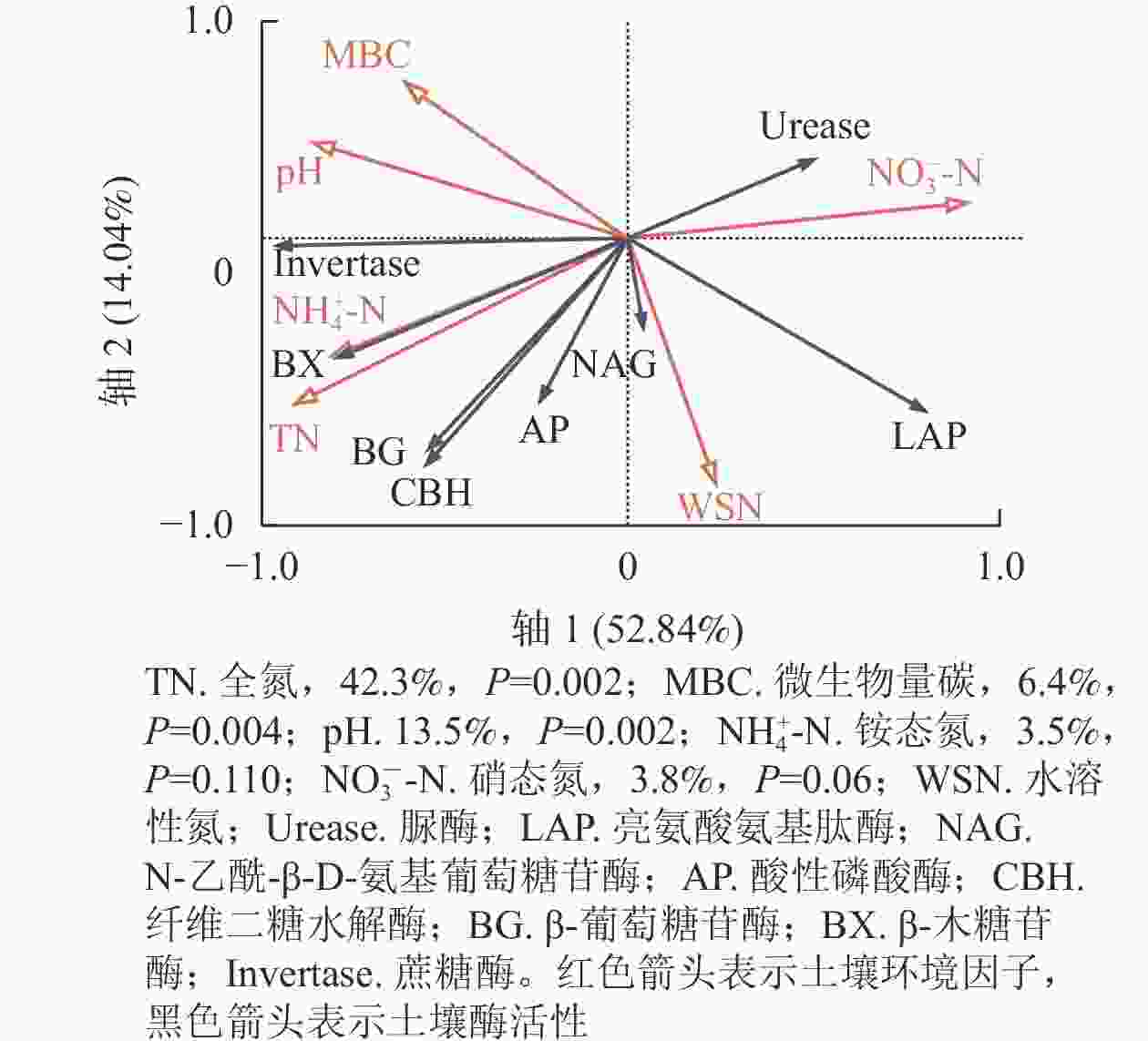
由表4可见:蔗糖酶活性与铵态氮、全氮、微生物量碳、土壤温度呈极显著正相关(P<0.01),与硝态氮呈极显著负相关(P<0.01)。β-葡萄糖苷酶活性与铵态氮、土壤温度呈显著正相关(P<0.05),与全氮呈极显著正相关(P<0.01),与水溶性氮呈显著负相关(P<0.05)。β-木糖苷酶活性与铵态氮、全氮、土壤温度呈极显著正相关(P<0.01),与硝态氮呈显著负相关(P<0.05)。纤维二糖水解酶活性与全氮呈极显著正相关(P<0.01),与水溶性氮呈极显著负相关(P<0.01)。亮氨酸氨基肽酶活性与全氮、土壤温度呈显著负相关(P<0.05),与pH、微生物量碳呈极显著负相关(P<0.01)。由图3中红色箭头表示土壤环境因子,黑色箭头表示土壤酶活性。可以看出:环境因子共同解释了土壤水解酶活性的66.88%,且全氮、pH、微生物量碳、硝态氮是解释度较高的4个环境因子,其中,全氮解释了土壤酶活性变异的42.3%,是土壤酶活性变化的最关键因子。整体来看,冗余分析同相关分析一致,全氮与大部分碳获取相关水解酶呈正相关。水溶性氮与所有碳、氮、磷获取相关的水解酶活性呈负相关。硝态氮与土壤碳获取水解酶活性呈负相关。微生物量碳与蔗糖酶活性呈正相关。
表 4 土壤水解酶活性和土壤环境因子的关系
Table 4. Correlations between soil hydrolytic enzyme activities and the environmental factors
土壤性质 蔗糖酶 β-葡萄糖苷酶 β-木糖苷酶 纤维二糖水解酶 亮氨酸氨基肽酶 硝态氮 −0.74** −0.32 −0.67** −0.38 0.38 铵态氮 0.74** 0.61* 0.63** 0.55 −0.52 全氮 0.79** 0.69** 0.83** 0.76** −0.59* pH 0.45 0.22 0.51 0.22 −0.72** 水溶性氮 −0.28 −0.58* −0.37 −0.64** 0.36 微生物量碳 0.64** 0.17 0.48 0.13 −0.80** 土壤温度 0.83** 0.61* 0.67** 0.47 −0.60* 说明:*表示P<0.05;**表示P<0.01 -
放牧是草地生态系统中一种典型的人为干扰,不仅会直接改变地表植被状况,还将影响诸多生物地球化学循环过程[31−33]。家畜采食是放牧行为中对草地影响面积最大、作用时间最长的放牧行为[12, 34]。目前,通常采用刈割来模拟家畜采食行为对草地生态系统的影响[16]。本研究发现:LD处理会显著增加纤维二糖水解酶、亮氨酸氨基肽酶、N-乙酰-β-D-氨基葡萄糖苷酶以及酸性磷酸酶的活性。类似的结果在以往研究中也有报道。例如,LIU等[21]研究发现:轻度采食(刈割)会增加高寒草甸土壤亮氨酸氨基肽酶和N-乙酰-β-D-氨基葡萄糖苷酶活性;HEWINS等[20]研究也表明:轻度采食(刈割)会提高加拿大天然草原土壤酸性磷酸酶的活性。家畜采食行为直接降低植物叶面积,导致光合效率的降低[35],进而造成地下根系分泌物量减少和根系的凋亡增加[36−37]。但这也可能会改变植物生长策略,例如将光合产物大部分转移到根部,产生更多的根系分泌物[21],进而促进土壤微生物分泌碳、氮、磷获取酶来降解土壤有机物质以获取养分。这可能就促使家畜采食植物后土壤水解酶活性恢复到采食前(补偿效应),甚至高于采食前(过度补偿效应)[31]。本研究表明:模拟采食处理下土壤溶解性有机碳和硝态氮质量分数会显著高于对照组处理,这进一步印证了采食(刈割)后的“过度补偿效应”。然而,在本研究中HD处理显著降低了土壤纤维二糖水解酶的活性,但增加了土壤氮获取酶亮氨酸氨基肽酶的活性。LIU等[21]和HEWINS等[20]结果显示:重度采食(刈割)会降低土壤纤维二糖水解酶活性。当家畜采食超过一定的限度时,植物的地上组织被大量移除,这会导致植物根部大量凋亡[21],减少根系分泌物的产生,进而抑制土壤碳获取水解酶纤维二糖水解酶的活性[38]。土壤水解酶活性由土壤底物浓度和土壤水解酶共同决定的[5],当全氮质量分数充足时,全氮质量分数与氮获取水解酶活性没有相关性[39];而当全氮质量分数降低时,会激发土壤氮获取酶活性[5]。本研究中,全氮是影响土壤酶活性的关键因子之一,HD处理会显著降低9月份土壤全氮质量分数。可能是家畜重度采食后牧草再生长会吸收大量土壤氮素,造成全氮降低,进而促进土壤氮获取水解酶亮氨酸氨基肽酶的活性[18]。此外,由于重度采食后地表裸露程度增加,青藏高原地区的极端气候以及高紫外辐射也可能会显著降低土壤的水解酶活性[31, 40−41]。
本研究发现:在同一模拟采食处理下,土壤水解酶活性存在显著的时间变异。总体上,碳获取酶蔗糖酶、β-葡萄糖苷酶、β-木糖苷酶和纤维素酶活性呈现7月最高、9月最低。土壤温度是高海拔地区控制土壤酶活性时间变化的关键因子。例如,D’ALÒ等[42]研究发现高海拔地区温度升高会显著促进土壤纤维素活性。本研究中,土壤碳获取酶总体上和土壤温度呈显著正相关。因此,高寒草甸土壤碳获取酶主要受7、8、9月气温的递减影响而表现出酶活性递减的时间性变异。而高寒草甸土壤氮获取酶的时间变异表现为随月份递增。这可能是因为7—9月高寒草甸的大部分牧草主要进行生殖生长,该过程需要消耗土壤氮素[43],引起土壤氮养分(硝态氮和全氮)降低,激发土壤氮获取酶的活性,以分解释放有机质中的氮养分[39, 44]。
-
青藏高原东缘高寒草甸夏季牧场家畜采食行为会对土壤水解酶产生显著影响,其中,轻度采食行为增加纤维素酶、亮氨酸氨基肽酶、N-乙酰-β-D氨基葡萄糖苷酶以及酸性磷酸酶的活性,而重度采食会降低纤维素酶活性、增加亮氨酸氨基肽酶活性;土壤碳获取酶、氮获取酶、磷获取酶都表现出时间性变异,其中碳获取酶的活性主要受土壤温度的影响,而氮获取酶主要受土壤全氮质量分数的影响。本研究表明:轻度采食行为可能会提高土壤水解酶活性,有助于维持高寒草甸土壤质量。
Responses of soil enzyme activities to different defoliation intensities in alpine meadow
-
摘要:
目的 探究家畜采食对高寒草甸土壤酶活性的影响,为揭示人为干扰下高寒草甸的退化机制提供依据。 方法 用刈割留茬模拟家畜轻度采食(LD)和重度采食(HD)行为,以未放牧的草地为对照(ck),测定土壤碳、氮、磷获取的酶活性以及土壤理化性质变化特征。 结果 总体上,土壤碳获取酶土壤蔗糖酶、β-葡萄糖苷酶和土壤氮获取酶脲酶的活性在不同采食强度下不存在显著差异,但呈现明显的时间变异; LD处理可显著提高纤维素二糖水解酶活性(P<0.05),而HD处理能降低纤维素二糖水解酶活性;LD处理也会提高氮获取酶亮氨酸氨基肽酶、N-乙酰-β-D-氨基葡萄糖苷酶以及磷获取酸性磷酸酶的活性;家畜的采食行为可能通过改变土壤养分来影响土壤酶活性;高寒草甸土壤酶活性的时间变异受控于土壤温度和土壤养分的变化。 结论 轻度采食行为可能会提高土壤水解酶活性,有助于维持土壤质量。图3表4参44 Abstract:Objective This study aims to investigate the effects of livestock defoliation on soil enzyme activities of alpine meadow, so as to provide evidence for revealing the degradation mechanisms of alpine meadow under human disturbance. Method Livestock defoliation behaviors, including light-intensity defoliation (LD) and heavy-intensity defoliation (HD) were simulated by cutting plants, and the non-grazed meadow was taken as the control (ck). The activity of enzymes obtained by carbon, nitrogen, and phosphorus, as well as the change characteristics of soil physical and chemical properties were measured. Result Generally, the activities of invertase, β-glucosidase (BG), and urease did not show any significant differences under different defoliation intensities, but there was significant time variation. The activity of cellobiohydrolase (CBH) increased in LD treatment (P<0.05), while it decreased in HD treatment. LD treatment also enhanced the activities of leucine aminopeptidase (LAP), N-acetyl-beta-D-glucosaminidase (NAG) and acid phosphatase (AP). Defoliation behavior of livestock might affect soil enzyme activity by changing soil nutrients. The temporal variation of soil enzyme activity in alpine meadow was controlled by the changes of soil temperature and soil nutrients. Conclusion Mild defoliation behavior may increase soil hydrolase activities, which helps maintain soil quality. [Ch, 3 fig. 4 tab. 44 ref.] -
Key words:
- grazing /
- defoliation /
- soil hydrolase /
- alpine meadow
-
表 1 不同采样时间和采食强度下的土壤理化性质
Table 1. Soil physical and chemical properties under different defoliation intensity and sampling time
月份 采食
行为土壤含
水量/%土壤温
度/℃pH 土壤有机碳/
(g·kg−1)可溶性有机碳/
(mg·kg−1)铵态氮/
(mg·kg−1)硝态氮/
(mg·kg−1)全氮/
(g·kg−1)水溶性氮/
(mg·kg−1)7 ck 17.98±0.98 Aa 23.60±2.50 Aa 5.71±0.02 Ba 63.84±3.90 Ab 67.78±6.35 Aa 36.33±3.42 Aa 10.68±0.69 Ba 7.07±0.15 Aa 17.66±1.11 Aa LD 17.18±1.41 Ba 23.13±2.65 Aa 5.56±0.05 Ba 54.57±1.34 Cc 63.63±4.11 Ba 35.67±2.90 ABa 9.59±0.56 Ba 7.02±0.26 Aa 19.54±0.82 Ba HD 19.40±1.10 Aa 23.05±2.81 Aa 5.72±0.04 Aa 71.68±0.70 Aa 75.59±1.47 Aa 39.74±4.67 ABa 8.93±1.42 Ca 7.51±0.23 Aa 15.69±1.61 Ca 8 ck 19.18±0.63 Aa 18.20±1.22 ABa 5.81±0.03 Aa 70.14±2.73 Aa 53.45±6.51 Aab 16.37±1.14 Ba 14.54±2.60 Ba 6.26±0.15 Ba 32.17±3.87 Ba LD 15.90±1.07 Ba 18.13±0.89 ABa 5.82±0.03 Aa 71.35±2.39 Ba 46.10±3.75 Cb 27.37±2.23 Ba 13.90±1.52 Ba 6.27±0.14 Ba 33.83±1.99 Aa HD 18.35±1.28 Aa 18.33±0.78 ABa 5.73±0.03 Aa 73.14±1.54 Aa 68.53±6.35 Aa 22.36±6.03 BCa 10.87±1.76 Ba 6.09±0.11 Ba 33.82±3.66 Aa 9 ck 18.20±2.24 Aa 13.25±0.69 Ba 5.42±0.03 Ca 72.57±0.45 Ab 55.81±4.70 Ab 7.25±1.66 Ca 24.54±2.90 Ab 5.30±0.12 Cab 20.93±1.20 Ba LD 22.33±0.98 Aa 13.20±0.74 Ba 5.49±0.03 Ca 77.64±1.01 Aa 79.62±1.48 Aa 10.18±2.57 Ca 25.15±1.42 Aab 5.54±0.11 Ca 21.69±1.96 Ba HD 20.00±0.82 Aa 13.33±0.80 Ba 5.47±0.05 Ba 66.98±0.53 Bc 75.78±2.99 Aa 12.93±2.49 Ca 32.93±3.06 Aa 5.22±0.05 Cb 25.51±1.65 Ba 说明:不同大写字母表示同一采食强度不同时间差异显著(P<0.05);不同小写字母表示同一时间不同采食强度间差异显著(P<0.05) 表 2 双因素方差分析检验采食强度和采样时间对土壤理化性质的影响
Table 2. Two-way ANOVA of the effects of defoliation intensity and sampling time on soil physicochemical properties
因素 土壤含水量 土壤温度 pH 土壤有机碳 可溶性有机碳 铵态氮 硝态氮 全氮 水溶性氮 微生物量碳 微生物量氮 采食强度 0.404 0.003 0.175 1.511 7.711** 1.345 0.385 0.171 0.406 0.830 0.188 采样时间 3.131 24.117** 62.138** 19.465** 8.957** 38.195** 69.507** 101.126** 38.269** 9.595** 3.170 采食强度×采样时间 2.523 0.033 1.330 12.816** 4.009* 1.648 3.232* 2.104 0.863 1.864 0.873 说明:数值为方差分析的F值;*表示P<0.05;**表示P<0.01 表 3 双因素方差分析检验采食强度和采样时间对土壤胞外酶活性的影响
Table 3. Two-way ANOVA of the effects of defoliation intensity and sampling time on soil extracellular enzyme activities
因素 蔗糖酶 β-葡萄糖苷酶 β-木糖苷酶 纤维二糖水解酶 脲酶 亮氨酸氨基肽酶 N-乙酰-β-D-氨基葡萄糖苷酶 酸性磷酸酶 采食强度 1.749 0.435 1.534 9.232** 1.108 12.470** 32.906** 0.324 采样时间 94.212** 24.420** 46.811** 59.608** 9.623** 358.530** 6.536** 11.718** 采食强度×采样时间 0.759 1.920 1.898 2.117 1.028 50.590** 8.497** 12.521** 说明:数值为方差分析的F值;**表示P<0.01 表 4 土壤水解酶活性和土壤环境因子的关系
Table 4. Correlations between soil hydrolytic enzyme activities and the environmental factors
土壤性质 蔗糖酶 β-葡萄糖苷酶 β-木糖苷酶 纤维二糖水解酶 亮氨酸氨基肽酶 硝态氮 −0.74** −0.32 −0.67** −0.38 0.38 铵态氮 0.74** 0.61* 0.63** 0.55 −0.52 全氮 0.79** 0.69** 0.83** 0.76** −0.59* pH 0.45 0.22 0.51 0.22 −0.72** 水溶性氮 −0.28 −0.58* −0.37 −0.64** 0.36 微生物量碳 0.64** 0.17 0.48 0.13 −0.80** 土壤温度 0.83** 0.61* 0.67** 0.47 −0.60* 说明:*表示P<0.05;**表示P<0.01 -
[1] CAO Guangmin, TANG Yanhong, MO Wenhong, et al. Grazing intensity alters soil respiration in an alpine meadow on the Tibetan plateau [J]. Soil Biology &Biochemistry, 2004, 36(2): 237 − 243. [2] LONG Ruijun, SHANG Zhanhua, GUO Xusheng, et al. The yak grazing system on the Qinghai-Tibetan plateau and its status [J]. The Rangeland Journal, 2008, 30(2): 241 − 246. [3] DONG Shikui, SHANG Zhanhuan, GAO Jixi, et al. Enhancing sustainability of grassland ecosystems through ecological restoration and grazing management in an era of climate change on Qinghai-Tibetan Plateau [J]. Agriculture,Ecosystems &Environment, 2020, 287(10): 66 − 84. [4] 向泽宇, 王长庭, 宋文彪, 等. 草地生态系统土壤酶活性研究进展[J]. 草业科学, 2011, 28(10): 1801 − 1806. XIANG Zeyu, WANG Changting, SONG Wenbiao, et al. Advance on soil activities in grassland ecosystem [J]. Pratacultural Science, 2011, 28(10): 1801 − 1806. [5] BURNS R G, DEFOREST J L, MARXSEN J, et al. Soil enzymes in a changing environment: current knowledge and future directions [J]. Soil Biology and Biochemistry, 2013, 58(2): 216 − 234. [6] GAVRICHKOVA O, MOSCATELLI M C, KUZYAKOV Y, et al. Influence of defoliation on CO2 efflux from soil and microbial activity in a Mediterranean grassland [J]. Agriculture,Ecosystems &Environment, 2010, 136(1): 87 − 96. [7] 张洪芹, 臧晓琳, 蔡宙霏, 等. 放牧对冷蒿根际微生物区系及土壤酶活性的影响[J]. 浙江农林大学学报, 2017, 34(4): 679 − 686. ZHANG Hongqin, ZANG Xiaolin, CAI Zhoufei, et al. Effects of grazing intensity on soil microbial flora and soil enzyme activities in the Artemisia frigida rhizosphere [J]. Journal of Zhejiang A&F University, 2017, 34(4): 679 − 686. [8] 刘肖肖, 戴伟, 戴奥娜. 北京山地4种阔叶林土壤酶活性及动力学特征[J]. 浙江农林大学学报, 2018, 35(5): 794 − 801. LIU Xiaoxiao, DAI Wei, DAI Aona. Soil enzyme activity and their kinetics in broadleaf forests of Beijing mountainous areas [J]. Journal of Zhejiang A&F University, 2018, 35(5): 794 − 801. [9] CENINI V L, FORNARA D A, MCMULLAN G, et al. Chronic nitrogen fertilization and carbon sequestration in grassland soils: evidence of a microbial enzyme link [J]. Biogeochemistry, 2015, 126(3): 301 − 313. [10] KONG Ling, CHU L M. Subtropical urban turfs: carbon and nitrogen pools and the role of enzyme activity [J]. Journal of Environmental Sciences, 2018, 65: 18 − 28. [11] ZHOU Xiaoqi, CHEN Chengrong, WANG Yanfen, et al. Warming and increased precipitation have differential effects on soil extracellular enzyme activities in a temperate grassland [J]. Science of the Total Environment, 2013, 444: 552 − 558. [12] 刘发央, 龙瑞军. 不同放牧强度对牦牛夏季放牧行为的影响[J]. 兰州大学学报(自然科学版), 2009, 45(2): 55 − 60. LIU Fayang, LONG Ruijun. Effect of different grazing intensities on grazing behavior of yak in summer [J]. Journal of Lanzhou University (Natural Sciences), 2009, 45(2): 55 − 60. [13] 和占星, 黄梅芬, 雷波, 等. 中国牦牛的生态行为研究进展[J]. 家畜生态学报, 2019, 40(4): 1 − 9. HE Zhanxing, HUANG Meifen, LEI Bo, et al. Research progress on ecological behavior of Chinese yaks [J]. Acta Ecologiae Animalis Domastici, 2019, 40(4): 1 − 9. [14] 孟庆辉, 陈永杏, 白加德, 等. 放牧条件下白牦牛采食的季节性微调整及其效应[J]. 农业工程学报, 2016, 32(18): 219 − 224. MENG Qinghui, CHEN Yongxing, BAI Jiade, et al. Seasonal subtle alternation of yak foraging and its effect under pasturing condition [J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(18): 219 − 224. [15] LI Chengyi, YANG Yuanwu, LI Xilai, et al. Effects of simulated climate warming and grazing on photosynthesis and respiration of permafrost meadow plant community [J]. Russian Journal of Ecology, 2020, 51(3): 224 − 232. [16] SKINNER R H, GOSLEE S C. Defoliation effects on pasture photosynthesis and respiration [J]. Crop Science, 2016, 56(4): 2045 − 53. [17] 张超, 闫瑞瑞, 梁庆伟, 等. 不同利用方式下草地土壤理化性质及碳、氮固持研究[J]. 草业学报, 2021, 30(4): 90 − 98. ZHANG Chao, YAN Ruirui, LIANG Qingwei, et al. Study on soil physical and chemical properties and carbon and nitrogen sequestration of grassland under different utilization modes [J]. Acta Prataculturae Sinica, 2021, 30(4): 90 − 98. [18] GILMULLINA A, RUMPEL C, BLAGODATSKAYA E, et al. Management of grasslands by mowing versus grazing-impacts on soil organic matter quality and microbial functioning [J/OL]. Applied Soil Ecology, 2020, 156: 103701[2022-03-10]. doi: 10.1016/j.apsoil.2020.103701. [19] WANG Ruzhen, WU Hui, SARDANS J, et al. Carbon storage and plant-soil linkages among soil aggregates as affected by nitrogen enrichment and mowing management in a meadow grassland [J]. Plant and Soil, 2020, 457(1/2): 407 − 420. [20] HEWINS D B, BROADBENT T, CARLYLE C N, et al. Extracellular enzyme activity response to defoliation and water addition in two ecosites of the mixed grass prairie [J]. Agriculture Ecosystems &Environment, 2016, 230: 79 − 86. [21] LIU Weilong, JIANG Yonglei, WANG Genxu, et al. Effects of N addition and clipping on above and belowground plant biomass, soil microbial community structure, and function in an alpine meadow on the Qinghai-Tibetan Plateau [J/OL]. European Journal of Soil Biology, 2021, 106: 103344[2022-03-10]. doi: 10.1016/j.ejsobi.2021.103344. [22] SHI Changguang, SILVA L C R, ZHANG Hongxuan, et al. Climate warming alters nitrogen dynamics and total non-structural carbohydrate accumulations of perennial herbs of distinctive functional groups during the plant senescence in autumn in an alpine meadow of the Tibetan Plateau, China [J]. Agricultural and Forest Meteorology, 2015, 200: 21 − 29. [23] MIPAM T D, ZHONG Linling, LIU Jianquan, et al. Productive overcompensation of alpine meadows in response to yak grazing in the eastern Qinghai-Tibet Plateau [J/OL]. Frontiers in Plant Science, 2019, 10: 925[2022-03-10]. doi: 10.3389/fpls.2019.00925. [24] 李晓刚, 朱志红, 周晓松, 等. 刈割、施肥和浇水对高寒草甸物种多样性、功能多样性与初级生产力关系的影响[J]. 植物生态学报, 2011, 35(11): 1136 − 1147. LI Xiaogang, ZHU Zhihong, ZHOU Xiaosong, et al. Effects of clipping, fertilizing and watering on the relationship between species diversity, functional diversity and primary productivity in alpine meadow of China [J]. Chinese Journal of Plant Ecology, 2011, 35(11): 1136 − 1147. [25] YAN Yingjie, QUAN Quan, MENG Cheng, et al. Varying soil respiration under long-term warming and clipping due to shifting carbon allocation toward below-ground[J/OL]. Agricultural and Forest Meteorology, 2021, 304: 108408[2022-03-10]. doi: 10.1016/j.agrformet.2021.108408. [26] BLAIR G, LEFROY R, LISLE L. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems [J]. Australian Journal of Agricultural Research, 1995, 46(7): 1459 − 1466. [27] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2005. BAO Shidan. Soil Agrochemical Analysis [M]. Beijing: China Agricultural Press, 2005. [28] FRANKENBERGER W T, JOHANSON J B. Factors affecting invertase activity in soils [J]. Plant and Soil, 1983, 74(3): 313 − 323. [29] 张海阔, 张宝刚, 周钟昱, 等. 亚热带天然林转变为毛竹林和茶园对土壤胞外酶活性的影响[J]. 农业环境科学学报, 2022, 41(4): 826 − 833. ZHANG Haikuo, ZHANG Baogang, ZHOU Zhongyu. Effects of converting natural forests to moso bamboo and tea plantations on soil extracellular enzyme activity in subtropical China [J]. Journal of Agro-Environment Science, 2022, 41(4): 826 − 833. [30] 吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2011. WU Jinshui, LIN Qimei, HUANG Qiaoyun, et al. Soil Microbial Biomass Measurement Method and its Application[M]. Beijing: China Meteorological Press, 2011. [31] SUN Geng, ZHUBARKER X, CHEN Dongming, et al. Responses of root exudation and nutrient cycling to grazing intensities and recovery practices in an alpine meadow: an implication for pasture management [J]. Plant and Soil, 2017, 416(1/2): 515 − 525. [32] RUI Yichao, WANG Yanfen, CHEN Chengrong, et al. Warming and grazing increase mineralization of organic P in an alpine meadow ecosystem of Qinghai-Tibet Plateau, China [J]. Plant and Soil, 2012, 357(1/2): 73 − 87. [33] 焦婷, 常根柱, 周学辉, 等. 高寒草甸草场不同载畜量下土壤酶与土壤肥力的关系研究[J]. 草业学报, 2009, 18(6): 98 − 104. JIAO Ting, CHANG Genzhu, ZHOU Xuehui, et al. Study on relationship between soil enzyme and soil fertility of alpine meadow in different carrying capacities [J]. Acta Prataculturae Sinica, 2009, 18(6): 98 − 104. [34] XIAO Xiang, ZHANG Tao, ANGERER J P, et al. Grazing seasons and stocking rates affects the relationship between herbage traits of alpine meadow and grazing behaviors of Tibetan Sheep in the Qinghai-Tibetan Plateau[J/OL]. Animals, 2020, 10(3): 488[2022-03-10]. doi: 10.3390/ani10030488. [35] ROLINSKI S, MÜLLER C, HEINKE J, et al. Modeling vegetation and carbon dynamics of managed grasslands at the global scale with LPJmL 3.6 [J]. Geoscientific Model Development, 2018, 11(1): 429 − 451. [36] ORGILL S E, CONDON J R, CONYERS M K, et al. Removing grazing pressure from a native pasture decreases soil organic carbon in Southern New South Wales, Australia [J]. Land Degradation &Development, 2016, 29(2): 274 − 283. [37] ZITER C, MACDOUGALL A S. Nutrients and defoliation increase soil carbon inputs in grassland [J]. Ecology, 2013, 94(1): 106 − 116. [38] LI Jianye, ZHANG Qichun, LI Yong, et al. Effects of long-term mowing on the fractions and chemical composition of soil organic matter in a semiarid grassland [J]. Biogeosciences, 2017, 14(10): 2685 − 2696. [39] JIAN Siyang, LI Jianwei, CHEN Ji, et al. Soil extracellular enzyme activities, soil carbon and nitrogen storage under nitrogen fertilization: a meta-analysis [J]. Soil Biology and Biochemistry, 2016, 101: 32 − 43. [40] 吴芳芳, 郑有飞, 吴荣军, 等. 太阳辐射减弱麦田根际土壤酶与有效微量元素的相关性分析[J]. 生态环境学报, 2012, 21(4): 595 − 600. WU Fangfang, ZHENG Youfei, WU Rongjun, et al. Correlative research on rhizosphere soil enzyme activities and available trace elements under reduced solar irradiance [J]. Ecology and Environmental Sciences, 2012, 21(4): 595 − 600. [41] SUN Jian, LIU Biying, YOU Yong, et al. Solar radiation regulates the leaf nitrogen and phosphorus stoichiometry across alpine meadows of the Tibetan Plateau [J]. Agricultural and Forest Meteorology, 2019, 271: 92 − 101. [42] D’ALÒ F, ODRIOZOLA I, BALDRIAN P, et al. Microbial activity in alpine soils under climate change[J/OL]. Science of the Total Environment, 2021, 783: 147012[2022-03-10]. doi: 10.1016/j.scitotenv.2021.147012. [43] ZHANG Zhilong, NIU Kechang, LIU Xudong, et al. Linking flowering and reproductive allocation in response to nitrogen addition in an alpine meadow [J]. Journal of Plant Ecology, 2013, 7(3): 231 − 239. [44] ZHU Yuanjun, DELGADO-BAQUERIZO M, SHAN Dan, et al. Grazing impacts on ecosystem functions exceed those from mowing [J]. Plant and Soil, 2021, 464(1/2): 579 − 591. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220281






 下载:
下载: