-
干旱作为植物重要的非生物胁迫之一,是全球面临的重大环境问题,严重影响植物的生长、发育和生存[1]。植物会通过形态、生理生化、光合作用及分子水平等层次的响应抵御干旱胁迫[2−9]。植物受干旱胁迫伤害时,脂膜过氧化导致丙二醛(MDA)积累,使蛋白质和核酸变性,导致膜流动性降低,膜透性增强,因此MDA的多少可衡量植物细胞受伤害的程度[10];活性氧保护酶过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)协同作用可有效清除植物体内过多的自由基,从而维持植物体内活性氧代谢系统的平衡[11−12];植物还会积累可溶性糖等渗透调节物质以提高细胞保水能力,从而维持细胞的正常生理过程来响应干旱胁迫[13−15];干旱胁迫还能破坏植物水分代谢,导致叶绿素分解,影响光能电子传递和转换、光合磷酸化及暗反应等过程,使植物光合速率下降,严重时还可导致叶绿体光合机构的破坏,对植物体造成不可逆影响。叶绿素荧光参数对干旱胁迫的响应非常灵敏,可作为监测光合作用过程中光能的吸收、传递、耗散和分配的指标,判断植物干旱胁迫的程度;董斌等[16]利用叶绿素荧光检测油茶Camellia oleifera的干旱抗性,选育出抗干旱的油茶品种。
植物根系利用细胞水势低于土壤水势的原理进行吸水,聚乙二醇6000(PEG 6000)可降低溶液水势,根系不易从周围吸收水分,从而造成干旱胁迫[17]。已有学者[18−19]利用不同质量分数PEG 6000模拟不同程度的干旱胁迫对小麦Triticum aestvum和玉米Zea mays的影响。铁皮石斛Dendrobium candidum是兰科Orchidaceae多年生草本植物,兼具很高的药用和观赏价值,分布于中国安徽、浙江、福建等地[20−21]。目前,已将铁皮石斛野生资源成功进行驯化和人工移栽,实现了铁皮石斛的大面积规模化产业种植和近野生栽培,不仅提高了铁皮石斛的经济价值,还推动中国中药材产业的可持续发展[22]。在铁皮石斛产业化种植和近野生栽培过程中,水分是一个重要的限制性生态因子,因缺水引起的干旱严重影响铁皮石斛的产量和品质,因此了解干旱胁迫下铁皮石斛生理生化和叶绿素荧光参数的变化特征,对研究铁皮石斛耐干旱机制及铁皮石斛的近野生栽培意义重大。近年来,已有关于干旱对铁皮石斛的生长和生理特性变化的报道。阮凌暄等[23]研究发现:随着PEG 6000模拟干旱胁迫时间的延长和胁迫强度的增加,3年生盆栽铁皮石斛叶片活性氧积累呈上升趋势,保护酶POD和SOD活性先增加后降低,第8天时达到最大值,叶片叶绿素最大荧光(Fm)、最大光化学效率(Fv/Fm)和光化学猝灭系数(qp)逐渐降低,光反应能力降低。吕朝燕等[24]研究指出:3年生盆栽铁皮石斛叶片净光合速率和气孔导度随干旱胁迫时间的延长呈先升高后降低的趋势,而胞间二氧化碳 (CO2)摩尔分数和蒸腾速率则相反,呈先降低再升高的趋势,认为铁皮石斛为干旱避免型植物。为进一步探讨铁皮石斛抵抗干旱胁迫的生理特性,本研究拟通过不同质量分数PEG 6000模拟干旱胁迫,对铁皮石斛幼苗MDA、可溶性糖和可溶性蛋白、POD、CAT等生理生化指标和叶绿素质量分数、叶绿素荧光参数等进行分析,探讨铁皮石斛幼苗抗旱的生理和叶绿素荧光特性,以期为铁皮石斛的品种选育及产业化栽培和近野生栽培技术的建立提供参考。
-
试验材料铁皮石斛‘晶品1号’D. candidum ‘Jingpin No. 1’幼苗于光照1500~3000 lx和(25±2) ℃的植物组织培养室培养60 d,每天光照和黑暗时间分别为14 h和10 h。
-
在MS液体培养基中添加不同质量分数PEG 6000(5%、10%、20%、30%)模拟干旱胁迫,以不含PEG 6000 的MS液体培养基为对照(ck)[25]。选择长势良好,生长较一致的‘晶品1号’幼苗,接种于不同质量分数PEG 6000的培养液中进行培养,光照1500~3000 lx,每天光照和黑暗时间分别为 14 h和10 h,培养温度(25±2) ℃,每个处理60株,处理后每隔2 d定时取5株植株叶片和茎段观察细胞学结构(分别记为D2、D4、D6、D8、D10和D12);取5株混合样测定铁皮石斛幼苗的MDA、POD、CAT、可溶性糖、可溶性蛋白和叶绿素等各项生理生化指标,选择5株植株测定叶片的叶绿素各荧光参数。每个处理3个生物学重复。
-
采用琼脂糖包埋法对铁皮石斛‘晶品1号’茎段和叶片进行固定。具体做法为:试验当天将新鲜茎段和叶片样品置于磷酸盐(PBS)缓冲溶液(pH 7.4)中,配制质量分数为5%琼脂糖凝胶,待凝胶温度为50~60 ℃时,将新鲜茎段和叶片置于凝胶中,于室温冷却至凝胶凝固,完成样品的固定;将固定好的茎段和叶片置于震荡切片机上进行横切,切片厚度为50~100 μm,切好的茎段和叶片横切片置于载玻片上,滴加1滴PBS缓冲液(pH 7.4),盖上盖玻片,于莱卡荧光显微镜(Leica DM-4000)下观察茎段和叶片的细胞结构变化,并拍照记录[26]。
-
采用硫代巴比妥酸法(TBA法)测定丙二醛(MDA)质量摩尔浓度[27−28];采用愈创木酚法测定POD酶活性;紫外分光光度法的CAT活性测定[11];蒽酮法测定茎段的可溶性糖质量分数[29];考马斯亮蓝比色法测定可溶性蛋白质量分数[30]。
-
用紫外分光度法测定叶片的叶绿素质量分数[31]。分别取不同处理‘晶品1号’幼苗叶片,去叶脉叶缘,剪碎叶片,将0.1 g新鲜叶片放入10 mL离心管,加入8 mL体积分数为95% 乙醇提取液,避光浸提 24 h后,测定波长 663、645和470 nm处吸光度,并计算叶绿素质量分数。
-
采用便携式调制叶绿素荧光仪(PAM-2500),于9:00—11:00,选择从上往下数的第3片叶子,先用暗适应夹夹住叶片暗适应20 min,然后开始测定不同质量分数PEG 6000处理的铁皮石斛‘晶品1号’幼苗叶片的电子传递速率(ETR)、qP、光合效率(α)、非化学猝灭系数(qNP)和Fv/Fm等叶绿素荧光参数。每个处理测定5株,每株测定3次,取平均值。
-
通过Excel 2018 整理所有原始数据,Graphpad 8.0作图,SPSS 20 进行方差分析,并采用单因素方差分析法和新复极差法对数据进行差异性分析和显著性比较,误差线用标准差表示。显著性水平为0.05。
-
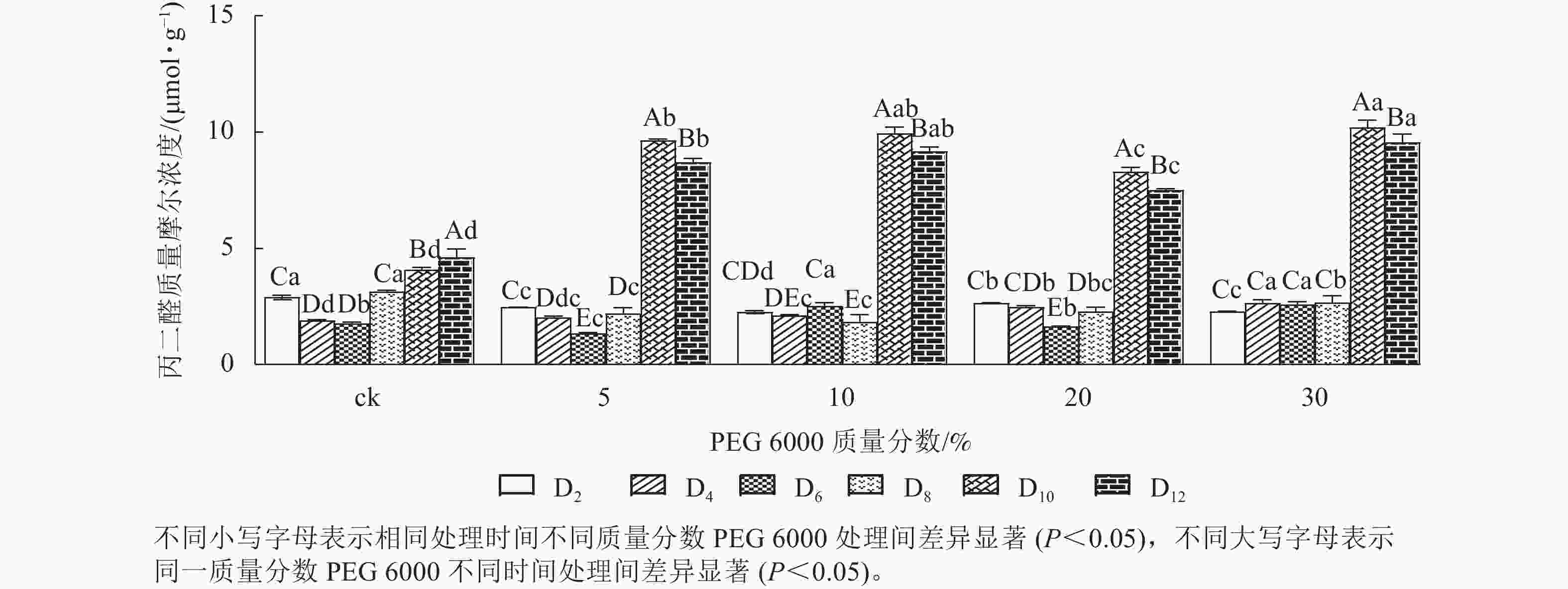
PEG 6000模拟干旱胁迫处理不同时间对铁皮石斛幼苗丙二醛质量摩尔浓度的影响差异显著(P<0.05)。不同质量分数PEG 6000模拟干旱胁迫处理2~8 d时的铁皮石斛幼苗茎段丙二醛比较稳定,说明短时间(≤8 d)的不同质量分数PEG 6000模拟干旱胁迫处理对铁皮石斛细胞膜的影响较小,而到第8天时丙二醛急剧上升,到第10天时达最大值,比同期ck组分别增加2.36 (5% PEG 6000)、2.43 (10% PEG 6000)、2.03 (20% PEG 6000)和2.50倍 (30% PEG 6000)(图1),说明不同质量分数PEG 6000模拟干旱胁迫对铁皮石斛幼苗细胞膜造成不同程度的伤害,PEG 6000质量分数越高(30%)对铁皮石斛细胞膜的伤害越大,抵御干旱的能力下降。
-
PEG 6000模拟干旱胁迫处理不同时间对铁皮石斛幼苗CAT和POD活性的影响差异显著(P<0.05)。由图2A可以看出:铁皮石斛幼苗CAT活性随着不同质量分数PEG 6000处理时间的延长呈先上升后下降的趋势,且在处理10 d时CAT活性达到最高值,12 d时CAT活性下降(图2A);铁皮石斛幼苗CAT活性随着PEG 6000质量分数的增加呈先上升后下降的趋势,PEG 6000质量分数为20%时CAT活性明显高于其他处理,且在处理第10天时,CAT活性是ck组的3.87倍;PEG 6000质量分数为30%时CAT活性降低,可能由于高质量分数PEG 6000可使细胞脱水,严重影响细胞正常生活,降低CAT活性。
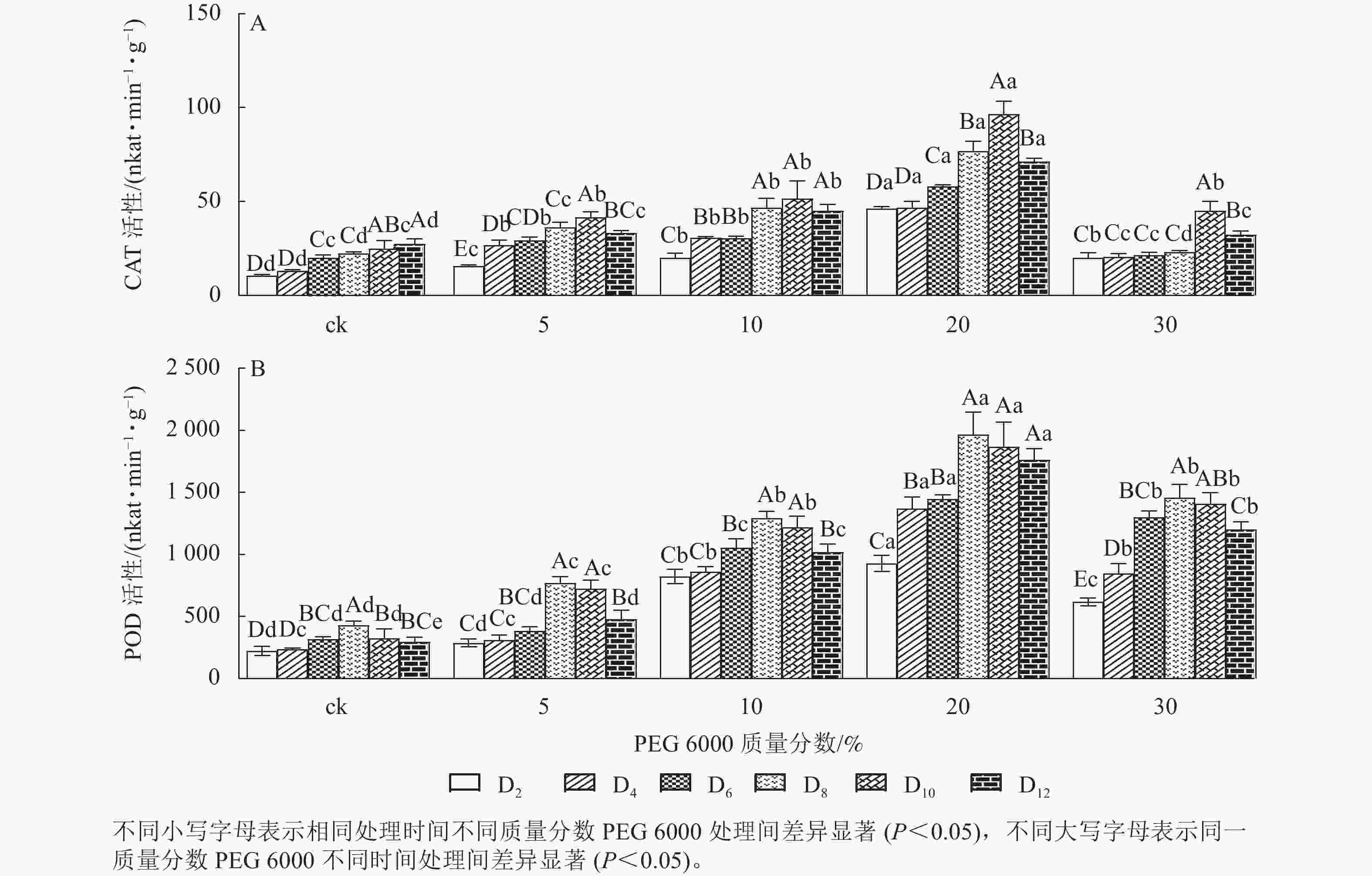
图 2 PEG 6000模拟干旱胁迫后铁皮石斛幼苗CAT和POD活性的变化
Figure 2. Changes of CAT and POD enzyme activities in D. candidum seedlings after PEG 6000 simulated drought stress
由图2A和图2B可知:PEG 6000模拟干旱胁迫后,铁皮石斛幼苗POD活性的变化趋势与CAT活性基本一致。没有PEG 6000处理的铁皮石斛幼苗的POD活性几乎保持不变,随着PEG 6000处理时间延长,铁皮石斛POD活性均呈现先上升后下降的趋势,在处理第8天时达到最高值(图2B),而后开始缓慢下降;PEG 6000模拟干旱处理后铁皮石斛幼苗POD活性均高于ck组,且随着PEG 6000质量分数的增加,POD活性呈先上升后下降的趋势,当PEG 6000质量分数为20%时达到峰值,为119×16.67 nkat·min−1·g−1 (图2B)。
-
PEG 6000模拟干旱胁迫处理不同时间对铁皮石斛幼苗可溶性糖和可溶性蛋白质量分数的影响差异显著(P<0.05)。可溶性糖不仅能够为植物提供碳源物质,还能维持一定的渗透压。从图3A可看出:铁皮石斛幼苗的可溶性糖质量分数随着PEG 6000质量分数的增加和处理时间的延长均呈上升趋势,到第12天时达最高,且随着PEG 6000质量分数的增加,可溶性糖质量分数呈上升趋势,PEG 6000为30%时,可溶性糖上升显著,说明铁皮石斛植株受到不同质量分数PEG 6000模拟干旱胁迫时,通过增加可溶性糖来维持植物体内细胞的渗透压。
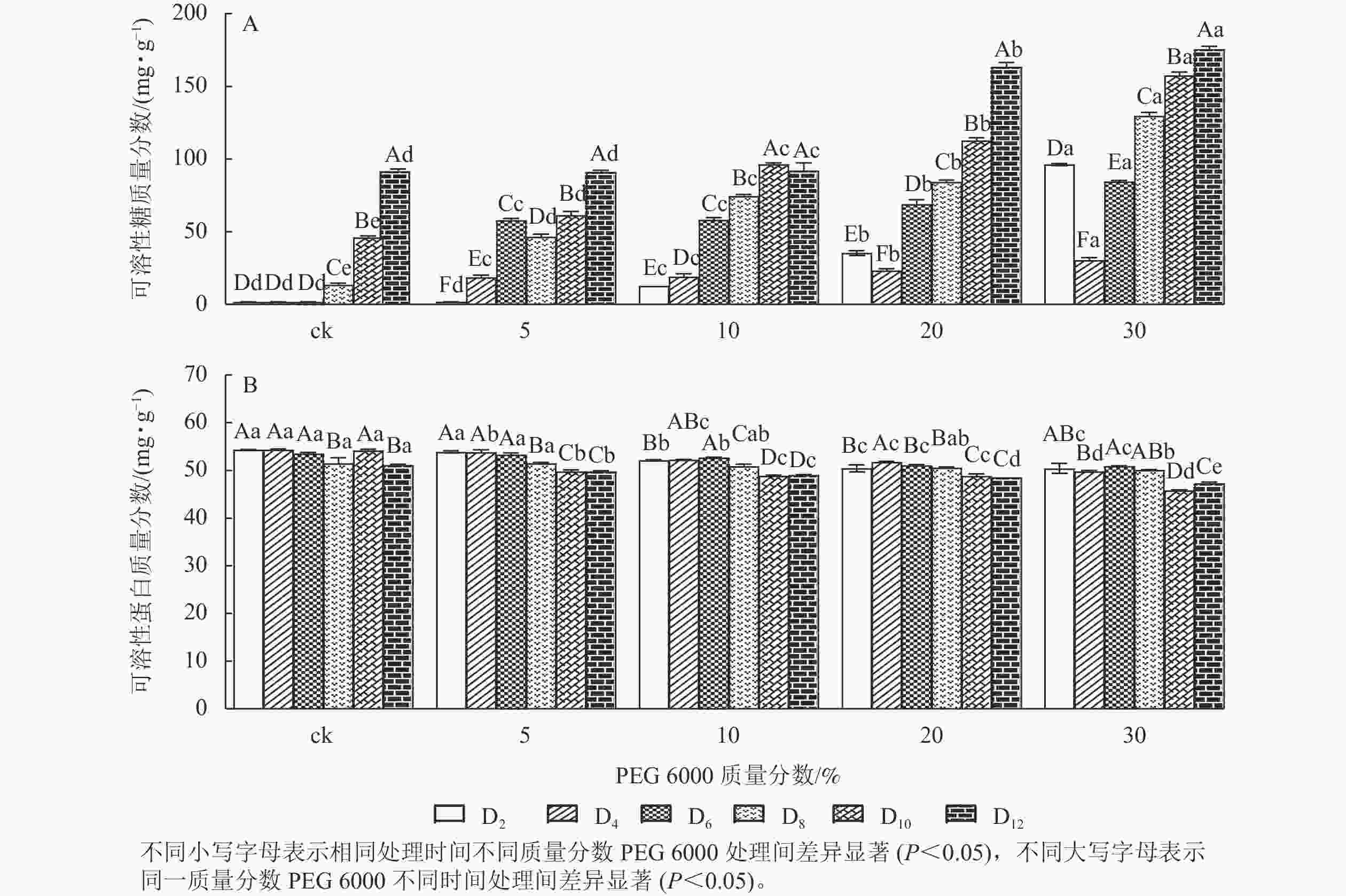
图 3 PEG 6000模拟干旱胁迫后铁皮石斛幼苗可溶性糖和可溶性蛋白质量分数的变化
Figure 3. Changes of soluble sugar and soluble protein contents in D. candidum seedlings after PEG 6000 simulated drought stress
从图3B可知:不同质量分数PEG 6000处理对铁皮石斛幼苗的可溶性蛋白质量分数有显著影响(P<0.05),且随着PEG 6000处理时间的延长,铁皮石斛幼苗的可溶性蛋白质量分数均呈下降趋势,且在处理相同时间,PEG 6000质量分数越高,铁皮石斛幼苗的可溶蛋白质量分数越少。当PEG 6000质量分数为30%时,可溶性蛋白质量分数在第8~10天时下降。此时蛋白质分解加速,合成减少,说明铁皮石斛幼苗可在一定程度上消耗可溶性蛋白来调节适应 PEG 6000的胁迫处理,但需要一定的胁迫强度和时间。
-
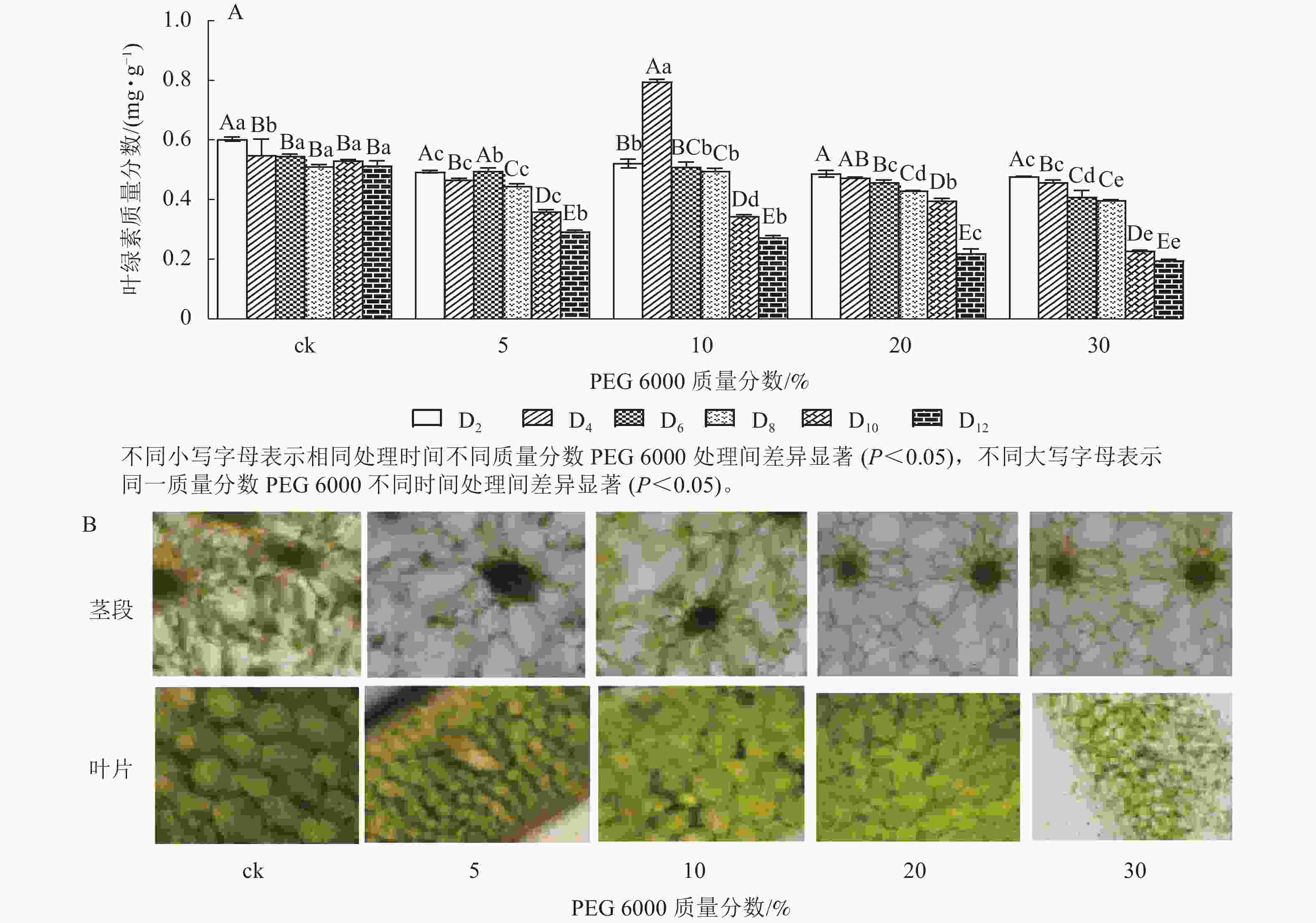
由图4A可知:PEG 6000模拟干旱胁迫对铁皮石斛幼苗茎段和叶片叶绿素质量分数有显著影响(P<0.05)。随着PEG 6000模拟干旱胁迫时间的延长,铁皮石斛幼苗叶绿素质量分数呈现逐渐减少的趋势,在PEG 6000模拟干旱处理2~8 d时,叶绿素质量分数呈现缓慢下降的趋势,到第10天时,叶绿素质量分数急剧下降,较同一时间的ck分别下降了32.01% (5%PEG 6000)、35.03% (10%PEG 6000)、44.07% (20%PEG 6000)和57.06% (30%PEG 6000),且随着PEG 6000质量分数的增加,叶绿素下降幅度明显增加。方差分析结果表明:不同质量分数PEG 6000处理对铁皮石斛幼苗叶绿素质量分数的有显著的影响(P<0.05)。对不同质量分数PEG 6000处理12 d时铁皮石斛幼苗茎段和叶片琼脂糖包埋震荡切片观察发现:铁皮石斛茎段和叶片细胞内叶绿素随着PEG 6000质量分数的增加而减少(图4B),与测得叶绿素质量分数的结果一致。
-
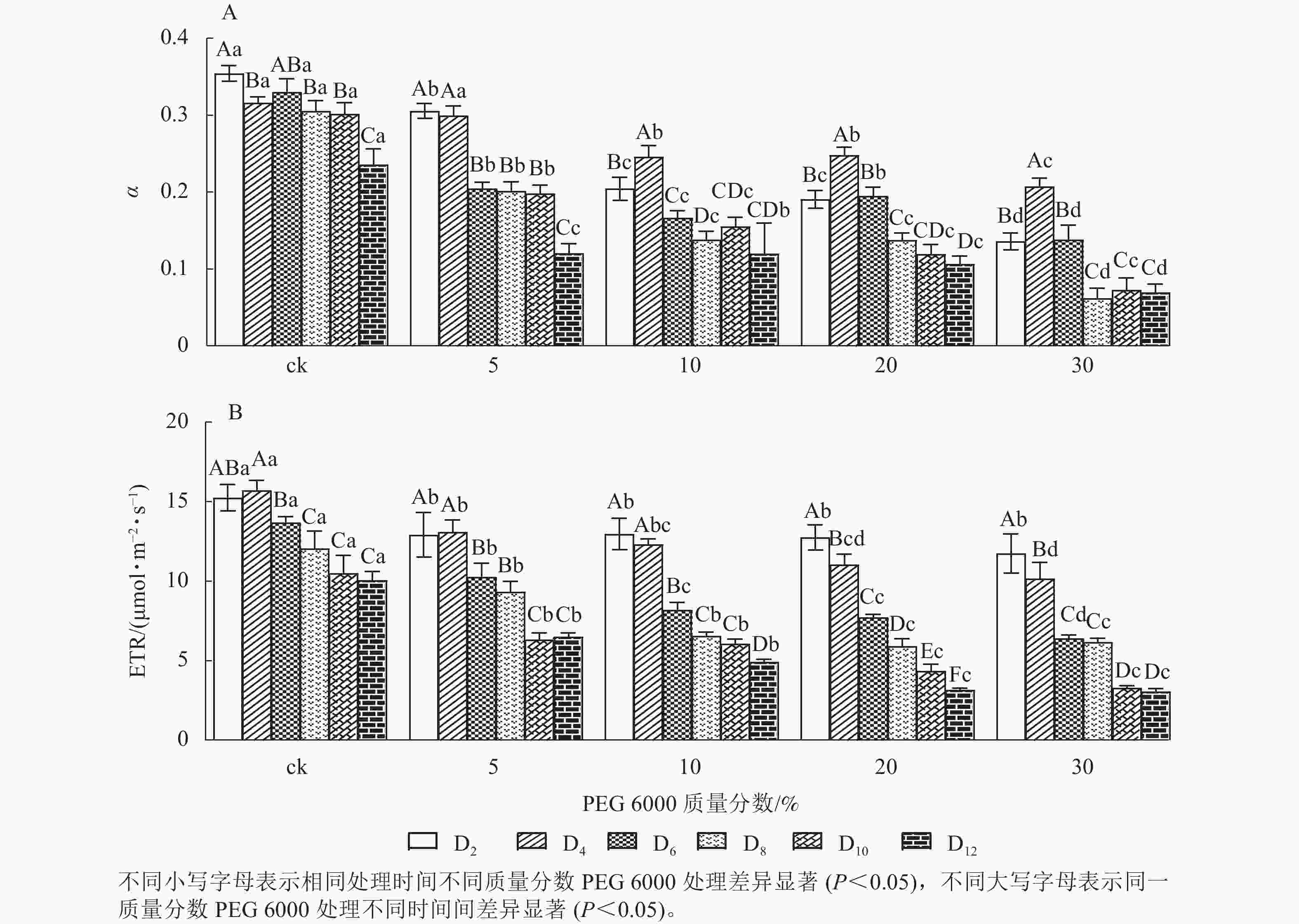
由图5A和5B可知:PEG 6000模拟干旱胁迫对铁皮石斛幼苗处理不同时间对α和ETR的影响差异显著(P<0.05)。随着PEG 6000胁迫处理时间的延长和PEG 6000质量分数的增加,α和ETR均呈下降趋势,在4~8 d时下降的幅度最大。与ck组相比,随着PEG 6000质量分数的增加,α下降幅度增大(图5A)。在PEG 6000 为30%处理时ETR下降幅度最大,PEG 6000为20%和30%处理12 d时ETR达到最低(图5B),说明PEG 6000胁迫处理会使铁皮石斛幼苗的光合作用减弱,且随着胁迫程度增加,光合作用减弱的幅度越大。这与PEG 6000胁迫处理下铁皮石斛叶绿素质量分数降低的结果一致。
-
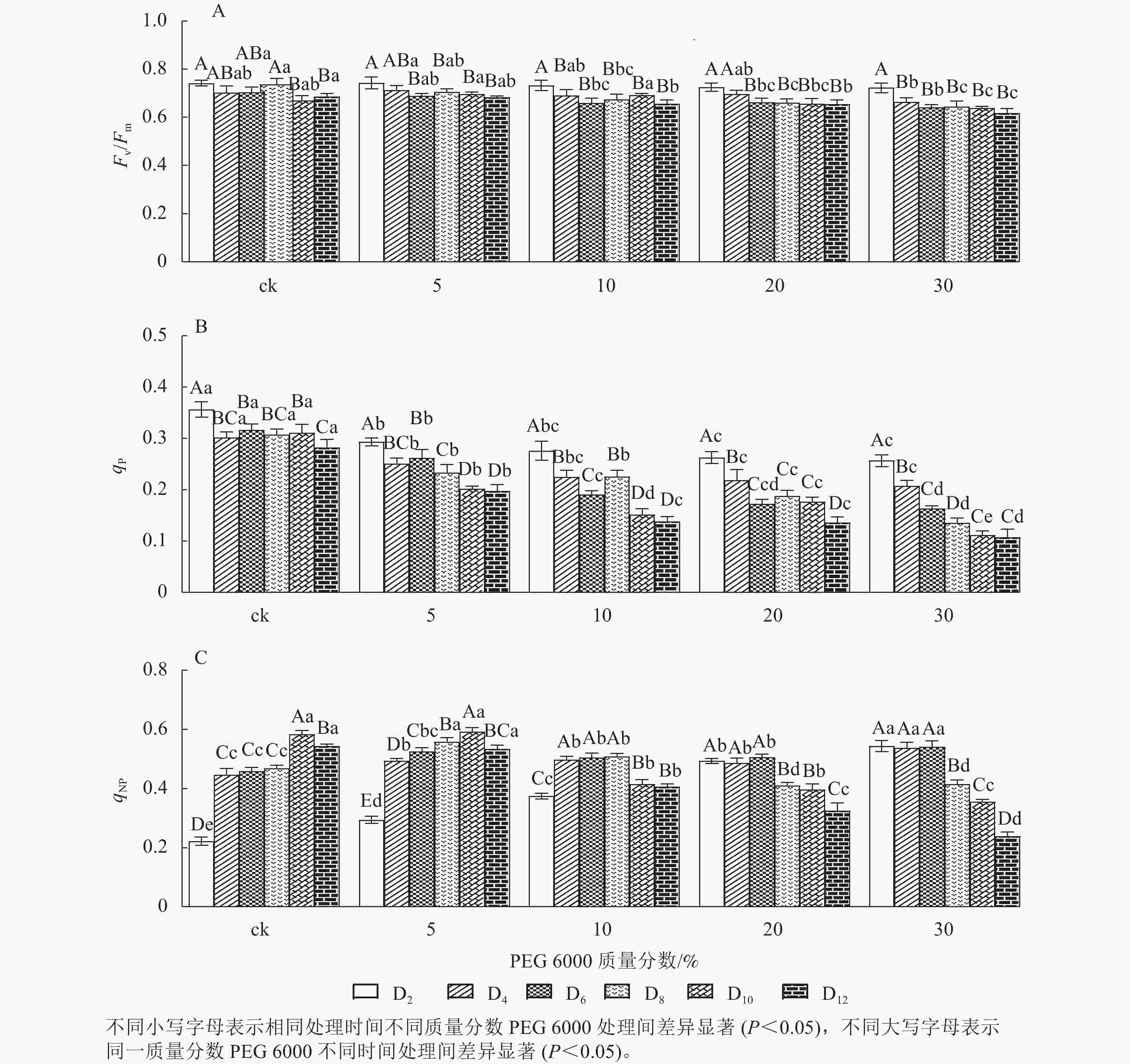
由图6A可知:Fv/Fm随着不同质量分数PEG 6000处理时间的延长呈逐渐下降的趋势,在PEG 6000处理第2天时,Fv/Fm为0.723~0.743。未添加PEG 6000处理在第2~8天时,铁皮石斛幼苗Fv/Fm为0.703~0.743,说明光能转换正常,但到第10~12天时,Fv/Fm显著下降(P<0.05),光转换效率降低,可能由于长时间液体培养会对铁皮石斛幼苗生长产生不利影响。随着PEG 6000质量分数的增加,Fv/Fm呈现显著下降趋势(P<0.05),低质量分数PEG 6000 (5%)处理后第2~8天,Fv/Fm为0.698~0.713,说明低质量分数PEG 6000对铁皮石斛幼苗PSⅡ的损伤较小,而第8~12天逐渐下降;10%~30%PEG 6000处理后第4天,Fv/Fm开始显著下降,说明铁皮石斛幼苗受到模拟干旱胁迫后,植株的最大光能转换效率降低,PSⅡ受到胁迫损伤,严重影响铁皮石斛幼苗的光合作用。
-
荧光猝灭主要有光化学猝灭和非光化学猝灭,光化学猝灭是由碳代谢酶光活化和气孔开放引起的PSⅡ电子传递速率增加,光化学猝灭系数(qP)一定程度上反映PSⅡ反应中心的开放程度;非光化学猝灭是由能量转变导致的热耗散效率增加,qNP为非光化学猝灭系数。非光化学猝灭是一种保护途径,通过热耗散消耗过剩的光能,使光合机构免受伤害[32−33]。PEG 6000模拟干旱胁迫对铁皮石斛幼苗处理不同时间对qNP和qP的影响差异显著(P<0.05)。由图6B可知:不同质量分数PEG 6000处理均使qP在第2~12天逐渐降低,且随着PEG 6000质量分数的增加而下降,说明PSⅡ反应中心的开放程度随之降低,参加光化学反应的激发能量明显降低,过剩的光能就会增加。由图6C可看出:当PEG 6000质量分数为0~10%时,铁皮石斛幼苗qNP随着处理时间的延长呈先上升后下降的趋势,PEG 6000为0和5%时,在处理的第10天qNP达最高值(0.584和0.593),PEG 6000为10%时于第8天qNP达最高值(0.509);PEG 6000为20%和30%时,铁皮石斛幼苗qNP随着处理时间的延长持续下降,说明低质量分数PEG 6000胁迫下,非光化学猝灭途径发挥了保护作用,qNP增大;但随着处理时间的延长或在高质量分数PEG 6000胁迫下,qNP自我保护机制达到一定限度,导致光合反应受到伤害,无法逆转,使qNP呈现持续下降的趋势。
-
干旱是全球性环境问题之一。植物不能逃避恶劣的自然环境条件,只能加速适应各种逆境。大多数植物可改变自身的生理生化指标来响应干旱逆境胁迫,以维持植物正常生长。
MDA是细胞膜受到逆境胁迫伤害引起的膜脂过氧化产物,MDA质量摩尔浓度是判断植物细胞膜受到伤害程度的重要指标,MDA质量摩尔浓度越高说明细胞膜受伤程度越大[28, 34−35]。本研究中,铁皮石斛幼苗MDA质量摩尔浓度随PEG 6000质量分数和处理时间不同存在差异,短时间(≤8 d) PEG 6000模拟干旱胁迫处理后铁皮石斛幼苗MDA变化不大,对细胞膜影响较小,而长时间(≥10 d)处理后MDA急剧上升,且PEG 6000质量分数越高,MDA质量摩尔浓度越高,因此,PEG 6000模拟干旱程度增加会导致细胞膜受到极大的伤害,膜脂过氧化程度也越大。这与构树Broussonetia papyrifera[36]、北美红栎Quercus rubra[37]和大豆Glycine max[38]幼苗在干旱胁迫时MDA的变化一致。
小分子渗透调节物质葡萄糖、果糖、蔗糖等可溶性糖能通过渗透调节平衡细胞渗透势,提高细胞保水能力而维持细胞的正常生理过程。同时,干旱胁迫会导致植物细胞膜受损,透性增大,引起膜脂过氧化反应,会对蛋白质造成伤害,因此细胞内可溶性糖和蛋白变化能够稳定渗透调节能力,是反映植物抗旱性的有效指标之一[14, 39]。本研究中,铁皮石斛幼苗可溶性糖质量分数随PEG 6000质量分数和胁迫处理时间的延长呈上升趋势,说明铁皮石斛幼苗细胞通过积累可溶性糖来提高细胞液浓度,降低细胞膜的渗透势,维持体内细胞的渗透压保持自身正常的生理过程。这与玉米的可溶性糖质量分数随干旱胁迫的加剧逐渐升高的变化趋势一致[40]。在处理时间相同时,PEG 6000质量分数越高,铁皮石斛幼苗可溶性蛋白质量分数越低,说明干旱环境对铁皮石斛细胞造成极大的伤害。
植物体内较低的活性氧不会对植物细胞产生伤害[41],而当植物受干旱胁迫时活性氧的代谢平衡被严重破坏,活性氧增多,攻击植物蛋白质上各种氨基酸残基,使蛋白质和叶绿素等分子解体,从而对植物细胞产生各种毒害作用。POD、CAT等保护酶能有效抑制和清除植物体内的各种活性氧和自由基[42]。本研究表明:PEG 6000模拟干旱处理铁皮石斛幼苗后,POD和CAT活性都呈现先上升后下降的趋势,POD和CAT酶活性的大幅提高大大增强对活性氧的抵抗能力和对植物光合机构的保护能力。该结果与三叶草Trifolium repens受到干旱胁迫时POD和CAT的活性变化一致[25]。因此,植物受干旱胁迫时通过提高相关保护酶活性来保持体内活性氧平衡。
-
叶绿素是光合作用最重要的色素,光合作用时叶绿素吸收能量,为CO2转变为碳水化合物提供能量;水分是叶绿素的合成原料,干旱胁迫能使叶绿素合成减缓及叶绿素解体,直接导致叶绿素质量分数降低。本研究中PEG 6000模拟干旱处理铁皮石斛幼苗后,茎段和叶片叶绿素质量分数明显降低,与PEG模拟干旱胁迫不同抗逆性棉花Gossypium hirsutum的叶绿素变化趋势一致[43]。
叶绿素荧光和植物光合作用关系密切,当强光持续照射植物时,为了有效避免植物叶绿体内吸收的光能超过光合作用中发生光化学反应的能量消耗及过量的光能灼伤植物光合作用机构,植物以荧光的方式耗尽消散掉部分光能以起重要保护作用;自然条件下叶绿素荧光和植物光合速率呈负相关,叶绿素荧光变弱时光合速率就高,反之亦然。植物遭受胁迫的程度与光合作用的叶绿素荧光特性有着密切的关系[44]。本研究中,PEG 6000模拟干旱处理铁皮石斛幼苗,Fv/Fm、qP、ETR均呈下降趋势,表明PEG 6000干旱胁迫对植物光合作用产生了伤害;PEG 6000干旱胁迫使铁皮石斛幼苗qNP呈上升趋势,说明铁皮石斛幼苗通过启动非光化学猝灭途径来大量消耗PSⅡ反应中心吸收的过剩光能。随着PEG 6000胁迫的不断加重,qNP也开始呈现明显下降的趋势,可能是由于热耗散机制受阻,无法使耗散掉吸收的过剩光能,导致光系统受到不可逆转的损伤,影响光合作用。因此,植物受到干旱胁迫时光合作用能力降低从而影响植物的正常生长。
-
通过研究对铁皮石斛幼苗进行PEG 6000模拟干旱胁迫处理后的生理和叶绿素荧光特性,发现铁皮石斛幼苗具有一定的抗旱能力,在适当干旱条件下可通过自身调节来达到正常生长的目的,但也有一定限度。在较低PEG 6000质量分数(≤5%)胁迫时,可以通过调节代谢实现自我保护,在高质量分数PEG 6000 (≥20%)时,干旱胁迫会损伤植物,影响生理过程和光合作用。20% PEG 6000胁迫10 d可作为铁皮石斛抗干旱品种筛选的标准;铁皮石斛幼苗可通过增加可溶性糖,减少可溶性蛋白,提高POD和CAT等防御酶活性抵抗和适应一定程度的干旱胁迫(≥20%PEG 6000处理≥10 d);铁皮石斛幼苗的最大光能转换效率降低,PSⅡ受到胁迫损伤,同时,铁皮石斛幼苗通过启动qNP途径来消耗PSⅡ反应中心吸收的过剩光能,维持正常的光合作用。因此,可溶性糖和可溶性蛋白、防御酶POD和CAT以及叶绿体荧光参数均可作为铁皮石斛的耐干旱指标。
Effects of PEG 6000 simulated drought stress on physiological and chlorophyll fluorescence characteristics of Dendrobium candidum seedlings
-
摘要:
目的 研究聚乙二醇6000(PEG 6000)模拟干旱对铁皮石斛Dendrobium candidum生理和叶绿素荧光特性的影响,为铁皮石斛的品种选育、产业化栽培和近野生栽培等提供参考。 方法 以铁皮石斛‘晶品1号’D. candidum ‘Jingpin No. 1’幼苗为实验材料,通过不同质量分数PEG 6000 (5%、10%、20%、30%)模拟干旱胁迫处理铁皮石斛幼苗,观察铁皮石斛幼苗茎段和叶片细胞结构,并检测铁皮石斛叶片过氧化物酶(POD)、过氧化氢酶(CAT)活性及丙二醛(MDA)质量摩尔浓度、可溶性糖质量分数、可溶性蛋白质量分数、叶绿素质量分数及叶绿素荧光参数的动态变化。 结果 ①高质量分数PEG 6000 (20%~30%)处理后铁皮石斛茎段和叶片细胞内叶绿素质量分数减少。②PEG 6000模拟干旱胁迫处理对铁皮石斛幼苗可溶性糖和可溶性蛋白、MDA、POD和CAT有显著影响(P<0.05)。可溶性糖质量分数随着PEG 6000质量分数的增加和处理时间的延长均呈上升趋势,到第12天时达最高值;可溶性蛋白则呈下降趋势;MDA质量摩尔浓度、POD活性和CAT活性随着PEG 6000质量分数的增加呈先上升后下降的趋势,在PEG 6000为20%时达到峰值。③PEG 6000模拟干旱处理对铁皮石斛幼苗最大光化学效率(Fv/Fm)、光合效率(α)、电子传递速度(ETR)、光化学猝灭系数(qP)和非化学猝灭系数(qNP)等叶绿素荧光参数有显著的影响(P<0.05)。随着PEG 6000胁迫处理时间的延长和PEG 6000质量分数的增加,α、ETR、Fv/Fm和qP均呈显著下降趋势(P<0.05);而qNP则呈先上升后下降的趋势。 结论 20% PEG 6000处理12 d可用作铁皮石斛抗干旱品种的筛选,铁皮石斛幼苗可通过增加可溶性糖质量分数,减少可溶性蛋白质量分数,提高POD和CAT活性等防御酶活性抵抗和适应一定程度的干旱胁迫;铁皮石斛幼苗的最大光能转换效率降低,光合系统Ⅱ(PS Ⅱ)受到胁迫损伤,严重影响铁皮石斛幼苗的光合作用。同时,铁皮石斛幼苗通过启动qNP途径来消耗PSⅡ反应中心吸收的过剩光能,维持正常的光合作用。因此,可溶性糖和可溶性蛋白、POD和CAT以及叶绿体荧光参数均可作为铁皮石斛耐干旱的指标。图6参44 Abstract:Objective The objective is to study the effects of PEG 6000 simulated drought on physiological and chlorophyll fluorescence characteristics of Dendrobium candidum, so as to provide reference for variety selection, industrial cultivation, and near wild cultivation of D. candidum. Method The seedlings of D. candidum ‘Jingpin No. 1’ were used as experimental materials and treated with PEG 6000 at different concentrations to simulate drought stress. The stem segment and leaf cell structure of D. candidum seedlings were observed, and the dynamic changes of peroxidase (POD), catalase (CAT) activity, malondialdehyde (MDA), soluble sugar, soluble protein, chlorophyll content and chlorophyll fluorescence parameters in D. candidum leaves were detected. Result (1) The content of chlorophyll in the stem and leaf cells of D. candidum decreased after treatment with high concentration of PEG 6000 (20%−30%). (2) PEG 6000 simulated drought stress significantly affected the content of soluble sugar and protein, MDA, POD and CAT activity of D. candidum seedlings. The soluble sugar content increased with the increase of PEG 6000 concentration and the extension of treatment time, reaching its highest value on the 12th day, while the soluble protein showed a downward trend. MDA content, POD and CAT activity increased first and then decreased with the increase of PEG 6000 concentration, reaching the peak at a PEG 6000 concentration of 20%. (3) PEG 6000 simulated drought treatment of D. candidum seedlings significantly affected chlorophyll fluorescence parameters such as maximum photochemical efficiency (Fv/Fm), photosynthetic efficiency (α), electron transfer rate (ETR), photochemical quenching coefficient (qP) and non-chemical quenching coefficient (qNP). With the extension of PEG 6000 stress treatment time and the increase of PEG 6000 concentration, α, ETR, Fv/Fm and qP showed a significant downward trend, while qNP showed a trend of first increasing and then decreasing. Conclusion 20% PEG 6000 treatment for 12 days can be used as a method for screening drought resistant varieties of D. candidum, which can resist and adapt to a certain degree of drought stress by increasing the content of soluble sugar, reducing the content of soluble protein and improving the activities of defense enzymes such as POD and CAT. The maximum light energy conversion efficiency of D. candidum seedlings decreases, and the photosystemⅡ (PSⅡ) is damaged by stress, which seriously affect the photosynthesis of D. candidum seedlings. At the same time, D. candidum seedlings consume the excess light energy absorbed by the PSⅡ reaction center by activating the qNP pathway to maintain normal photosynthesis. Therefore, soluble sugars and protein, POD and CAT, and chloroplast fluorescence parameters can all be used as indicators of drought resistance in D. candidum. [Ch, 6 fig. 44 ref.] -
-
[1] 翟宇宁, 张广华, 董寅壮, 等. PEG 6000模拟干旱胁迫对甜菜幼苗生长及生理指标的影响[J/OL]. 黑龙江大学自然科学学报, 2023, 40[2023-04-11]. doi: 10.13482/j.issn1001-7011.2022.05.112. ZHAI Yuning, ZHANG Guanghua, DONG Yinzhuang, et al. Effects of PEG-6000 imulated drought stress on growth and physiological indexes of sugar beet seedling [J/OL]. Journal of Natural Science of Heilongjiang University, 2023, 40[2023-04-11]. doi: 10.13482/j.issn1001-7011.2022.05.112. [2] 刘淑兰, 李进, 马永慧, 等. 独脚金内酯对干旱胁迫下黑果枸杞种子萌发和幼苗生理变化的影响[J]. 草地学报, 2023, 31(1): 130 − 139. LIU Shulan, LI Jin, MA Yonghui, et al. Effects of strigolactones on seed germination and seedling physiological changes of Lycium ruthenicum under drought [J]. Acta Agrestia Sinica, 2023, 31(1): 130 − 139. [3] 邓杨, 王瑶, 郭洋楠, 等. 干旱胁迫下柳枝稷在露天矿区土壤中的种子萌发和生长特性[J]. 生态学报, 2022, 42(22): 9175 − 9185. DENG Yang, WANG Yao, GUO Yangnan, et al. Effect of drought stress on the seed germination and growth characteristics of switchgrass [J]. Acta Ecologica Sinica, 2022, 42(22): 9175 − 9185. [4] 汪堃, 南丽丽, 师尚礼, 等. 干旱胁迫对不同根型苜蓿根系生长及根际土壤细菌的影响[J]. 生态学报, 2021, 41(19): 7735 − 7742. WANG Kun, NAN Lili, SHI Shangli, et al. Influence of root growth and bacterial community in the rhizosphere of different root types of alfalfa under drought stress [J]. Acta Ecologica Sinica, 2021, 41(19): 7735 − 7742. [5] 伊力努尔·艾力, 陈晓楠, 高文礼, 等. AMF-多枝柽柳幼苗共生体对干旱胁迫的生理响应[J]. 植物科学学报, 2022, 40(5): 724 − 732. Yilinuer Aili, CHEN Xiaonan, GAO Wenli, et al. Physiological responses of arbuscular mycorrhizal fungus-Tamarix ramosissima Ledeb. seedling symbionts to drought stress [J]. Plant Science Journal, 2022, 40(5): 724 − 732. [6] 刘鑫, 付丽娟, 于静, 等. 5种外源物质对干旱胁迫下笔筒树幼苗生长的缓解效应[J]. 西北植物学报, 2022, 42(7): 1169 − 1179. LIU Xin, FU Lijuan, YU Jing, et al. Alleviation effect of five exogenous substances on Sphaeropteris lepifera seedings under drough stress [J]. Acta Botanica Boreali-Occidentalia Sinica, 2022, 42(7): 1169 − 1179. [7] 路秉翰, 卓定龙, 刘晓洲, 等. 干旱胁迫对红玉姜黄光合和叶绿素荧光参数的影响[J]. 热带农业科学, 2022, 42(6): 11 − 16. LU Binghan, ZHUO Dinglong, LIU Xiaozhou, et al. Effect of drought stress on photosynthetic and chlorophyll fluorescence parameters of Curcuma ‘Hongyu’ [J]. Chinese Journal of Troical Agriculture, 2022, 42(6): 11 − 16. [8] 魏娜, 李艳鹏, 马艺桐, 等. 全基因组水平紫花苜蓿TCP基因家族的鉴定及其在干旱胁迫下表达模式分析[J]. 草业学报, 2022, 31(1): 118 − 130. WEI Na, LI Yanpeng, MA Yitong, et al. Genome-wide identification of the alfalfa TCP gene family and analysis of gene transcription patterns in alfalfa (Medicago sativa) under drought stress [J]. Acta Prataculturae Sinica, 2022, 31(1): 118 − 130. [9] 李晓艳, 周敬雯, 严铸云, 等. 基于转录组测序揭示适度干旱胁迫对丹参基因表达的调控[J]. 中草药, 2020, 51(6): 1600 − 1608. LI Xiaoyan, ZHOU Jingwen, YAN Zhuyun, et al. Sequencing and analysis of transcriptome to reveal regulation of gene expressionin Salvia miltiorrhiza under moderate drought stress [J]. Chinese Traditional and Herbal Drugs, 2020, 51(6): 1600 − 1608. [10] 韩志顺, 郑敏娜, 梁秀芝, 等. 干旱胁迫对不同紫花苜蓿品种形态特征和生理特性的影响[J]. 中国草地学报, 2020, 42(3): 37 − 43. HAN Zhishun, ZHENG Minna, LIANG Xiuzhi, et al. Effects of drought stress on morphological and physiological characteristics of different alfalfa cultivars [J]. Chinese Journal of Grassland, 2020, 42(3): 37 − 43. [11] 武曦, 张罡, 郭华, 等. 干旱胁迫对多裂叶荆芥幼苗形态和不同部位生理生化指标的影响[J]. 山西农业科学, 2022, 50(2): 161 − 169. WU Xi, ZHANG Gang, GUO Hua, et al. Effects of drought stress on morphology, physiological and biochemical indexes in different parts of Nepeta multifida L. seedlings [J]. Journal of Shanxi Agricultural Sciences, 2022, 50(2): 161 − 169. [12] 杨顺强, 吴银梅, 王磊, 等. 光叶珙桐根系对PEG模拟干旱胁迫的生理响应及综合评价[J]. 南方林业科学, 2020, 48(3): 1 − 6. YANG Shunqiang, WU Yinmei, WANG Lei, et al. Physiological response and comprehensive evaluation of the root systemof Davidia involucrata var. vilmoriniana to drought stress simulated by PEG [J]. South China Forestry Science, 2020, 48(3): 1 − 6. [13] 孙萍, 段喜华. 干旱胁迫对长春花光合特性及可溶性糖的影响[J]. 东北林业大学学报, 2010, 38(8): 54 − 56. SUN Ping, DUAN Xihua. Effects of drought stress on souble sugars and photosynthetic characteristics of Catharanthus roseus seedlings [J]. Journal of Northeast Forestry University, 2010, 38(8): 54 − 56. [14] 周芳, 刘恩世, 孙海彦, 等. 前期干旱锻炼对木薯根系内源激素及可溶性糖含量的影响[J]. 热带作物学报, 2013, 34(3): 486 − 494. ZHOU Fang, LIU Enshi, SUN Haiyan, et al. Effect of drought hardening on the content of endogenous phytohormone and soluble sugar incassava roots [J]. Chinese Journal of Tropical Crops, 2013, 34(3): 486 − 494. [15] 徐扬, 赵健, 张雷, 等. 干旱胁迫对板栗2年生嫁接苗叶片相对含水量和可溶性糖含量的影响[J]. 农学学报, 2017, 7(1): 91 − 94. XU Yang, ZHAO Jian, ZHANG Lei, et al. Effect of drought stress on leaf relative water content and soluble sugar content of 2-year-old grafted Castanea mollissima [J]. Journal of Agriculture, 2017, 7(1): 91 − 94. [16] 董斌, 蓝来娇, 黄永芳, 等. 干旱胁迫对油茶叶片叶绿素含量和叶绿素荧光参数的影响[J]. 经济林研究, 2020, 38(3): 16 − 25. DONG Bin, LAN Laijiao, HUANG Yongfang, et al. Effects of drought stress on photosynthetic pigments and chlorophyll fluorescence characteristics in leaves of Camellia oleifera [J]. Non-wood Forest Research, 2020, 38(3): 16 − 25. [17] AZZEME A, ABDULLAH S N A, AZIZ M A, et al. Oil palm drought inducible DREB1 induced expression of DRE/CRT- and non-DRE/CRT-containing genes in lowland transgenic tomato under cold and PEG treatments [J]. Plant Physiology and Biochemistry, 2017, 112: 129 − 151. [18] 王爱英, 李双, 焦浈, 等. PEG-6000模拟干旱对不同抗性小麦品种光合和叶绿素荧光特性的影响[J]. 甘肃农业大学学报, 2022, 57(4): 49 − 56. WANG Aiying, LI Shuang, JIAO Zhen, et al. Effects of PEG-6000 simulated drought stress on photosynthetic and chlorophyll fluorescence characteristics of different drought resistant wheat varieties [J]. Journal of Gansu Agricultural University, 2022, 57(4): 49 − 56. [19] 王霞, 尹晓雨, 于晓明, 等. 玉米跨代干旱胁迫记忆生理机制及DNA甲基化变化分析[J]. 西北植物学报, 2021, 41(10): 1691 − 1699. WANG Xia, YIN Xiaoyu, YU Xiaoming, et al. Transgenerational drought stress on memory physiological mechanism and changes of DNA methylation in maize [J]. Acta Botanica Boreali-Occidentalia Sinica, 2021, 41(10): 1691 − 1699. [20] 斯金平, 张媛, 罗毅波, 等. 石斛与铁皮石斛关系的本草考证[J]. 中国中药杂志, 2017, 42(10): 2001 − 2005. SI Jinping, ZHANG Yuan, LUO Yibo, et al. Herbal textual research on relationship between Chinese medicine“Shihu”(Dendrobium spp. ) and “Tiepi Shihu”(D. catenatum) [J]. China Journal of Chinese Materia Medica, 2017, 42(10): 2001 − 2005. [21] 杨健, 吴浩, 吕朝耕, 等. 基于稳定同位素的铁皮石斛产地识别研究[J]. 中国中药杂志, 2018, 43(6): 1118 − 1123. YANG Jian, WU Hao, LÜ Chaogeng, et al. Geographical origin discriminant of Dendrobium officinale based on stable isotope ratios [J]. China Journal of Chinese Materia Medica, 2018, 43(6): 1118 − 1123. [22] 周美玲, 张志勇, 蒋春艳, 等. 福建省铁皮石斛产业发展现状及对策[J]. 现代农业科技, 2018(13): 89 − 90. ZHOU Meiling, ZHANG Zhiyong, JIANG Chunyan, et al. Development status and countermeasures of Dendrobium candidum industry in Fujian Province [J]. Modern Agricultural Science and Technology, 2018(13): 89 − 90. [23] 阮凌暄, 马骁勇, 林秀莲, 等. 干旱胁迫对铁皮石斛叶片活性氧清除系统与叶绿素荧光特性的影响[J]. 西部林业科学, 2017, 46(6): 104 − 107. RUAN Lingxuan, MA Xiaoyong, LIN Xiulian, et al. Effects of drought stress on active oxygen scavenging systems and chlorophyll fluorescence characteristics of Dendrobium officinale leaves [J]. Journal of West China Forestry Science, 2017, 46(6): 104 − 107. [24] 吕朝燕, 高智席, 邓富梅, 等. 2种石斛属植物光合特性对干旱胁迫及复水的响应[J]. 节水灌溉, 2023(2): 111 − 120, 127. LÜ Chaoyan, GAO Zhixi, DENG Fumei, et al. Responses of photosynthetic characteristics of two Dendrobium plants to drought stress and rewatering [J]. Water Saving Irrigation, 2023(2): 111 − 120, 127. [25] 李妍, 宋凯旋, 赵静, 等. 聚乙二醇(PEG)模拟干旱胁迫对三叶草生长及抗氧化酶活性的影响[J]. 北方园艺, 2019(11): 92 − 96. LI Yan, SONG Kaixuan, ZHAO Jing, et al. Effect of drought stress stimulated by PEG on growth and anti-oxidative enzyme activity in white clover [J]. Northern Horticulture, 2019(11): 92 − 96. [26] 刘美雅, 张群峰, 倪康, 等. 1种高效的茶树基因细胞学定位方法: CN110398483A[P]. 2019-11-01. LIU Meiya, ZHANG Qunfeng, NI Kang, et al. An Efficient Cytological Mapping Method of Tea Tree Genes: CN110398483A[P]. 2019-11-01. [27] 赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯, 1994, 30(3): 207 − 210. ZHAO Shijie, XU Changcheng, ZHOU Qi, et al. Improvements of method for measurement of malondialdehvde in plant tissues [J]. Plant Physiology Communication, 1994, 30(3): 207 − 210. [28] 张清航, 张永涛. 植物体内丙二醛(MDA)含量对干旱的响应[J]. 林业勘查设计, 2019(1): 110 − 112. ZHANG Qinghang, ZHANG Yongtao. Study on response to drought stress of MDA content in plants [J]. Forest Investigation Design, 2019(1): 110 − 112. [29] 位杰, 吴翠云, 蒋媛, 等. 蒽酮法测定红枣可溶性糖含量条件的优化[J]. 食品科学, 2014, 35(24): 136 − 140. WEI Jie, WU Cuiyun, JIANG Yuan, et al. Sample preparation optimization for determination of soluble sugar in red jujube fruits by Anthrone method [J]. Food Science, 2014, 35(24): 136 − 140. [30] 陈卫东, 张玉霞, 丛百明, 等. 钾肥对紫花苜蓿根颈丙二醛、可溶性蛋白含量与抗氧化系统的影响[J]. 草地学报, 2021, 29(4): 717 − 723. CHEN Weidong, ZHANG Yuxia, CONG Baiming, et al. Effects of potassium fertilizer on MDA, SP content and antioxidant system of alfalfa root neck [J]. Acta Agrestia Sinica, 2021, 29(4): 717 − 723. [31] 曾维军, 屈坤杰, 万诚, 等. 干旱胁迫对毛豹皮樟扦插苗光合作用与叶片组织结构的影响[J]. 广东农业科学, 2021, 48(6): 7 − 14. ZENG Weijun, QU Kunjie, WAN Cheng, et al. Effects of drought stress on photosynthesis and leaf tissue structure of Litsea coreana Levl. var. lanuginose cutting seedlings [J]. Guangdong Agriculture Science, 2021, 48(6): 7 − 14. [32] 何季, 鲍芳, 吴波, 等. 典型荒漠植物白刺叶绿素荧光特性对模拟增雨的响应[J]. 西北林学院学报, 2020, 35(2): 55 − 63. HE Ji, BAO Fang, WU Bo, et al. Response of chlorophyll fluorescence characteristics of a typical desert plant species Nitraria tangutorum to simulated rainfall enhancement [J]. Journal of Northwest Forestry University, 2020, 35(2): 55 − 63. [33] 王波. 干旱胁迫及多胺修复下闽楠幼苗光合生理的研究[D]. 长沙: 中南林业科技大学, 2019. WANG Bo. Study on Photosynthetic Physiology of Phoebe minnan Seedlings under Drought Stress and Polyamine Repair[D]. Changsha: Central South University of Forestry Science and Technology, 2019. [34] 王红梅, 蒙玺, 孙海龙. 植物卷材不同肥水配比对紫穗槐生理特性的影响[J]. 北方园艺, 2017(16): 90 − 94. WANG Hongmei, MENG Xi, SUN Hailong. Effect of different fertilizer and water ratios of vegetation coil on physiology characteristic of Amorpha fruticosa [J]. Northern Horticulture, 2017(16): 90 − 94. [35] 万燕, 欧阳建勇, 袁航, 等. 干旱胁迫对苦荞生理特征和红外光谱表征特性的影响[J]. 成都大学学报(自然科学版), 2020, 39(3): 230 − 233, 240. WAN Yan, OUYANG Jianyong, YUAN Hang, et al. Effects of drought stress on physiological characteristics and infrared spectrum characterization of tartary buckwheat [J]. Journal of Chengdu University (Natural Science Edition), 2020, 39(3): 230 − 233, 240. [36] 丁菲, 杨帆, 杜天真. 干旱胁迫对构树幼苗抗氧化酶活性变化的影响[J]. 江西农业大学学报, 2018, 30(4): 680 − 683. DING Fei, YANG Fang, DU Tianzhen. Effects of drought stress on activities of antioxidant enzymes in Broussonetia papyrifera L. [J]. Acta Agriculturea University Jiangxiensis, 2018, 30(4): 680 − 683. [37] 苏寒之, 金建邦, 祝遵凌. 干旱胁迫对北美红栎幼苗生理特性的影响[J]. 东北林业大学学报, 2014, 42(8): 34 − 39. SU Hanzhi, JIN Jianbang, ZHU Zunling. Effects of drought stress on physiological characteristics of Quercus rubra seedlings [J]. Journal of Northeast Forestry University, 2014, 42(8): 34 − 39. [38] 张春兰, 曹帅, 满丽莉, 等. PEG胁迫下2个大豆品种苗期的耐旱性与相关响应基因表达分析[J]. 分子植物育种, 2019, 17(18): 5891 − 5898. ZHANG Chunlan, CAO Shuai, MAN Lili, et al. Analysis of PEG stress on drought tolerance and related response genes expression in soybean seedlings of two varieties [J]. Molecular Plant Breeding, 2019, 17(18): 5891 − 5898. [39] HAYASHI T, HARADA A, SAKAI T, et al. Ca2+ transient induced by extracellular changes in osmotic pressure in Arabidopsis leaves: differential involvement of cell wall-plasma membrane adhesion [J]. Plant Cell Environment, 2006, 29(4): 661 − 672. [40] 王仲林, 谌俊旭, 程亚娇, 等. 干旱胁迫下玉米叶片可溶性糖光谱估测研究[J]. 四川农业大学学报, 2018, 36(4): 436 − 443. WANG Zhonglin, CHEN Junxu, CHENG Yajiao, et al. Assessing the soluble sugar of maize leaves in drought stress based on Hyperspectral Data [J]. Journal of Sichuan Agricultural University, 2018, 36(4): 436 − 443. [41] 崔慧萍, 周薇, 郭长虹. 植物过氧化物酶体在活性氧信号网络中的作用[J]. 中国生物化学与分子生物学报, 2017, 33(3): 220 − 226. CUI Huiping, ZHOU Wei, GUO Changhong. The role of plant peroxisomes in ROS signalling network [J]. Chinese Journal of Biochemistry and Molecular Biology, 2017, 33(3): 220 − 226. [42] 张雪, 李强, 余宏军, 等. 氮胁迫对黄瓜幼苗抗氧化酶系统的影响[J]. 农业工程学报, 2016, 32(增刊 2): 142 − 147. ZHANG Xue, LI Qiang, YU Hongjun, et al. Response of antioxidant enzyme system to nitrogen deficiency in cucumber seedling [J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(suppl 2): 142 − 147. [43] 胡根海, 董娜, 晁毛妮, 等. PEG模拟干旱胁迫对不同抗逆性棉花的生理特性的影响[J]. 干旱地区农业研究, 2017, 35(5): 223 − 228. HU Genhai, DONG Na, CHAO Maoni, et al. Effects of drought stress simulated by PEG 6000 on physiological characteristics of different upland cotton [J]. Agricultural Research in the Arid Areas, 2017, 35(5): 223 − 228. [44] 杨斌, 彭长辉, 张贤, 等. 干旱胁迫对刺槐幼苗叶片氮含量、光合速率及非结构性碳水化合物的影响[J]. 应用与环境生物学报, 2019, 25(6): 1261 − 1269. YANG Bin, PENG Changhui, ZHANG Xian, et al. The mechanism of enzymatic control on soil organic carbon in response to external input of nitrogen and phosphorus in a peatland in the Changbai Mountains [J]. Chinese Journal of Applied Environmental Biology, 2019, 25(6): 1261 − 1269. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20230301






 下载:
下载: