-
化学计量学是衡量化学元素平衡的科学,强调有机体主要元素(碳、氮、磷)的化学计量关系[1],土壤碳、氮、磷及其计量比是指示植被养分限制性状况和循环效率的有效工具[2],驱动着整个喀斯特地区生态系统的演替过程。滇东喀斯特地区土壤侵蚀严重,石漠化面积逐年扩大,植被恢复是石漠化治理的根本途径,土壤生态化学计量特征的研究对掌握喀斯特区植被恢复效益和土壤养分效率具有重要意义。前期研究集中在石漠化区土壤和叶片-调落物-土壤一体的生态化学计量特征方面,但针对石漠化区不同植被恢复模式下的土壤碳、氮、磷化学计量特征的研究较少。王霖娇等[3]对西南喀斯特典型石漠化区土壤化学计量特征进行了研究并探讨其环境因子,为西南地区土壤石漠化治理和肥力提升提供了依据。王亚娟等[4]对油松Pinus tabulaeformis人工林的植物器官-调落物-土壤化学计量特征的季节变化进行了分析,为揭示油松的养分利用效率和合理经营提供了依据。不同植被恢复模式下的植物对养分的竞争策略和归还土壤的能力存在较大差异[5],自然恢复的雨林在地表碳存储和土壤保持方面都高于人工恢复的桉树Eucalyptus robusta[6],与单一植被相比,混合栽培植物能保留更多的养分,并促进养分更快循环,有利于缓解养分竞争[7],李非凡等[8]研究发现:红锥Castanopsis hystrix人工林土壤碳、氮、磷含量和凋落物养分回归效率高于次生林。土壤生态化学计量特征的影响因素在大尺度的气候[9]、地形[10]已有了较多研究,但对小尺度的凋落物、土壤根系、团聚体等因素研究较少。云南松Pinus yunnanensis在滇东地区广泛分布,具有生长快、耐干旱贫瘠的特点,是西南喀斯特区荒山造林的先锋树种[11],本研究以滇东石漠化坡地的云南松纯林、云南松人工混交林、云南松天然次生林为研究对象,通过研究云南松不同恢复模式土壤碳、氮、磷质量分数及化学计量比特征,明晰不同恢复模式下云南松林土壤碳、氮、磷化学计量特征在水平和垂直方向的空间变化规律并探讨其影响因子,为喀斯特地区植被恢复和重建提供理论依据。
-
研究区位于滇东喀斯特高原山地北部(25°35′~25°57′N,103°29′~103°39′E),为断陷盆地,地势崎岖,地下裂隙纵横发育,地表小生境广泛分布。海拔为1 960~2 040 m。属于典型的亚热带高原季风气候,夏秋温暖湿润,冬春干燥寒冷,年降水量为1 073~1 090 mm,雨季为5—10月,降水量占全年的87.3%,全年≥10 ℃积温为4 436 ℃,全年无霜期为280 d。土壤浅薄不连续,以黄棕壤、红壤为主。由于严重的土壤侵蚀和人类活动的影响,原生林大量减少,大部分演化为次生植被——暖温性针叶、阔叶云南松林,各种地带性植被镶嵌交叉分布,森林覆盖率为75.7%。样地概况见表1。
表 1 样地基本特征
Table 1. Basic characteristics of the plot
样地类型 坡度/(°) 坡向 土壤类型 平均
林龄/a优势树种 平均树高/m 平均胸径/cm 凋落物储量/
(t·hm−2)生境类型 纯林 19.95 NE 棕红色石灰土 15 云南松 10.3±0.65 b 11.7±1.55 b 5.09 c 土坡 人工混交林 18.49 SE 棕红色石灰土 >30 云南松、滇油杉、华山松 12.5±0.31 ab 13.3±1.40 ab 6.28 b 土坡、土面 天然次生林 15.43 E 棕红色石灰土 >50 云南松、滇油杉、华山松、麻栎 13.4±0.42 a 14.7±1.49 a 9.93 a 石沟、 土面 说明:滇油杉Keteleeria evelyniana、华山松Pinus armandii、麻栎Quercus acutissima,同列不同小写字母表示差异显著(P<0.05)。 -
在滇东石漠化区的云南松纯林、云南松人工混交林和云南松天然次生林中分别布设3个监测样地(20 m×20 m),选择海拔、坡度等立地条件基本一致的典型区域作为标准样地。在每个样地中,设置3个0.5 m× 0.5 m的小样方,收取样方内所有凋落物,混合为1个样品;按蛇形布点法选3个采样点,用环刀法分别挖取0~10、10~20、20~40、40~60 cm的土壤,采样3次后分别混合均匀。将凋落物样品放入烘箱中75 ℃烘干至恒量;土壤样品于室内风干,过60目筛,称取100 g风干土用纯水浸润过夜,过0.25 mm粒径筛子,在纯水环境中进行湿筛震荡(振幅4 cm,频率30次·min−1),进而得到粒径>0.25 mm的大团聚体和粒径<0.25 mm的微团聚体2个粒径组分。土壤和凋落物碳采用重铬酸钾氧化-容量法测定;凋落物样品用靛酚蓝比色法测氮质量分数,钼锑抗比色法测磷质量分数;土壤氮质量分数采用自动凯氏定氮仪法测定,土壤磷质量分数采用紫外-可见光分光光度计法测定。土壤容重采用环刀法测定,土壤含水率采用烘干法测定,土壤孔隙度用环刀法和比重瓶法计算。根长密度应用方形整段标本法采集土样,由单位土壤中的根系长度与土壤体积之比得出。
-
应用Excel和SPSS 26.0软件对数据进行初步整理和描述统计分析;采用单因素方差分析(one-way ANOVA)并用LSD法进行多重比较;对样地凋落物和土壤的碳、氮、磷化学计量特征进行Pearson相关性分析;用Oringin 8.0绘图;采用 Canoco 5.0中的冗余分析法(RDA)分析土壤化学计量特征的影响因子。
-
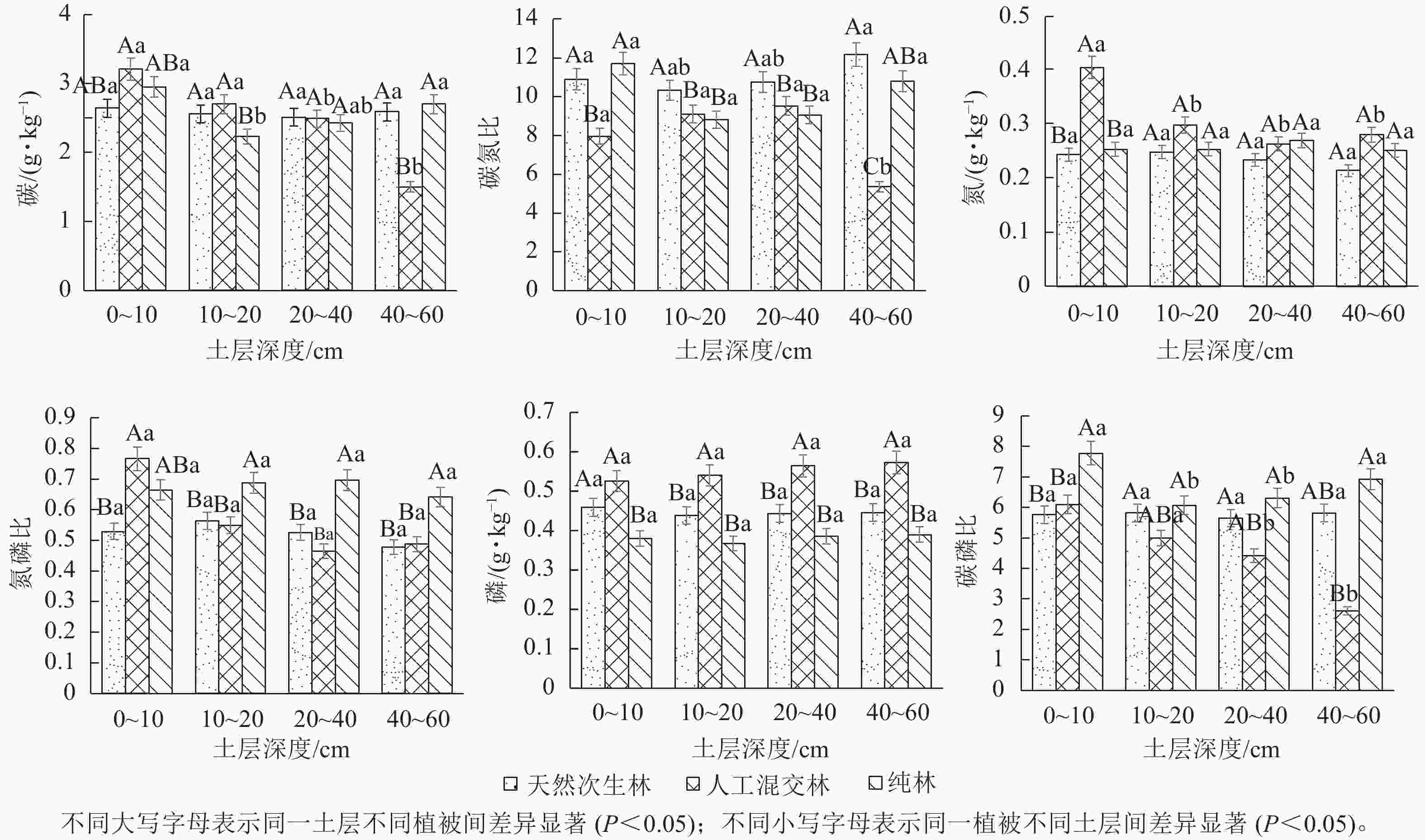
由表2可知:云南松林凋落物碳、氮、磷质量分数都显著高于土壤(P<0.05),凋落物碳和氮质量分数从大到小均为天然次生林、人工混交林、纯林,凋落物碳氮比从大到小为纯林、人工混交林、天然次生林,化学计量比均差异显著(P<0.05)。云南松林土壤碳、氮、磷质量分数均值分别为2.94、0.26、0.46 g·kg−1,云南松天然次生林的土壤碳质量分数显著高于人工混交林和纯林(P<0.05),土壤氮和磷则在人工混交林中最丰富,土壤磷质量分数差异不显著(P>0.05)。云南松林土壤碳氮比、氮磷比和碳磷比均值分别为11.43、0.59和4.53,天然次生林土壤的碳氮比和碳磷比显著高于纯林和人工混交林(P<0.05),纯林土壤的氮磷比显著高于人工混交林和天然次生林(P<0.05)。
表 2 凋落物和土壤碳、氮、磷化学计量特征
Table 2. Stoichiometric characteristics of C, N and P in litter and soil
样地类型 组分 碳/(g·kg−1) 氮/(g·kg−1) 磷/(g·kg−1) 碳氮比 氮磷比 碳磷比 天然次生林 凋落物 415.55±22.34 b 9.78±1.83 a 0.45±0.04 ab 42.50±5.54 b 21.63±5.78 a 919.22±53.57 a 土壤 3.58± 0.53 a 0.23±0.01 ab 0.45±0.02 a 15.56±2.34 a 0.52±0.03 b 7.96±1.37 a 人工混交林 凋落物 416.43±13.46 b 7.99±1.75 a 0.75±0.04 a 52.09±2.31 b 10.67±1.93 b 555.73±23.16 b 土壤 2.68±0.57 b 0.31±0.01 a 0.55±0.01 a 8.64±1.27 bc 0.57±0.01 ab 4.87±1.13 b 纯林 凋落物 433.45±30.67 a 6.29±1.67 b 0.44±0.01 ab 68.96±5.85 a 14.37±1.67 ab 990.84±45.80 a 土壤 2.58±0.07 b 0.26±0.01 ab 0.38±0.02 ab 10.10±1.47 b 0.67±0.04 a 6.77±1.23 a 说明:同列不同小写字母表示同一组分间差异显著(P<0.05)。 由图1可知:除天然次生林土壤中碳随土层加深逐渐增加,人工混交林和纯林土壤中碳和氮质量分数都随土层加深递减,在0~10 cm土层中最大,碳和氮呈表聚性;土壤磷在3种云南松恢复模式中变化都较小;随土层加深天然次生林土壤碳氮比递增,人工混交林和纯林土壤碳氮比递减,3种云南松林土壤氮磷比和碳磷比都递减。
-
由表3可知:3种云南松林恢复模式下凋落物和土壤碳、氮、磷化学计量特征存在相关关系。土壤碳与凋落物碳呈显著正相关(P<0.05),与凋落物碳氮比呈极显著负相关(P<0.01),与凋落物氮呈显著正相关(P<0.05)。土壤氮与凋落物碳氮比呈显著负相关(P<0.05)。土壤磷与凋落物磷、土壤碳氮比与凋落物氮磷比呈显著正相关(P<0.05)。
表 3 凋落物与土壤碳、氮、磷化学计量特征相关关系
Table 3. Correlation of stoichiometric characteristics of litter and soil C, N and P
组分 指标 凋落物 碳 氮 磷 碳氮比 氮磷比 碳磷比 土壤 碳 0.474* 0.510* − −0.728** − − 氮 − − − −0.675* − − 磷 − − 0.542* − − − 碳氮比 − − − − 0.684* − 氮磷比 − − − −- − − 碳磷比 − − − − − − 说明:*表示显著相关 (P<0.05),**表示极显著相关 (P<0.01)。− 表示存在自相关关系,不宜进行相关分析。 -
由图2所示:第1轴解释度为62.87%,主要因子有大团聚体、微团聚体、凋落物碳和氮磷比、土壤含水率、容重;第2轴解释度为27.02%,主要因子有凋落物氮、碳氮比和根长密度。大团聚体、土壤孔隙度与土壤碳、氮、氮磷比和碳磷比呈显著负相关,凋落物氮与土壤氮、氮磷比呈显著正相关,根长密度与土壤碳、氮、磷呈显著正相关,微团聚体、容重与土壤碳、氮、碳磷比呈显著正相关,土壤含水率、凋落物氮磷比与土壤碳、碳氮比呈显著正相关,凋落物碳氮比与土壤碳、氮、碳磷比、氮磷比呈显著负相关。
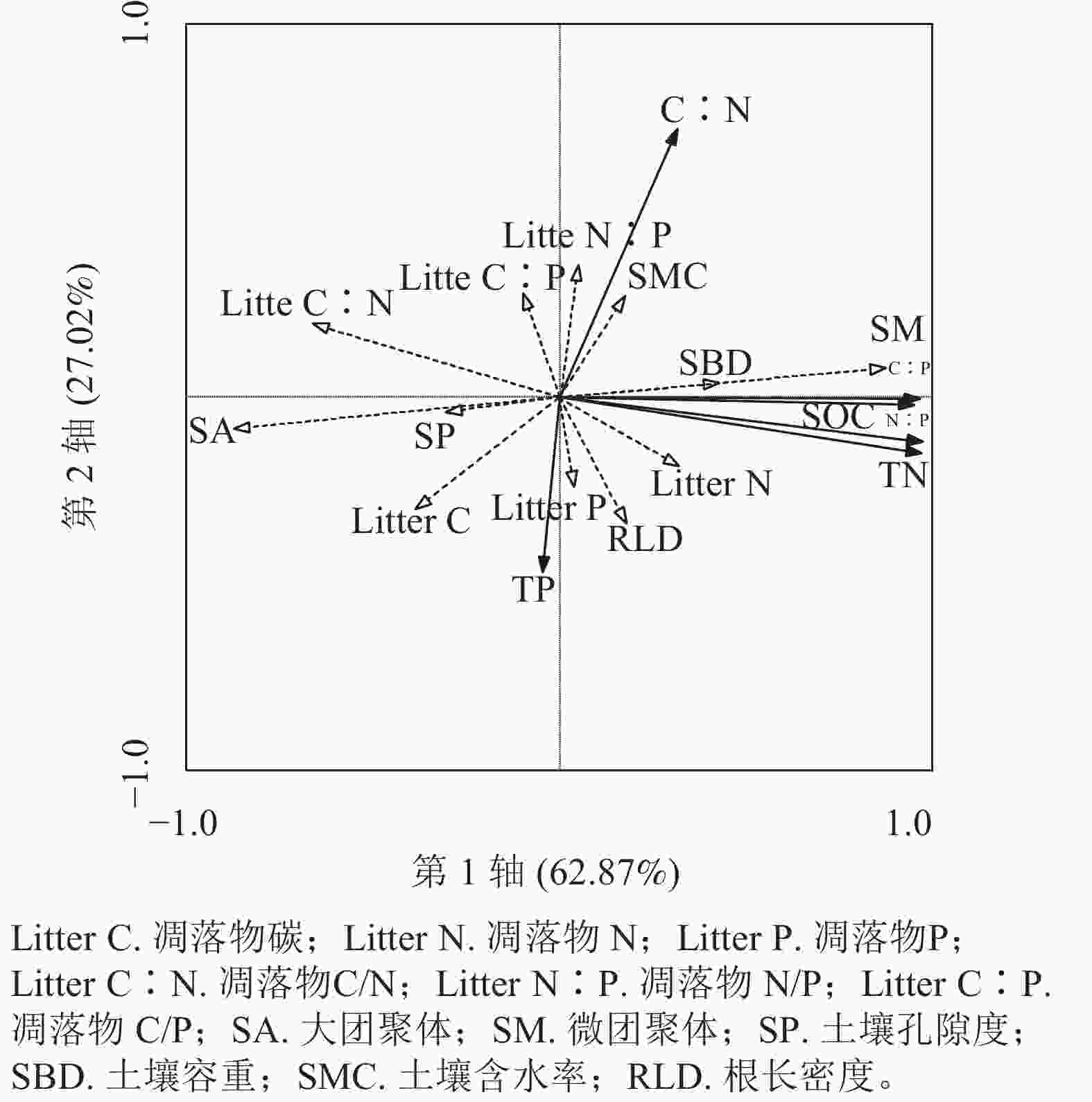
图 2 影响因子与土壤化学计量特征的RDA排序
Figure 2. RDA ranking of impact factors and soil stoichiometry characteristics
由图3所示:3种云南松林恢复模式中,大团聚体质量分数显著高于微团聚体(P<0.05),大团聚体质量分数超过90%,说明云南松林有利于土壤大团聚体形成,人工混交林土壤大团聚体质量分数最高,纯林土壤微团聚体质量分数最高。
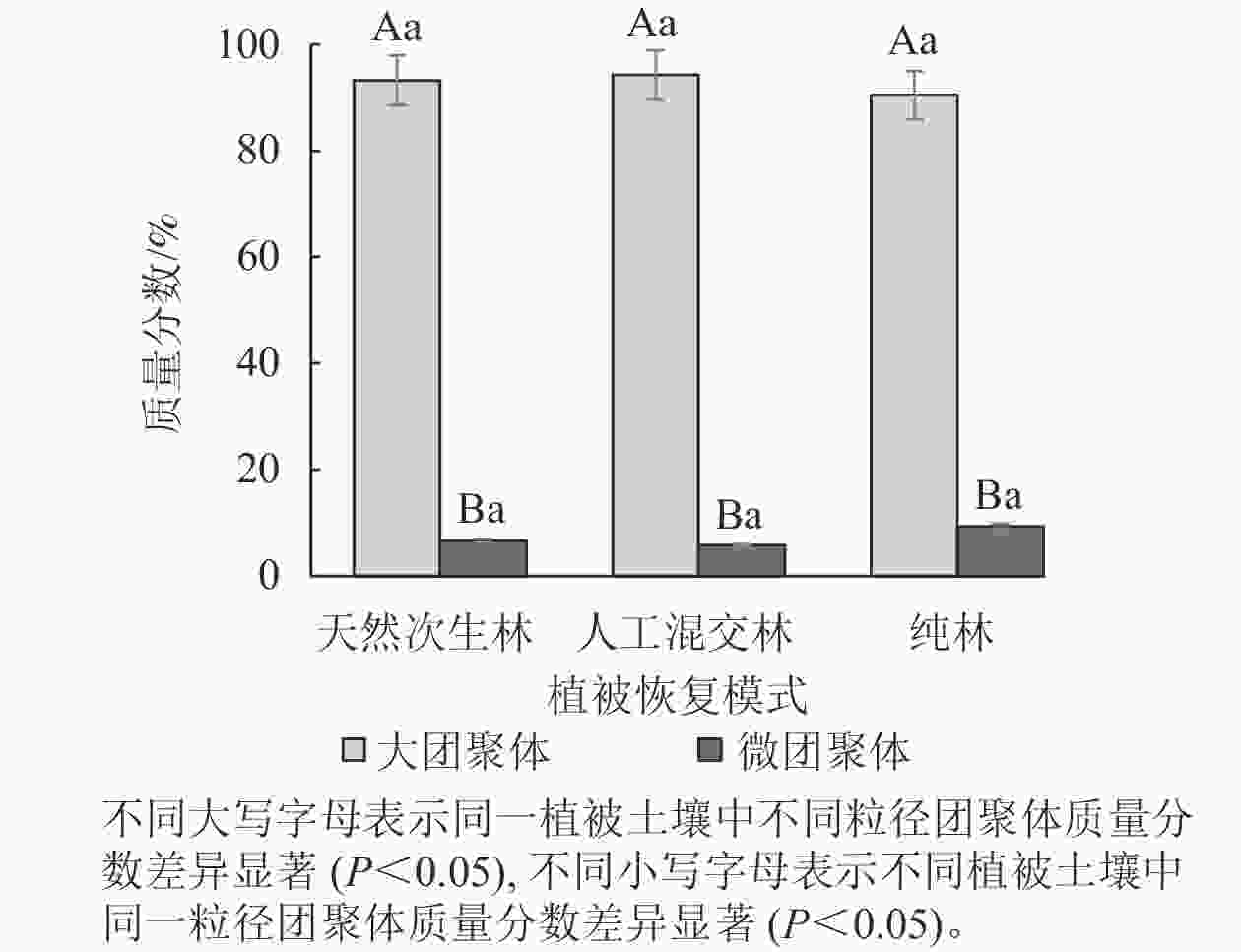
图 3 不同植被恢复模式土壤团聚体分布特征
Figure 3. Distribution characteristics of soil aggregates in different vegetation restoration modes
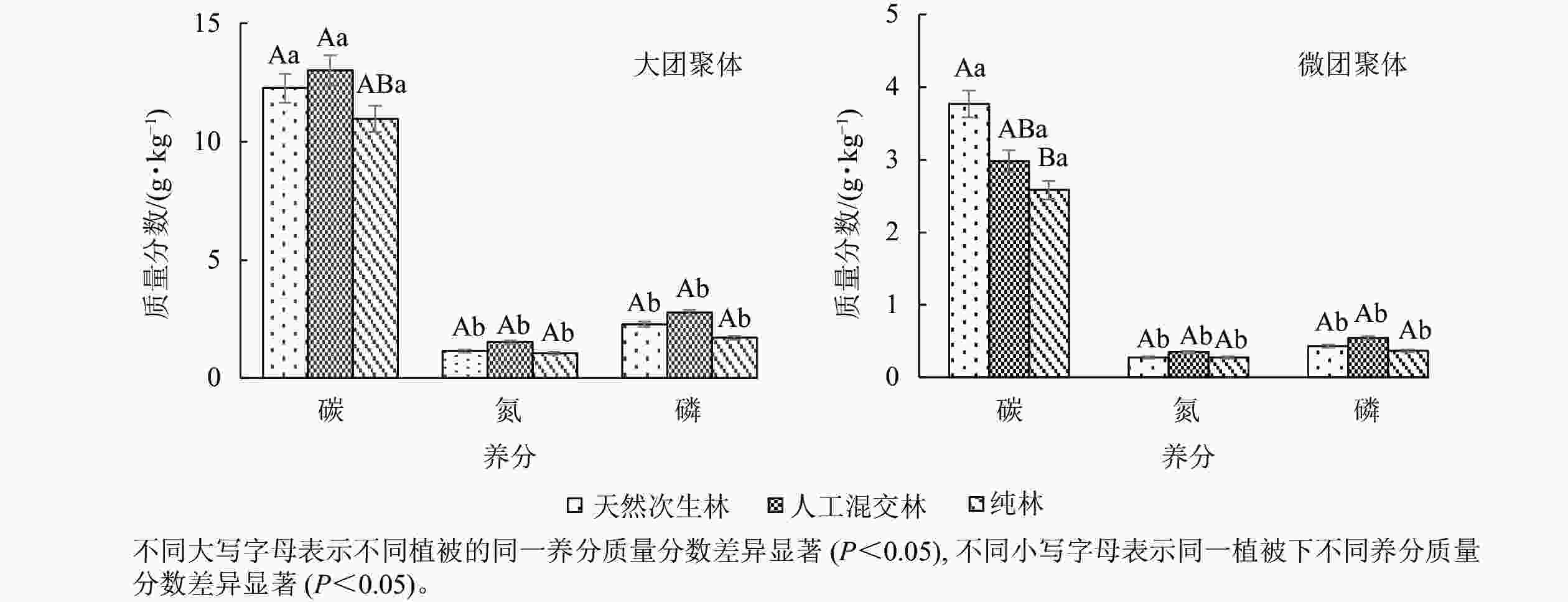
由图4可知:云南松林土壤不同团聚体组分对土壤碳、氮、磷的固存能力存在差异,大团聚体碳、氮、磷质量分数显著高于微团聚体;在大团聚体中,云南松林土壤团聚体碳、氮、磷质量分数从高到低依次为人工混交林、天然次生林、纯林;天然次生林下土壤微团聚中碳质量分数最高,微团聚体氮和磷质量分数从高到低依次为人工混交林、天然次生林、纯林,团聚体氮质量分数在大团聚体和微团聚体中都以人工混交林土壤最多。说明在云南松林恢复模式中,土壤大团聚体更有利于土壤碳、氮、磷的固存,且人工混交林下土壤大团聚体对碳、氮、磷的积累效应最好。
-
土壤碳、氮、磷是养分元素转化与循环的关键,驱动和平衡着整个喀斯特系统的生态过程,是土壤有机质组成和质量变化的基础指标[12]。滇东喀斯特云南松土壤碳、氮、磷质量分数均值为2.94、0.26、0.46 g·kg−1,与滇中喀斯特土壤(9.92、0.76、0.40 g·kg−1)[13]、滇南云南松林地土壤(50.20、4.54、0.51 g·kg−1)[14]相比,呈低碳和低氮的格局,说明云南松林恢复模式可维持土壤磷库,但碳氮流失严重。可能是因为云南松林凋落物中含有很多木质素、木栓、角质等难以分解的物质[15],导致碳、氮回归土壤较少。此外,云南松林林多生长于土面漏斗、石沟、石坑生境中,该系列小生境都有地面土壤不连续、地下裂隙纵横发育的特点,养分易随土壤漏失,结合当地高温多雨的气候,土壤碳、氮矿化速率较快且不易保存。张子琦等[16]也表明:土壤矿化速率高会导致土壤肥力下降。土壤磷元素主要受岩石和地形的影响[17],受其他外界因素影响很小,所以水平和垂直变异性都很小,这与许宇星等[18]的人工林土壤中磷在垂直方向变化小的研究结果相似。云南松天然次生林的土壤碳质量分数显著高于人工混交林和纯林(P<0.05),凋落物是主要原因,LIAO等[19]指出:凋落物质量和类型是影响凋落物分解的关键因素,天然次生林包括众多针阔混交树种,凋落物数量大、类型多样,加速了凋落物向土壤的养分归还速率,使天然次生林的土壤碳较丰富。云南松人工混交林下的土壤氮和磷质量分数为最高,高于纯林。WEI等[20]研究表明:多样化的植被能够增加土壤的固氮能力,还能促进凋落物氮的释放[21],使氮元素回归土壤较多,混交林群落并促进养分更快循环,使土壤保留更多的养分[7]。
从土壤垂直方向上看,土壤碳质量分数在天然次生林土壤中随土层加深逐渐增加,这可能是因为天然林生长年限长,当地丰富的降水使表层土壤长期受淋溶作用影响[22],养分易随土面和石沟的垂直裂隙向下迁移,使土壤碳在深层土壤逐渐积累。在3种云南松林恢复模式下,土壤碳和氮都在土层0~10 cm最为丰富,呈表聚性,这是因为浅层土壤养分主要受土壤表面凋落物归还量[23]和根系[24]的影响,凋落物和死亡的根系使土壤有机质来源丰富,加上滇东高温多雨,有机质分解速率快,导致表层土壤碳和氮质量分数最高。
土壤化学计量比是衡量土壤碳、氮、磷矿化和固持作用的指标。滇东石漠化坡地土壤碳氮比、氮磷比、碳磷比均值分别为11.43、0.59和4.53,小于滇中喀斯特区[13](12.65、1.94、25.80)、茂兰喀斯特区[25](11.95、6.64、79.16)和高原峡谷喀斯特区[26](3.17、14.00、43.09)。其中碳氮比高于高原峡谷区的土壤,这是研究区土壤氮元素较贫瘠导致的,土壤碳磷比远小于其他地区,可能是因为该地土壤的磷有效性较高。土壤碳氮比和碳磷比在天然次生林下最大,这跟凋落物输入土壤的质与量有关[27],天然次生林的凋落物储量最高导致土壤有机质输入最多,从而使碳和其他养分的营养比最大。研究区土壤氮磷比均值为0.59,3种云南松恢复模式下的凋落物氮磷比都小于25,刘娜等[28]研究表明:土壤氮磷比<14,则土壤缺氮,而凋落物氮磷比<25时,分解主要受氮元素限制[29],说明滇东云南松林土壤氮缺乏且凋落物分解也受氮元素限制。天然次生林下土壤氮磷比最小,表明天然次生林下的土壤氮元素最缺乏,人工纯林相对较好。这可能是因为成熟的天然次生林对蛋白质和核酸的需求较大,导致土壤氮储量较少,而纯林有适量的施肥维护,此外,氮沉降易发生在植被覆盖较低的土壤[30],纯林覆盖率较低,氮沉降易直接作用于土壤。
凋落物与土壤存在耦合关系,两者的碳、氮、磷及其化学计量比具有显著相关关系。喀斯特地区土壤浅薄、不连续,水土涵养能力弱,土壤养分主要来自于凋落物归还[23]。碳和氮是评价凋落物质量的重要因素,凋落物碳氮比与土壤碳、氮呈显著负相关,主要是因为植被中较低的凋落物碳氮比具有较高的氮利用率和较快的调落物分解效率[31],天然次生林下的凋落物储量多且碳氮比较低,分解速率快,所以土壤的养分保持率高。刘艳等[32]指出:地表凋落物能促进土壤大团聚体的形成,从而改善土壤结构,大团聚体能反过来对土壤养分提供物理保护,因此,云南松恢复模式下凋落物储量较多,土壤大团聚体数量占优势,人工混交林下的土壤大团聚体质量分数最高,对养分的积累效应最好。土壤容重和孔隙度是土壤通气水平和土壤紧实度的指标[10],土壤碳、氮质量分数与土壤容重呈负相关,与土壤孔隙度呈正相关,说明本研究区中较紧密的土壤结构更利于养分的保持,这跟滇东地区土壤易受侵蚀、漏失有很大关系。根长密度与土壤氮、磷质量分数呈显著正相关,根系对土壤结构具有锚固加筋作用[33],根系本身的有机质输入也是土壤养分的重要来源[24],密集的根系有利于土壤养分的保存。
-
滇东喀斯特区云南松土壤呈低碳低氮格局,土壤磷有效性较高,土壤碳和氮在云南松林土壤中呈表聚性。研究区植被生长主要受氮元素限制,云南松天然次生林土壤氮最缺乏,但土壤碳较为丰富,土壤氮和磷人工混交林最丰富,纯林最缺乏。因此,在滇东石漠化区云南松植被恢复过程中应用针阔混交林替代纯林,注重地表凋落物和地下根系有机质的保存,可通过人工干预间接改造土壤大团聚体、容重、孔隙度等土壤物理性质,改善土壤结构,促进养分积累。
Stoichiometric characteristics and influencing factors of soil C, N and P in Pinus yunnanensis forests under different restoration modes on rocky desertification slope land in eastern Yunnan
-
摘要:
目的 研究不同植被恢复模式下云南松Pinus yunnanensis林土壤碳、氮、磷化学计量特征,为喀斯特石漠化区植被恢复和土壤肥力提高提供依据。 方法 在滇东石漠化区选取云南松纯林、云南松人工混交林、云南松天然次生林为研究对象,测定各样地0~10、10~20、20~40、40~60 cm土层土壤的碳、氮、磷质量分数,计算其化学计量比并用冗余分析工具分析土壤化学计量特征的影响因子。 结果 滇东喀斯特区云南松林土壤碳、氮、磷质量分数均值分别为2.94、0.26、0.46 g·kg−1,呈低碳低氮格局。云南松天然次生林的土壤有机碳质量分数显著高于人工混交林和纯林(P<0.05),人工混交林土壤氮和磷质量分数最为丰富,土壤磷质量分数差异不显著(P>0.05);天然次生林土壤有机碳质量分数随土层加深递增,人工混交林和纯林土壤碳、氮质量分数在土层0~10 cm达最大,呈表聚性,土壤磷质量分数在云南松林不同土层中变异较小。云南松林土壤碳氮比、氮磷比和碳磷比均值分别为11.43、0.59和4.53,天然次生林土壤的碳氮比和碳磷比显著高于纯林和人工混交林(P<0.05),纯林土壤氮磷比最大,3种云南松林下土壤氮磷比小于14,凋落物氮磷比小于25,土壤氮缺乏且凋落物分解也受氮元素限制,其中天然次生林土壤氮最缺乏;人工混交林和纯林土壤碳氮比随土层加深递减,3种云南松林土壤氮磷比和碳磷比随土层加深递减。研究区土壤碳、氮、磷化学计量特征受凋落物碳氮比和土壤大团聚体、容重、孔隙度、根长密度等环境因素的影响。 结论 滇东云南松林土壤呈低碳低氮格局,主要受氮元素限制,建议云南松林恢复时用混交林代替纯林,并针对元素限制性的植被施肥。图4表3参33 Abstract:Objective The objective is to study the stoichiometric characteristics of soil carbon (C), nitrogen (N) and phosphorus (P) of Pinus yunnanensis under different vegetation restoration modes, so as to provide the basis for vegetation restoration and fertility improvement in karst rocky desertification areas. Method Pure forest, artificial mixed forest and natural secondary forest of P. yunnanensis were selected as research objects in the rocky desertification area of eastern Yunnan. The contents of C, N and P in 0−10, 10−20, 20−40 and 40−60 cm soil layers of various plots were measured , the stoichiometric ratio was calculated and the influencing factors of soil stoichiometric characteristics were analyzed with redundancy analysis tools. Result The average contents of soil C, N and P of P. yunnanensis vegetation were 2.94, 0.26 and 0.46 g·kg−1, showing a pattern of low C and low N. The soil organic C content in natural secondary forest was significantly higher than that in artificial mixed forest and pure forest (P<0.05), and the artificial mixed forest had the richest soil N and P contents. There was no significant difference in soil P content (P>0.05). Soil organic C content in natural secondary forest increased with soil deepening, while soil C and N contents in artificial mixed forest and pure forest reached the maximum in 0−10 cm soil layer, showing a surface aggregation. The soil P content had little variation in different soil layers of P. yunnanensis. The mean values of soil C/N, N/P and C/P in P. yunnanensis vegetation were 11.43, 0.59 and 4.53, and the values of soil C/N and C/P in natural secondary forest were significantly higher than those in pure forest and artificial mixed forest (P<0.05). The soil N/P ratio in pure forest was the greatest. In the 3 P. yunnanensis vegetation types, the soil N/P ratio was less than 14 and the litter N/P ratio was less than 25, so soil N was deficient and litter decomposition was also limited by N. The natural secondary forest was the most deficient in soil N. With the deepening of soil, the soil C/N ratio in artificial mixed forest and pure forest decreased, so did the soil N/P ratio and C/P ratio of the 3 P. yunnanensis vegetation. The stoichiometric characteristics of soil C, N and P in the study area were affected by the litter C/N ratio, soil macroaggregates, bulk density, porosity, root length density and other environmental factors. Conclusion The vegetation soil of P. yunnanensis in eastern Yunnan presents a pattern of low C and low N, which is mainly limited by N elements. It is suggested that mixed forest should be used instead of pure forest in vegetation restoration of P. yunnanensis, and fertilization should be applied to vegetation with limited elements. [Ch, 4 fig. 3 tab. 33 ref.] -
表 1 样地基本特征
Table 1. Basic characteristics of the plot
样地类型 坡度/(°) 坡向 土壤类型 平均
林龄/a优势树种 平均树高/m 平均胸径/cm 凋落物储量/
(t·hm−2)生境类型 纯林 19.95 NE 棕红色石灰土 15 云南松 10.3±0.65 b 11.7±1.55 b 5.09 c 土坡 人工混交林 18.49 SE 棕红色石灰土 >30 云南松、滇油杉、华山松 12.5±0.31 ab 13.3±1.40 ab 6.28 b 土坡、土面 天然次生林 15.43 E 棕红色石灰土 >50 云南松、滇油杉、华山松、麻栎 13.4±0.42 a 14.7±1.49 a 9.93 a 石沟、 土面 说明:滇油杉Keteleeria evelyniana、华山松Pinus armandii、麻栎Quercus acutissima,同列不同小写字母表示差异显著(P<0.05)。 表 2 凋落物和土壤碳、氮、磷化学计量特征
Table 2. Stoichiometric characteristics of C, N and P in litter and soil
样地类型 组分 碳/(g·kg−1) 氮/(g·kg−1) 磷/(g·kg−1) 碳氮比 氮磷比 碳磷比 天然次生林 凋落物 415.55±22.34 b 9.78±1.83 a 0.45±0.04 ab 42.50±5.54 b 21.63±5.78 a 919.22±53.57 a 土壤 3.58± 0.53 a 0.23±0.01 ab 0.45±0.02 a 15.56±2.34 a 0.52±0.03 b 7.96±1.37 a 人工混交林 凋落物 416.43±13.46 b 7.99±1.75 a 0.75±0.04 a 52.09±2.31 b 10.67±1.93 b 555.73±23.16 b 土壤 2.68±0.57 b 0.31±0.01 a 0.55±0.01 a 8.64±1.27 bc 0.57±0.01 ab 4.87±1.13 b 纯林 凋落物 433.45±30.67 a 6.29±1.67 b 0.44±0.01 ab 68.96±5.85 a 14.37±1.67 ab 990.84±45.80 a 土壤 2.58±0.07 b 0.26±0.01 ab 0.38±0.02 ab 10.10±1.47 b 0.67±0.04 a 6.77±1.23 a 说明:同列不同小写字母表示同一组分间差异显著(P<0.05)。 表 3 凋落物与土壤碳、氮、磷化学计量特征相关关系
Table 3. Correlation of stoichiometric characteristics of litter and soil C, N and P
组分 指标 凋落物 碳 氮 磷 碳氮比 氮磷比 碳磷比 土壤 碳 0.474* 0.510* − −0.728** − − 氮 − − − −0.675* − − 磷 − − 0.542* − − − 碳氮比 − − − − 0.684* − 氮磷比 − − − −- − − 碳磷比 − − − − − − 说明:*表示显著相关 (P<0.05),**表示极显著相关 (P<0.01)。− 表示存在自相关关系,不宜进行相关分析。 -
[1] 贺金生, 韩兴国. 生态化学计量学: 探索从个体到生态系统的统一化理论[J]. 植物生态学报, 2010, 34(1): 2 − 6. HE Jinsheng, HAN Xingguo. Ecological stoichiometry: searching for unifying principles from individuals to ecosystems [J]. Chinese Journal of Plant Ecology, 2010, 34(1): 2 − 6. [2] AGREN G I. The C∶N∶P stoichiometry of autotrophs: theory and observations [J]. Ecology Letters, 2004, 7(3): 185 − 191. [3] 王霖娇, 汪攀, 盛茂银. 西南喀斯特典型石漠化生态系统土壤养分生态化学计量特征及其影响因素[J]. 生态学报, 2018, 38(18): 6580 − 6593. WANG Linjiao, WANG Pan, SHENG Maoyin. Stoichiometric characteristics of soil nutrient elements and its influencing factors in typical karst rocky desertification ecosystems, Southwest China [J]. Acta Ecologica Sinica, 2018, 38(18): 6580 − 6593. [4] 王亚娟, 陈云明, 孙亚荣, 等. 黄土丘陵区油松人工林植物器官-凋落物-土壤化学计量特征的季节变化[J]. 水土保持学报, 2022, 36(4): 350 − 356. WANG Yajun, CHEN Yunming, SUN Yarong, et al. Seasonal variation of plant organ-litter-soil stoichiometry in Pinus tabulae formis plantation in Loess Hilly Region [J]. Journal of Soil and Water Conservation, 2022, 36(4): 350 − 356. [5] GÜSEWELL S. N∶P ratios in terrestrial plants: variation and functional significance [J]. New Phytologist, 2004, 164(2): 243 − 266. [6] HUA Fangyuan, BRUIJNZEEL L A, MELI P, et al. The biodiversity and ecosystem service contributions and trade-offs of forest restoration approaches[J/OL]. Science, 2022, 376(6595): 839[2022-05-15]. doi: 10.1126/science.abl4649. [7] CHEN Xinlin, CHEN H Y H, SEARLE E B, et al. Negative to positive shifts in diversity effects on soil nitrogen over time [J]. Nature Sustainability, 2020, 4(3): 225 − 232. [8] 李非凡, 孙冰, 裴男才, 等. 粤北3种林分凋落叶-根系-土壤生态化学计量特征[J]. 浙江农林大学学报, 2020, 37(1): 18 − 26. LI Feifan, SUN Bing, PEI Nancai, et al. Characteristics of litter-root-soil ecological stoichiometry of three forest stands in northern Guangdong [J]. Journal of Zhejiang A&F University, 2020, 37(1): 18 − 26. [9] 尉剑飞, 王誉陶, 张翼, 等. 黄土高原典型草原植被及土壤化学计量对降水变化的响应[J]. 草地学报, 2022, 30(3): 532 − 543. WEI Jianfei, WANG Yutao, ZHANG Yi, et al. Response of vegetation and soil stoichiometry to precipitation gradients of typical steppe in the Loess Plateau [J]. Acta Agrestia Sinica, 2022, 30(3): 532 − 543. [10] 董廷发. 不同海拔云南松林土壤养分及其生态化学计量特征[J]. 生态学杂志, 2021, 40(3): 672 − 679. DONG Tingfa. Soil nutrients and ecological stoichiometry in Pinus yunnanensis forests at different elevations [J]. Chinese Journal of Ecology, 2021, 40(3): 672 − 679. [11] 余茂源. 云南松种质资源与遗传多样性研究进展[J]. 林业调查规划, 2011, 36(3): 39 − 42. YU Maoyuan. Research advances of Pinus yunnanensis germplasm resources and genetic diversity [J]. Forest Inventory and Planning, 2011, 36(3): 39 − 42. [12] 李艳琼, 黄玉清, 徐广平, 等. 桂林会仙喀斯特湿地芦苇群落土壤养分及微生物活性[J]. 生态学杂志, 2018, 37(1): 64 − 74. LI Yanqiong, HUANG Yuqing, XU Guangping, et al. Characteristics of soil nutrients and microbial activities of reed vegetation in the Huixian karst wetland, Guilin, China [J]. Chinese Journal of Ecology, 2018, 37(1): 64 − 74. [13] 张雨鉴, 王克勤, 宋娅丽, 等. 滇中亚高山森林植物叶-凋落叶-土壤生态化学计量特征[J]. 生态学报, 2020, 40(21): 7648 − 7658. ZHANG Yujian, WANG Keqin, SONG Yali, et al. Ecological stoichiometry of leaf-litter-soil of alpine forest plants in central Yunnan, China [J]. Acta Ecologica Sinica, 2020, 40(21): 7648 − 7658. [14] 陶慧敏, 孙宁骁, 温家豪, 等. 滇南喀斯特地区灌木群落和人工林土壤元素化学计量特征[J]. 生态学报, 2019, 39(24): 9119 − 9130. TAO Huimin, SUN Ningxiao, WEN Jiahao, et al. Characteristics of soil stoichiometry in native shrub and plantation communities in karst regions of Yunnan Province [J]. Acta Ecologica Sinica, 2019, 39(24): 9119 − 9130. [15] DERENNE S, LARGEAU C. A review of some important families of refractory macromolecules: composition, origin, and fate in soils and sediments [J]. Soil Science, 2001, 166(11): 833 − 847. [16] 张子琦, 焦菊英, 陈同德, 等. 拉萨河流域洪积扇不同植被类型的土壤化学计量特征[J]. 生态学报, 2022, 42(16): 6801 − 6815. ZHANG Ziqi, JIAO Juying, CHEN Tongde, et al. Soil stoichiometry characteristics of different vegetation types in alluvial fans of the Lhasa River Basin[J]. Acta Ecologica Sinica, 2022, 42(16): 6801 − 6815. [17] 吕金林, 闫美杰, 宋变兰, 等. 黄土丘陵区刺槐、辽东栎林地土壤碳、氮、磷生态化学计量特征[J]. 生态学报, 2017, 37(10): 3385 − 3393. LÜ Jinlin, YAN Meijie, SONG Bianlan, et al. Ecological stoichiometry characteristics of soil carbon, nitrogen, and phosphorus in an oak forest and a black locust plantation in the loess hilly region [J]. Acta Ecologica Sinica, 2017, 37(10): 3385 − 3393. [18] 许宇星, 王志超, 竹万宽, 等. 雷州半岛3种速生人工林下土壤生态化学计量特征[J]. 浙江农林大学学报, 2018, 35(1): 35 − 42. XU Yuxing, WANG Zhichao, ZHU Wankuan, et al. Ecological stoichiometric characteristics of soil C, N, P, and K in three types of plantations on the Leizhou Peninsula [J]. Journal of Zhejiang A&F University, 2018, 35(1): 35 − 42. [19] LIAO Chang, LONG Chunyuan, ZHANG Qian, et al. Stronger effect of litter quality than micro-organisms on leaf and root litter C and N loss at different decomposition stages following a subtropical land use change [J]. Functional Ecology, 2021, 36(4): 896 − 907. [20] WEI Xiaorong, REICH P B, HOBBIE S E, et al. Legumes regulate grassland soil N cycling and its response to variation in species diversity and N supply but not CO2 [J]. Global Change Biology, 2019, 25(7): 2396 − 2409. [21] ZHOU Guoyi, XU Shang, CIAIS P, et al. Climate and litter C/N ratio constrain soil organic carbon accumulation [J]. National Science Review, 2019, 6(4): 746 − 757. [22] 潘嘉琛, 刘超, 董智, 等. 黄泛沙地不同林龄杨树人工林土壤团聚体及有机碳特征[J]. 水土保持研究, 2022, 29(3): 25 − 30,37. PAN Jiachen, LIU Chao, DONG Zhi, et al. Distribution characteristics of soil aggregates and soil organic carbon in Populus artificial forest with different forest ages in Yellow River Flood Plain [J]. Research of Soil and Water Conservation, 2022, 29(3): 25 − 30,37. [23] 曾昭霞, 王克林, 刘孝利, 等. 桂西北喀斯特森林植物-凋落物-土壤生态化学计量特征[J]. 植物生态学报, 2015, 39(7): 682 − 693. ZENG Zhaoxia, WANG Kelin, LIU Xiaoli, et al. Stoichiometric characteristics of plants, litter and soils in karst plant communities of northwest Guangxi [J]. Chinese Journal of Plant Ecology, 2015, 39(7): 682 − 693. [24] FENG Jiguang, HE Keyi, ZHANG Qiufang, et al. Changes in plant inputs alter soil carbon and microbial communities in forest ecosystems [J]. Global Change Biology, 2022, 28(10): 3426 − 3440. [25] 吴鹏, 崔迎春, 赵文君, 等. 喀斯特森林植被自然恢复过程中土壤化学计量特征[J]. 北京林业大学学报, 2019, 41(3): 80 − 92. WU Peng, CUI Yingchun, ZHAO Wenjun, et al. Characteristics of soil stoichiometric in natural restoration process of Maolan karst forest vegetation, southwestern China [J]. Journal of Beijing Forestry University, 2019, 41(3): 80 − 92. [26] 杜家颖, 王霖娇, 盛茂银, 等. 喀斯特高原峡谷石漠化生态系统土壤C、N、P生态化学计量学特征[J]. 四川农业大学学报, 2017, 35(1): 45 − 51. DU Jiaying, WANG Llinjiao, SHENG Maoyin, et al. Soil C, N and P stoichiometry of rocky desertification ecosystems in the karst plateau canyon area [J]. Journal of Sichuan Agricultural University, 2017, 35(1): 45 − 51. [27] PANG Danbo, WANG Genzhu, LI Guijing, et al. Ecological stoichiometric Ccharacteristics of two typical plantations in the karst ecosystem of southwestern China[J/OL]. Forests, 2018, 9(2)[2022-05-16]. doi:10.3390/f9020056. [28] 刘娜, 喻理飞, 赵庆, 等. 喀斯特高原石漠化区次生林叶片-枯落物-土壤连续体碳氮磷生态化学计量特征[J]. 应用与环境生物学报, 2020, 26(3): 681 − 688. LIU Na, YU Lifei, ZHAO Qing, et al. C∶N∶P stoichiometry of leaf-litter-soil continuum in secondary forests of the rocky desertification regions of the karst plateau [J]. Chinese Journal of Applied and Environmental Biology, 2020, 26(3): 681 − 688. [29] 任悦, 高广磊, 丁国栋, 等. 沙地樟子松人工林叶片-枯落物-土壤氮磷化学计量特征[J]. 应用生态学报, 2019, 30(3): 743 − 750. REN Yue, GAO Guanglei, DING Guodong, et al. Stoichiometric characteristics of nitrogen and phosphorus in leaf-litter-soil system of Pinus sylvestris var. mongolica plantations [J]. Chinese Journal of Applied Ecology, 2019, 30(3): 743 − 750. [30] 吴丽芳, 王紫泉, 王妍, 等. 喀斯特高原不同石漠化程度土壤C、N、P化学计量特征和酶活性的关系[J]. 生态环境学报, 2019, 28(12): 2332 − 2340. WU Lifang, WANG Ziquan, WANG Yan, et al. Relationship between soil C, N, P stoichiometric characteristics and enzyme activity in karst plateau soils with different degree of rocky desertification [J]. Ecology and Environment Sciences, 2019, 28(12): 2332 − 2340. [31] 毕建华, 苏宝玲, 于大炮, 等. 辽东山区不同森林类型生态化学计量特征[J]. 生态学杂志, 2017, 36(11): 3109 − 3115. BI Jianhua, SU Baoling, YU Dapao, et al. Ecological stoichiometry of different forest types in mountainous region of eastern Liaoning Province [J]. Chinese Journal of Ecology, 2017, 36(11): 3109 − 3115. [32] 刘艳, 查同刚, 王伊琨, 等. 北京地区栓皮栎和油松人工林土壤团聚体稳定性及有机碳特征[J]. 应用生态学报, 2013, 24(3): 607 − 613. LIU Yan, ZHA Tonggang, WANG Yikun, et al. Soil aggregate stability and soil organic carbon characteristics in Quercus variabilis and Pinus tabulaeformis plantations in Beijing area [J]. Chinese Journal of Applied Ecology, 2013, 24(3): 607 − 613. [33] 余芹芹, 乔娜, 胡夏嵩, 等. 植物根-土复合体固坡力学效应及模型研究现状与进展[J]. 中国水土保持, 2011(7): 51 − 54,69. YU Qinqin, QIAO Na, HU Xiasong, et al. Current status and progress of study on mechanical effect and model of plant root-soil complex for slope consolidation [J]. Soil and Water Conservation in China, 2011(7): 51 − 54,69. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220417






 下载:
下载: