-
氮素在森林生态系统的能量流动与物质循环过程中有着非常重要的作用[1-2]。长期氮沉降以及人类活动干扰等,造成全球氮(N)沉降的增加,对自然生态系统产生了一系列影响[2-3]。研究表明:即使在没有物理扰动的情况下,长期氮沉降也会通过降低碳周转率、改变氮的有效性和转化来影响温带森林生态系统的生物地球化学循环[4]。此外,也有研究表明:氮添加会通过改变凋落叶特性(碳、氮、磷变化)对其养分分解速率产生影响[3]。据报道,中国已成为全球第三大氮沉降地区,大气含氮化合物增长迅速[5]。在未来几十年中氮沉降继续增加的背景下,研究氮沉降对森林凋落物养分分解的影响显得尤为重要[6-7]。凋落物在森林生态系统组成中占据重要地位,它的分解也会对森林生态系统的生物地球化学循环产生相当大的影响[8-9]。凋落物分解不仅是林下土壤有机质形成所需碳源以及土壤养分的主要来源,而且对于土壤质地的构建、肥力的维持、微生物代谢的调控都起重大作用,并且通过这一系列作用进而影响微生物的群落结构[10-11]。大果木姜子Cinnamomum migao又名米槁,系樟科Lauraceae樟属Cinnamomum常绿乔木,主要分布于中国广西、云南、贵州三省交界的南北盘江、红水河流域,为中国特有种。其果实常常被苗族作为治疗胃肠道疾病的传统药物,并且疗效卓越。21世纪初,贵州省科学技术厅以及贵州省民族医药研究所确定大果木姜子为贵州省的道地药材[12]。近年来,随着其药用价值的提高,大果木姜子野生资源受到极大破坏,在《中国生物多样性红色名录——高等植物卷》(2013版)已将其列为近危种,野外资源储量极其有限。目前,相关学者对大果木姜子的研究报道还不是很全面,主要集中在果实精油、脂肪油、挥发油化学成分分析[13]、药用成分的药理作用与生物活性[14-15]、栽培技术与病虫害防治[12]、地理分布[15]、生物生理特性[16-17]等方面。大果木姜子凋落叶的分解对氮沉降增加的响应规律还未见报道。本研究通过野外模拟氮沉降的试验,探讨不同施氮处理对大果木姜子凋落叶养分分解的影响,以期探讨大果木姜子凋落叶分解对外源氮添加的响应机制,且为其物质循环机理研究提供理论依据。
-
贵州省罗甸县位于云贵高原和丘陵过渡的斜坡地带,四季呈现春早、夏长、秋迟、冬短的特点,因其特殊的地势与优良的自然环境被称为大果木姜子生长的典型生境。试验样地设置于罗甸县逢亭镇西部的祥林村6年生大果木姜子药材种植基地,地处25°15′41′′N,106°31′03′′E,海拔524 m。属于亚热带季风气候,年平均气温20.6 ℃,≥10 ℃年积温为6 125.0 ℃,年降水量1200.0 mm,无霜期335.0~349.5 d,年均日照时数1 448.9 h。试验区土壤为酸性黄壤,土层厚度≥40 cm。于2017年1月初在试验地设置12块大小为3 m×5 m的样地进行试验。
-
以2010年中国大气氮沉降特征分析中贵州的氮沉降总和低于15 g·m−2·a−1为依据,本研究从低到高设置4个氮处理,即对照(ck,0 g·m−2·a−1)、低氮(N1,5 g·m−2·a−1)、中氮(N2,15 g·m−2·a−1)和高氮(N3,30 g·m−2·a−1),每处理重复3次。为消除环境异质性的影响,各样地之间间隔5 m。按照试验设计要求,每个处理设定样方面积为3 m×5 m,将各样方每次所需喷施的NH4NO3溶解于20 L自来水中,采用按压式喷壶来回均匀喷洒至样地,ck组喷洒等量的水。于试验2017年1月进行首次施氮试验,共喷洒3次,分别于1、5、9月取样完成,重新放置尼龙袋后进行等量施氮。
-
凋落叶分解试验于2017年1月开始进行,采用尼龙网袋分解方法。准备540个25 cm × 25 cm的分解袋,每个样地放置45袋。试验前于罗甸县大果木姜子林种植基地收集大果木姜子凋落叶带回实验室,清洗风干后装入分解袋中,10.00 g·袋−1。试验期间放置在12个施氮处理样地中(分解袋放置前修整空地表面枯枝落叶层,平铺网袋,使其尽可能接近自然分解状态。每次放置好尼龙袋后立即喷施氮源)。每隔2个月于各样地随机收取3袋分解袋,用刷子清除每次取回分解袋表面的泥垢后,置于75 ℃烘箱烘干至质量恒定,称其质量用于计算凋落叶质量损失率。然后研磨过孔径0.5 mm尼龙筛,保存备用。质量损失率(W):W=Xt/X0×100%。其中:X0为凋落叶初始质量,Xt为分解t时间后凋落叶质量。
-
凋落叶全氮质量分数采用H2SO4-H2O2 靛酚蓝比色法测定,全磷质量分数采用钼锑抗显色法测定,全钾质量分数采用HClO4+HNO3消煮-原子吸收分光光度法测定,碳质量分数采用浓硫酸-重铬酸钾法测定。凋落叶各元素的残留率按照下式计算。元素残留率(R):R=XtCt/X0C0×100%。其中:X0为凋落叶初始质量,Xt为分解t时间后凋落叶的质量,C0为凋落叶初始养分质量分数,Ct为t采样时间凋落叶养分质量分数。
-
运用Excel和SPSS 18.0软件进行初步统计分析,采用最小显著差法(LSD)多重方差显著性检验凋落叶质量损失率、残留率和养分质量分数与不同施氮处理间的差异显著性,利用Olson 负指数衰减模型(y=ae−Kt)对质量残留率与时间的关系进行拟合,其中:y为质量残留率(%),a为拟合参数,K为分解系数,t为时间(a)。利用Origin 2018绘制图表。
-
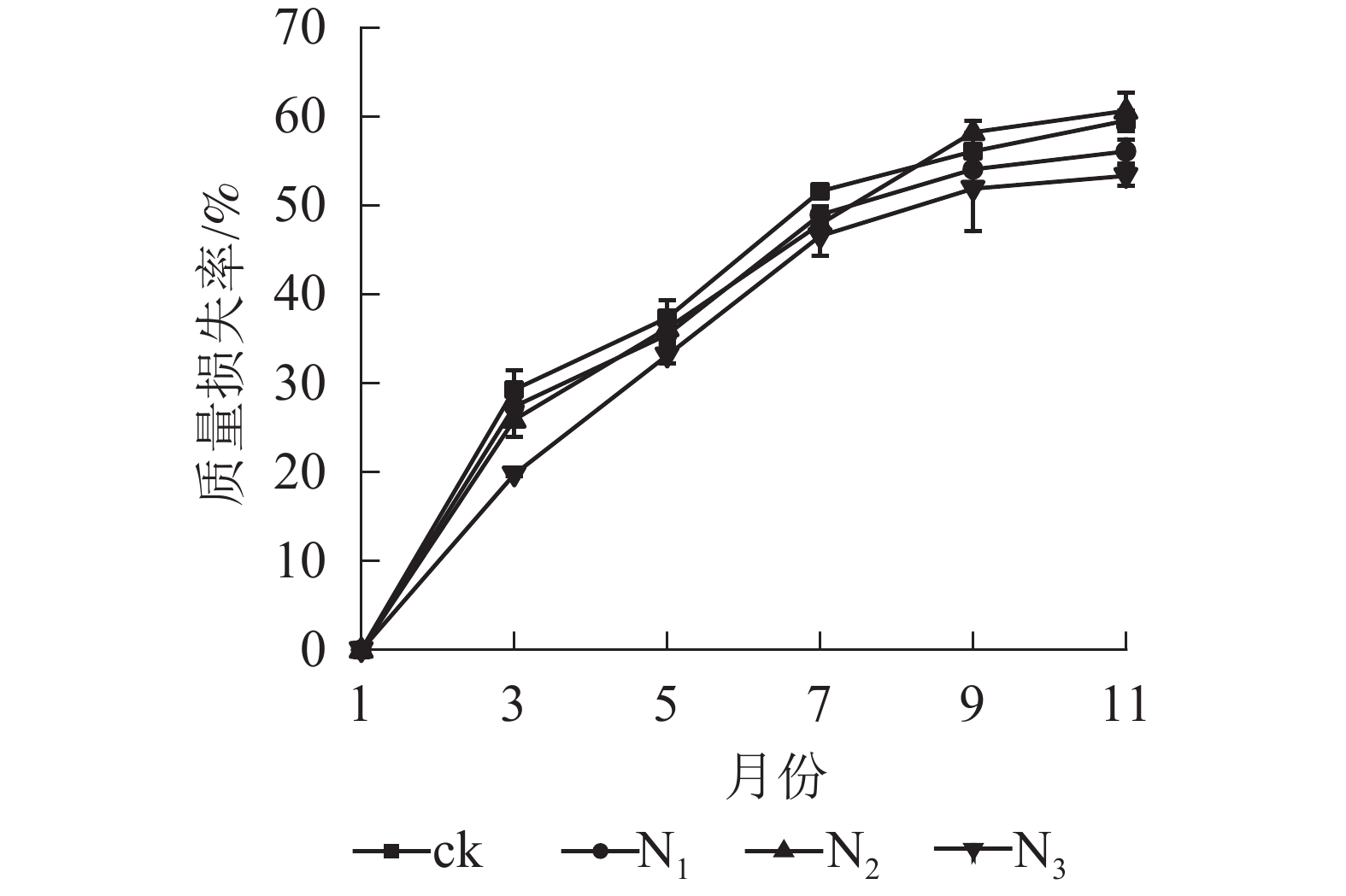
图1显示:1−9月各处理凋落叶质量损失率随着时间的推移表现为迅速递增趋势,其中ck凋落叶质量损失率大于其他处理;9月以后各处理凋落叶分解速率趋于平缓。整个分解试验过程中,N3处理凋落叶质量损失率为0~53.35%,且始终低于其他处理。9月以前,N1、N2处理凋落叶质量损失率显著高于N3处理(P<0.05),即凋落叶质量损失率从大到小依次为N2、N1、N3;分解结束时(11月),各处理凋落叶质量损失率从大到小依次为N2、ck、N1、N3。
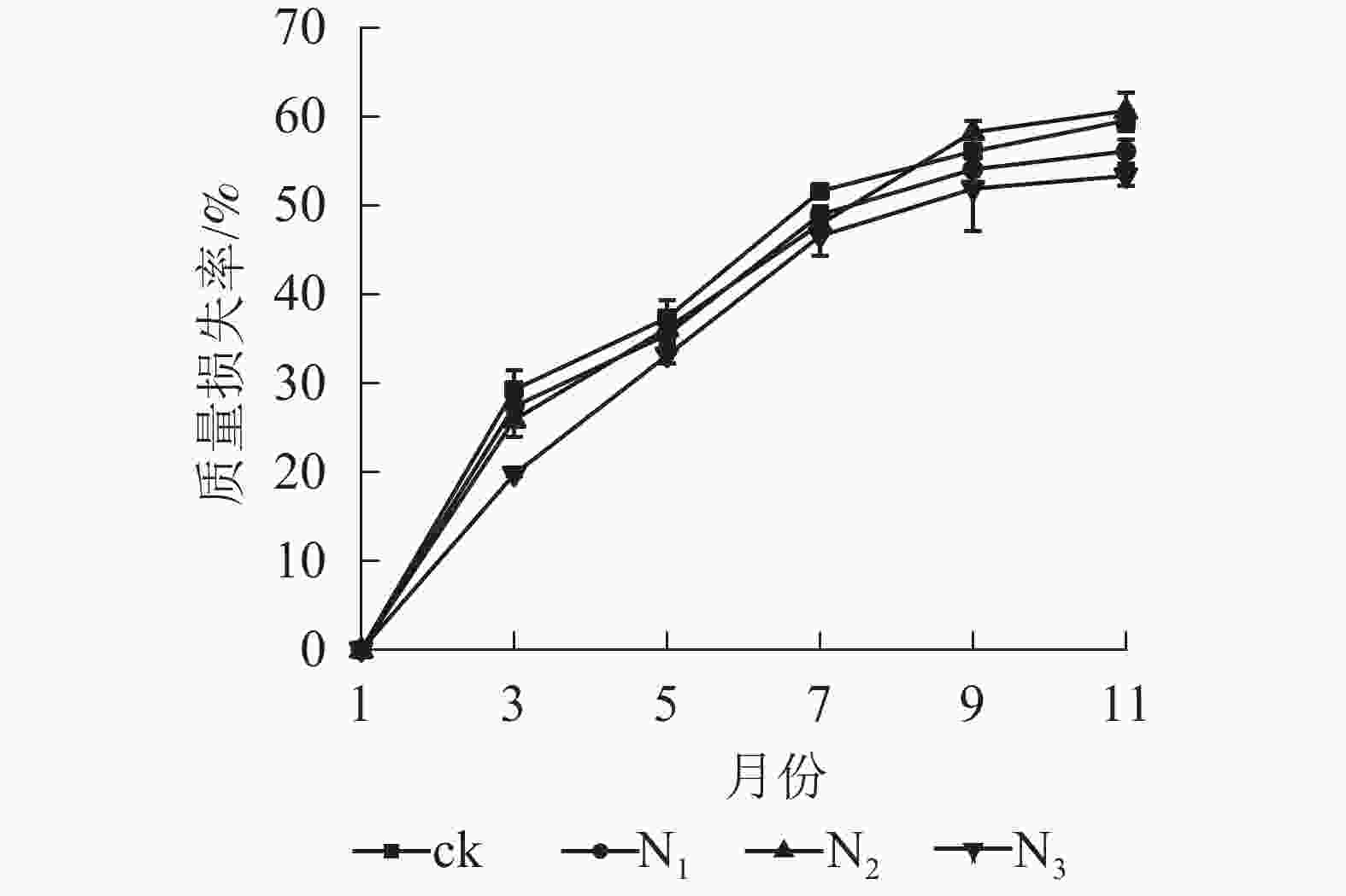
图 1 不同处理下大果木姜子凋落叶质量损失率
Figure 1. Change of mass loss rate and residual rate of leaf litter of C. migao under the condition of different treatments
从表1可以看出:4个处理的拟合模型R2均大于0.9000,且达到显著水平(P<0.05),其中N3处理Olson模型的拟合效果最佳。ck处理的凋落叶质量分解系数最大(K=0.085),N3处理最小(K=0.060)。N1、N2、N3处理凋落叶分解95%所需时间分别比ck长0.653、0.312、0.698 a,其中N3处理下凋落叶分解时间所需最长。综合表明:氮添加延缓了大果木姜子凋落叶的分解。
表 1 不同处理大果木姜子凋落叶质量残留率(y)随时间(x)变化的Olson模型
Table 1. Decomposition rate model of litter residue rate (y) with time (x) under different treatments
处理 分解方程 分解系数(K) 决定系数(R2) 相关系数(r) 显著性 凋落叶分解50%所需时间/月 凋落叶分解95%所需时间/a ck y=81.727e−0.085x 0.085 0.970 −0.944 0.005 8.155 2.973 N1 y=81.666e−0.067x 0.067 0.948 −0.940 0.005 10.045 3.626 N2 y=87.461e−0.076x 0.076 0.907 −0.963 0.002 9.120 3.285 N3 y=87.319e−0.068x 0.060 0.977 −0.951 0.004 10.193 3.671 -
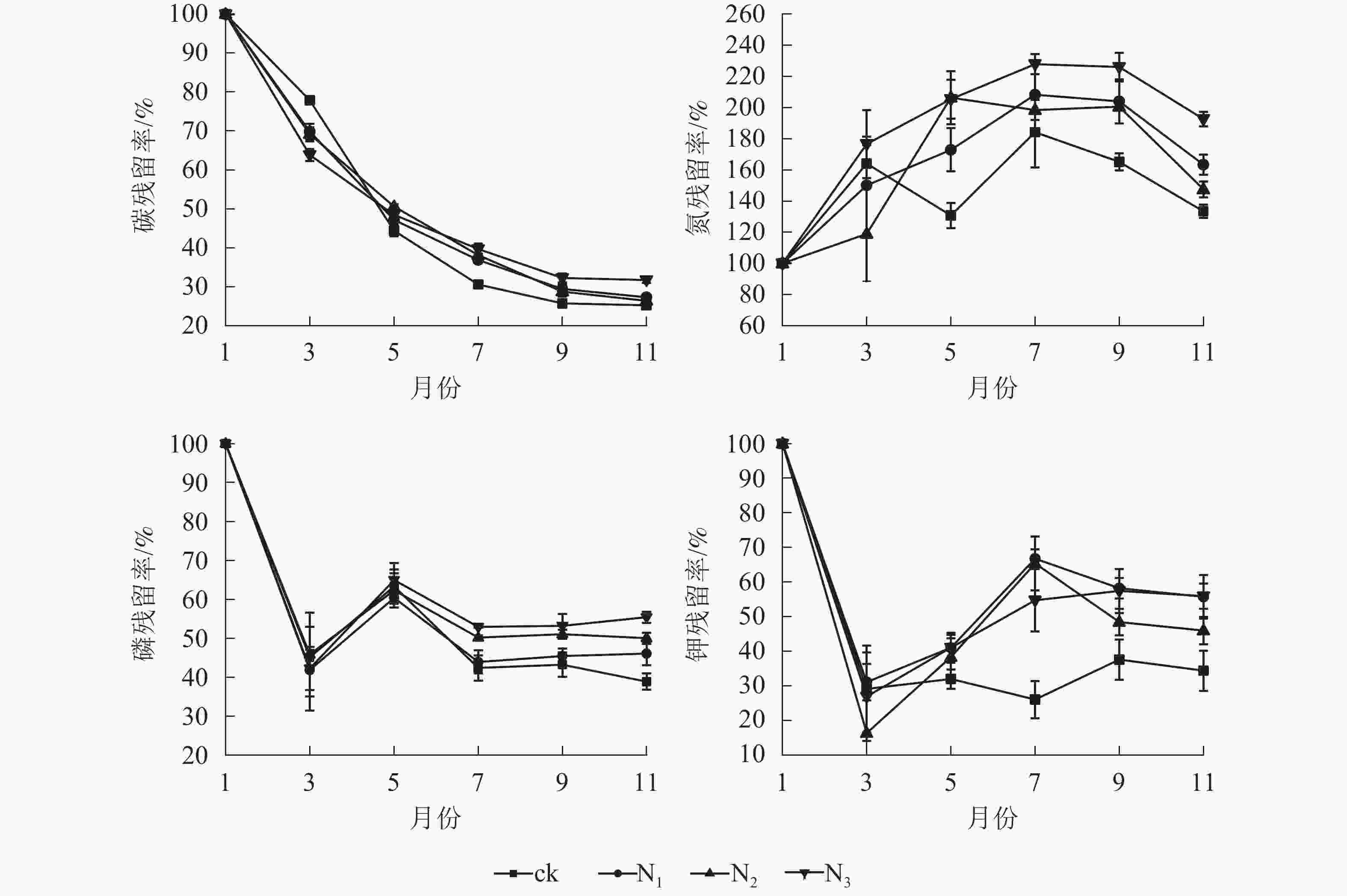
由图2可知:各处理凋落叶碳质量数总体均呈下降趋势,且分解前期(1−5月)下降较快,后期(5−11月)下降较慢。各处理凋落叶全氮质量分数变化趋势基本相同,整体上均呈先增加后降低的趋势,其中9月最高。各处理凋落叶全磷与全钾质量分数变化趋势相似,即在分解初期下降,之后整体上升,最后趋于平稳。
-
由图3可以看出:由于碳元素主要以有机形式存在于凋落叶中,受淋溶影响,各处理碳残留率呈降低趋势,其中分解各时段3个施氮处理碳残留率整体上显著高于ck(P<0.05)。ck的全氮残留率整体上呈先上升后下降再上升后下降趋势,各施氮处理的全氮残留率整体上呈先上升后下降趋势;1−7月,各处理全磷残留率呈先下降后升高再下降的趋势;7月之后,N1、N2、N3处理全磷的残留率趋于稳定,ck处理全磷残留率呈先上升后下降趋势。1−3月,各处理全钾残留率迅速降低,3月之后各处理全钾残留率总体呈增加趋势,整体表现为淋溶—富集—释放模式。
-
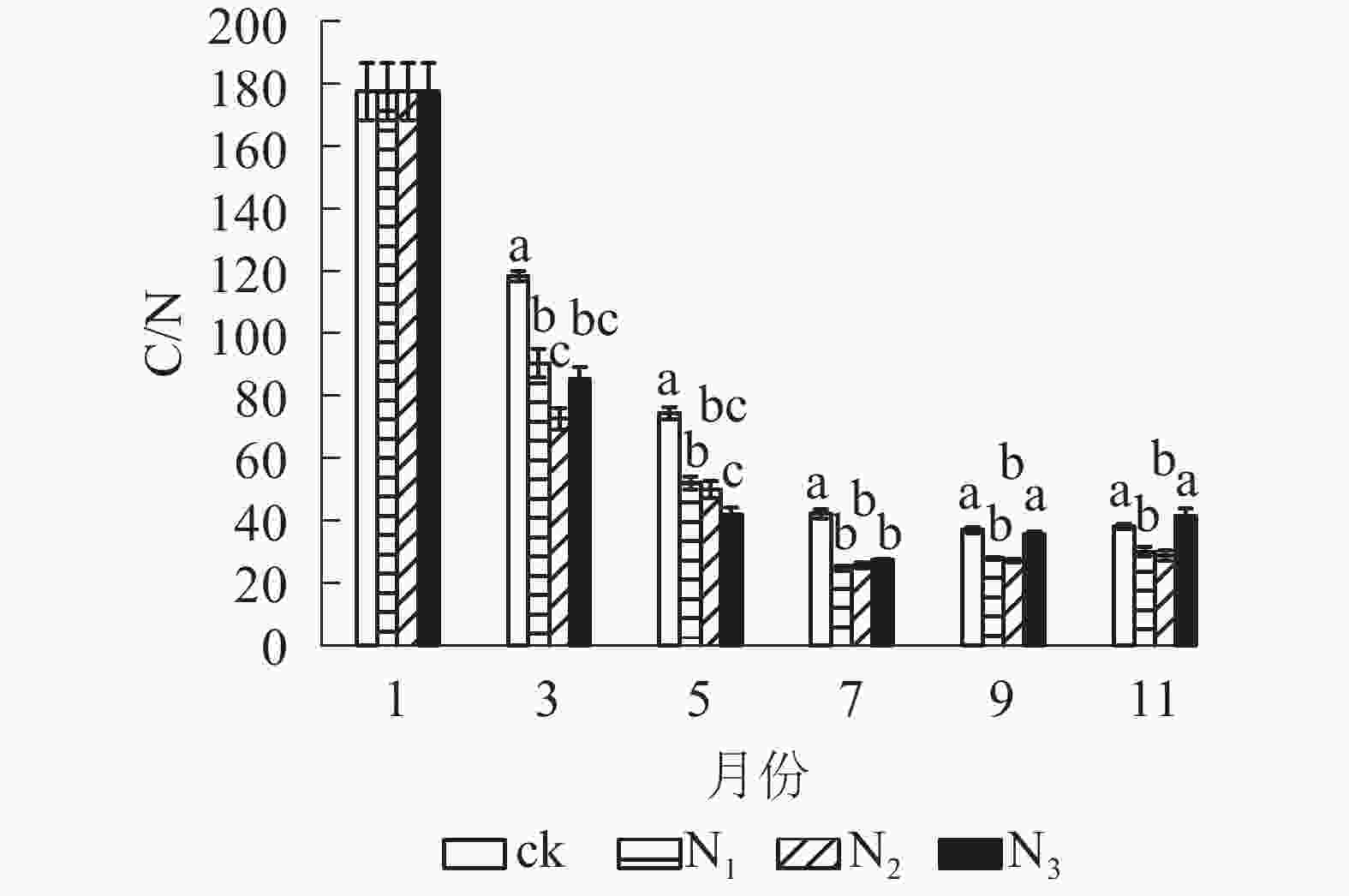
从图4可以看出:试验期间各处理C/N为24.60~177.51,整体表现出下降趋势。分解前期(1−7月) C/N下降速度较快,后期(7−11月)变化总体上比较平稳。在分解各时间段,ck的C/N基本高于其他各施氮处理。在试验前期(1−7月) ck处理与各施氮处理间有显著差异(P<0.05);试验后期(7−11月) ck组与N1、N2处理差异显著(P<0.05),与N3差异不显著(P>0.05)。总体来看,添加氮降低了大果木姜子凋落叶的C/N。
-
凋落叶分解速率的大小受到气候、凋落叶分解质量、微生物类型及作用等条件的影响[8]。目前,关于氮添加对凋落物分解速率的影响主要分为促进、抑制和无影响3种,这主要取决于施氮量的高低及施氮时间的长短。O’ CONNELL[18]分析了施加外源氮对桉树Eucalyptus凋落物分解及养分含量变化的影响。研究结果表明:施氮处理下凋落物分解释放速率变慢。郑欣颖等[19]模拟外源氮添加对火力楠Michelia macclurei凋落叶分解影响,结果显示:氮添加会促进凋落叶的分解。樊后保等[20]通过对杉木Cunninghamia lanceo-lata人工林凋落物施加外源氮,结果出现了“低促高抑”现象。文海燕等[21]对长芒草Stipa bungeana和阿尔泰狗娃花Heteropappus altaicus进行凋落叶模拟氮沉降试验。结果发现:氮添加对2种植物凋落叶分解无影响。
本研究结果显示:氮添加对大果木姜子凋落叶分解具有一定的抑制作用。大果木姜子凋落叶质量年损失率表现为ck高于各施氮处理,其中N3处理质量损失率最低。这是因为试验过程中施加外源氮的量超过了试验样地土壤所需氮的阈值,从而使凋落叶分解过程中起主要作用的微生物分解效率降低,进而对凋落叶的分解表现出抑制作用[22-23]。凋落叶分解本身具有的养分特性也会使凋落叶在不同分解阶段表现出不同规律,通常为前期分解较快,后期变慢。这是因为分解初期凋落物自身养分含量较高,可通过养分流失调控分解速率;随着养分的流失,后期则通过难分解的木质素和纤维来调控养分分解,所以分解速率表现为前期大于后期,且随着时间推移逐渐变慢[21-23]。在本研究前期(3−9月),大果木姜子凋落叶质量损失率迅速增加,主要是因为此时凋落叶的质量大,易分解物质含量高,导致凋落叶分解速率随着易分解物质的分解而加快;试验后期(9−11月)分解速率缓慢且质量损失率趋于平缓,这与后期凋落叶中易分解物质减少,难分解物质含量升高有关[24-25]。
-
土壤是植被生长过程中主要矿质营养的来源,而凋落物分解释放的养分归还是土壤肥力的重要来源(植物生长发育过程中从土壤中吸收的养分70%~90%得益于凋落物的分解释放)[26],因此,在森林生态系统中,凋落物的分解在植被养分循环过程中起着至关重要的作用。碳元素作为地球一切生命的基本单元,既是植物生长发育的基础又是维持植物生活的能量来源,氮和磷元素是氨基酸、核苷酸的重要组成元素,钾元素是调节细胞内外适宜渗透压和体液酸碱平衡,参与胞内糖和蛋白质代谢的重要阳离子。4种元素都是植物生命过程中不可缺少的[27-28]。研究表明:植物生长过程所需的养分分别有70%~80%的氮、65%~80%的磷和30%~40%的钾来自凋落物的分解释放[29]。
本研究中,5−11月各施氮处理碳质量分数显著低于ck(P<0.05),而氮质量分数表现相反。这是因为外源氮的添加使凋落叶中碳氮转化酶活性发生改变而影响两者的质量分数,且氮添加抑制了纤维素等物质的降解从而使凋落叶分解过程出现“碳封存”状态。凋落叶分解过程中,外界氮源的输入以及原生质素伴随自身固氮菌的侵入逐渐增加使氮质量分数增加[20],因此,C/N随着分解时间变长而总体下降。试验期间,凋落叶中全磷、全钾变化不稳定,各处理差异显著。11月凋落叶全磷质量分数表现为N1、N2、N3处理高于ck,且N2、N3差异显著(P<0.05),说明氮添加促进了大果木姜子凋落叶中全磷质量分数的积累,且施加氮的量越大表现出的差异越显著(P<0.05)。这与国内外多数研究结果相同,如BERG等[30]模拟氮沉降对樟子松Pinus sylvestris凋落叶养分分解影响研究表明:氮添加促进了凋落叶中全氮、全磷质量分数的积累。肖银龙等[31]模拟氮沉降对苦竹Pleioblastus amarus林凋落叶养分分解的研究同样表明:氮添加促进全氮、全磷的积累。本研究中,11月N1和N2处钾质量分数高于ck,而N3处理低于ck,说明添加过多的氮对凋落叶中全钾具有抑制作用,这是因为氮添加到土壤后,大量的氮以NO3−的形式淋失,为了达到土壤中养分电荷平衡,必然会带走等量的盐基离子(K+)[32-33]。
凋落物中的C/N一般比较高,不利于微生物的活动,而增施氮肥后有利于微生物数量的增加,从而促进凋落物的分解。本研究中土壤本身氮质量分数较高,再增施氮肥使其超过了“临界值”,打破了土壤中养分平衡,从而氮添加对大果木姜子凋落叶分解表现出抑制作用[22]。
综上所述,在氮添加的情况下,不利于大果木姜子凋落叶分解及养分的释放,其中N3处理作用更显著。凋落物分解后养分归还于土壤,再次作用于植物,但土壤养分输入对氮添加作何响应,还需进一步进行模拟探究。
Effects of nitrogen addition on decomposition and nutrient release of Cinnamomum migao litter leaves
-
摘要:
目的 研究不同施氮水平对大果木姜子Cinnamomum migao凋落叶养分分解的影响。 方法 于2017年1月,以药用植物大果木姜子人工林凋落叶为研究对象,将凋落叶清洗风干后装入分解袋中,每袋10.00 g。试验期间放置在不同施氮处理[对照(ck,0 g·m−2·a−1)、N1(5 g·m−2·a−1)、N2(15 g·m−2·a−1)、N3(30 g·m−2·a−1)]样地中,每处理3个重复,分别于试验的3、5、7、9、11月采集凋落叶样品,测定凋落叶质量及养分质量分数的变化,分析氮沉降对大果木姜子凋落叶养分释放动态影响。 结果 凋落叶分解试验结束时,各施氮组凋落叶质量损失率整体小于ck,凋落叶残留率整体大于ck,且N2与ck差异不显著,N2、N3差异显著(P<0.05),ck、N1、N2、N3凋落叶分解95%时所需的时间分别为2.973、3.626、3.285、3.671 a;各处理凋落叶碳质量分数总体均呈下降趋势,全氮质量分数整体上均呈先增加后降低的趋势,全磷与全钾质量分数变化趋势相似,为分解初期下降,之后整体上升,最后趋于平稳;各处理凋落叶碳、全磷、全钾残留率总体呈降低趋势,全氮残留率整体上呈先上升后下降趋势。其中分解各时段各施氮处理碳残留率均显著高于ck (P<0.05);随着时间推移,ck处理氮的残留率呈先上升后下降趋势,各施氮处理的氮残留率整体上呈先上升后下降趋势;整个分解过程中各施氮组碳氮比均小于ck,且分解前期与ck表现出显著差异(P<0.05)。 结论 添加氮不利于大果木姜子凋落叶的分解及养分的释放,且施氮越多抑制分解作用更显著。图4表1参33 Abstract:Objective This research aims to examine the effects of different nitrogen application levels on nutrient decomposition of Cinnamomum migao litter leaves. Method In January 2017, the litter leaves of the medicinal plant C. migao were taken as the research object. The leaves were washed, air dried and put into decomposition bags, 10.00 g each. Nitrogen treatments were designed as ck(0 g·m−2·a−1), N1(5 g·m−2·a−1), N2(15 g·m−2·a−1), and N3(30 g·m−2·a−1), and there were three repetitions for each treatment. The samples of litter leaves were collected in March, May, July, September and November, respectively. The quality and nutrient contents of the leaves were measured, and the dynamic effects of nitrogen deposition on nutrient release from the leaves were analyzed. Result At the end of litter decomposition experiment, the mass loss rate of litter leaves in all nitrogen application groups was lower than that of ck, the residue rate of litter was higher than that of ck. The difference between N2 and ck was not significant, but the difference between N2 and N3 was significant (P<0.05). The time needed for 95% decomposition of ck, N1, N2 and N3 was 2.973, 3.626, 3.285 and 3.671 a, respectively. In the leaves of all treatments, the content of C decreased and the content of total N increased first and then decreased, while the content of total P and total K was similar, which decreased at the initial stage of decomposition, then increased as a whole, and finally stabilized. The residual rates of C, total P, total K in the leaves decreased, while the residue rates of total N increased first and then decreased. The residual rate of C in each nitrogen treatment was significantly higher than that of ck (P<0.05). With the passage of time, the residue rate of N, which increased first and then decreased in ck treatment, showed an overall upward and then downward trend in each nitrogen application treatment. C/N ratio of each nitrogen application group was lower than that of ck in the whole decomposition process, and there was a significant difference between the early decomposition stage and ck (P<0.05). Conclusion Nitrogen addition is not conducive to the decomposition and nutrient release of litter leaves. The more nitrogen is applied, the more obvious the inhibition of decomposition is.[Ch, 4 fig. 1 tab. 33 ref.] -
Key words:
- forest ecology /
- nitrogen deposition /
- Cinnamomum migao /
- litter decomposition /
- nutrient release
-
表 1 不同处理大果木姜子凋落叶质量残留率(y)随时间(x)变化的Olson模型
Table 1. Decomposition rate model of litter residue rate (y) with time (x) under different treatments
处理 分解方程 分解系数(K) 决定系数(R2) 相关系数(r) 显著性 凋落叶分解50%所需时间/月 凋落叶分解95%所需时间/a ck y=81.727e−0.085x 0.085 0.970 −0.944 0.005 8.155 2.973 N1 y=81.666e−0.067x 0.067 0.948 −0.940 0.005 10.045 3.626 N2 y=87.461e−0.076x 0.076 0.907 −0.963 0.002 9.120 3.285 N3 y=87.319e−0.068x 0.060 0.977 −0.951 0.004 10.193 3.671 -
[1] 马鹏宇, 张红光, 昝鹏, 等. 长期氮添加对东北地区兴安落叶松人工林土壤酶的影响[J]. 植物研究, 2019, 39(4): 598 − 603. MA Pengyu, ZHANG Hongguang, ZAN Peng, et al. Effects of long-term nitrogen addition on soil enzymes in Larix gmelnii plantation in northeast China [J]. Bull Bot Res, 2019, 39(4): 598 − 603. [2] ABERJ D, GOODALEC L, OLLINGER S V, et al. Is nitrogen deposition altering the nitrogen status of northeastern forests [J]. Bioscience, 2003, 53(4): 375 − 389. [3] LIU Xuejun, ZHANG Ying, HAN Enxuan, et al. Enhanced nitrogen deposition over China [J]. Nature, 2013, 494: 459 − 463. [4] AUSTIN A T, MARCHESINIV A. Gregarious flowering and death of understorey bamboo slow litter decomposition and nitrogen turnover in a southern temperate forest in Patagonia, Argentina [J]. Funct Ecol, 2012, 26(1): 265 − 273. [5] GALLOWAY J N, ABER J D, ERISMAN J W, et al. The nitrogen cascade [J]. Bioscience, 2003, 53(4): 341 − 356. [6] ASNER G P, TOWNSEND A, RILEY W J, et al. Physical and biogeochemical controls over terrestrial ecosystem responses to nitrogen deposition [J]. Biogeochemistry, 2001, 54(1): 1 − 39. [7] MATSON P, LOHSE K A, HALL S J. The globalization of nitrogen deposition: consequences for terrestrial ecosystems [J]. Ambio-A J Human Environ, 2002, 31(2): 113 − 119. [8] 董雄德, 邢亚娟, 闫国永, 等. 不同生态系统凋落物分解对氮沉降的响应综述[J]. 中国农学通报, 2016, 32(22): 140 − 150. DONG Xiongde, XING Yajuan, YAN Guoyong, et al. Response of litter decomposition in different ecosystem types to nitrogen deposition: a review [J]. Chin Agric Sci Bull, 2016, 32(22): 140 − 150. [9] JIA Bingrui, ZHOU Guangsheng, XU Zhenzhu. Forest litter fall and its composition: a new data set of observational data from China [J]. Ecology, 2016, 97(5): 1365 − 1365. [10] SMYTH C E, MACEY D, TROFYMOW J A. Long-term litter decay in Canadian forests and the influence of soil microbial community and soil chemistry [J]. Soil Biol Biochem, 2015, 80: 251 − 259. [11] 侯玲玲, 孙涛, 毛子军, 等. 小兴安岭不同林龄天然次生白桦林凋落物分解及养分变化[J]. 植物研究, 2012, 32(4): 492 − 496. HOU Linlin, SUN Tao, MAO Zijun, et al. Litter decomposition and nutrient dynamic of Betula platyphylla secondary forest with different stand ages in Xiaoxing’ an mountains [J]. Bull Bot Res, 2012, 32(4): 492 − 496. [12] 江兴龙, 潘俊锋, 何茂琦. 贵州大果木姜子的栽培与病虫害防治技术[J]. 林业调查规划, 2005, 30(4): 104 − 108. JIANG Xinglong, PAN Junfeng, HE Maoqi. Summary on the recourse situation and medical value as well as cultivation techniques of Cinnamomum migao in Guizhou Province [J]. For Invent Plann, 2005, 30(4): 104 − 108. [13] 周涛, 杨占南, 江维克, 等. 民族药大果木姜子果实挥发油成分的变异及其规律[J]. 中国中药杂志, 2010, 35(7): 852 − 856. ZHOU Tao, YANG Zhannan, JIANG Weike, et al. Variation and regularity of volatile oil constituents in fruits of national medicine Cinnamomum migao [J]. China J Chin Mat Medica, 2010, 35(7): 852 − 856. [14] 沈丽, 马琳, 朱海燕, 等. 大果木姜子的化学成分[J]. 中国实验方剂学杂志, 2011, 17(15): 15 − 17. SHEN Li, MA Lin, ZHU Hanyan, et al. Chemical composition of Cinnamomum migao [J]. Chin J Exper Tradit Med Formulae, 2011, 17(15): 15 − 17. [15] 张小波, 周涛, 郭兰萍, 等. 苗药大果木姜子挥发油成分变化及其地理分布[J]. 生态学报, 2011, 31(18): 5299 − 5306. ZHANG Xiaobo, ZHOU Tao, GUO Lanping, et al. Volatile oil contents correlate with geographical distribution patterns of the miao ethnic herb Fructus cinnamomi [J]. Acta Ecol Sin, 2011, 31(18): 5299 − 5306. [16] 王军才. 氮磷营养对大果木姜子幼苗生长及生理特征的影响[D]. 贵阳: 贵州大学, 2016. WANG Juncai. The Effect of Nitrogen and Phosphorus on Growth and Physiological Characteristics of Cinnamomum migao Seedling[D]. Guiyang: Guizhou University, 2016. [17] 文爱华. 大果木姜子苗期光合及水分生理特性研究[D]. 贵阳: 贵州大学, 2016. WEN Aaihua. Study on Characteristics of Photosynthetic and Water Physiology of Cinnamomum migao H. W. Li Seedling[D]. Guiyang: Guizhou University, 2016. [18] O’ CONNELL A M. Decomposition and nutrient content of litter in a fertilized eucalypt forest [J]. Biol Fert Soil, 1994, 17(2): 159 − 166. [19] 郑欣颖, 佘汉基, 薛立, 等. 外源性氮和磷对火力楠凋落叶分解的影响[J]. 华南农业大学学报, 2018, 39(1): 98 − 104. ZHENG Xinying, SHE Hanji, XUE Li, et al. Effects of N and P additions on leaf litter decomposition in Michelia macclurei woodland [J]. J South China Agric Univ, 2018, 39(1): 98 − 104. [20] 樊后保, 刘文飞, 杨跃霖, 等. 杉木人工林凋落物分解对氮沉降增加的响应[J]. 北京林业大学学报, 2008, 30(2): 8 − 13. FAN Houbao, LIU Wenfei, YANG Yuelin, et al. Decomposition of leaf litter of Chinese fir in response to increased nitrogen deposition [J]. J Beijing For Univ, 2008, 30(2): 8 − 13. [21] 文海燕, 傅华, 郭丁. 黄土高原典型草原优势植物凋落物分解及养分释放对氮添加的响应[J]. 生态学报, 2017, 37(6): 2014 − 2022. WEN Haiyan, FU Hua, GUO Ding. Influence of nitrogen addition on Stipa bungeana and Heteropappus altaicus litter decomposition and nutrient release in a steppe located on the Loess Plateau [J]. Acta Ecol Sin, 2017, 37(6): 2014 − 2022. [22] MICKS P, DOWNS M R, MAGILL A H, et al. Decomposing litter as a sink for 15 N-enriched additions to an oak forest and a red pine plantation [J]. For Ecol Manage, 2004, 196(1): 71 − 87. [23] BERG B. Litter decomposition and organic matter turnover in northern forest soils [J]. For Ecol Manage, 2000, 133(1/2): 13 − 22. [24] MO Jiangming, BROWN S, PENG Shaolin, et al. Nitrogen availability in disturbed, rehabilitated and mature forests of tropical China [J]. For Ecol Manage, 2003, 175(1/3): 573 − 583. [25] 王其兵, 李凌浩, 白永飞, 等. 模拟气候变化对3种草原植物群落混合凋落物分解的影响[J]. 植物生态学报, 2000, 24(6): 674 − 679. WANG Qibing, LI Linghao, BAI Yongfei, et al. Effects of simulated climate change on the decomposition of mixed of mixed litter in three steppe communities [J]. Acta Phytoecol Sin, 2000, 24(6): 674 − 679. [26] BRIDGHAM S D, PASTOR J, MCCLAUGHERTY C A, et al. Nutrient-efficiency: a litter fall index, a model, and a test along a nutrient-availability gradient in north Carolina peatlands [J]. Am Nat, 1995, 145(1): 1 − 21. [27] 曾昭霞, 王克林, 刘孝利, 等. 桂西北喀斯特区原生林与次生林鲜叶和凋落叶化学计量特征[J]. 生态学报, 2016, 36(7): 1907 − 1914. ZENG Zhaoxia, WANG Kelin, LIU Xiaoli, et al. Stoichiometric characteristics of live fresh leaves and leaf litter from typical plant communities in a karst region of northwestern Guangxi, China [J]. Acta Ecol Sin, 2016, 36(7): 1907 − 1914. [28] 李合生. 现代植物生理学[M]. 北京: 高等教育出版社, 2012. [29] GHOLZ H L, PERRY C S, CROPPER W P, et al. Litterfall, decomposition, and nitrogen and phosphorus dynamics in a chrono sequence of slash pine (Pinus elliottii) plantations [J]. For Sci, 1985, 31(2): 463 − 478. [30] BERG B, BERG M, BOTTNER P, et al. Litter mass loss rates in pine forests of Europe and eastern United States: some relationships with climate and litter quality [J]. Biogeochemistry, 1993, 20(3): 127 − 159. [31] 肖银龙, 涂利华, 胡庭兴, 等. 模拟氮沉降对华西雨屏区苦竹林凋落物养分输入量的早期影响[J]. 生态学报, 2013, 33(23): 7355 − 7363. XIAO Yinlong, TU Lihua, HU Tingxing, et al. Early effects of simulated nitrogen deposition on annual nutrient input from litter fall in a Pleioblastus amarus plantation in rainy area of west China [J]. Acta Ecol Sin, 2013, 33(23): 7355 − 7363. [32] NAKAJI T, TAKENAGA S, KUROHA M, et al. Photosynthetic response of Pinus densiflora seedlings to high nitrogen load [J]. Environ Sci, 2002, 9(4): 269 − 282. [33] HOEGBERG P, FAN Houbao, QUIST M E, et al. Tree growth and soil acidification in response to 30 years of experimental nitrogen loading on boreal forest [J]. Global Change Biol, 2006, 12(3): 489 − 499. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20200106






 下载:
下载: