-
温室气体排放加剧全球气候变暖[1],导致系列环境问题频发,如水资源短缺[2]、区域干旱化加剧[3]等。氧化亚氮(N2O)是主要的温室气体之一,在百年尺度上,N2O造成全球变暖的潜力是二氧化碳(CO2)的265倍[4]。土壤是N2O的一个重要排放源[5],据估计,大气中80%~90%的N2O来源于土壤[6]。土壤中由微生物介导的硝化和反硝化过程是N2O主要产生途径,其中,施肥土壤是N2O排放量最高的土壤。有研究表明:氮(N)、磷(P)肥的大量施用会增加土壤气态氮、氧化氮(NO)、N2O等的排放[7-9]。因此,合理施肥对缓解全球气候变化显得极为重要。土壤N2O的排放不仅仅与施N、P肥相关,还受土壤含水量的影响,土壤含水量是影响N2O的排放的一种潜在因素[10]。有研究表明:土壤含水量的增加会降低土壤N2O的排放[11-12],也有研究表明:土壤含水量的增加会促进土壤N2O的排放[13-15]。聚丙烯酰胺是用强吸水性树脂制成的超高吸水保水能力的高分子聚合物。它可以吸收大量的水,然后形成水凝胶,且可以反复吸水。当土壤处于干旱时,它会缓慢的将水分释放,供土壤和植物利用[16-18],大幅度提高了用水效率。而且聚丙烯酰胺还具有改善土壤结构、低成本、使用方便等诸多优点,对农林产品的生产经营具有一定的实际意义。油茶Camellia oleifera是中国南方最重要的食用油料树种,主要分布于秦岭淮河以南至华南北部,以江西和湖南为主产区。江西省油茶产区属于典型的红壤地区,受亚热带季风气候的影响,夏季水热不同期。在这一时期内,油茶树进行产果,氮磷的缺乏会影响油茶的油脂转化,缺水会导致油茶落果,这将会限制油茶林的高产[19]。因此,保水剂聚丙烯酰胺的施用对油茶林的产果量有着很大意义。近年来,已有不少研究表明施氮、磷肥可以促进温室气体排放[7-9],聚丙烯酰胺可以增加土壤含水量,进而影响土壤N2O排放,那聚丙烯酰胺和氮、磷肥共同施用会如何影响油茶林土壤N2O排放?本研究通过添加不同肥料和不同用量聚丙烯酰胺,来探究聚丙烯酰胺和施肥对油茶土壤N2O排放的影响,为发展高效节水林业和缓解全球气候变化提供理论依据。
-
样地位于江西农业大学科技园(28°45′53″N,115°50′10″E),属于亚热带湿润季风气候。年日照时间为1 723~1 820 h,日照率为40%,7−8月最高,2−3月最低;年平均气温约18 ℃,年降水量为1 600~1 700 mm,降水日主要集中在4−6月。土壤为典型红壤。
所用油茶苗是1年生实生苗,土壤采自未施肥油茶林。所施用的氮肥为硝酸铵(NH4NO3,分析纯),磷肥为磷酸氢二钠(Na2HPO4,分析纯)。保水剂聚丙烯酰胺(分析纯)为阴离子型,平均分子量不小于1 000万。土壤基本理化性质:有机碳13.01 g·kg−1、全氮1.46 g·kg−1、速效磷1.07 mg·kg−1、铵态氮1.87 mg·kg−1、硝态氮1.68 mg·kg−1、pH 5.76。
-
盆栽试验于2018年4月17日至9月26日进行,盆栽容器为高18 cm,宽16 cm的圆形花盆,每盆土质量为1 500 g。试验共设置12个处理:C0+ck、C0+P、C0+N、C0+N+P、C1+ck、C1+P、C1+N、C1+N+P、C2+ck、C2+P、C2+N、C2+N+P。其中,C0、C1、C2分别为施用保水剂聚丙烯酰胺0、1.0、2.0 g·kg−1。每个处理3个重复,聚丙烯酰胺与土壤混施,氮磷肥加水混合均匀喷施。共施肥3次,分别为6月1日(0.050 g·kg−1 N,0.025 g·kg−1 P)、6月24日(0.040 g·kg−1 N,0.020 g·kg−1 P)和7月18日(0.040 g·kg−1 N,0.020 g·kg−1 P),共施氮肥0.130 g·kg−1,磷肥0.065 g·kg−1。
-
采用静态暗箱法测定土壤N2O通量。静态箱体由箱体和底座2个部分组成,箱体是由有机玻璃制成的内径为18 cm,高为80 cm的圆柱体。箱体上侧的中心位置有1个小孔,用于放置温度计,用于记录箱体温度。箱体外部用锡箔纸进行包裹,保证在采气过程中内部是黑暗状态。底座由水进行密封,保证在抽气过程中箱内空间密闭。采样时把每盆油茶苗搬到底座上,再扣上箱体,用50 mL的医用注射器进行气体采集。采气过程中,注射器需反复抽拉10次,保证所采气体是混合均匀的[20]。气体采集时间自5月23日开始,7 d采集1次,每次施肥后的第1、3、6天进行气体采集,后逐渐延长采气时间。每次的气体采集时间为9:00−11:00,盖上箱体后的0、5、10、15 min分别抽取40 mL气体注入真空气袋。在气体采集过程中,用W.E.T Sensor Kit测定盆栽内土壤的温度和湿度。
N2O排放通量的测定:用气相色谱仪(安捷伦7890B)测定N2O质量浓度,并根据方程式计算N2O排放通量(L):
$L=P\times V\times \dfrac{\Delta c}{\Delta t}\times \dfrac{1}{R\times T}\times M\times \dfrac{1}{S}$ 。其中:P代表标准大气压力(Pa),V指箱内空间的体积(m3),Δc/Δt代表单位时间内N2O质量浓度的变化量(μg·L−1),R代表通用气体常数(m3·mol−1·K−1),T代表采气时箱内温度(K),M代表N2O的分子质量(g·mol−1),S代表箱体的底面积(m2)。N2O累积排放量根据以下公式计算:
$$ E=\sum _{i=1}^{n}\frac{\left({L}_{i}+{L}_{i+1}\right)}{2}\times \left({t}_{i+1}-{t}_{i}\right)\times 24{\text{。}}$$ 其中:L代表N2O排放通量(μg·m−2·h−1),i表示第i次进行气体采集,ti+1−ti代表2次采样的间隔天数,n代表气体采集的次数。
-
用Excel 2010对数据进行统计和处理,利用JMP 9.0软件进行单因素方差分析,利用Origin 2017软件绘图。
-
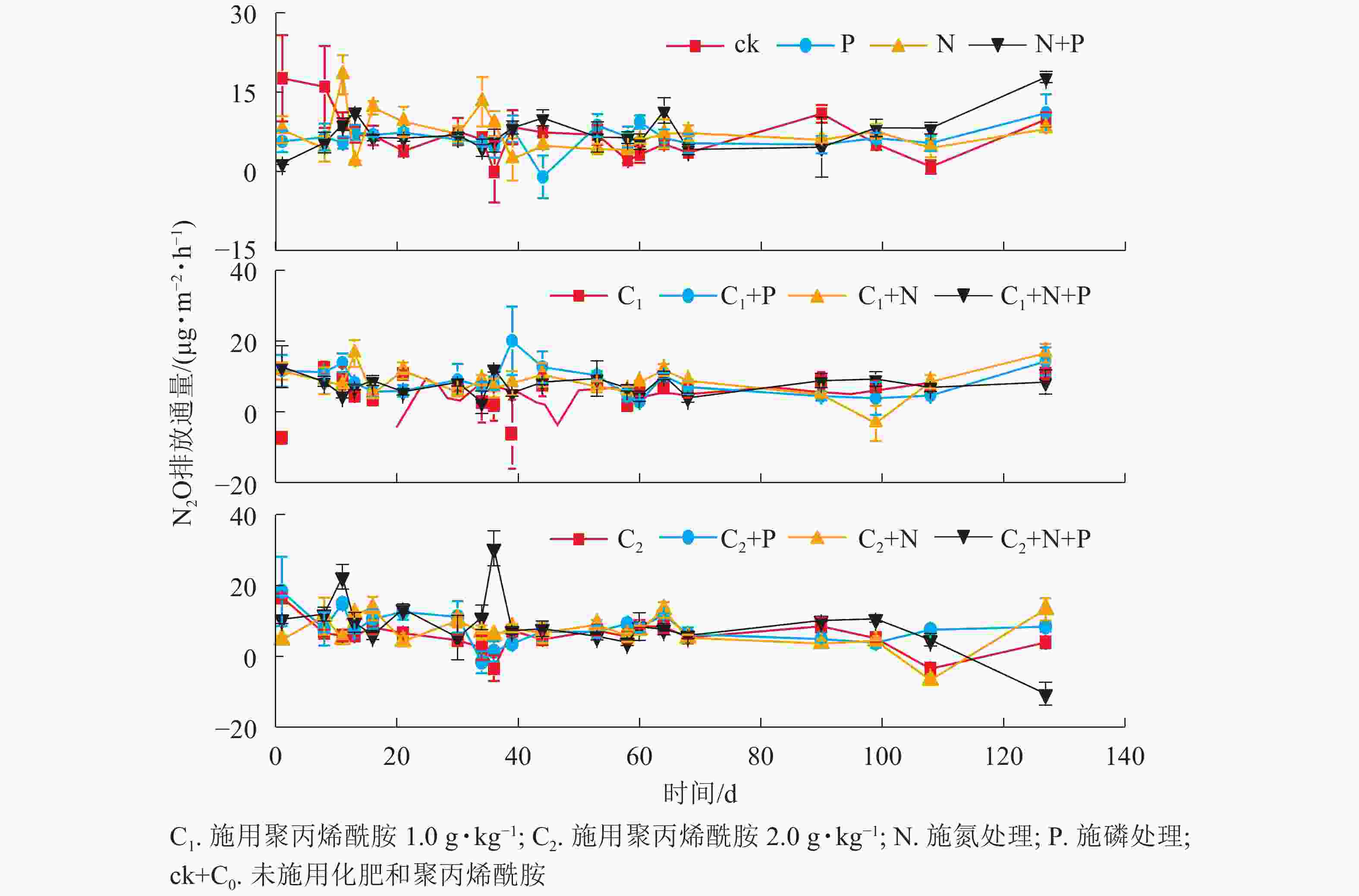
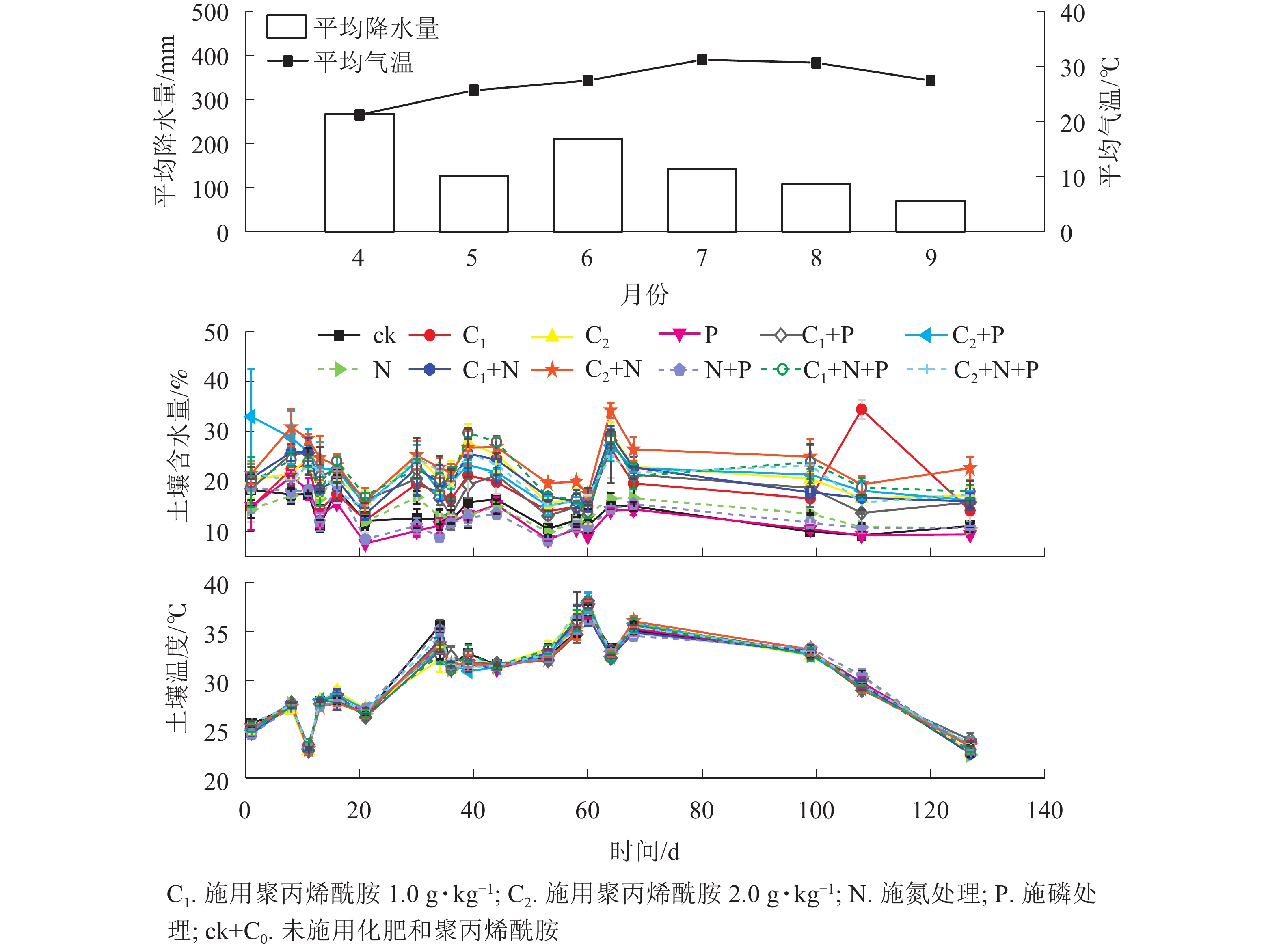
由图1和图2可见:随着时间的变化,不同处理土壤温度和N2O排放通量无明显差异。聚丙烯酰胺处理土壤含水量高于未添加聚丙烯酰胺,说明聚丙烯酰胺对土壤有很好的保水作用。
-
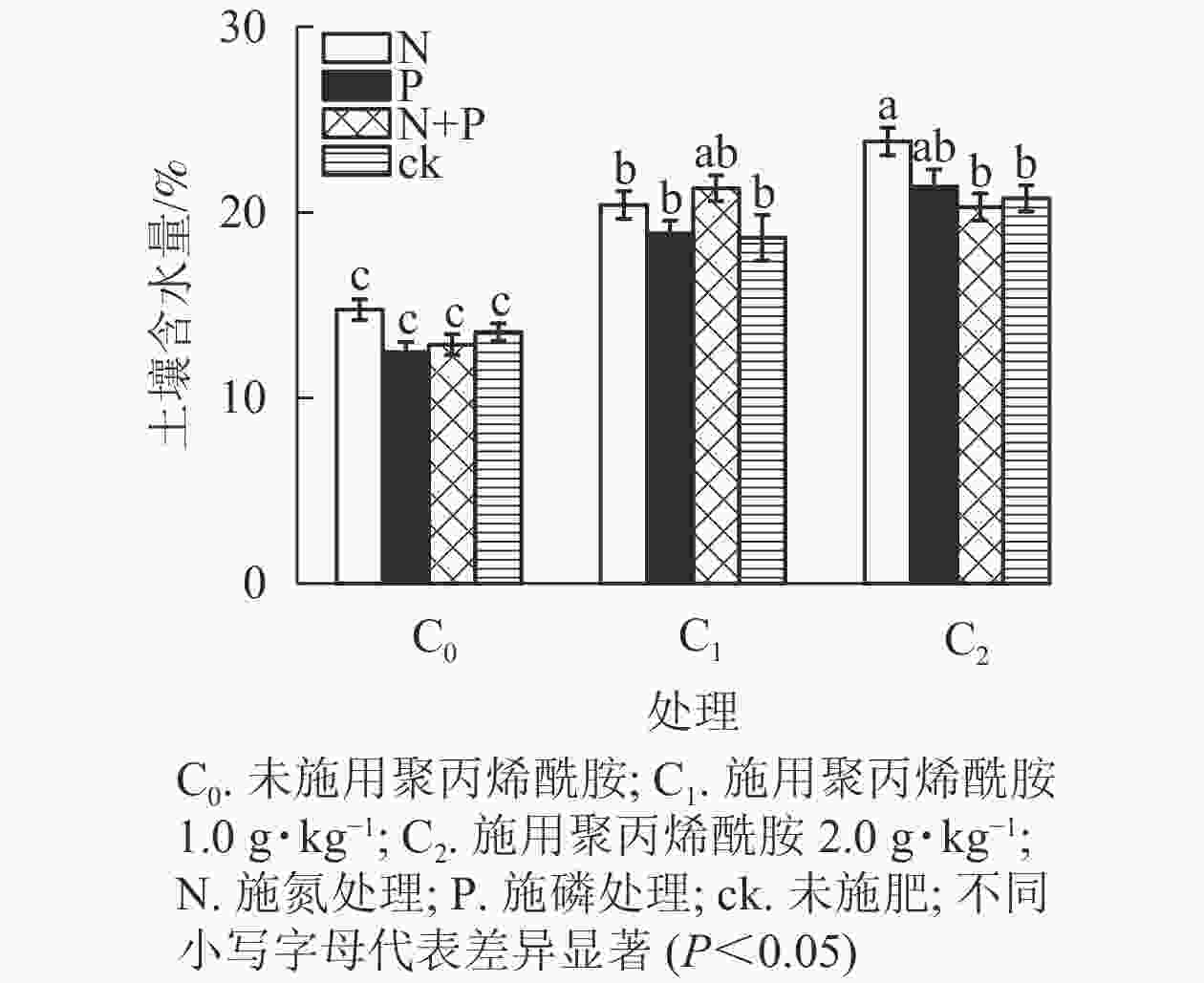
由表1和图3可见:未施肥条件下,C1和C2处理土壤含水量较之C0,分别增加37.5%、53.2%(P<0.05);单施N条件下,土壤含水量从大到小依次为C2、C1、C0,与C0对比,C1和C2分别增加38.3%、61.4%(P<0.05);单施P条件下,C1和C2处理土壤含水量较之C0,分别增加51.4%、71.6%(P<0.05);施N+P条件下,C1和C2处理土壤含水量较之C0,分别增加65.4%、57.6%(P<0.05)。总体上,C1、C2处理土壤含水量均显著高于C0,说明聚丙烯酰胺可以有效提高土壤保水性能。
表 1 不同处理对土壤N2O排放通量、土壤含水量和N2O累积排放量的影响
Table 1. Effects of different treatments on soil N2O emission flux, soil moisture content and cumulative N2O emission
处理 df F N2O排放通量 土壤含水量 N2O累积排放量 N 1 5.41* 13.72** 1.35 P 1 6.27* 5.05* 5.41* N+P 1 2.23 4.19 0.49 C 2 0.66 200.89** 2.75 N+C 2 0.13 1.34 0.18 P+C 2 2.45 3.78* 2.24 N+P+C 2 3.13* 4.17* 1.71 说明:N表示施氮处理,P表示施磷处理,C表示施加聚丙烯 酰胺处理;*P<0.05,**P<0.01 -
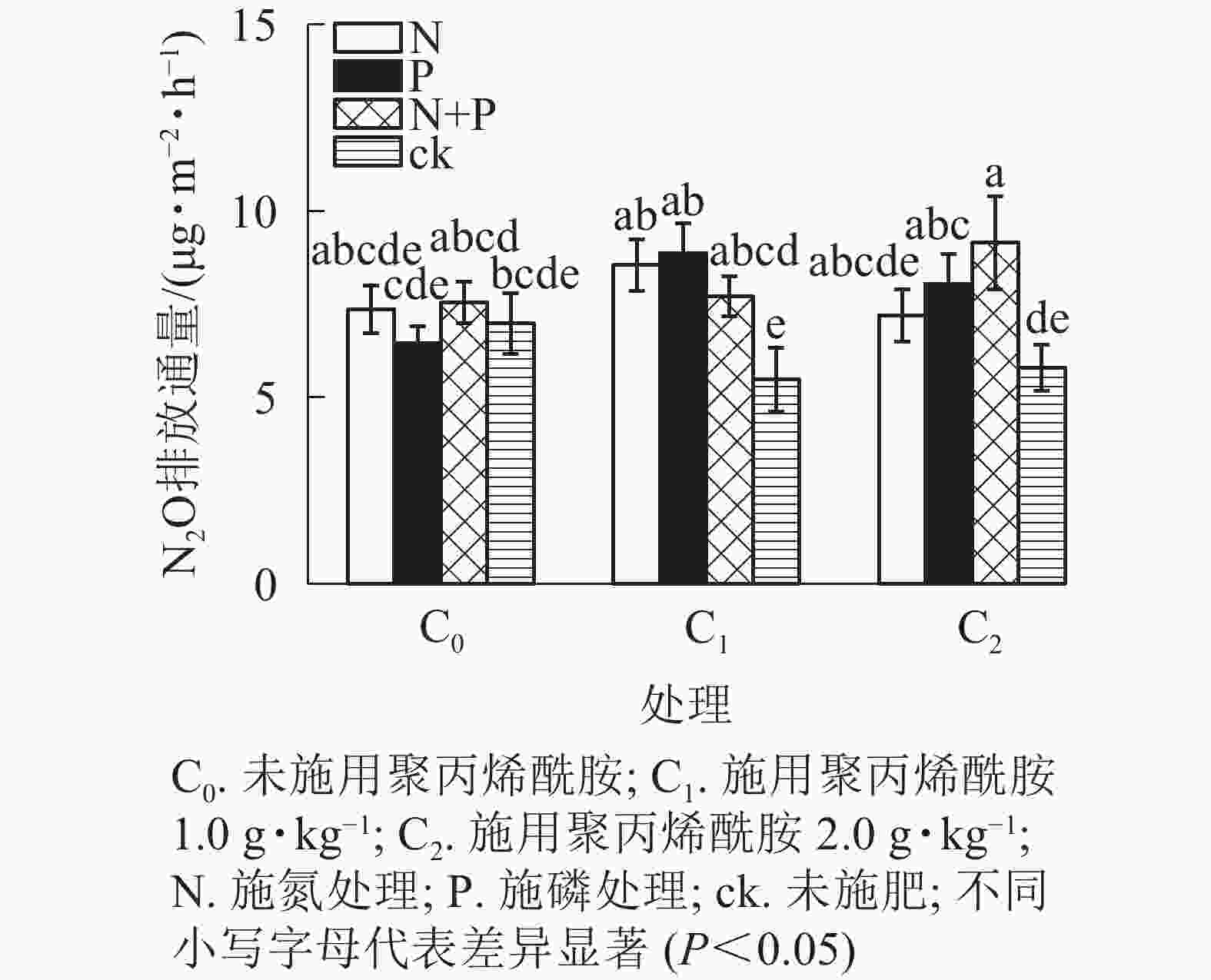
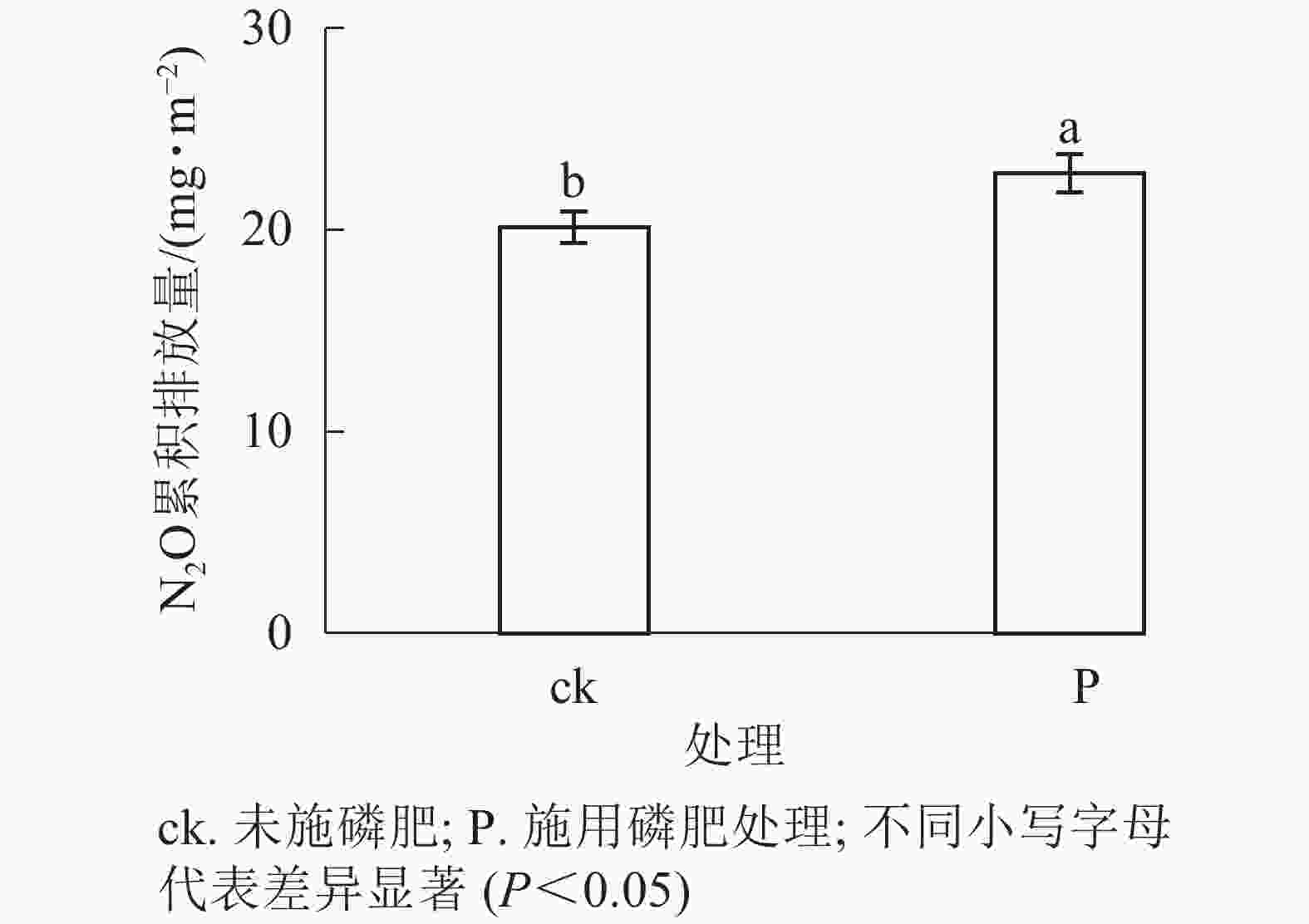
由图4和图5可见:添加1.0 g·kg−1聚丙烯酰胺条件下,施N、P、N+P的土壤N2O排放通量较之未施肥土壤,分别增加56.0%、61.7%、40.7%(P<0.05);添加2.0 g·kg−1聚丙烯酰胺条件下,施P、N+P的土壤N2O排放通量较之未施肥土壤,分别增加38.7%、58.1%(P<0.05)。C0+ck、C1+ck、C2+ck处理表明:添加聚丙烯酰胺的土壤N2O排放通量要低于未添加的,但不显著,可能是聚丙烯酰胺施用的量较小。相对于只添加聚丙烯酰胺的处理,施肥和添加聚丙烯酰胺的,土壤N2O排放通量增加,说明聚丙烯酰胺与N、P之间存在某种作用促进土壤N2O排放。施P显著提高土壤N2O累积排放量(P<0.05),相较于ck增加13.3%。
-
施用聚丙烯酰胺显著提高了油茶土壤的含水量,原因可能是聚丙烯酰胺影响了土壤的孔隙状况,降低土壤入渗率,增加了土壤的持水能力[21],而且聚丙烯酰胺是一种含有大量亲水基和疏水基的高分子化合物,它可以加强土壤对水分子的吸着能力,从而有效抑制土壤水分的蒸发,增加土壤含水量[22]。而土壤含水量和施肥共同影响土壤N2O排放通量。不同施肥处理的土壤含水量从大到小依次为C2+N、C1+N、C0+N和C2+P、C1+P、C0+P和C1+N+P、C2+N+P、C0+N+P,不同施肥处理土壤N2O排放通量最高的分别是C1+N、C1+P、C2+N+P,总体表现为施肥处理下的土壤N2O排放通量随着土壤含水量的增加呈现先增后减的趋势。因为土壤含水量控制着氧气进入土壤以及土壤中NO、N2O和氮气(N2)的排放[23],在干燥的土壤中,气体的扩散率很高,所以大部分NO在被消耗之前就可以从土壤中扩散出去[24]。在湿润的土壤中,气体的扩散率较低,透气性较差,大部分NO在逸出土壤之前就被减少了,更多的被还原,氧化物N2O是主要的最终产物。当土壤的含水量更高且土壤大多为厌氧状态时,大部分的N2O在逸出土壤之前被反硝化作用进一步还原为N2[25]。本研究中,在C0处理下,施N、N+P处理并没有显著增加土壤N2O排放通量,造成这样的原因可能是低土壤含水量影响了土壤微生物活性,减少了无机氮的产生,抑制了土壤的硝化和反硝化作用[24];施P处理的土壤N2O排放通量略低于ck,可能是磷肥的施用促进植物对氮的吸收利用。通过比较C0+ck、C1+ck、C2+ck,较高的土壤含水量抑制了土壤N2O排放通量,这可能是因为土壤处于厌氧环境,反硝化最终的主要产物是N2,而且较高的土壤含水量有利于提升养分的运输速率,加快了植物对无机氮的吸收,从而减少了土壤N2O的排放[26]。
-
磷是油茶品质和产量的关键限制因子,所以在经营油茶林的时候,磷肥的施用是不可少的。本研究发现施用磷肥促进了N2O累积排放量,这与以往的一些研究恰好相反。有研究[11, 27]发现:施用磷肥减少了N2O的排放,并认为这可能是土壤中的速效磷含量低,限制了植物对无机氮的吸收,而磷肥的施用增加了土壤速效磷含量,解除了植物的营养限制,减少了可用于生产N2O的无机氮含量,从而降低了土壤N2O的排放。但也有研究表明:施用磷肥促进了N2O的排放[28-30],与本研究结果一致。一方面,因为土壤在缺磷的时候,微生物的活性受到抑制[31-33],而施用磷肥解除了微生物的磷限制,从而微生物活性增强,由微生物介导的硝化和反硝化作用就会被加强,促进了土壤N2O的排放。另一方面,施用磷肥刺激了异养菌群的活性,增加了土壤中氧气的消耗,创造出一个厌氧环境,有利于反硝化作用[34]。而且施用磷肥也可能会通过诱导微生物对氮的需求来促进土壤有机质的分解,影响土壤总氮的矿化,增加硝化和反硝化作用的底物,从而促进土壤N2O的排放[35]。本研究所用土壤是典型红壤,存在较强的磷限制,这不仅限制了植物对养分的吸收,还限制了微生物的活性。施用磷肥解除了这些限制,促进了植物对无机氮的吸收,但也加强了微生物的硝化和反硝化作用。从本结果来看,可能是微生物介导气态氮释放过程的强度要大于植物对N的吸收强度,导致总体的土壤N2O排放的增加。
-
施用聚丙烯酰胺会显著提高油茶林土壤含水量,并随施用聚丙烯酰胺施用量的增加土壤含水量也不断升高。施用聚丙烯酰胺不会促进土壤N2O排放通量,但氮、磷肥和聚丙烯酰胺存在交互作用,施聚丙烯酰胺条件下,施用氮、磷肥会显著增加土壤N2O排放量。施用磷肥促进了油茶林土壤N2O排放,因此,油茶林要合理施肥,在磷肥能满足树木生长所需的前提下,减少磷肥施用,有利于缓解温室效应。
Effects of water-retaining agent on soil nitrous oxide emission in Camellia oleifera forest under nitrogen and phosphorus addition
-
摘要:
目的 化肥施用导致土壤氧化亚氮(N2O)排放增加,加剧了全球气候变化。在干旱和降水分配不均地区,土壤含水量是影响土壤N2O排放的关键因子,施用保水剂(如聚丙烯酰胺)可能影响土壤N2O排放。本研究目的是探究氮(N)与磷(P)肥添加下施用聚丙烯酰胺对土壤N2O排放的影响。 方法 以油茶Camellia oleifera林土壤为研究对象,设置不同处理,包括不同肥料添加[N、P、N+P、不施肥(ck)],不同聚丙烯酰胺用量(C0:0 g·kg−1,C1:1.0 g·kg−1,C2:2.0 g·kg−1)以及两者交互处理,利用静态箱-气相色谱法测定油茶苗生长期内土壤N2O排放。 结果 ①施用聚丙烯酰胺显著提高了油茶林土壤含水量(P<0.05),且土壤含水量随保水剂施用量的增加而增加。与C0相比,C1和C2土壤的含水量分别增加47.1%和57.4%,但施用聚丙烯酰胺不会促进土壤N2O排放(F=2.75,P>0.05)。②施磷肥显著提高土壤N2O累积排放量(P<0.05),相较于ck增加13.3%。③与只添加聚丙烯酰胺的土壤相比,1.0 g·kg−1聚丙烯酰胺分别与N、P、N+P肥混施处理的土壤N2O排放通量分别显著增加56.0%、61.7%、40.7% (P<0.05);2.0 g·kg−1聚丙烯酰胺与P、N+P肥混施处理的土壤N2O排放通量分别显著增加38.7%、58.1% (P<0.05)。 结论 施用聚丙烯酰胺不仅能有效提高油茶土壤保水能力,而且还不会促进油茶土壤N2O排放,有利于发展高效节水林业和缓解全球气候变化。图5表1参35 Abstract:Objective The application of chemical fertilizer accelerates soil nitrous oxide (N2O) emission and intensifies global climate change. Soil moisture content is a key factor affecting soil N2O emission in arid and uneven rainfall distribution areas, so the application of water retaining agent (such as polyacrylamide) affects soil N2O emission. The purpose of this study is to explore the effect of polyacrylamid on soil N2O emission under the application of N and P fertilizer. Method Taking Camellia oleifera forest soil as the research object, different treatments were set, including different fertilizer additions (N, P, N+P, ck), different polyacrylamide dosage (C0: 0 g·kg−1, C1: 1.0 g·kg−1, C2: 2.0 g·kg−1) and their interaction. The soil N2O emission during the growth of C. oleifera seedlings was determined by static chamber gas chromatography. Result (1) The application of polyacrylamide significantly increased the soil moisture content of C. oleifera (P<0.05), which increased with the increase of the application amount. Compared with C0, the soil moisture content of C1 and C2 increased by 47.1% and 57.4% respectively, but the application of polyacrylamide did not promote soil N2O emission (F=2.75, P>0.05). (2) The application of P fertilizer significantly increased the cumulative soil N2O emission (P<0.05), which increased by 13.3% compared with ck. (3) Compared with the soil supplemented only with polyacrylamide, the N2O emission fluxes of soil treated with 1.0 g·kg−1 polyacrylamide and N, P, N+P fertilizer increased significantly by 56.0%, 61.7%, and 40.7%, respectively (P<0.05). The N2O emission fluxes of soil treated with 2.0 g·kg−1 polyacrylamide and P, N+P fertilizer increased significantly by 38.7% and 58.1%, respectively. Conclusion The application of polyacrylamide in C.oleifera soil can effectively improve soil water holding capacity, but will not promote soil N2O emission, which is conducive to the development of efficient water-saving forestry and the mitigation of global climate change. [Ch, 5 fig. 1 tab. 35 ref.] -
表 1 不同处理对土壤N2O排放通量、土壤含水量和N2O累积排放量的影响
Table 1. Effects of different treatments on soil N2O emission flux, soil moisture content and cumulative N2O emission
处理 df F N2O排放通量 土壤含水量 N2O累积排放量 N 1 5.41* 13.72** 1.35 P 1 6.27* 5.05* 5.41* N+P 1 2.23 4.19 0.49 C 2 0.66 200.89** 2.75 N+C 2 0.13 1.34 0.18 P+C 2 2.45 3.78* 2.24 N+P+C 2 3.13* 4.17* 1.71 说明:N表示施氮处理,P表示施磷处理,C表示施加聚丙烯 酰胺处理;*P<0.05,**P<0.01 -
[1] AGLIARDI E, ALEXOPOULOS T, CECH C. On the relationship between GHGS and global temperature anomalies: multi-level rolling analysis and copula calibration [J]. Environ Resour Econ, 2019, 72(1): 109 − 133. [2] 金银雪. 全球变暖下的水资源危机[J]. 生态经济, 2020, 36(6): 5 − 8. JIN Yinxue. Water crisis under global warming [J]. Ecol Econ, 2020, 36(6): 5 − 8. [3] HUANG Jianping, YU Haipeng, GUAN Xiaodan, et al. Accelerated dryland expansion under climate change [J]. Nat Climate Change, 2016, 6(2): 166 − 171. [4] JEFFERSON M. IPCC fifth assessment synthesis report: “Climate change 2014: Longer report”? Critical analysis [J]. Technol Forecasting Soc Change, 2015, 92: 362 − 363. [5] 张玉铭, 胡春胜, 张佳宝, 等. 农田土壤主要温室气体(CO2、CH4、N2O)的源/汇强度及其温室效应研究进展[J]. 中国生态农业学报, 2011, 19(4): 966 − 975. ZHANG Yuming, HU Chunsheng, ZHANG Jiabao, et al. Research advances on source/sink intensities and greenhouse effect of CO2, CH4 and N2O in agricultural soils [J]. Chin J Eco-Agric, 2011, 19(4): 966 − 975. [6] FOWLER D, COYLE M, SKIBA U, et al. The global nitrogen cycle in the twenty-first century [J]. Philosophical Transac Royal Soc B Biol Sci, 2013, 368(1621): 20130164. doi: 10.1098/rstb.2013.0165. [7] LIU Shuwei, LIN Feng, WU Shuang, et al. A meta-analysis of fertilizer-induced soil NO and combined NO+N2O emissions [J]. Glob Change Biol, 2017, 23(6): 2520 − 2532. [8] 王颖. 长期施肥对旱地农田温室气体N2O排放的影响[D]. 杨凌: 西北农林科技大学, 2017. WANG Ying. Effect of Long-term Fertilization on Greenhouse Gas N2O Emission in Rain-fed Farmland[D]. Yangling: Northwest A&F University, 2017. [9] 曹登超, 高霄鹏, 李磊, 等. 氮磷添加对昆仑山北坡高山草地N2O排放的影响[J]. 植物生态学报, 2019, 43(2): 165 − 173. CAO Dengchao, GAO Xiaopeng, LI Lei, et al. Effects of nitrogen and phosphorus additions on nitrous oxide emissions from alpine grassland in the northern slope of Kunlun Mountains [J]. Chin J Plant Ecol, 2019, 43(2): 165 − 173. [10] 赵苗苗, 邵蕊, 杨吉林, 等. 基于DNDC模型的稻田温室气体排放通量模拟[J]. 生态学杂志, 2019, 38(4): 1057 − 1066. ZHAO Miaomiao, SHAO Rui, YANG Jilin, et al. Simulation of greenhouse gas fluxes in rice fields based on DNDC model [J]. Chin J Ecol, 2019, 38(4): 1057 − 1066. [11] 程功, 刘廷玺, 王冠丽, 等. 科尔沁沙丘-草甸梯级生态系统CO2, CH4和N2O通量特征[J]. 水土保持研究, 2019, 26(4): 96 − 104. CHENG Gong, LIU Tanxi, WANG Guanli, et al. Characteristics of CO2, CH4 and N2O fluxes in Horqin dune-meadow cascade ecosystem [J]. Res Soil Water Conserv, 2019, 26(4): 96 − 104. [12] 武岩. 施肥措施对河套灌区农田氮素损失及平衡的影响[D]. 呼和浩特: 内蒙古农业大学, 2018. WU Yan. Effects of Fertilization on Farmland Nitrogen Loss and Balance in Hetao Irrigated Area[D]. Huhhot: Inner Mongolia Agricultural University, 2018. [13] 朱文煜. 艾比湖湿地季节性冻融土壤温室气体排放规律研究[J]. 北京师范大学学报(自然科学版), 2020, 56(1): 1 − 8. ZHU Wenyu. Greenhouse gas emission from seasonal frozen-thawed soil in Ebinur Lake wetland [J]. J Beijing Norm Univ Nat Sci, 2020, 56(1): 1 − 8. [14] 缪平贵, 于显枫, 张绪成, 等. 立式深旋耕作对马铃薯农田土壤温室气体排放的影响[J]. 作物杂志, 2020(3): 109 − 116. MIAO Pinggui, YU Xianfeng, ZHANG Xucheng, et al. Effects of vertical deep rotary tillage on soil greenhouse gas emissions from potato farmland [J]. Crops, 2020(3): 109 − 116. [15] 李水秀. 模拟降雨量改变对松嫩草地N2O通量的影响[D]. 长春: 东北师范大学, 2019. LI Shuixiu. Effects of Simulated Precipitation Changes on N2O Flux in Songnen Meadow Steppe[D]. Changchun: Northeast Normal University, 2019. [16] OMIDIAN H, ROCCA J G, PARK K. Advances in superporous hydrogels [J]. J Controlled Release, 2005, 102(1): 3 − 12. [17] 邹新禧. 超强吸水剂[M]. 北京: 化学工业出版社, 2002: 473 − 635. [18] 闫永利, 于健, 魏占民, 等. 土壤特性对保水剂吸水性能的影响[J]. 农业工程学报, 2007, 23(7): 76 − 79. YAN Yongli, YU Jian, WEI Zhanmin, et al. Effects of soil properties on water absorption of super absorbent polymers [J]. Transac Chin Soc Agric Eng, 2007, 23(7): 76 − 79. [19] LIU Caixia, CHEN Longsheng, TANG Wei, et al. Predicting potential distribution and evaluating suitable soil condition of oil tea Camellia in China [J]. Forests, 2018, 9(8): 487. doi: 10.3390/f9080487. [20] 王书丽, 郭晓敏, 黄立君, 等. 不同施肥和保水措施对油茶土壤N2O排放的影响[J]. 农业环境科学学报, 2020, 39(9): 1 − 12. WANG Shuli, GUO Xiaomin, HUANG Lijun, et al. Effects of different fertilization and water retention measures on N2O emission from Camellia oleifera soil [J]. JAgro-Environ Sci, 2020, 39(9): 1 − 12. [21] 陈渠昌, 雷廷武, 李瑞平. PAM对坡地降雨径流入渗和水力侵蚀的影响研究[J]. 水利学报, 2006, 37(11): 1290 − 1296. CHEN Quchang, LEI Tingwu, LI Ruiping. The impacts of PAM on runoff infiltration and water erosion from slope lands [J]. J Hydraulic Eng, 2006, 37(11): 1290 − 1296. [22] 李娜, 耿玉清, 赵新宇, 等. 生物炭和PAM混施影响煤矸石基质水分的入渗和蒸发[J]. 水土保持学报, 2020, 34(2): 290 − 295. LI Na, GENG Yuqin, ZHAO Xinyu, et al. Mixed application of biochar and PAM influences water infiltration and evaporation of coal gangue matrix [J]. J Soil Water Conserv, 2020, 34(2): 290 − 295. [23] 魏达, 旭日, 王迎红, 等. 青藏高原纳木错高寒草原温室气体通量及与环境因子关系研究[J]. 草地学报, 2011, 19(3): 412 − 419. WEI Da, XU Ri, WANG Yinghong, et al. CH4, N2O and CO2 fluxes and correlation with environmental factors of alpine steppe grassland in Nam Co Region of Tibetan Plateau [J]. Acta Agrestia Sin, 2011, 19(3): 412 − 419. [24] 王冠钦, 李飞, 彭云峰, 等. 土壤含水量调控高寒草原生态系统N2O排放对增温的响应[J]. 植物生态学报, 2018, 42(1): 105 − 115. WANG Guanqin, LI Fei, PENG Yunfeng, et al. Response of soil N2O emission to experimental warming regulated by soil moisture in an alpine steppe [J]. Chin J Plant Ecol, 2018, 42(1): 105 − 115. [25] DAVIDSON E A, KELLER M, ERICKSON H E, et al. Testing a conceptual model of soil emissions of nitrous and nitric oxides [J]. BioScience, 2000, 50(8): 667 − 680. [26] 董艳芳, 黄景, 李伏生, 等. 不同灌溉模式和施氮处理下稻田CH4和N2O排放[J]. 植物营养与肥料学报, 2017, 23(3): 578 − 588. DONG Yanfang, HUANG Jing, LI Fusheng, et al. Emissions of CH4 and N2O under different irrigation methods and nitrogen treatments [J]. J Plant Nutr Fert, 2017, 23(3): 578 − 588. [27] MORI T, OHTA S, ISHIZUKA S, et al. Phosphorus application reduces N2O emissions from tropical leguminous plantation soil when phosphorus uptake is occurring [J]. Biol Fert Soils, 2014, 50(1): 45 − 51. [28] MEHNAZ K R, DIJKSTRA F A. Denitrification and associated N2O emissions are limited by phosphorus availability in a grassland soil [J]. Geoderma, 2016, 284: 34 − 41. [29] MORI T, WACHRINRAT C, STAPORN D, et al. Effects of phosphorus addition on nitrogen cycle and fluxes of N2O and CH4 in tropical tree plantation soils in Thailand [J]. Agric Nat Resour, 2017, 51(2): 91 − 95. [30] MORI T, OHTA S, ISHIZUKA S, et al. Effects of phosphorus addition with and without ammonium, nitrate, or glucose on N2O and NO emissions from soil sampled under Acacia mangium plantation and incubated at 100% of the water-filled pore space [J]. Biol Fert Soils, 2013, 49(1): 13 − 21. [31] CAMENZIND T, HÄTTENSCHWILER S, TRESEDER K K, et al. Nutrient limitation of soil microbial processes in tropical forests [J]. Ecol Monographs, 2018, 88(1): 4 − 21. [32] CLEVELAND C C, TOWNSEND A R, SCHMIDT S K. Phosphorus limitation of microbial processes in moist tropical forests: evidence from short-term laboratory incubations and field studies [J]. Ecosystems, 2002, 5(7): 680 − 691. [33] VITOUSEK P M, WALKER L R, WHITEAKER L D, et al. Nutrient limitations to plant growth during primary succession in Hawaii Volcanoes National Park [J]. Biogeochemistry, 1993, 23(3): 197 − 215. [34] KLEMEDTSSON L, SVENSSON B H, ROSSWALL T. Relationships between soil moisture content and nitrous oxide production during nitrification and denitrification [J]. Biol Fert Soils, 1988, 6(2): 106 − 111. [35] BAKKEN L R, BERGAUST L, LIU B, et al. Regulation of denitrification at the cellular level: a clue to the understanding of N2O emissions from soils [J]. Philosophical Transac Royal Soc B Biol Sci, 2012, 367(1593): 1226 − 1234. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210411






 下载:
下载: