-
硝化和反硝化是土壤中氮素损失的潜在途径。随着人类活动的加剧,土壤中的硝化和反硝化作用会向大气中释放更多的温室气体氧化亚氮。由人为活动所产生的氧化亚氮中,耕地土壤的释放量贡献了65%左右[1]。反硝化作用(denitrification)是指把硝酸盐等较复杂的含氮化合物转化为氮气、一氧化氮和二氧化氮的过程,这是厌氧条件下( > 60%的土壤孔隙水含量)陆地氧化亚氮产生的主要生物过程。在过去的1个多世纪里,人们通常认为反硝化过程都是由进行无氧呼吸的细菌进行的,但近年来的研究发现,真菌也可以进行反硝化作用[2]。在分离获得的真菌中,已经发现很多种具有产生氧化亚氮的能力。虽然在纯培养条件下,真菌产生氧化亚氮活性与细菌相比要低几个数量级[3],但是对土壤氧化亚氮产生能力的测定结果表明,真菌产氧化亚氮的能力远超细菌[4-5]。Laughlin等[4]研究表明:在草地及耕作泥炭土中使用放线菌酮抑制真菌活性时,土壤氧化亚氮排放通量减少了80%,而用链霉素抑制土壤细菌活性后,土壤氧化亚氮排放通量仅减少30%左右。真菌在土壤氧化亚氮排放中的重要贡献可能是由于其生物量在土壤微生物中占据着非常大的优势。土壤原位氧化亚氮排放通量与土壤真菌生物量呈显著正相关,而与反硝化细菌及其他土壤性质没有明显的相关[6]。已经有一些关于草地、湿地以及耕地等生态系统土壤真菌氧化亚氮排放的研究,但是对于林地土壤的研究尚不多见[4-5, 7-8]。部分经济林的集约经营程度越来越高,它们对土壤微生物,特别是对土壤真菌的干扰也非常剧烈。由于真菌可以耐受更低的pH值,且在林地土壤中的生物量也往往高于细菌,因此真菌在南方酸性森林土壤氧化亚氮排放过程中可能具有更大的贡献[9-10]。毛竹Phyllostachy edulis是中国南方的主要竹种[11],地下根鞭发达,穿透能力极强,可以帮助毛竹不断向周边森林蔓延并替代原有森林。此外,毛竹林的经济价值较高,目前农户对其的集约经营程度也在不断提高。由于真菌对人为干扰较为敏感,原有天然林改变为毛竹林必将导致土壤真菌群落结构的变化,进而导致土壤氧化亚氮排放通量的改变。本研究利用选择性抑制方法,研究毛竹林及阔叶林土壤细菌及真菌对氧化亚氮排放的贡献率,揭示不同微生物在林地土壤温室气体排放中的作用及其影响机制,从而对阔叶林演变成毛竹林进行生态风险评估,为合理经营毛竹林,减少温室气体排放提供理论依据。
-
在浙江省临安市天目山国家级自然保护区进行野外调查,在相似地形地貌条件下分别选取4块毛竹林地(moso bamboo forest,MB)和4块阔叶林地(broad-leaved forest, BL)。所有样地土壤均为花岗岩发育的红壤,毛竹林地土壤为粉黏土(黏粒43.27%,粉粒40.34%,砂粒16.39%),阔叶林地土壤为粉黏壤土(黏粒38.50%,粉粒48.68%,砂粒12.82%)。采用5点采样法采取土样,采集表层(0~20 cm)土壤,装入自封袋带回实验室。去除大的动植物残体及石砾后,样品过2 mm钢筛混匀,四分法后弃去多余样品。样品分为2份,1份立即进行室内培养试验和磷脂脂肪酸分析,另1份风干后测定土壤pH值、有机质、全氮质量分数等基本理化性质。
-
混合后的新鲜土样用于室内培养试验,测定细菌及真菌对土壤氧化亚氮排放通量的贡献率。试验共分为4个处理:①对照(control),不添加任何抗生素;②链霉素(streptomycin,strep),土壤中添加1.0 mg·g-1的链霉素;③放线菌酮(cycloheximide,cyclo),土壤添加2.0 mg·g-1放线菌酮;④链霉素+放线菌酮(both),土壤中同时添加1.0 mg·g-1的链霉素和2.0 mg·g-1放线菌酮。重复3次·土样-1。
-
称取相当于20.0 g干质量的新鲜土壤放进150 mL棕色试剂瓶中,加入4.0 mL不同抗生素溶液(对照仅加去离子水)使土壤抗生素质量分数达到试验设计要求。试剂瓶装好土样后,先在4 ℃条件下过夜预培养,以使抗生素逐渐扩散至整个土壤空隙中。之后,将试剂瓶移至室温培养,向土壤中分别加入100 mmol· L-1葡萄糖和100 mmol· L-1硝酸钾,使土壤含水量达到田间最大持水量的90%左右。将试剂瓶用塞上橡胶塞后,向其中充体积分数为10%的乙炔以抑制氧化亚氮继续还原成氮气。将土样与溶液充分混合后,放在培养箱中18 ℃培养7 h后,开始用针筒抽取试剂瓶内气体,岛津(GC-2014)气相色谱测定氧化亚氮通量。
-
新鲜样品带回实验室后,立即进行冷冻干燥,测定土壤磷脂脂肪酸摩尔质量浓度。磷脂脂肪酸测定参照Wu等[12]方法。称取3.0 g冻干土样,采用氯仿提取总磷脂后,将样品装载硅胶柱(SPE-Si),分别用氯仿、丙酮和甲醇洗脱中性脂、糖脂和极性磷脂。将所有组分进行甲基化,氯仿回收,氮气吹干后气相色谱(安捷伦6890N)测定。总磷脂脂肪酸摩尔质量浓度用于表征土壤总微生物量。细菌的代表性组分为:i15:0, a15:0, 15:0, i16:0, 16:1w7c, i17:0, a17:0, cy17:0, 17:0, 18:1w7c, cy19:0w8c;真菌特征性脂肪酸为18:2w6, 9c[13]。磷脂脂肪酸摩尔质量浓度以nmol·g-1干土表示。
-
土壤有机质采用重铬酸钾外加热法测定;全氮采用凯氏法测定;硝态氮和铵态氮采用氯化钾浸提,流动分析仪测定;有效磷采用Bray法测定,盐酸-氟化铵溶液浸提,比色法测定;速效钾采用乙酸铵提取-火焰光度法测定;pH值采用1:2.5土水比,酸度计测定[14]。
-
采用Excel 2007和SPSS 18.0处理数据,Duncan单因素方差分析法比较各处理之间的差异显著性(P < 0.05),配对样本t检验比较毛竹林与阔叶林土壤理化性质及土壤细菌与真菌反硝化能力的差异显著性,采用Pearson相关系数检验不同微生物氧化亚氮排放能力与土壤理化性质的相关关系。
-
所有样地土壤均表现出不同程度的酸性,而不同毛竹林及阔叶林样地之间土壤pH值差异也较大。分析结果表明:毛竹林不同样地土壤有机质、全氮、有效磷及硝态氮质量分数均没有显著差异,而阔叶林不同样地之间土壤有机质、全氮及速效钾也没有显著差异,说明不同林分土壤有机质及全氮质量分数分布总体较为均一。对比2种林分,阔叶林土壤pH值显著低于毛竹林(P < 0.05),而有机质与有效磷质量分数显著高于毛竹林土壤(P < 0.05)。相反,毛竹林土壤速效钾质量分数显著高于阔叶林(P < 0.05,表 1)。毛竹林入侵阔叶林或阔叶林人工演替为毛竹林后,由于地上植被以及凋落物输入的改变,土壤理化性质也发生了相应的变化。此外,毛竹林人为干扰程度也在不断增加,如劈灌、翻耕、施肥以及伐竹等,都会导致养分含量的改变,如土壤有机质质量分数。肖复明等[15]研究表明:长期集约经营后,毛竹林土壤有机碳逐渐下降。而毛竹林土壤速效钾高于阔叶林,可能是由于人为施肥所造成的。
表 1 毛竹林及阔叶林土壤理化性质
Table 1. Soil parameters of Phyllostachy edulis and broad-leaved forest
样地 pH值 有机质/(g·kg-1) 全氮/(g·kg-1) 有效磷/(mg·kg-1) 速效钾/(mg·kg-1) 铵态氮/(mg·kg-1) 硝态氮/(mg·kg-1) 毛竹林 MB-1 5.22±0.01 a 10.60±1.17 a 1.24±0.12 a 29.60±6.38 a 60.50±4.77 a 41.83±2.34 a 10.81±0.05 a MB-2 5.02±0.01 b 11.40±0.23 a 1.16±0.09 a 28.89±7.53 a 60.17±6.66 a 54.07±2.51 b 11.32±1.81 a MB-3 5.22±0.02 a 10.72±0.48 a 1.18±0.14 a 30.23±11.21 a 49.17±4.25 b 42.61±1.13 a 10.95±0.91 a MB-4 4.96±0.01 c 11.71±1.08 a 1.33±0.11 a 25.12±6.44 a 57.67±0.58 ab 55.11±2.78 b 11.68±1.81 a 阔叶林 BL-1 4.45±0.01 a 12.39±0.16 a 1.25±0.24 a 38.70±8.36 a 52.00±3.61 a 54.07±2.51 a 12.65±0.61 a BL-2 4.60±0.01 b 14.40±0.72 a 1.33±0.10 a 46.93±10.25 a 44.50±5.89 a 38.44±2.51 b 13.51±1.96 a BL-3 4.66±0.01 c 12.10±0.11 a 1.29±0.06 a 47.72±7.13 ab 42.00±12.17 a 43.39±3.41 ab 11.25±1.12 ab BL-4 4.79±0.01 d 13.41±2.18 a 1.26±0.13 a 55.40±4.97 b 38.17±3.06 a 44.95±1.78 ab 9.58±0.81 b 配对t检验P值 0.032 0.012 0.377 0.023 0.023 0.641 0.608 说明:表中数据为平均值,同列不同字母表示样地间差异达到显著水平(P < 0.05)。毛竹林与阔叶林之间的差异经配对样本t检验其显著性。 -
磷脂脂肪酸是几乎所有活体微生物细胞膜的主要成分,周转速率极快且随细胞死亡而迅速降解[16]。因此,本试验采用土壤微生物总磷脂脂肪酸摩尔质量浓度作为土壤微生物量的指标,可以最大限度地测定土壤中的活性微生物。结果表明:无论是总微生物量、细菌及真菌生物量以及真菌/细菌比值,毛竹林与阔叶林2种林分之间均没有显著差异。同样,毛竹林的不同样地之间也没有显著差异。阔叶林土壤中,BL-4样地总微生物量与细菌生物量均显著高于BL-1样地(P < 0.05,表 2)。Pearson相关分析表明:真菌生物量与土壤pH值呈显著负相关(R2=-0.752,P < 0.05),而与土壤有机质呈极显著正相关(R2=0.965,P < 0.01);细菌生物量与土壤速效磷显著相关(R2=0.830,P < 0.05),而土壤真菌/细菌比值与硝态氮显著相关(R2=0.815,P < 0.05)。与细菌相比,真菌可以适应更广的pH值范围,且酸性pH值有利于真菌而不利于细菌的生长[17]。因此,在酸性的毛竹林和阔叶林土壤中,真菌的活性相对较强。有机质也是影响真菌的一个重要因素。研究表明:森林转换为耕地之后导致土壤有机质降低,进而降低林地土壤真菌生物量[18]。与土壤有机质相似的是,毛竹林真菌生物量与阔叶林相比有下降的趋势,尽管没有显著差异。
表 2 毛竹林及阔叶林土壤微生物量
Table 2. Soil microbial biomass of Phyllostachy edulis and broad-leaved forest
样地 土壤微生物量/(nmol·g-1) 真菌生物量/(nmol·g-1) 细菌生物量/(nmol·g-1) 真菌/细菌 毛竹林 MB-1 31.06±4.80 a 3.52±0.25 a 12.13±0.88 a 0.29±0.02 a MB-2 24.75±3.96 a 3.80±0.45 a 11.80±2.54 a 0.33±0.07 a MB-4 23.50±4.25 a 3.75±0.26 a 12.94±1.35 a 0.29±0.05 a MB-3 26.67±4.76 a 4.12±0.55 a 11.56±2.00 a 0.37±0.11 a 阔叶林 BL-1 26.98±2.23 a 4.83±0.55 a 12.99±0.82 ab 0.37±0.04 a BL-2 34.27±4.93 ab 4.10±0.30 a 14.65±0.71 b 0.28±0.03 a BL-3 36.05±3.34 b 4.26±0.29 a 14.91±0.56 b 0.29±0.02 a BL-4 27.22±1.75 a 4.04±0.63 a 11.41±1.19 a 0.36±0.08 a 说明:表中数据为平均值,同列不同字母表示同一林分不同样地之间差异达到显著水平(P < 0.05)。 -
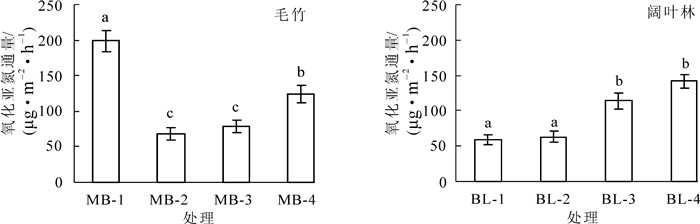
不同林分土壤以及同一种林分不同样地之间氧化亚氮的排放通量都存在较大差异,其中毛竹林MB-1样地土壤氧化亚氮排放通量最高,其次是MB-4,BL-3及BL-4等样地,MB-2和BL-1,BL-2等样地的氧化亚氮排放通量最低(图 1)。相关分析结果表明:土壤氧化亚氮排放通量与本研究所选择测定的部分土壤理化性质没有显著相关性。土壤氧化亚氮排放与许多因素有关,如土壤含水量、容重、pH值、有机质质量分数、氮肥施用量等等[19]。因此,本研究中不同林分甚至同一林分不同样地之间存在的巨大差异,可能是由多种土壤环境因素共同决定的,其影响因素还有待于进一步的研究。统计结果表明:毛竹林和阔叶林土壤氧化亚氮排放通量没有显著差异(t=-0.574, P=0.606)。在以往对森林土壤氧化亚氮排放通量的研究过程中,往往将土壤温度和湿度作为关键因子[20],但近年来的研究则发现:氮素水平是一个关键因素[21]。对比2种不同林分,无论是土壤全氮还是矿质态氮均没有显著差异(表 1),这可能是2种林分氧化亚氮排放通量没有差异的主要原因。
无论是单独添加放线菌酮、链霉素还是同时添加2种抗生素,均显著抑制了土壤氧化亚氮排放通量(P < 0.05)。同时添加2种抗生素对土壤氧化亚氮排放通量的抑制率在73%~83%,但是同一林分的不同样地之间没有显著差异,而单独添加链霉素或者放线菌酮的处理对土壤氧化亚氮排放通量的抑制率变化较大。图 2结果表明:在2种林分的样地中,除了个别样地外(MB-2,BL-1),其他所有土壤真菌氧化亚氮排放通量均显著高于细菌(P < 0.05)。如在毛竹林土壤中,真菌对土壤氧化亚氮排放的贡献率为40.8%~56.2%,远高于细菌(9.0%~33.4%)。阔叶林土壤中也呈现同样的规律,真菌对土壤氧化亚氮排放贡献率为38.0%~62.8%,而细菌的贡献率为12.6%~32.4%(图 2)。目前,已有研究表明,在森林生态系统中的真菌群落对土壤氧化亚氮排放的贡献要大于草地以及人为耕作的生态系统[4-5, 8]。同时,真菌与细菌对土壤氧化亚氮排放的贡献比在不同的生态系统中存在着较大的差异[22]。毛竹林与阔叶林由于其地上植被以及人为干扰程度不一样,真菌与细菌对土壤氧化亚氮排放的贡献率也就存在着一定的差异。

图 2 毛竹林及阔叶林土壤真菌及细菌的氧化亚氮排放通量
Figure 2. Contributions of fungi and bacteria on N2O fluxes in Phyllostachy edulis and broad-leaved forest soils
与此类似的是,在2种林分的不同样地之间,土壤真菌及细菌对氧化亚氮排放通量的贡献率也有着显著的差异(P < 0.05)。如在毛竹林土壤中,尽管氧化亚氮排放通量显著低于样地MB-1(P < 0.05),但是MB-3样地的土壤真菌氧化亚氮排放贡献率达到56.2%,显著高于MB-1样地真菌排放贡献率(49.7%,P < 0.05)。而在阔叶林土壤中,BL-3和BL-4样地土壤总氧化亚氮排放通量显著高于(P < 0.05)另外2个样地的同时,其真菌氧化亚氮排放贡献率也显著高于样地BL-1和BL-2(P < 0.05)。
将土壤氧化亚氮排放通量与所有土壤理化性质及微生物生物量进行Pearson相关分析。结果表明:真菌与细菌的氧化亚氮排放贡献之间存在极显著的相关性(P < 0.01),可能与2种微生物群落反硝化的环境条件要求较为相似有关。值得注意的是,真菌及细菌氧化亚氮排放通量与其生物量之间没有显著相关性,说明生物量并非是决定氧化亚氮排放通量的关键因素。由于只有一些特定的真菌即细菌种类可以进行反硝化作用,如真菌中的镰刀菌属Fusarium spp.具有较强的氧化亚氮释放能力[23]。因此,真菌的氧化亚氮排放贡献主要与真菌群落及特定种群的反硝化活性相关。今后仍然需要从微生物物种多样性以及功能基因丰度等方面来进一步研究土壤反硝化作用的主要贡献者及其关键影响因素。以往有研究结果表明:真菌与细菌的氧化亚氮产生活性与土壤pH值关系较大,这可能是由于pH值对这2种微生物数量及活性均有着重要的影响[22, 24]。由于真菌可以适应非常宽的pH值范围,其受土壤pH值改变的影响相对细菌小,而细菌生物量在酸性条件下可能会受到抑制,因此在酸性土壤中真菌对氧化亚氮排放的贡献就会大于细菌。然而与以往结果不同的是,本研究发现土壤真菌即细菌氧化亚氮排放通量与土壤pH值没有显著相关关系,这可能与不同样地之间pH值较为接近有关。但是,真菌氧化亚氮排放通量与土壤硝态氮含量有较强的负相关关系,尽管并不显著(R2=-0.673,P=0.067)。通常,氧化亚氮通量与NO3-N呈负相关关系。随着反硝化作用的进行,NO3-N作为电子受体含量下降,还原成氧化亚氮释放出来[25]。
-
抗生素选择性抑制试验结果表明:①无论是毛竹林还是阔叶林,真菌都是土壤氧化亚氮排放的主要贡献者;②阔叶林演替为毛竹林既没有改变土壤氧化亚氮排放通量,也没有影响真菌及细菌对土壤氧化亚氮排放通量的相对贡献率;③真菌和细菌氧化亚氮排放特征相似,但与生物量没有相关性。
近年来,毛竹林不断替代阔叶林的同时,经营强度也在不断增加。据统计,有40%~50%的毛竹林实行集约化栽培。与天然状态的粗放经营毛竹林相比,集约经营毛竹林的典型特点表现为清除林下杂草,土壤翻耕以及施用大量化肥等。尽管集约经营措施可以一定程度上增加毛竹地上部的生物量,提高碳储量[26],但也有研究表明,使用化肥显著增加了毛竹林土壤二氧化碳和氧化亚氮的排放通量,且毛竹林土壤温室气体的排放速率随着化肥施用量增加呈显著增加趋势[27],但是其内在机制仍不清楚。人为干扰如翻耕、放牧以及氮肥施用等都会影响土壤真菌群落结构和功能[28],继而对土壤氧化亚氮排放产生潜在影响。本研究中,我们只是针对阔叶林和毛竹林进行了研究,但是不同经营年限以及经营强度对毛竹林土壤真菌氧化亚氮相对排放贡献的影响尚未涉及,今后仍需在更加广泛的范围内针对人工经营毛竹林进行采样,并结合稳定性同位素标记手段来研究真菌在森林,特别是人工经营森林生态系统氧化亚氮排放中的贡献。明确土壤真菌氧化亚氮排放相对贡献及其对毛竹林人为经营的响应特征,对于合理经营毛竹林,控制全球气候变化将具有十分重要的意义。
Fungal and bacterial contribution to soil N2O production in Phyllostachys edulis and broadleaf forest ecosystems
-
摘要: 为研究真菌及细菌对毛竹Phyllostachys edulis林和阔叶林土壤氧化亚氮排放的贡献率, 评估阔叶林演替为毛竹林对温室气体排放的影响, 野外调查毛竹及阔叶林样地, 每种林分选取4个样地采集土样, 测定土壤理化性质及磷脂脂肪酸摩尔质量浓度, 并进行室内抗生素抑制培养试验。试验设置4个处理:①不添加抗生素的对照; ②仅添加放线菌酮; ③仅添加链霉素; ④同时添加放线菌酮和链霉素。培养7 h后, 测定氧化亚氮排放通量。结果表明:土壤真菌生物量与有机质极显著正相关(R2=0.965, P < 0.01), 而与pH值显著负相关(R2=-0.752, P < 0.05)。毛竹林和阔叶林土壤氧化亚氮排放通量没有显著差异。2种林地土壤中, 真菌都是氧化亚氮排放的主要贡献者(毛竹林40.8%~56.2%, 阔叶林38.0%~62.8%), 其贡献率显著高于细菌(毛竹林9.0%~33.4%, 阔叶林12.6%~32.4%)。阔叶林演替为毛竹林对土壤真菌及细菌的氧化亚氮排放相对贡献率没有影响。相关分析结果表明:真菌及细菌氧化亚氮排放具有显著的同步效应(P < 0.01), 但与其生物量没有显著相关关系。Abstract: To determine the relative contribution of fungi and bacteria to soil N2O production in Phyllostachys edulis and broadleaf forest ecosystems and to further study the impact of forest type on soil N2O emission when converting from a broadleaf forest to a Ph. edulis forest, an incubation experiment with soils collected from different forest types was conducted. Four broadleaf and Ph. edulis forest with similar topograph were selected randomly, and toplayer (0-20 cm) soils were sampled. Soil phospholipid fatty acids (PLFAs) were extracted and analyzed to measure the soil microbial biomass. To study the relative contribution of fungi and bacteria to soil N2O emissions, a selective inhibition experiment with addition of different antibiotics (streptomycin and/or cycloheximide, and an antibiotic-free control) was established using a random complete block design. Soil water content was adjusted to 90% water-filled pore space and N2O production was measured by gas chromatography after 7 h of incubation. Student's t-test and Pearson's correlation were used for statistical comparisons and correlation analyses, separately. Results indicated that fungal biomass was significantly and highly correlated with soil organic matter content (R2=0.965, P < 0.01) and significantly and negatively correlated with pH (R2=-0.752, P < 0.05). No significant differences for N2O flux between Ph. edulis and a broadleaf forest were found. For the two forest types, fungi contributed significantly more (P < 0.05) to soil N2O fluxes (40.8%-56.2% with Ph. edulis and 8.0%-62.8% for the broadleaf forest) than bacteria (9.0%-33.4% with Ph. edulis and 12.6%-32.4% in the broadleaf forest). The correlation analyses showed that the fungi and bacteria for these two forest types had similar N2O flux patterns (P < 0.01), but they were not correlated to biomass. Thus, the conversion of a broadleaf forest to Ph. edulis did not increase the N2O flux; denitrification activity of specific fungal species may also play a more important role in soil fungi originated N2O emissions than the fungal biomass.
-
Key words:
- forest soil science /
- N2O /
- Phyllostachys edulis /
- broadleaf forest /
- fungi
-
表 1 毛竹林及阔叶林土壤理化性质
Table 1. Soil parameters of Phyllostachy edulis and broad-leaved forest
样地 pH值 有机质/(g·kg-1) 全氮/(g·kg-1) 有效磷/(mg·kg-1) 速效钾/(mg·kg-1) 铵态氮/(mg·kg-1) 硝态氮/(mg·kg-1) 毛竹林 MB-1 5.22±0.01 a 10.60±1.17 a 1.24±0.12 a 29.60±6.38 a 60.50±4.77 a 41.83±2.34 a 10.81±0.05 a MB-2 5.02±0.01 b 11.40±0.23 a 1.16±0.09 a 28.89±7.53 a 60.17±6.66 a 54.07±2.51 b 11.32±1.81 a MB-3 5.22±0.02 a 10.72±0.48 a 1.18±0.14 a 30.23±11.21 a 49.17±4.25 b 42.61±1.13 a 10.95±0.91 a MB-4 4.96±0.01 c 11.71±1.08 a 1.33±0.11 a 25.12±6.44 a 57.67±0.58 ab 55.11±2.78 b 11.68±1.81 a 阔叶林 BL-1 4.45±0.01 a 12.39±0.16 a 1.25±0.24 a 38.70±8.36 a 52.00±3.61 a 54.07±2.51 a 12.65±0.61 a BL-2 4.60±0.01 b 14.40±0.72 a 1.33±0.10 a 46.93±10.25 a 44.50±5.89 a 38.44±2.51 b 13.51±1.96 a BL-3 4.66±0.01 c 12.10±0.11 a 1.29±0.06 a 47.72±7.13 ab 42.00±12.17 a 43.39±3.41 ab 11.25±1.12 ab BL-4 4.79±0.01 d 13.41±2.18 a 1.26±0.13 a 55.40±4.97 b 38.17±3.06 a 44.95±1.78 ab 9.58±0.81 b 配对t检验P值 0.032 0.012 0.377 0.023 0.023 0.641 0.608 说明:表中数据为平均值,同列不同字母表示样地间差异达到显著水平(P < 0.05)。毛竹林与阔叶林之间的差异经配对样本t检验其显著性。 表 2 毛竹林及阔叶林土壤微生物量
Table 2. Soil microbial biomass of Phyllostachy edulis and broad-leaved forest
样地 土壤微生物量/(nmol·g-1) 真菌生物量/(nmol·g-1) 细菌生物量/(nmol·g-1) 真菌/细菌 毛竹林 MB-1 31.06±4.80 a 3.52±0.25 a 12.13±0.88 a 0.29±0.02 a MB-2 24.75±3.96 a 3.80±0.45 a 11.80±2.54 a 0.33±0.07 a MB-4 23.50±4.25 a 3.75±0.26 a 12.94±1.35 a 0.29±0.05 a MB-3 26.67±4.76 a 4.12±0.55 a 11.56±2.00 a 0.37±0.11 a 阔叶林 BL-1 26.98±2.23 a 4.83±0.55 a 12.99±0.82 ab 0.37±0.04 a BL-2 34.27±4.93 ab 4.10±0.30 a 14.65±0.71 b 0.28±0.03 a BL-3 36.05±3.34 b 4.26±0.29 a 14.91±0.56 b 0.29±0.02 a BL-4 27.22±1.75 a 4.04±0.63 a 11.41±1.19 a 0.36±0.08 a 说明:表中数据为平均值,同列不同字母表示同一林分不同样地之间差异达到显著水平(P < 0.05)。 -
[1] SMITH K A, CONEN F. Impacts of land management on fluxes of trace greenhouse gases[J]. Soil Use Manage, 2004, 20(2):255-263. [2] ZUMFT W G. Cell biology and molecular basis of denitrification[J]. Microbiol Mol Biol Rev, 1997, 61(4):533-616. [3] KURAKOV A V, NOSIKOV A N, SKRYNNIKOVA E V, et al. Nitrate reductase and nitrous oxide production by Fusarium oxysporum 11dn1 under aerobic and anaerobic conditions[J]. Curr Microbiol, 2000, 41(2):114-119. [4] LAUGHLIN R J, STEVENS R J. Evidence for fungal dominance of denitrification and co-denitrification in a grassland soil[J]. Soil Sci Soc Am J, 2002, 66(5):1540-1548. [5] CRENSHAW C L, LAUBER C, SINSABAUGH R L, et al. Fungal control of nitrous oxide production in semiarid grassland[J]. Biogeochemistry, 2008, 87(1):17-27. [6] KOMATSUZAKI M, SATO Y, OHTA H. Relationships between fungal biomass and nitrous oxide emission in upland rice soils under no tillage and cover cropping systems[J]. Microbes Environ, 2008, 23(3):201-208. [7] KINNEY C A, MOSIER A R, FERRER I, et al. Effects of the herbicides prosulfuron and metolachlor on fluxes of CO2, N2O, and CH4 in a fertilized Colorado grassland soil[J]. J Geophys Res, 2004, 109(D5):doi:10.1029/2003JD003536. [8] MCLAIN J E T, MARTENS D A. N2O production by heterotrophic N transformations in a semiarid soil[J]. Appl Soil Ecol, 2006, 32(2):253-263. [9] JOERGENSEN R G, WICHERN F. Quantitative assessment of the fungal contribution to microbial tissue in soil[J]. Soil Biol Biochem, 2008, 40(12):2977-2991. [10] STRICKLAND M S, ROUSK J. Considering fungal:bacterial dominance in soils-methods, controls, and ecosystem implications[J]. Soil Biol Biochem, 2010, 42(9):1385-1395. [11] 王奇赞, 徐秋芳, 姜培坤, 等.天目山毛竹入侵阔叶林后土壤细菌群落16S rDNA V3区片段PCR的DGGE分析[J].土壤学报, 2009, 46(4):662-669. WANG Qizan, XU Qiufang, JIANG Peikun, et al. DGGE analysis of PCR of 16SrDNA V3 fragment of soil bacteria community in soil under natural broadleaf forest invaded by Phyllostachy pubescens in Tianmu Mountain Nature Reserve[J]. Acta Pedol Sin, 2009, 46(4):662-669. [12] WU Yuping, DING Na, WANG Gang, et al. Effects of different soil weights, storage times and extraction methods on soil phospholipid fatty acid analyses[J]. Geoderma, 2009, 150(1):171-178. [13] DING Na, GUO Haichao, HAYAT T, et al. Microbial community structure changes during Aroclor 1242 degradation in the rhizosphere of ryegrass (Lolium multiflorum L)[J]. FEMS Microbiol Ecol, 2009, 70(2):305-314. [14] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社, 2000. [15] 肖复明, 范少辉, 汪思龙, 等.毛竹林地土壤团聚体稳定性及其对碳储量影响研究[J].水土保持学报, 2008, 22(2):131-134. XIAO Fuming, FAN Shaohui, WANG Silong, et al. Moso bamboo plantation soil aggregate stability and its impact on carbon storage[J]. J Soil Water Conserv, 2008, 22(2):131-134. [16] HILL T C J, MCPHERSON E F, HARRIS J A.Microbial biomass estimated by phospholipid phosphate in soils with diverse microbial communities[J]. Soil Biol Biochem, 1993, 25(12):1779-1786. [17] WHEELER K A, HURDMAN B F, PITT J I. Influence of pH on the growth of some toxigenic species of Aspergillus, Penicillium and Fusarium[J]. Int J Food Microbiol, 1991, 12(2):141-149. [18] MONTECCHIA M S, CORREA O S, SORIA M A, et al. Multivariate approach to characterizing soil microbial communities in pristine and agricultural sites in Northwest Argentina[J]. Appl Soil Ecol, 2011, 47(3):176-183. [19] 刘实, 王传宽, 许飞. 4种温带森林非生长季土壤二氧化碳、甲烷及氧化亚氮通量[J].生态学报, 2010, 30(15):4075-4084. LIU Shi, WANG Chuankuan, XU Fei. Soil effluxes of carbon dioxide, methane and nitrous oxide during non-growing season for four temperate forests in northeastern China[J]. Acta Ecol Sin, 2010, 30(15):4075-4084. [20] 周存宇, 周国逸, 王跃思, 等.鼎湖山主要森林生态系统地表N2O通量[J].中国环境科学, 2004, 24(6):688-691. ZHOU Cunyu, ZHOU Guoyi, WANG Yuesi, et al. The N2O flux from soils of main forest ecosystems in Dinghushan[J]. China Environ Sci, 2004, 24(6):688-691. [21] 张炜, 莫江明, 方运霆, 等.氮沉降对森林土壤主要温室气体通量的影响[J].生态学报, 2008, 28(5):2309-2319. ZHANG Wei, MO Jiangming, FANG Yunting, et al. Effects of nitrogen deposition on the greenhouse gas fluxes from forest soil[J]. Acta Ecol Sin, 2008, 28(5):2309-2319. [22] CHEN Huahai, MOTHAPO N V, SHI Wei. The significant contribution of fungi to soil N2O production across diverse ecosystems[J]. Appl Soil Ecol, 2014, 73(1):70-77. [23] KINNEY C A, MOSIER A R, FERRER I, et al. Effects of the fungicides mancozeb and chlorothalonil on fluxes of CO2, N2O, and CH4 in a fertilized Colorado grassland soil[J]. J Geophys Res, 2004, 109(D5):doi:10.1029/20035D003655. [24] HEROLD M B, BAGGS E M, DANIELL T J. Fungal and bacterial denitrification are differently affected by long-term pH amendment and cultivation of arable soil[J]. Soil Biol Biochem, 2012, 54(1):25-35. [25] 傅民杰, 王传宽, 王颖, 等. 4种温带森林土壤氮矿化与硝化时空格局[J].生态学报, 2009, 29(7):3747-3758. FU Minjie, WANG Chuankuan, WANG Ying, et al. Soil nitrous oxide emission in four temperate forests in northeastern China[J]. Acta Ecol Sin, 2009, 29(7):3747-3758. [26] 周国模, 姜培坤.毛竹林的碳密度、碳储量及其空间分布[J].林业科学, 2004, 40(6):5-11. ZHOU Guomo, JIANG Peikun. Density, storage and spatial distribution of carbon in Phyllostachy pubescens forest[J]. Sci Silv Sin, 2004, 40(6):5-11. [27] 李永夫, 姜培坤, 刘娟, 等.施肥对毛竹林土壤水溶性有机碳氮与温室气体排放的影响[J].林业科学, 2010, 46(12):165-170. LI Yongfu, JIANG Peikun, LIU Juan, et al. Effect of fertilization on water-soluble organic C, N, and emission of greenhouse gases in the soil of Phyllostachys edulis stands[J]. Sci Silv Sin, 2010, 46(12):165-170. [28] JIROUT J, SIMEK M, ELHOTTOVÁD. Inputs of nitrogen and organic matter govern the composition of fungal communities in soil disturbed by overwintering cattle[J]. Soil Biol Biochem, 2011, 43(3):647-656. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2014.06.014







 下载:
下载: