-
土壤中的有机碳既是碳汇又是碳源。全球土壤圈碳储量约1 500 Gt,约是大气圈碳储量的2倍,植被碳储量的3倍,每年因土地利用变化所释放的二氧化碳(CO2)约占全球CO2释放量的25%[1-4]。不合理的土地利用方式能够引起土壤碳汇功能减弱[5]。一般而言,湿地由于较低的有机质分解速率和较高的生产力而成为重要的碳汇[6]。有研究[7]表明:在过去近200 a中,湿地开垦后土壤碳素损失约4 Gt。水田是蕴含人类文明的人工湿地生态系统,由于其巨大的碳库储存能力而逐渐受到学者的关注。近年来,随着休闲农业的不断发展,中国南方大面积水田改种花卉和果树,水稻Oryza sativa播种面积逐渐减少。相关年鉴统计表明:2017年全国水稻播种面积为3 074.7万hm2,比1978年减少了367.4万hm2;2019年浙江省水稻播种面积为76.1万hm2,比2012年减少7.3万hm2,比1995年减少137.8万hm2。水田(水耕人为土)改旱作后,土体环境由还原过程占优势向氧化过程为主过渡,土壤有机碳矿化速率明显加快。目前,关于土壤碳储量的研究主要集中在同一种土地利用方式碳循环影响因素、碳排放结构特征和区域差异[8],以及天然湿地转化为农田以后对碳储存的影响等方面[5-7],针对水田改旱作后土壤有机碳储量变化及其空间分布的研究较少。本研究通过测算水田改旱前后土壤有机碳含量的差异,分析其时空分异特征及影响因素,对提高土壤肥力和土壤固碳潜力,科学评价和保护人工湿地生态系统,减少碳排放有重要意义。
-
浙江省(27°02′~31°11′N, 118°01′~123°10′E)处于典型亚热带湿润季风气候区,冬夏季风交替明显,四季分明,气温适中,雨水丰沛,日照充足,平均气温为15.0~18.1 ℃,≥10℃积温为5 200~5 700 ℃,年日照总时数为1 100~2 200 h,历年平均降水量为1 060~2 000 mm,相对湿度为75%~80%。近年来,随着生产生活方式的转变,浙江省很多农业用地被用来发展休闲农业。
-
依据中国土壤系统分类检索(第3版),水耕人为土(水稻土)可分为潜育、铁渗、铁聚和简育水耕人为土等四大类[9]。在浙江省范围内,构建4个水耕人为土改旱序列剖面,每个序列包含1个长期种植水稻的土壤剖面和2个水改旱不同年限(最长为15~20 a)的土壤剖面,共计12个采自独立田块的代表性土壤剖面。土壤剖面样地信息详见表1,所有样地海拔为2.7~5.2 m,成土母质为湖沼、湖海或河海相淤积物。
表 1 土壤样品基本信息
Table 1. Basic information of soil samples
序列类型 采样地点 剖面号 旱作年限/a 纬度(N) 经度(E) 利用方式 经济作物 潜育 嘉兴市南湖区大桥镇江南村 QYP1 0 30°44′50″ 120°51′47″ 水田 水稻 QYP2 7 30°44′52″ 120°52′09″ 果园 葡萄 QYP3 15 30°45′01″ 120°51′56″ 铁渗 绍兴市柯桥区福全镇赵家畈村 TSP1 0 29°58′27″ 120°30′02″ 水田 水稻 TSP2 12 29°58′28″ 120°30′01″ 林地 樟树 TSP3 19 29°58′27″ 120°30′00″ 铁聚 杭州市余杭区瓶窑镇窑北村 TJP1 0 30°24′27″ 119°56′24″ 水田 水稻 TJP2 8 30°24′26″ 119°56′23″ 果园 桃 TJP3 20 30°24′24″ 119°56′18″ 简育 杭州市萧山区新塘街道霞江村 JYP1 0 30°08′43″ 120°19′26″ 水田 水稻 JYP2 8 30°08′42″ 120°19′22″ 林地 樟树 JYP3 15 30°08′30″ 120°19′26″ 说明:葡萄Vitis vinifera,樟树Cinnamomum camphora,桃Amygdalus persica 根据土壤剖面发育状况,确定发生层及其深度,分层采集土壤样品。田间采集的分层土样带回实验室采用常规方法风干处理,依次过2.00和0.15 mm土筛,用于土壤有机质测定,同时用烘干法测定含水率,矫正分析结果。
-
土壤含水率测定采用烘干法;土壤pH测定采用电位法;土壤有机碳(SOC)质量分数测定采用重铬酸钾-硫酸外加热法;土壤容重测定采用环刀法[10]。
-
依据《中国土壤系统分类检索》[9]和单正军等[11]估算温室气体排放的方法,按照SOC剖面分布特征,分层计算SOC损失量,公式为C0=HBC。C0为SOC密度(kg·m−2),H为土层厚度(m),B为土壤容重(kg·cm−3),C为SOC质量分数(kg·kg−1);其中C=0.58CM,CM为测定出的土壤有机质,0.58为转换系数。将计算出的各土层SOC叠加,计算水耕人为土改旱(水改旱)作前后1 m土体中SOC总量,计算旱作前后土体中SOC总量的差值,测算SOC的损失量;通过计算损失量与旱作时间的比值,测算SOC年损失率。采用Excel 2003处理数据,Origin 8.0制图。
-
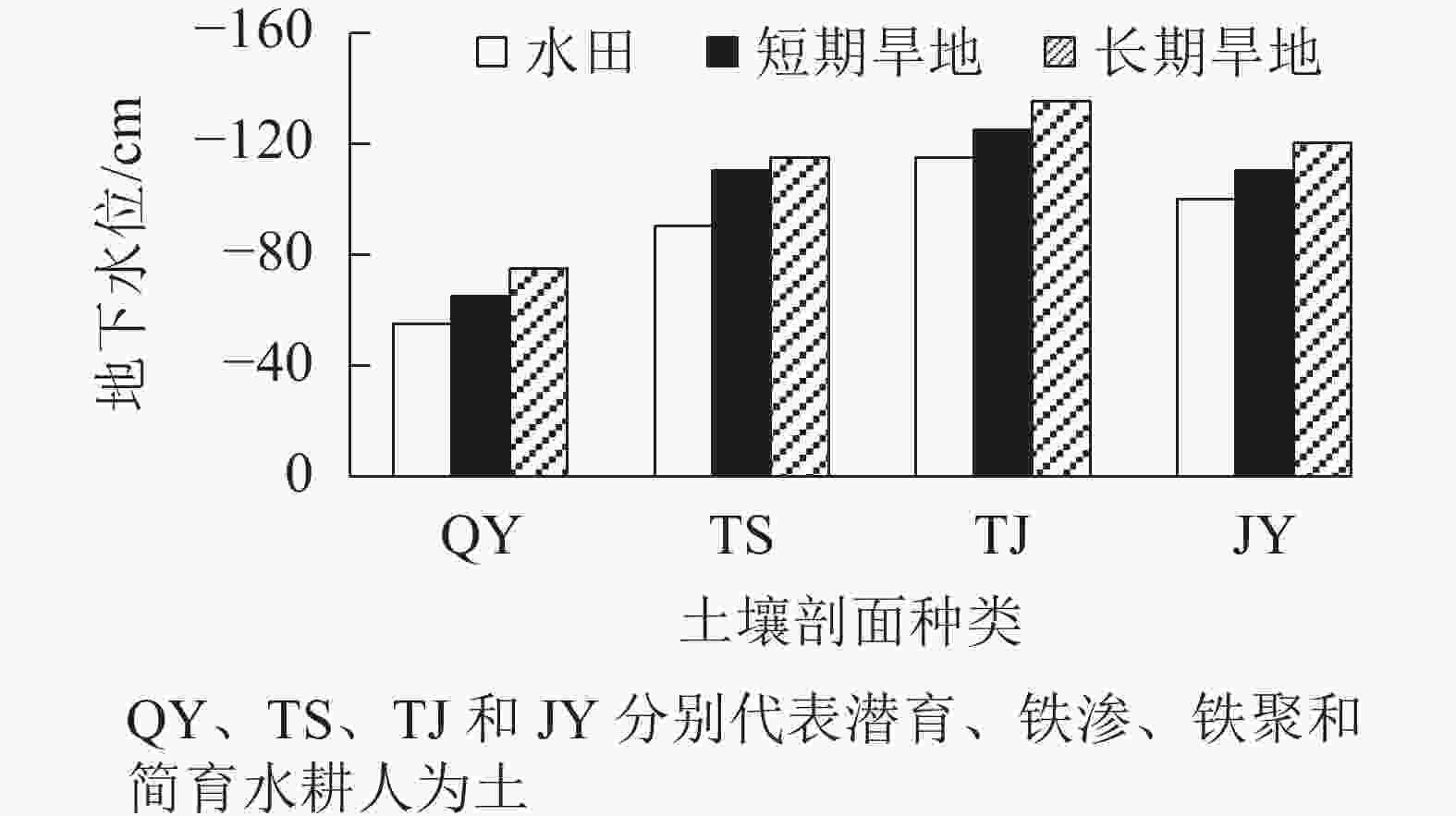
湿地CO2释放量与地下水位呈负相关[12-13]。从图1可见:4类水耕人为土改旱作后地下水位均呈现不同程度下降,其中以潜育和铁渗水耕人为土改旱后地下水位下降最为明显。改旱后,土壤田间含水率明显下降,短期旱地表层土壤田间含水率降幅为28.88%~51.42%,长期旱地表层土壤田间含水率降幅为31.41%~56.65% (表2)。
表 2 土壤剖面样品基本性质
Table 2. Basic properties of soil profile samples
剖面号 发生层深度/cm 田间含水率/% 容重/(g·cm−3) pH 剖面号 发生层深度/cm 田间含水率/% 容重/(g·cm−3) pH QYP1 0~14 47.12 1.08 6.36 TSP1 0~12 59.20 0.95 5.57 14~30 37.03 1.34 7.13 12~25 56.89 1.07 5.78 30~100 38.61 1.39 7.74 25~47 29.78 1.50 7.37 47~88 31.36 1.42 7.40 88~100 32.24 1.37 6.05 QYP2 0~14 33.51 1.30 6.08 TSP2 0~12 38.87 1.18 5.09 14~30 31.78 1.35 7.10 12~25 43.91 1.20 6.32 30~100 31.43 1.43 7.59 25~47 25.13 1.53 7.50 47~88 28.65 1.41 7.39 88~100 32.20 1.37 6.30 QYP3 0~14 32.32 1.32 5.67 TSP3 0~12 34.78 1.27 4.55 14~30 34.39 1.40 6.33 12~25 35.47 1.29 6.32 30~100 35.23 1.45 7.50 25~47 25.91 1.55 7.34 47~88 32.77 1.40 7.47 88~100 32.04 1.37 6.11 TJP1 0~17 46.57 0.99 5.82 JYP1 0~12 54.40 0.96 6.51 17~30 29.92 1.53 5.71 12~22 27.23 1.26 6.54 30~65 25.80 1.60 6.71 22~67 19.03 1.55 7.97 65~85 29.76 1.58 7.00 67~100 21.20 1.48 8.30 85~100 32.07 1.60 6.97 TJP2 0~17 28.48 1.25 5.63 JYP2 0~12 26.43 1.18 6.08 17~30 29.25 1.58 5.45 12~22 23.44 1.36 6.42 30~65 27.86 1.61 6.66 22~67 21.82 1.58 7.89 65~85 28.67 1.64 6.79 67~100 20.53 1.49 8.26 85~100 29.19 1.61 6.76 TJP3 0~17 26.90 1.28 5.12 JYP3 0~12 23.58 1.29 4.72 17~30 28.36 1.63 5.05 12~22 22.01 1.42 5.75 30~65 21.32 1.64 5.85 22~67 19.09 1.60 7.88 65~85 28.67 1.66 6.34 67~100 23.58 1.48 8.20 85~100 29.19 1.62 6.88 说明:QY、TS、TJ和JY分别代表潜育、铁渗、铁聚和简育水耕人为土。P1为水田土壤,P2为短期旱作土壤,P3为长期旱作土壤 -
容重大小不仅能反映土壤结构状况和有机质质量分数的高低,还是衡量湿地土壤持水性能和蓄水性能的重要指标之一[14]。改旱作后,各序列表层和亚表层土壤容重随旱作时间延长呈现增加趋势,其中表层土壤容重增加最为明显(表2);这与改旱后土壤翻耕减少,土壤有机质质量分数降低以及进入土壤的植物根系等残体明显减少有关。改旱后,各序列剖面土壤淀积层和底土层(相当于潜育层或母质层)土壤容重变化不明显(表2)。
改旱后,4个改旱序列部分发生层土壤pH明显下降(表2),可能原因是改旱后土壤中施用大量酸性肥料促进了土壤的酸化(表3);其次,土壤中铵态氮在硝化细菌的作用下转化为硝态氮,以及土壤中锰离子(Mn2+)、铁离子(Fe2+)等离子被氧化,都释放出大量的质子(H+),加速了土壤酸化。
表 3 水田及改旱土壤施肥量的差异
Table 3. Differences of fertilization between paddy and upland soils
土壤类型 利用方式 施肥量/(kg·hm−2) 尿素 过磷酸钙 氯化钾 复合肥 鸡粪 蓖麻饼 生石灰 QY 水田 180~300 375~525 150~225 150~300 − − − 果园 525~675 1050~1 200 450~675 1050~1 350 30 000~45 000 6 000~10 500 450~600 TS 水田 180~300 375~525 150~225 150~300 − − − 林地 150~300 525~675 150~225 675~825 12 000~18 000 − − TJ 水田 180~300 375~525 150~225 150~300 − − − 果园 270~375 900~1 050 375~525 900~1 200 19 500~27 000 − − JY 水田 300~525 600~825 300~375 300~525 − − − 林地 375~525 750~900 375~525 900~1 200 27 000~37 500 − − 说明:−表示无施肥。QY、TS、TJ和JY分别代表潜育、铁渗、铁聚和简育水耕人为土 -
随着旱作时间延长,4个改旱序列SOC质量分数都呈现整体降低趋势,并以表层和亚表层SOC降低最为明显(图2)。短期(7~12 a)改旱后,4类水耕人为土表层SOC下降幅度为22.44%~33.03%,亚表层SOC下降幅度为17.26%~27.61%。长期(15~20 a)改旱后,4类水耕人为土表层SOC分别下降34.13%、42.08%、42.08%和36.96%,亚表层SOC分别下降30.58%、57.06%、42.07%和29.25%。从空间分布看,各土壤剖面表层和亚表层SOC质量分数均高于其他发生层;同一剖面中,随着深度增加,SOC质量分数逐渐降低。

图 2 水田和改旱土壤剖面有机碳分布
Figure 2. Distribution of organic carbon in the profiles of paddy and upland soils
水田改旱作后剖面各发生层中SOC质量分数降低的主要原因是:改旱作后人为滞水水分状况消失,土壤通气性增强,微生物对有机质的分解速率加快;同时,改旱后土壤充分暴露在空气中,加速有机碳化学氧化;此外,改旱后植物根系、枝干等植物残体进入土壤的数量减少,使SOC总量下降。改旱后,表下层SOC质量分数略微降低,主要与改旱后随黏粒淋溶并淀积到上述发生层的有机碳减少有关。
-
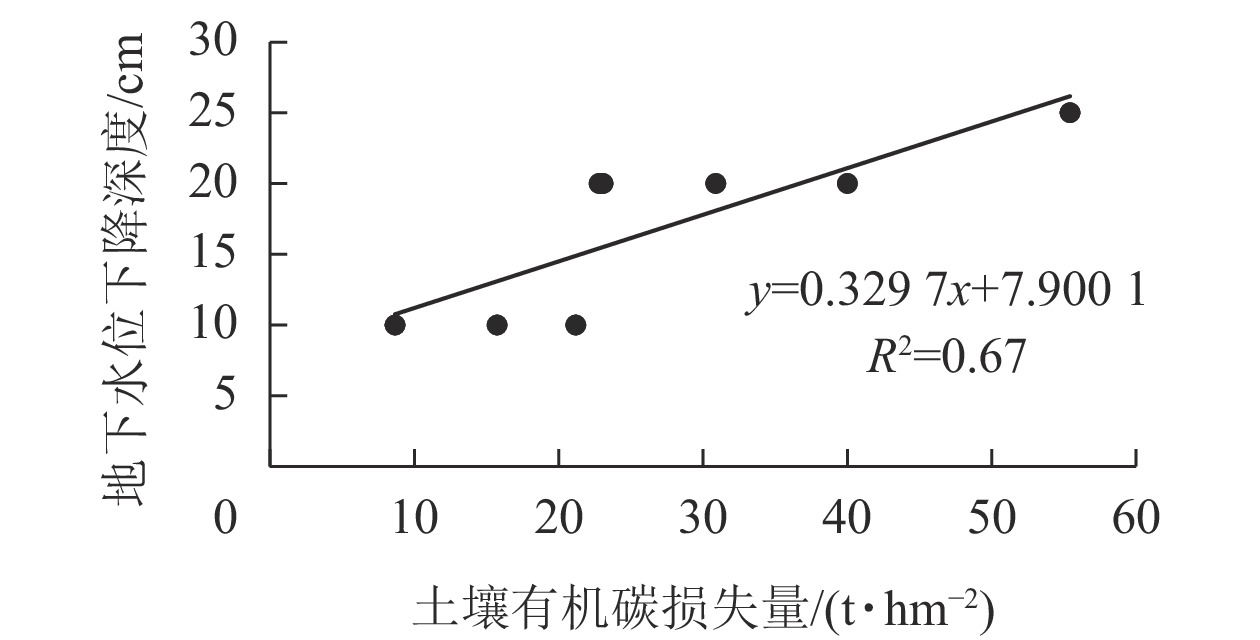
由表4可知:改旱作15~20 a后,潜育、铁渗、铁聚和简育改旱序列,1 m深度土体内SOC分别损失13.90%、34.92%、18.93%和23.89%,年损失率分别为2.06、2.92、1.14和1.54 t·hm−2·a−1。本研究结果与水田改玉米地后表层土壤(0~15 cm)有机碳损失率(1.9 t·hm−2·a−1)的结论基本一致[15]。研究表明:水耕人为土改旱作后SOC减少与地下水位下降有关,供试SOC损失量与地下水下降深度呈极显著正相关(P<0.01),相关系数达0.82 (图3)。
表 4 土壤剖面有机碳密度及其年损失率
Table 4. Content and loss rate of soil organic carbon of profile samples
土壤类型 水田土壤有机
碳密度/(t·hm−2)短期旱地 长期旱地 有机碳密度/
(t·hm−2)损失量/
(t·hm−2)年损失率/
(t·hm−2·a−1)有机碳密度/
(t·hm−2)损失量/
(t·hm−2)年损失率/
(t·hm−2·a−1)QY 222.17 200.97 21.20 3.03 191.29 30.88 2.06 TS 158.75 118.75 40.00 3.33 103.32 55.43 2.92 TJ 120.46 111.80 8.66 1.08 97.66 22.80 1.14 JY 96.57 80.83 15.74 1.97 73.50 23.07 1.54 说明:QY、TS、TJ和JY分别代表潜育、铁渗、铁聚和简育水耕人为土 -
水耕人为土(水稻土)可分为潜育、铁渗、铁聚和简育等 4 类,浙江省内4种水耕人为土均有分布,以铁聚和简育水耕人为土分布最为广泛。潜育水耕人为土多分布在低洼区,一般地下水位较高,表层土壤容易受到地下水的影响;铁渗水耕人为土由于强烈还原淋溶和氧化淀积作用,有明显的铁淋失的亚层;铁聚水耕人为土具有明显氧化还原淋溶和氧化铁淀积作用,在水耕氧化还原层的上部具有明显的铁积累亚层;简育水耕人为土是氧化还原作用引起的铁锰淋溶淀积作用较弱的一类水耕人为土。本研究发现:潜育、铁渗和简育改旱系列,旱作前期土壤有机碳损失率高于后期,这主要与改旱后人为滞水水分状况消失,土壤田间水分含量在旱作前期较后期下降更加明显等因素有关。由于潜育水耕人为土改旱系列土壤有机碳含量的绝对值较大,铁聚水耕人为土系列地下水位相对较低,改旱后潜育和铁聚水耕人为土土壤有机碳的年损失率相对较高。水耕人为土改旱序列土壤有机碳损失量与地下水位下降深度呈极显著正相关(P<0.01),相关性系数达0.82。
1995—2012年浙江省水田面积减少100.6万hm2,2019年比2012年水稻播种面积减少7.3万hm2,水田面积下降趋势减缓。本研究发现:1 m深度土体内4个系列土壤有机碳年损失率为1.14~2.92 t ·hm−2·a−1;由此推算:同1995年相比,2019年浙江省不同类型水耕人为土改旱作导致1 m深土壤有机碳储量减少了122.96万~314.95万t,平均减少218.96万t。与NISHIMURA等[16]发现的水改旱导致土壤碳素损失的结论是一致的。水耕人为土改旱作后,土壤碳汇功能减弱,温室气体排放增加,对区域碳平衡产生重要影响;有效控制水耕人为土改为旱地的土地面积,是减少第一产业碳排放的重要方法。
-
休闲农业旅游背景下,水田改旱作后,进入土壤的植物残体减少,土壤植物碳输入减少;土壤水分含量降低,碳矿化损失增加,是导致土壤有机碳大幅下降的主要原因。水改旱后,地下水位下降导致土壤有机碳损失速率加快;改旱作后人为滞水水分状况的消失,以及较低的地下水位,不利于土壤有机碳储存。保持和提高现有水田面积,有利于土壤有机碳储存和减少农田温室气体排放。随着近年来浙江省水田改旱地面积的有效控制,水改旱引起的温室气体排放问题,有望得到缓和。
Spatiotemporal differentiation of organic carbon in upland soils converted from paddy field under the leisure agriculture tourism background in Zhejiang Province
-
摘要:
目的 研究休闲农业旅游背景下,浙江省由水田改种花卉、果树和苗圃的土壤有机碳(SOC)的时空分异,掌握利用方式改变后农田土壤固碳情况。 方法 选择浙江省水田及其改旱作后的土壤为研究对象,采用野外调查和室内分析方法,以“空间换时间”研究水田改旱作后1 m深土体内SOC密度和储量的时空变化,对比不同类型水田土壤改旱作后SOC变化的差异,估测浙江省水改旱土壤SOC储量变化。 结果 水田改旱作15~20 a后,潜育、铁渗、铁聚和简育等4类改旱系列土壤1 m深土体内,SOC分别下降了13.9%、34.9%、18.9%和23.9%,SOC密度损失量分别为2.06、2.92、1.14和1.54 t·hm−2·a−1。改旱后,SOC下降速率与地下水位下降深度呈极显著正相关(P<0.01)。 结论 水田是有利于SOC储存的土地利用方式,水田改旱作会降低SOC储存量,影响区域碳平衡。图3表4参16 Abstract:Objective This paper, with an exploration of the spatiotemporal differentiation of soil organic carbon (SOC) in such upland as nurseries of flowers and trees as well as orchards, which have been converted from paddy field in Zhejiang Province under the background of leisure agriculture tourism, is aimed to better understand the carbon sequestration in soils after the land-use conversions. Method With soil samples selected from paddy field and the converted upland as the research objects, combined methods of field investigation and laboratory analysis were employed, on the basis of “trading space for time”, to investigate the spatiotemporal changes in the density and storage of SOC in 1 meter depth soil before a comparison was conducted of the differences of SOC among different types of upland converted from paddy fields and an estimation was made of the storage changes of SOC after the land-use conversions in Zhejiang Province. Result Soil organic carbon on four types of stagnic anthrosols (hap-stagnic, Fe-leachi-stagn, iFe-accumuli-stagnic and hapli-stagnic anthrosols) in 1 meter depth upland soils decreased by 13.9%, 34.9%, 18.9% and 23.9% respectively after 15 to 20 years with the loss of SOC density being 2.06, 2.92, 1.14 and 1.54 t·hm−2·a−1, respectively. There was a significant positive correlation (P<0.01) between the decline rate of SOC and the decline depth of groundwater level in the upland soils. Conclusion Paddy field is a better choice for the storage of SOC whereas the conversion from paddy field to upland decreases the storage of SOC and affects regional carbon balance. [Ch, 3 fig. 4 tab. 16 ref.] -
Key words:
- leisure agriculture /
- paddy field /
- land use /
- soil organic carbon density /
- carbon sink /
- carbon source
-
表 1 土壤样品基本信息
Table 1. Basic information of soil samples
序列类型 采样地点 剖面号 旱作年限/a 纬度(N) 经度(E) 利用方式 经济作物 潜育 嘉兴市南湖区大桥镇江南村 QYP1 0 30°44′50″ 120°51′47″ 水田 水稻 QYP2 7 30°44′52″ 120°52′09″ 果园 葡萄 QYP3 15 30°45′01″ 120°51′56″ 铁渗 绍兴市柯桥区福全镇赵家畈村 TSP1 0 29°58′27″ 120°30′02″ 水田 水稻 TSP2 12 29°58′28″ 120°30′01″ 林地 樟树 TSP3 19 29°58′27″ 120°30′00″ 铁聚 杭州市余杭区瓶窑镇窑北村 TJP1 0 30°24′27″ 119°56′24″ 水田 水稻 TJP2 8 30°24′26″ 119°56′23″ 果园 桃 TJP3 20 30°24′24″ 119°56′18″ 简育 杭州市萧山区新塘街道霞江村 JYP1 0 30°08′43″ 120°19′26″ 水田 水稻 JYP2 8 30°08′42″ 120°19′22″ 林地 樟树 JYP3 15 30°08′30″ 120°19′26″ 说明:葡萄Vitis vinifera,樟树Cinnamomum camphora,桃Amygdalus persica 表 2 土壤剖面样品基本性质
Table 2. Basic properties of soil profile samples
剖面号 发生层深度/cm 田间含水率/% 容重/(g·cm−3) pH 剖面号 发生层深度/cm 田间含水率/% 容重/(g·cm−3) pH QYP1 0~14 47.12 1.08 6.36 TSP1 0~12 59.20 0.95 5.57 14~30 37.03 1.34 7.13 12~25 56.89 1.07 5.78 30~100 38.61 1.39 7.74 25~47 29.78 1.50 7.37 47~88 31.36 1.42 7.40 88~100 32.24 1.37 6.05 QYP2 0~14 33.51 1.30 6.08 TSP2 0~12 38.87 1.18 5.09 14~30 31.78 1.35 7.10 12~25 43.91 1.20 6.32 30~100 31.43 1.43 7.59 25~47 25.13 1.53 7.50 47~88 28.65 1.41 7.39 88~100 32.20 1.37 6.30 QYP3 0~14 32.32 1.32 5.67 TSP3 0~12 34.78 1.27 4.55 14~30 34.39 1.40 6.33 12~25 35.47 1.29 6.32 30~100 35.23 1.45 7.50 25~47 25.91 1.55 7.34 47~88 32.77 1.40 7.47 88~100 32.04 1.37 6.11 TJP1 0~17 46.57 0.99 5.82 JYP1 0~12 54.40 0.96 6.51 17~30 29.92 1.53 5.71 12~22 27.23 1.26 6.54 30~65 25.80 1.60 6.71 22~67 19.03 1.55 7.97 65~85 29.76 1.58 7.00 67~100 21.20 1.48 8.30 85~100 32.07 1.60 6.97 TJP2 0~17 28.48 1.25 5.63 JYP2 0~12 26.43 1.18 6.08 17~30 29.25 1.58 5.45 12~22 23.44 1.36 6.42 30~65 27.86 1.61 6.66 22~67 21.82 1.58 7.89 65~85 28.67 1.64 6.79 67~100 20.53 1.49 8.26 85~100 29.19 1.61 6.76 TJP3 0~17 26.90 1.28 5.12 JYP3 0~12 23.58 1.29 4.72 17~30 28.36 1.63 5.05 12~22 22.01 1.42 5.75 30~65 21.32 1.64 5.85 22~67 19.09 1.60 7.88 65~85 28.67 1.66 6.34 67~100 23.58 1.48 8.20 85~100 29.19 1.62 6.88 说明:QY、TS、TJ和JY分别代表潜育、铁渗、铁聚和简育水耕人为土。P1为水田土壤,P2为短期旱作土壤,P3为长期旱作土壤 表 3 水田及改旱土壤施肥量的差异
Table 3. Differences of fertilization between paddy and upland soils
土壤类型 利用方式 施肥量/(kg·hm−2) 尿素 过磷酸钙 氯化钾 复合肥 鸡粪 蓖麻饼 生石灰 QY 水田 180~300 375~525 150~225 150~300 − − − 果园 525~675 1050~1 200 450~675 1050~1 350 30 000~45 000 6 000~10 500 450~600 TS 水田 180~300 375~525 150~225 150~300 − − − 林地 150~300 525~675 150~225 675~825 12 000~18 000 − − TJ 水田 180~300 375~525 150~225 150~300 − − − 果园 270~375 900~1 050 375~525 900~1 200 19 500~27 000 − − JY 水田 300~525 600~825 300~375 300~525 − − − 林地 375~525 750~900 375~525 900~1 200 27 000~37 500 − − 说明:−表示无施肥。QY、TS、TJ和JY分别代表潜育、铁渗、铁聚和简育水耕人为土 表 4 土壤剖面有机碳密度及其年损失率
Table 4. Content and loss rate of soil organic carbon of profile samples
土壤类型 水田土壤有机
碳密度/(t·hm−2)短期旱地 长期旱地 有机碳密度/
(t·hm−2)损失量/
(t·hm−2)年损失率/
(t·hm−2·a−1)有机碳密度/
(t·hm−2)损失量/
(t·hm−2)年损失率/
(t·hm−2·a−1)QY 222.17 200.97 21.20 3.03 191.29 30.88 2.06 TS 158.75 118.75 40.00 3.33 103.32 55.43 2.92 TJ 120.46 111.80 8.66 1.08 97.66 22.80 1.14 JY 96.57 80.83 15.74 1.97 73.50 23.07 1.54 说明:QY、TS、TJ和JY分别代表潜育、铁渗、铁聚和简育水耕人为土 -
[1] 潘根兴, 李恋卿, 张旭辉, 等. 中国土壤有机碳库量与农业土壤碳固定动态的若干问题[J]. 地球科学进展, 2003, 18(4): 609 − 618. PAN Genxing, LI Lianqing, ZHANG Xuhui, et al. Soil organic carbon storage of China and the sequestration dynamics in agricultural lands [J]. Adv Earth Sci, 2003, 18(4): 609 − 618. [2] 张国盛, 黄高宝, YIN Chan. 农田土壤有机碳固定潜力研究进展[J]. 生态学报, 2005, 25(2): 351 − 357. ZHANG Guosheng, HUANG Gaobao, YIN Chan. Soil organic carbon sequestration potential in cropland [J]. Acta Ecol Sin, 2005, 25(2): 351 − 357. [3] 毛艳玲, 杨玉盛, 邹双全, 等. 土地利用变化对亚热带山地红壤团聚体有机碳的影响[J]. 山地学报, 2007, 25(6): 706 − 713. MAO Yanling, YANG Yusheng, ZOU Shuangquan, et al. Effects of land use on soil organic carbon in aggregates of hilly red soil in subtropical China [J]. J Mt Sci, 2007, 25(6): 706 − 713. [4] 邓万刚, 吴蔚东, 陈明智, 等. 土地利用方式及母质对土壤有机碳的影响[J]. 生态环境, 2008, 17(3): 1130 − 1134. DENG Wangang, WU Weidong, CHEN Mingzhi, et al. Effects of land use change and soil parent material on soil organic carbon [J]. Ecol Environ, 2008, 17(3): 1130 − 1134. [5] 张婷, 蔡海生, 王晓明. 土地利用变化的碳排放机理及效应研究综述[J]. 江西师范大学学报(自然科学版), 2013, 37(1): 93 − 100. ZHANG Ting, CAI Haisheng, WANG Xiaoming. Summarization of the effects of land use changes on carbon emission [J]. J Jiangxi Norm Univ Nat Sci Ed, 2013, 37(1): 93 − 100. [6] GORHAM E. Northern peatlands: role in the carbon cycle and prob-able responses to climatic warming [J]. Ecol Appl, 1991, 1(2): 182 − 195. [7] BRIX H, SORRELL B K, LORENZEN B. Are Phragmites-dominated wetlands a net source or net sink of greenhouse gases? [J]. Aquatic Bot, 2001, 69(2/4): 313 − 324. [8] 赵明松, 李德成, 张甘霖, 等. 1980—2010年安徽省土壤有机碳密度及储量时空变化分析[J]. 地理研究, 2018, 37(11): 84 − 95. ZHAO Mingsong, LI Decheng, ZHANG Ganlin, et al. Spatial-temporal change of soil organic carbon density and storage in Anhui Province from 1980 to 2010 [J]. Geogr Res, 2018, 37(11): 84 − 95. [9] 中国科学院南京土壤研究所土壤分类课题组, 中国土壤系统分类课题研究协作组. 中国土壤系统分类检索[M]. 3版. 合肥: 中国科学技术大学出版社, 2001: 22 − 191. Soil Classification Research Group of Nanjing Institute of Soil Research, Chinese Academy of Sciences, China Research Collaborative Group on Soil System Classification. Soil System Classification Search in China [M]. 3rd ed. Hefei: Chinese Science and Technology University Press, 2001: 22 − 191. [10] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Rukun. Analysis Methods of Soil Agricultural Chemistry [M]. Beijing: China Agricultural Science Press, 2000. [11] 单正军, 蔡道基, 任阵海. 土壤有机质矿化与温室气体释放初探[J]. 环境科学学报, 1996, 16(2): 150 − 154. SHAN ZhengJun, CAI Daoji, REN Zhenhai. A preliminary assessment of CO2, CH4 and N2O emission from soils in China [J]. Acta Sci Circumst, 1996, 16(2): 150 − 154. [12] OECHEL W C, VOURLITIS G L, HASTINGS S J, et al. The effect of water table manipulation and elevated temperature on the net CO2 flux of wet sedge tundra ecosystem [J]. Glob Change Biol, 1998, 4(1): 77 − 90. [13] ALM J, SCHULMAN L, WALDEN J, et al. Carbon balance of a Boreal Bog during a year with an exceptionally dry summer [J]. Ecology, 1999, 80(1): 161 − 174. [14] 张文菊, 彭佩钦, 童成立, 等. 洞庭湖湿地有机碳垂直分布与组成特征[J]. 环境科学, 2005, 26(3): 56 − 60. ZHANG Wenju, PENG Peiqin, TONG Chengli, et al. Characteristics of distribution and composition of organic carbon in Dongting Lake Floodplain [J]. Environ Sci, 2005, 26(3): 56 − 60. [15] 李志鹏, 潘根兴, 张旭辉. 改种玉米连续3年后稻田土壤有机碳分布和13C自然丰度变化[J]. 土壤学报, 2007, 44(2): 244 − 251. LI Zhipeng, PAN Genxing, ZHANG Xuhui. Topsoil organic carbon pool and 13C natural abundance changes from a paddy after 3 years corn cultivation [J]. Acta Pedol Sin, 2007, 44(2): 244 − 251. [16] NISHIMURA S, YONEMURA S, SAWAMOTO T, et al. Effect of land use change from paddy rice cultivation to upland crop cultivation on soil carbon budget of a cropland in Japan [J]. Agric Ecosyst Environ, 2008, 125(1/4): 9 − 20. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20210607






 下载:
下载: