-
香榧绿藻Chlorella sp.是一种附着在榧树Torreya grandis枝、叶表面的粗糙灰绿色苔状物[1]。近些年,随着香榧T. grandis ‘Merrillii’种植面积的不断扩大,香榧病害发生率也在逐年攀升。现阶段香榧绿藻病害主要依赖石硫合剂等除藻剂进行防治,效果较明显,但存在抗药性以及会对环境造成二次污染等问题[2]。为保证榧农收益并贯彻可持续发展的理念,研发设计一种新型绿色灭藻剂具有重要意义。
近几年利用植物源物质对藻类进行抑制的研究不断开展,并且植物源物质作为抑藻剂具有见效快、易控制、生态安全性高等特点[3]。大蒜油作为一种提取自大蒜Allium sativum的天然产物,主要成分是二烯丙基硫化物(DAS)、二烯丙基二硫化物(DADS)和二烯丙基三硫化物(DATS)[4−5]。已有研究证明:大蒜油具有生物活性作用,已被应用于医学、食品、抑菌等各个领域[6−8]。有研究表明:以β-环糊精包封大蒜油纳米颗粒,能够通过控制释放来延长大蒜油的活性,但这需要很高的包封率(75%~90%)[9−10]。SALEHI等[11]研究发现:银纳米粒子和大蒜油的联合作用可有效治疗耐药性微生物菌株引起的皮肤感染。STREHLOW等[12]将大蒜油封装于乳糖形成的微球中,开发出一种用于治疗肺部疾病的微粒制剂。由此可见,科研人员通过改性包封大蒜油来改善其挥发性强、气味强烈、不溶于水等物理化学特性,但改性过程都较复杂,包封率较低[13]。因此急需一种新型的方法,在保存大蒜油的同时扩大其适用性,保证其杀菌效果的同时又弥补其易挥发等不足。微乳液恰好能够兼顾两者。微乳液是指由水、油、表面活性剂以及少量助表面活性剂自发形成的透明或半透明并带有淡蓝色光泽的热力学稳定体系,粒径为10~100 nm,具有良好的稳定性、两亲性等特点[14−15]。微乳技术解决了微胶囊化技术包埋率低的问题[16]。有研究表明:表面包埋技术能降低油品的氧化速率[17−19]。将大蒜油制备成微乳液不仅能克服诸多加工技术限制,而且在一定程度上掩盖了大蒜油的刺激性气味。另外,100 nm以下的大蒜油微乳液更有利于进一步对其进行封装和加工[20]。随着微乳液在药物制备、采油、微生物反应器、纳米颗粒合成等方面的广泛应用,大蒜油制备成微乳液将具有广阔的市场价值,这对大蒜油的推广应用具有重要意义[21−23]。
基于以上分析,本研究分析了表面活性剂和助表面活性剂与大蒜油之间的质量配比对水包油微乳液形成条件的影响以及粒径分布特征,测试了最佳条件制备的大蒜油微乳液的离心、温度、pH稳定性以及抑藻效果。
-
材料与试剂:大蒜油(江苏正大清江制药有限公司),槐糖脂(化学纯,陕西亿康龙生物技术有限公司),吐温80 (Tween 80,化学纯),司盘80 (Span 80,化学纯),丁二酸二辛酯磺酸钠(多库脂钠,化学纯),无水乙醇(分析纯),正丁醇(分析纯),苏丹Ⅲ(分析纯),亚甲基蓝(分析纯)均购自上海麦克林生化科技有限公司。香榧绿藻来自浙江农林大学林业与生物技术学院。
仪器与设备:MS104TS 型电子分析天平(梅特勒-托利多国际股份有限公司);DF-101S 型集热式磁力搅拌器(上海聚昆仪器设备有限公司);紫外分光光度计(北京普析通用仪器有限责任公司);高速冷冻离心机(赛默飞世尔科技公司);DT-300型zeta粒度分析仪(康塔仪器公司)。
-
运用相转变法制备大蒜油微乳液。按照预定比例称取一定量的表面活性剂、助表面活性剂和大蒜油混合均匀,使混合表面活性剂与大蒜油质量比为9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9。在磁力搅拌器的持续搅拌下,向其中缓慢滴加水相,当体系由浑浊变为澄清时,停止滴水,记录此时各相质量百分比,以油相、水相、表面活性剂(含助表面活性剂)混合物相作为顶点,标出各临界点并连线即得大蒜油微乳区。
-
根据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》[24],分别以槐糖脂、Tween 80、Span 80、丁二酸二辛酯磺酸钠作为表面活性剂,无水乙醇作为助表面活性剂,固定表面活性剂与助表面活性剂的质量比为1∶1。按照1.2.1的方法制备大蒜油微乳液,并对微乳液状态进行细致描述[25]。结果见表1。
表 1 不同表面活性剂对微乳液形成的影响
Table 1. Effects of different surfactants on the formation of microemulsion
表面活性剂种类 不同表面活性剂与大蒜油质量比对微乳液的影响 9∶1 8∶2 7∶3 6∶4 5∶5 4∶6 3∶7 2∶8 1∶9 槐糖脂 − =− − =− − =− − =− − =+ − =+ − =+ − =+ − Tween 80 − − − =− − =− − =− − =− − × × Span 80 =− − =+ − =++ − =× − =× − =× ++ =+ − =× + =× ++ 多库脂钠 − − + + =++ − =++ − =++ ++ + + + + 说明:澄清透明(−);较透明(+);浑浊(+ +);静置分层(=);白色浊液(×);分层,上下层均透明(=− −);分层,上层较透明,下层透明(=+ −);分层,上层浑浊,下层透明(=++ − );分层,上层白色浊液,下层透明(=× −);分层,上层白色浊液,下层较透明(=× +);分层,上层白色浊液,下层浑浊(=× ++)。 -
分别以丙三醇、无水乙醇、正丁醇、无水乙醇与正丁醇按质量比1∶1混合为助表面活性剂,将表面活性剂与助表面活性剂按质量比1∶1混合。按照1.2.1的方法配制大蒜油微乳液,并根据微乳区域面积选择最适助表面活性剂。
-
以Tween 80、正丁醇为助表面活性剂,比较5、25、45 ℃条件下大蒜油微乳液面积,确定最佳实验温度。
-
在单因素实验的基础上,采用L9(33)混合正交实验,选取混合表面活性剂与大蒜油质量比A(λ)、助表面活性剂与表面活性剂质量比B(Km)、制备温度C(T)为因素,大蒜油粒径为考察对象进行3因素3水平正交实验。正交实验因素水平如表2所示。
表 2 正交实验因素表
Table 2. Orthogonal experiment factor table
水平 A(λ) B(Km) C(T)/℃ 1 4∶6 1∶2 5 2 5∶5 1∶1 25 3 6∶4 2∶1 45 -
分别向已制备好的等体积大蒜油微乳液中滴入苏丹Ⅲ和亚甲基蓝溶液。亚甲基蓝为水溶性染料,苏丹Ⅲ为油溶性染料。若亚甲基蓝在微乳液中扩撒速率快,且易分散,则为水包油型(O/W)型微乳液;若苏丹Ⅲ扩散速率快,且易分散,则为油包水型(W/O型)微乳液。
-
将大蒜油微乳液在不同的转速(5000和10000 r·min−1)离心15 min,观察微乳液状态,在220 nm下测定其吸光度,并与未离心的微乳液(对照)的吸光度进行比较,按公式(1)计算透光率[26]。
$$ T = \frac{{{A_0}}}{{{A_1}}} \times 100\%。 $$ (1) 式(1)中:T为透光率(%),A0为离心前微乳液吸光度,A1为离心后微乳液吸光度。将微乳液在不同温度条件下(−20、4、25、37、80 ℃)储存6 h,恢复室温后,在220 nm 下测定其吸光度,并与室温下微乳液的吸光度进行比较,按公式(1)计算透光率。将大蒜油微乳液加入到不同pH (1、5、9、13)溶液中,测定其在220 nm 波长下的吸光度,并与室温下微乳液吸光度作比较,按公式(1)计算透光率。
-
用20 mL二甲基亚砜配制8 g·L−1大蒜油微乳液母液,向藻液中滴入0.5、4.0 mL大蒜油微乳液母液,使溶液最终体积为100 mL,大蒜油微乳液最终质量浓度为40、320 mg·L−1,实验组3个平行,对照组滴入等量二甲基亚砜,在第4、8、12 天观察藻液颜色变化,并运用血小板计数法,记录藻细胞密度变化。抑藻率计算公式如下:
$$ R_{{\rm{I}}} = \frac{{N_{{\rm{0}}} - N_{{\rm{S}}}}}{{N_{{\rm{0}}}}} \times 100\% 。 $$ (2) 式(2)中:RI为抑制率(%),N0为对照组藻细胞密度,NS为处理组藻细胞密度。
-
采用SPSS 26.0分析数据,并运用Origin 2018和Graphad prism 8绘制图形。
-
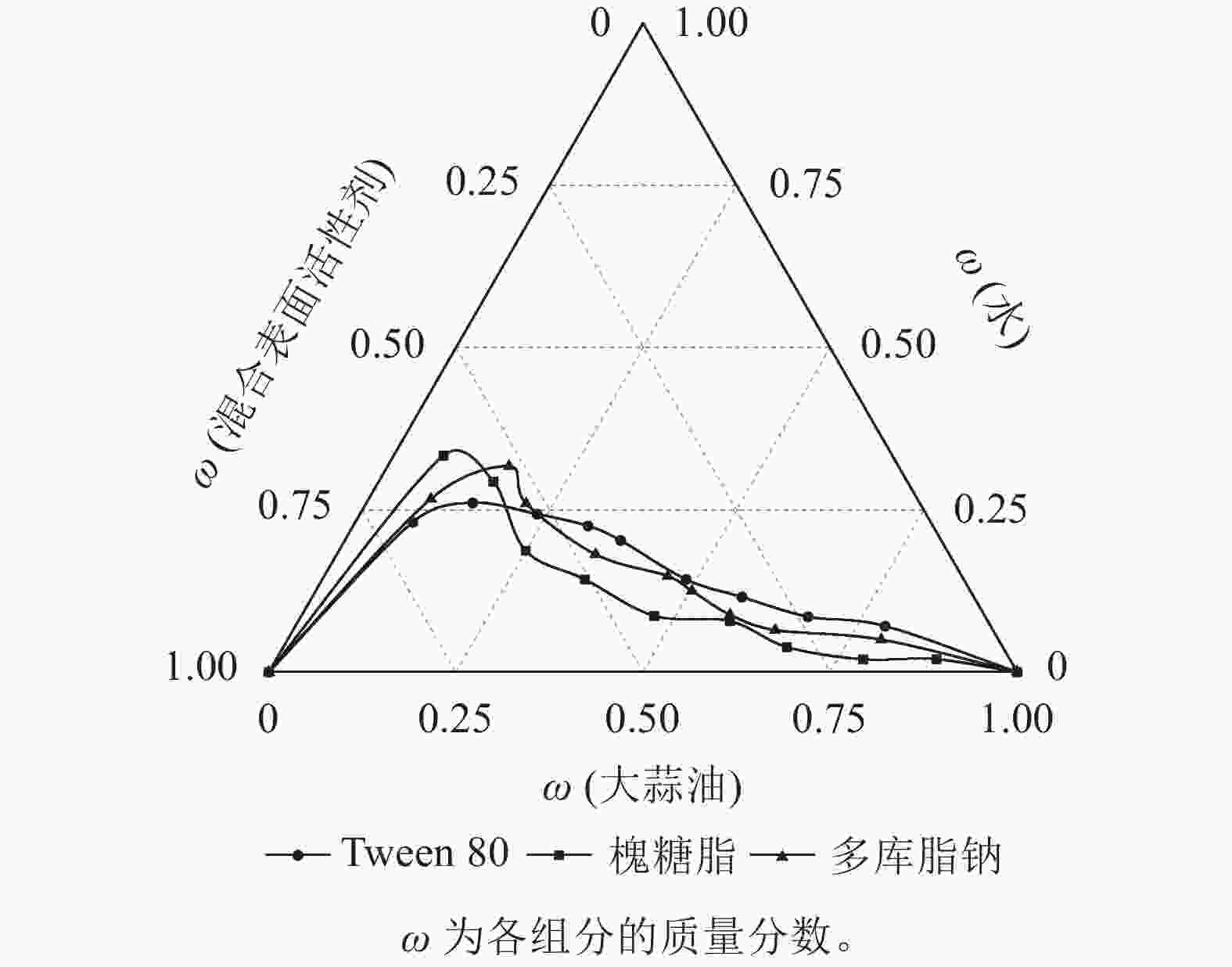
按照1.2.1方法制备大蒜油微乳液并绘制拟三元相图,通过观察微乳液的状态、品相和计算微乳区面积(以总面积为1计),考察表面活性剂对大蒜油微乳液形成的影响。结合表1和图1可知:4种表面活性剂中Span 80乳化效果不理想,各比例均存在明显分层现象,并随着油相质量的增加,品相越来越浑浊,难以形成微乳液。这表明Span 80并不适合作为制备大蒜油微乳液的表面活性剂。Tween 80的微乳区面积为14.42%,乳化效果最优,在表面活性剂相与大蒜油质量比为9∶1、8∶2、7∶3时,可形成外观澄清透明的微乳液,表面活性剂相与大蒜油质量比为6∶4、5∶5、4∶6、3∶7时,仅有少量浮油形成,表面活性剂相与大蒜油质量比为2∶8、1∶9时则为白色乳浊液。槐糖脂在制备大蒜油微乳液的过程中容易出现大油滴,仅表面活性剂相与大蒜油质量比为9∶1时能够形成较好的微乳液,微乳区面积为11.23%。多库脂钠微乳区面积为12.62%,在表面活性剂相与大蒜油质量比9∶1、8∶2时能够形成品相良好的微乳液,但随着油相质量的增加,品相开始分层并出现浑浊现象,并且浮油居多。这说明在相同环境下,同等质量的Tween 80较槐糖脂、多库脂钠能够增溶更多的大蒜油,更好地形成微乳液,多余的油会以浮油形式存在于微乳液上层,形成WinsorⅠ型微乳体系[27]。
-
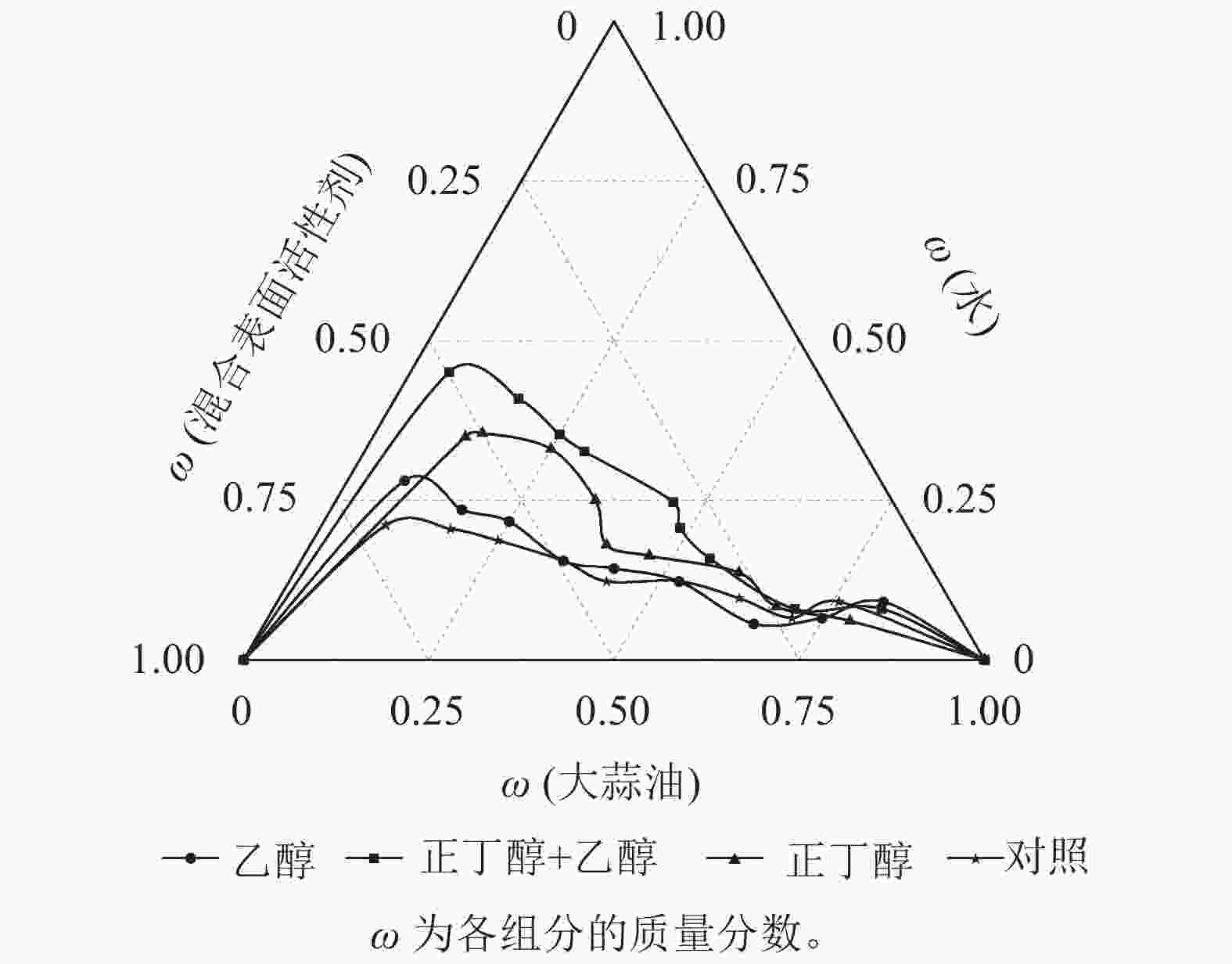
实验发现:丙三醇作为助剂时无论如何改变表面活性剂与大蒜油质量比(Km)值,都无法形成大蒜油微乳液,其原因可能是大蒜油在丙三醇中溶解度低。由图2可知:用无水乙醇、正丁醇以及两者质量比1∶1混合作为助表面活性剂的微乳区面积分别为12.76%、15.89%、20.76%;不添加助剂的面积仅有11.46%。说明助表面活性剂的加入有明显的增溶效果。使用正丁醇作为助表面活性剂时,大蒜油微乳液均未出现分层现象。这说明正丁醇能够增溶更多质量的大蒜油(图3A),其原因可能是正丁醇具有4个碳原子,表现出优于无水乙醇的亲水亲油性能。以质量比为1∶1混合两者作为助表面活性剂时,増溶效果最为明显,并且在质量比为6∶4、5∶5、4∶6时所形成的大蒜油微乳液品相较单独使用正丁醇的大蒜油微乳液具有更明显的丁达尔现象,这说明前者所形成的大蒜油微乳液粒径更小(图3B)。这可能是因为正丁醇具有良好的亲脂性,无水乙醇具有良好的亲水性,两者混合嵌入表面活性剂分子之间,与表面活性剂共同构成界面膜,分布在互不相溶的2种液体的接触界面上,改变界面膜的曲率,降低了界面膜张力,增加了界面流动性,促使微小液滴的形成,进而增大微乳区的面积和微乳液的稳定性[28]。
-
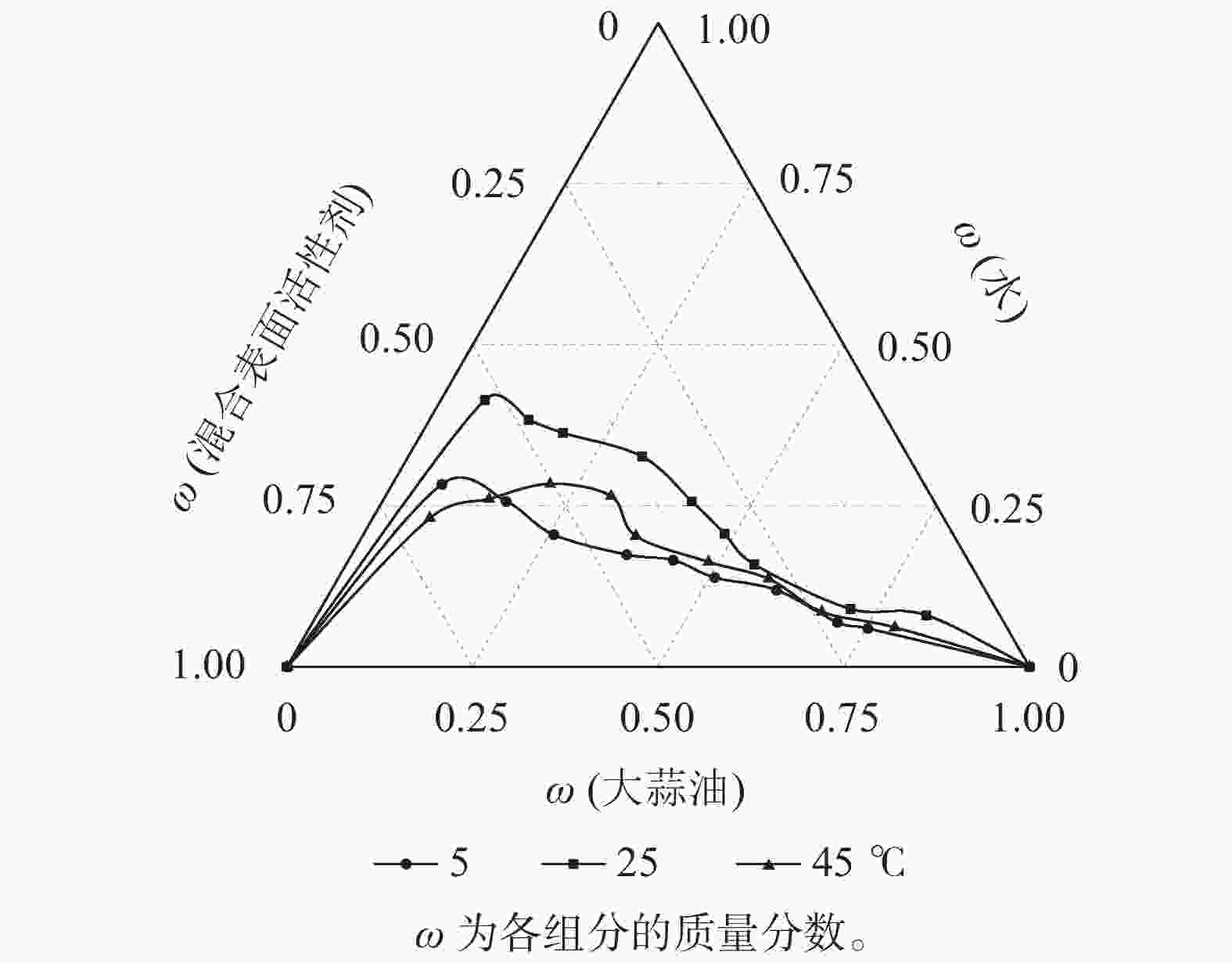
以Tween 80为表面活性剂,以质量比1∶1混合无水乙醇和正丁醇作为助表面活性剂,在表面活性剂与助表面活性剂质量比为1∶1条件下,探讨不同制备温度对大蒜油微乳液的影响(图4)。45和5 ℃所形成的微乳区面积分别为15.14%、13.31%,均远小于25 ℃处理下所形成的微乳区面积(20.63%),这与前人研究结果一致[29]。因此,选择25 ℃为大蒜油微乳液的制备温度,此时可达到最大的増溶效果。
-
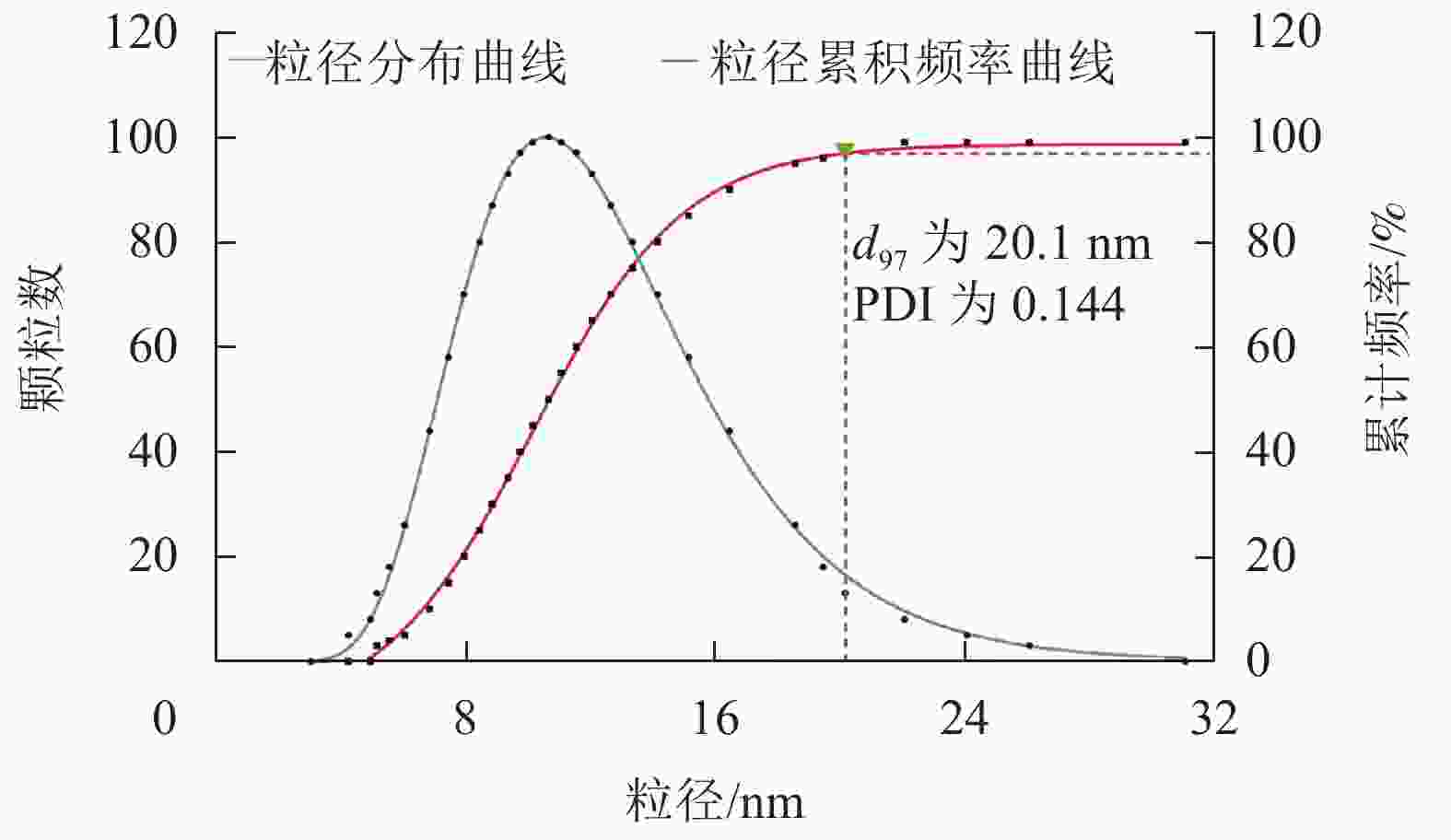
如表3所示:以粒径为评测指标,3因素排序为A>B>C;以分级评分为指标,3因素排序为B>A>C。粒径与分级评分的最优方案均为A1B3C2,即混合表面活性剂与大蒜油质量比为4∶6,无水乙醇、正丁醇和Tween 80质量比为1∶1∶1,制备温度为25 ℃。有效粒径(d97)为20.1 nm,多分散系数(PDI)为0.144 (图5)。
表 3 正交实验结果
Table 3. Orthogonal experimental results
实验号 A(λ) B(Km) C(T)/℃ 粒径/nm 分级评分 1 1 1 1 59.3 92.5 2 2 3 3 87.2 90.1 3 1 2 3 65.5 91.7 4 2 1 2 105.2 89.4 5 3 1 3 139.6 82.4 6 1 3 2 20.1 96.3 7 3 3 1 43.0 93.7 8 3 2 2 129.2 84.8 9 2 2 1 154.7 81.4 粒径 K1 144.9 304.1 257 K2 347.1 349.4 254.4 K3 311.8 150.3 292.3 R 202.2 199.1 37.9 分级评分 K1 280.5 260.3 267.6 K2 260.9 257.9 270.5 K3 260.9 280.1 261.2 R 19.6 22.2 9.1 说明:微乳液状态分级评分:Ⅰ级. 为澄清透明黄色溶液,流动性好(91~100);Ⅱ级. 澄清透明伴有淡蓝色光泽,流动性较好(81~90);Ⅲ级. 半透明伴有淡蓝色光泽溶液(61~80);Ⅳ级. 分层,乳化效果不好,有浮油(60以下)。 -
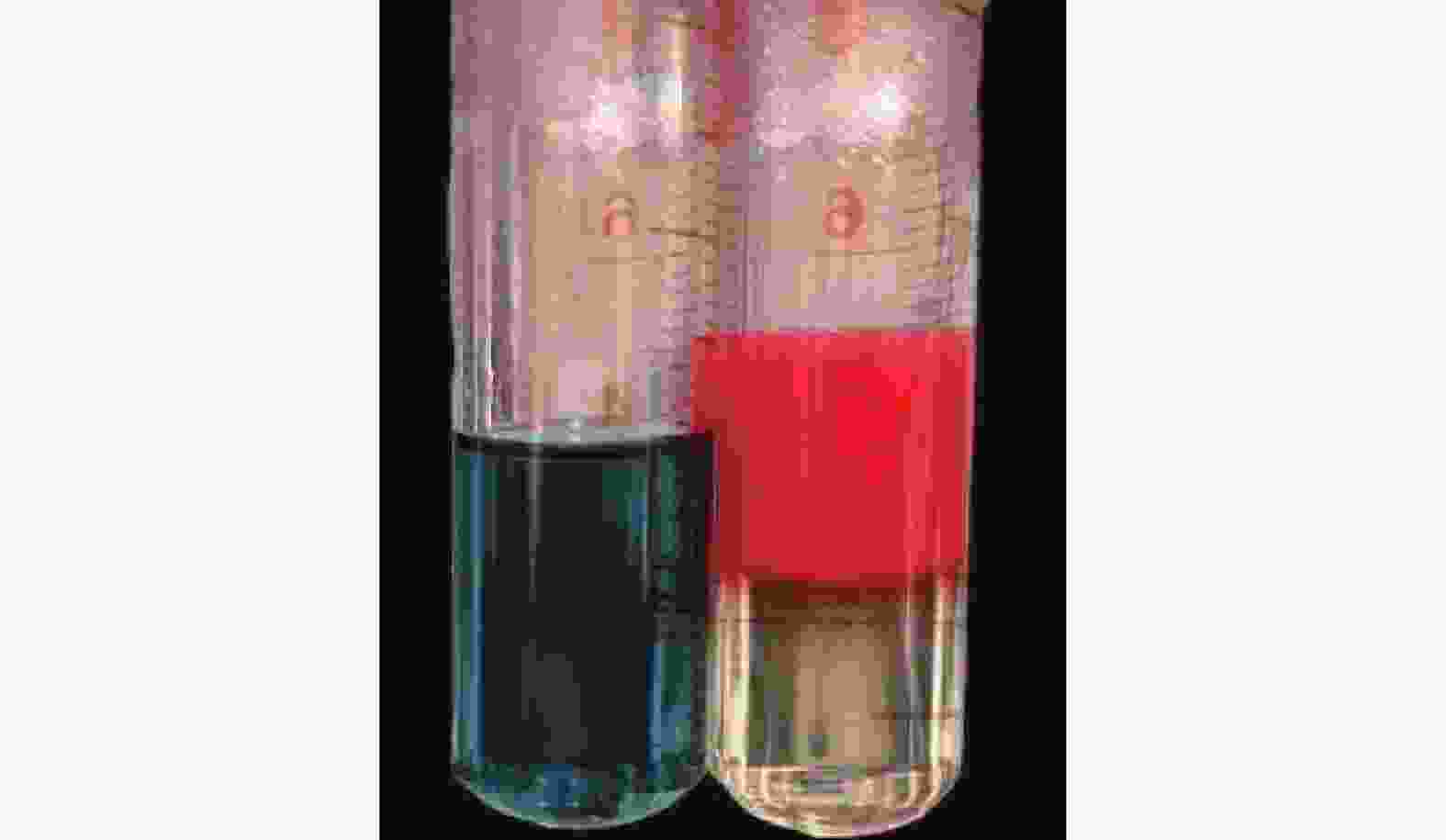
由图6可以明显观察到:亚甲基蓝溶液在大蒜油微乳液中均匀分布,而苏丹Ⅲ则扩散缓慢,并出现分层现象。说明制备的大蒜油微乳液为水包油型(O/W型)微乳液。
-
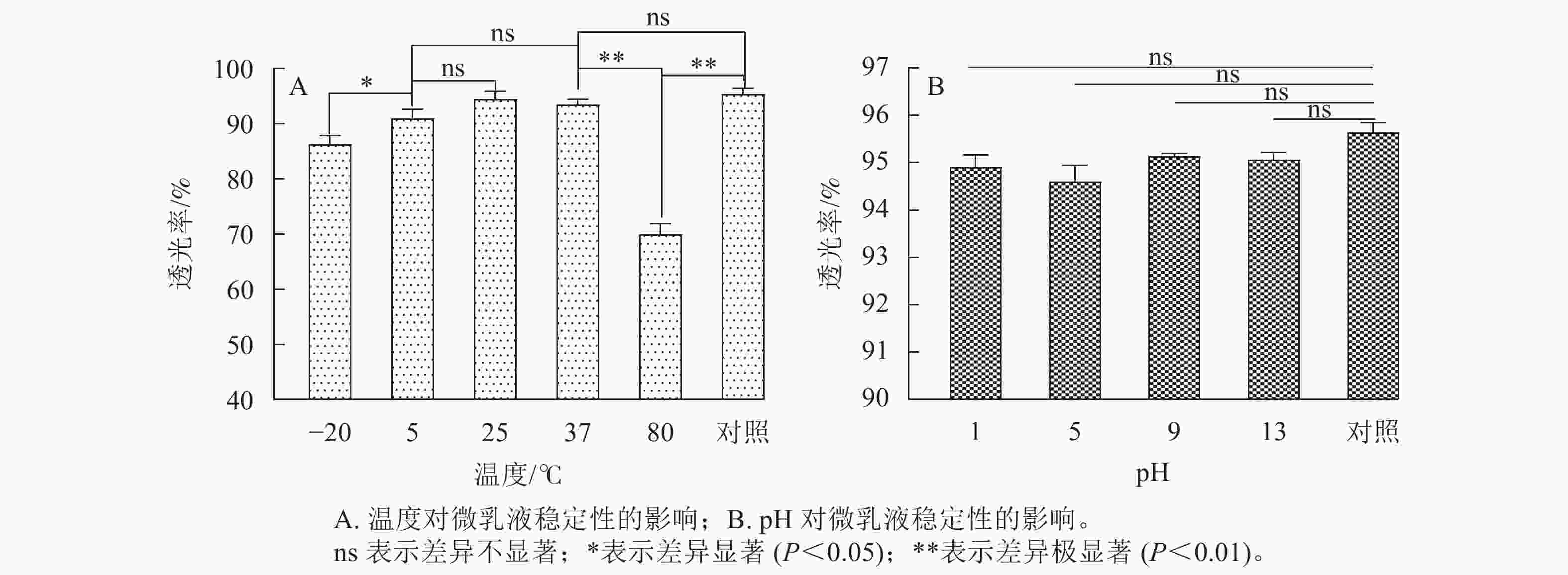
按照A1B3C2重复制备5个批次大蒜油微乳液,并在5 000和10 000 r·min−1下离心15 min,设5次重复。结果表明:对照的微乳液透光率为95.43%,5 000 r·min−1离心后微乳液的透光率为94.18%,10 000 r·min−1离心后微乳液的透光率为93.52%。这说明大蒜微乳液在高速离心后,微乳颗粒发生聚集现象,透光率有所降低,但透光率均高于90%,聚集程度较小,因此大蒜油微乳液具有较高的离心稳定性。
-
如图7A所示:在25和37 ℃下,微乳体系保持着较高的透光率。80 ℃下,大蒜油微乳液透光率低于37 ℃以及对照,并且存在极显著差异(P<0.01),原因可能是Tween 80中的氢键不稳定,其亲水性随温度升高而降低,造成微乳体系的稳定性降低[14]。在5 ℃处理下的大蒜油微乳液透光率有所下降,但微乳液透光率略大于90%,且与25 ℃以及室温和对照之间无明显差异(P>0.05),说明微乳液的稳定性较好,与−20 ℃之间存在显著差异(P<0.05)。这表明低温条件对大蒜油微乳液的影响要小于高温条件,大蒜油微乳液更适合在常温条件下储存。
-
如图7B所示:不同pH对大蒜油微乳液透光率的影响与对照组之间均不显著。其原因可能是Tween 80是非离子型表面活性剂,亲水性受酸碱浓度的影响较小,所以大蒜油微乳液的pH稳定性良好。此结果与前人研究一致[17]。
-
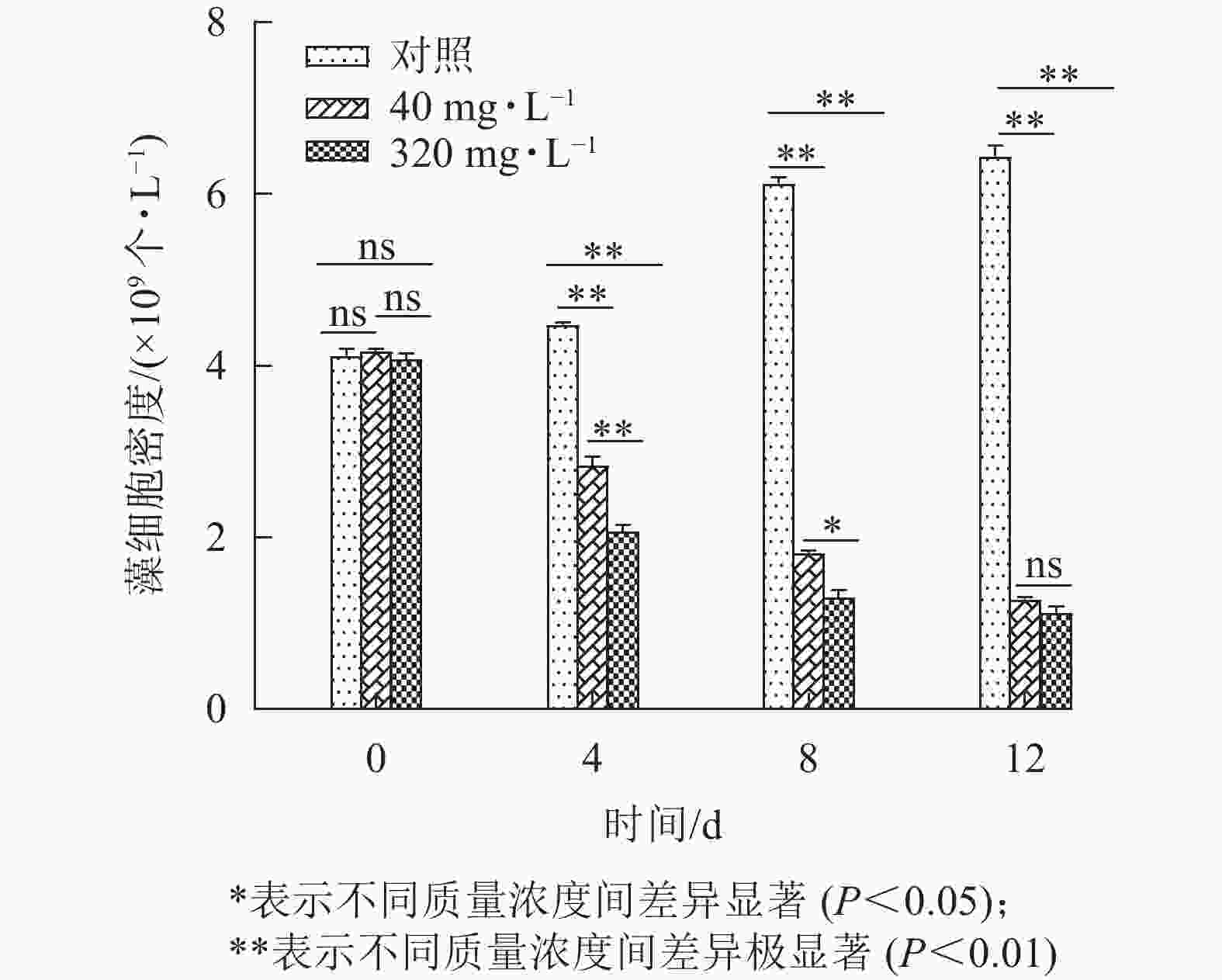
图8为添加不同质量浓度大蒜油微乳液后,藻液状态的变化情况。对照组第12天藻液颜色较第0 天时明显加深,表明藻液生长状态良好。添加40、320 mg·L−1大蒜油微乳液的处理组藻液颜色在第4、8、12天均呈不同程度的减退,最后发黄直至透明。如图9所示:第0 天时对照组与处理组之间无明显差异,第4、8、12天时,对照组与处理组之间均存在显著差异(P<0.05),第12 天时,40和320 mg·L−1处理组之间无显著差异(P>0.05),这说明随着培养时间的延长,低质量浓度(40 mg·L−1)与高质量浓度(320 mg·L−1)大蒜油微乳液之间的药效差异逐渐减小。第12 天时,40 mg·L−1处理组抑藻率为80.65%,320 mg·L−1处理组抑藻率为82.54%,可能是因为微乳液体系使低质量浓度大蒜油能够缓慢释放并持续作用于藻液[30−31]。
-
采用相转变法制备大蒜油微乳液,从不同表面活性剂、助表面活性剂中筛选最佳组分,确定制备大蒜油微乳液的最佳制备条件为:Tween 80/无水乙醇/正丁醇为混合表面活性剂,其中:m(Tween 80)∶m(无水乙醇)∶m(正丁醇)为1∶1∶1,混合表面活性剂与大蒜油质量比为4∶6,制备温度为25 ℃。在该条件下制备的大蒜油微乳液外观澄清透明伴有淡蓝色光泽。该体系能在常温以及较低温度下保存,透光率高,稳定性良好。320 mg·L−1大蒜油微乳液抑藻率为82.54%。
Preparation and algae inhibition of garlic oil microemulsion
-
摘要:
目的 将大蒜油加工制备成大蒜油微乳液,以期提高大蒜油的稳定性,并开发新型植物源灭藻剂。 方法 运用相转变法和拟三元图探讨表面活性剂和助表面活性剂种类以及质量比(Km)对大蒜油微乳液体系形成的影响并进行正交实验。考察了以最优条件制备的大蒜油微乳液在不同温度、不同pH以及5 000和10 000 r·min−1离心条件下的稳定性,并进行了大蒜油微乳液抑藻实验。 结果 最佳制备条件为25 ℃、以吐温80 (Tween 80)为表面活性剂,乙醇和正丁醇为助表面活性剂,三者质量比为1∶1∶1,混合表面活性剂与大蒜油质量比为4∶6。所得微乳液为黄色澄清透明状液体并伴有淡蓝色光泽,有效粒径为20.1 nm,多分散系数为0.144。320 mg·L−1大蒜油微乳液的抑藻率为82.54%。 结论 成功制备的水包油型大蒜油微乳液,稳定性良好,粒径大小合适,抑藻效果明显,有望制备成新型的灭藻剂。图9表3参31 Abstract:Objective This study aims to prepare microemulsion from garlic oil in order to improve the stability of garlic oil and develop a new type of plant-derived algaecide. Method The effects of surfactant and co-surfactant types and mass ratio (Km) on the formation of garlic oil microemulsion system were investigated by phase transition method and pseudo-ternary diagram, and orthogonal experiments were carried out. The stability of garlic oil microemulsion prepared under the optimal conditions under different temperature, pH and centrifugation conditions of 5 000 and 10 000 r·min−1 was investigated, and the algae inhibition of garlic oil microemulsion experiment was carried out. Result The optimum preparation conditions were 25 ℃, Tween 80 as surfactant, ethanol and n-butanol as co-surfactants. The mass ratio of the three was 1∶1∶1, and the mass ratio of mixed surfactant and garlic oil was 4∶6. The obtained microemulsion was yellow clear transparent liquid with light blue luster. The average particle size was 20.1 nm and the polydispersity coefficient was 0.144. The algae inhibition rate of 320 mg·L−1 garlic oil microemulsion was 82.54%. Conclusion The successfully prepared oil-in-water type garlic oil microemulsion has good stability, suitable particle size, and obvious algae inhibitory effect. It is expected to be a new algaecide. [Ch, 9 fig. 3 tab. 31 ref.] -
Key words:
- garlic oil microemulsion /
- pseudo-ternary phase diagram /
- surfactant /
- Chlorella sp.
-
表 1 不同表面活性剂对微乳液形成的影响
Table 1. Effects of different surfactants on the formation of microemulsion
表面活性剂种类 不同表面活性剂与大蒜油质量比对微乳液的影响 9∶1 8∶2 7∶3 6∶4 5∶5 4∶6 3∶7 2∶8 1∶9 槐糖脂 − =− − =− − =− − =− − =+ − =+ − =+ − =+ − Tween 80 − − − =− − =− − =− − =− − × × Span 80 =− − =+ − =++ − =× − =× − =× ++ =+ − =× + =× ++ 多库脂钠 − − + + =++ − =++ − =++ ++ + + + + 说明:澄清透明(−);较透明(+);浑浊(+ +);静置分层(=);白色浊液(×);分层,上下层均透明(=− −);分层,上层较透明,下层透明(=+ −);分层,上层浑浊,下层透明(=++ − );分层,上层白色浊液,下层透明(=× −);分层,上层白色浊液,下层较透明(=× +);分层,上层白色浊液,下层浑浊(=× ++)。 表 2 正交实验因素表
Table 2. Orthogonal experiment factor table
水平 A(λ) B(Km) C(T)/℃ 1 4∶6 1∶2 5 2 5∶5 1∶1 25 3 6∶4 2∶1 45 表 3 正交实验结果
Table 3. Orthogonal experimental results
实验号 A(λ) B(Km) C(T)/℃ 粒径/nm 分级评分 1 1 1 1 59.3 92.5 2 2 3 3 87.2 90.1 3 1 2 3 65.5 91.7 4 2 1 2 105.2 89.4 5 3 1 3 139.6 82.4 6 1 3 2 20.1 96.3 7 3 3 1 43.0 93.7 8 3 2 2 129.2 84.8 9 2 2 1 154.7 81.4 粒径 K1 144.9 304.1 257 K2 347.1 349.4 254.4 K3 311.8 150.3 292.3 R 202.2 199.1 37.9 分级评分 K1 280.5 260.3 267.6 K2 260.9 257.9 270.5 K3 260.9 280.1 261.2 R 19.6 22.2 9.1 说明:微乳液状态分级评分:Ⅰ级. 为澄清透明黄色溶液,流动性好(91~100);Ⅱ级. 澄清透明伴有淡蓝色光泽,流动性较好(81~90);Ⅲ级. 半透明伴有淡蓝色光泽溶液(61~80);Ⅳ级. 分层,乳化效果不好,有浮油(60以下)。 -
[1] 叶晓明, 钱宇汀, 叶雯, 等. 香榧绿藻的生物学特性及物种鉴定[J]. 浙江农林大学学报, 2019, 36(4): 629 − 637. YE Xiaoming, QIAN Yuting, YE Wen, et al. Biological characteristics and species identification of Chlorella sp. with Torreya grandis ‘Merrillii’ [J]. Journal of Zhejiang A&F University, 2019, 36(4): 629 − 637. [2] 吕军美, 郑文彪, 刘金龙, 等. 石硫合剂防治香榧绿藻的试验[J]. 南方林业科学, 2015, 43(3): 30 − 33. LÜ Junmei, ZHENG Wenbiao, LIU Jinlong, et al. Test of LSSS control of Chlorella [J]. South China Forestry Science, 2015, 43(3): 30 − 33. [3] XING Wei, HUANG Wenmin, LIU Guihua. Effect of excess iron and copper on physiology of aquatic plant Spirodela polyrrhiza (L. ) Schleid [J]. Environmental Toxicology, 2010, 25(2): 103 − 112. [4] CORZO-MARTÍNEZ M, CORZO N, VILLAMIEL M. Biological properties of onions and garlic [J]. Trends in Food Science &Technology, 2007, 18(12): 609 − 625. [5] EHNERT S, BRAUN K F, BUCHHOLZ A, et al. Diallyl-disulphide is the effective ingredient of garlic oil that protects primary human osteoblasts from damage due to cigarette smoke [J]. Food Chemistry, 2012, 132(2): 724 − 729. [6] BORLINGHAUS J, FOERSTER J, KAPPLER U, et al. Allicin, the odor of freshly crushed garlic: a review of recent progress in understanding allicin’s effects on cells[J/OL]. Molecules, 2021, 26(6): 1505[2022-04-10]. doi: 10.3390/molecules26061505. [7] 赵娜娜, 麦迪娜·托乎塔森, 卢若滨. 12种植物精油对两种仓储害虫熏蒸活性的研究[J]. 中国粮油学报, 2020, 35(8): 128 − 133. ZHAO Nana, Maidina Tuohutasen, LU Ruobin. Fumigant activity of 12 essential oils against Tribolium castaneum and Trogoderma variabile [J]. Journal of the Chinese Cereals and Oils Association, 2020, 35(8): 128 − 133. [8] ZENG Tao, ZHANG Cuili, SONG Fuyong, et al. Garlic oil alleviated ethanol-induced fat accumulation via modulation of SREBP-1, PPAR-α, and CYP2E1 [J]. Food and Chemical Toxicology, 2012, 50(3/4): 485 − 491. [9] 齐美玲, 高晶, 邵清龙. 大蒜素-β-环糊精包合物的制备及大蒜素的含量测定[J]. 北京理工大学学报, 2004, 24(7): 650 − 652. QI Meiling, GAO Jing, SHAO Qinglong. Preparation of allic in-β-cyclodextr in inclusion complex and determination of allicin by gas chromatography [J]. Transactions of Beijing Institute of Technology, 2004, 24(7): 650 − 652. [10] AYALA-ZAVALA J F, SOTO-VALDEZ H, GONZÁLEZ-LEÓN A, et al. Microencapsulation of cinnamon leaf (Cinnamomum zeylannicum) and garlic (Allium sativum) oils in β-cyclodextrin [J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2008, 60: 359 − 368. [11] SALEHI B, ZUCCA P, ORHAN I E, et al. Antimicrobial synergic effect of allicin and silver nanoparticles on skin infection caused by methicillin-resistant Staphylococcus aureus spp. [J]. Annals of Medical and Health Sciences Research, 2014, 4: 863 − 868. [12] STREHLOW B, BAKOWSKY U, PINNAPIREDDy S R, et al. A novel microparticulate formulation with allicin in situ synthesis[J/OL]. Journal of Pharmaceutics & Drug Delivery Research, 2016, 5[2022-04-10]. doi:10.4172/2325-9604.1000143. [13] SALEHI B, ZUCCA P, ORHAN I E, et al. Allicin and health: a comprehensive review [J]. Trends in Food Science &Technology, 2019, 86: 502 − 516. [14] LOURITH N, KANLAYAVATTANAKUL M, RUKTANONCHI U. Formulation and stability of Moringa oleifera oil microemulsion [J]. Soft Matter, 2016, 14(1/2/3/4): 64 − 71. [15] 田莞尔, 易有金, 李昌珠, 等. 利用微乳技术从植物油料中同步提取油脂及天然活性成分的研究进展[J]. 中国粮油学报, 2019, 34(12): 115 − 122. TIAN Waner, YI Youjin, LI Changzhu, et al. Advances in the simultaneous extraction of oils and natural active ingredients from vegetable oils by microemulsion technology [J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(12): 115 − 122. [16] 黄国平, 温其标, 罗志刚, 等. 微乳技术在食品化学中的应用[J]. 食品科技, 2003(1): 7 − 10. HUANG Guoping, WEN Qinbiao, LUO Zhigang, et al. Microemulsions for food-chemistry applications [J]. Food Science and Technology, 2003(1): 7 − 10. [17] 闫圣坤, 万文瑜, 王庆惠, 等. 核桃油微乳液的制备及其稳定性研究[J]. 保鲜与加工, 2020, 20(5): 100 − 106. YAN Shengkun, WAN Wenyu, WANG Qinghui, et al. Preparation of walnut oil microemulsion and its stability [J]. Storage and Process, 2020, 20(5): 100 − 106. [18] 杨晨, 韩瑞, 孔凡, 等. 牡丹籽油微乳液的制备及其性质研究[J]. 中国油脂, 2021, 46(6): 59 − 64, 70. YANG Chen, HAN Rui, KONG Fan, et al. Preparation and properties of peony seed oil microemulsion [J]. China Oils and Fats, 2021, 46(6): 59 − 64, 70. [19] 蔡程晨, 朱式业, 熊武国, 等. 猕猴桃籽油微乳液的制备及货架期预测[J]. 食品与机械, 2019, 35(4): 127 − 132. CAI Chengchen, ZHU Shiye, XIONG Wuguo, et al. Preparation of kiwi fruit seed oil micro-emulsion and its shelf life prediction [J]. Food &Machinery, 2019, 35(4): 127 − 132. [20] 朱加进, 叶璐, 常成, 等. 南极磷虾油W/O型微乳液制备及稳定性研究[J]. 中国食品学报, 2017, 17(10): 80 − 87. ZHU Jiajin, YE Lu, CHANG Cheng, et al. Preparation and stability study of krill oil microemulsion [J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(10): 80 − 87. [21] ZHANG Xu, XIE Yi, XU Fen, et al. Growth of BaWO4 fishbone-like nanostructures in W/O microemulsion [J]. Journal of Colloid and Interface Science, 2004, 274(1): 118 − 121. [22] KE W T, LIN S Y, HO H O, et al. Physical characterizations of microemulsion systems using tocopheryl polyethylene glycol 1000 succinate (TPGS) as a surfactant for the oral delivery of protein drugs [J]. Journal of Controlled Release, 2005, 102(2): 489 − 507. [23] LI Xiangcun, HE Gaohong, XIAO Gongkui, et al. Synthesis and morphology control of ZnO nanostructures in microemulsions [J]. Journal of Colloid and Interface Science, 2009, 333(2): 465 − 473. [24] 国家卫生健康委员会. 食品安全国家标准 食品添加剂使用标准: GB2760—2014[S]. 北京: 中国标准出版社, 2014. National Health Commission. National Standard for Food SafetyStandard for Use of Food Additives: GB2760−2014[S]. Beijing: China Standard Press, 2014. [25] 丛方地, 王海风, 张媛媛, 等. 大蒜油的预乳化及分散性研究[J]. 日用化学工业, 2015, 45(9): 495 − 499. CONG Fangdi, WANG Haifeng, ZHANG Yuanyuan, et al. Study on garlic oil pre-emulsion and therefore dispersion [J]. China Surfactant Detergent &Cosmetics, 2015, 45(9): 495 − 499. [26] 季文长, 张宇航, 戴各生, 等. 大蒜油有效成分的定量和定性分析[J]. 深圳大学学报(理工版), 1989, 6(3): 47 − 50. JI Wenchang, ZHANG Yuhang, DAI Gesheng, et al. Determination Ⅱof garlic oil composition by UV and FTIR [J]. Journal of Shenzhen University (Science and Engineering), 1989, 6(3): 47 − 50. [27] 邓伶俐, 余立意, 买尔哈巴·塔西帕拉提, 等. 纳米乳液与微乳液的研究进展[J]. 中国食品学报, 2013, 13(8): 173 − 180. DENG Lili, YU Liyi, Maierhaba Taxipalati, et al. The research progress on nanoemulsionand microemulsion [J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(8): 173 − 180. [28] 郑华名. 载大蒜素微胶囊的制备及其控释性能的研究[D]. 武汉: 武汉大学, 2014. ZHENG Huangming. Preparation and Controlled Release Characterization of Allicin-load Microcapsule[D]. Wuhan: Wuhan University, 2014. [29] 肖小年, 周洁, 易孜成, 等. 大蒜油自微乳的制备及其初步稳定性[J]. 南昌大学学报(理科版), 2020, 44(1): 42 − 48. XIAO Xiaonian, ZHOU Jie, YI Zicheng, et al. Preparations and preliminary stability evaluation of garlic oil self-microemulsifying drug delivery system [J]. Journal of Nanchang University (Natural Science), 2020, 44(1): 42 − 48. [30] 崔绮嫦, 吴克刚, 莫镕弛, 等. 溶剂和微乳化的稀释效应对食用植物精油抗菌活性的影响[J]. 中国食品学报, 2020, 20(3): 195 − 203. CUI Qichang, WU Kegang, MO Rongchi, et al. Dilution effect of solvent and micro emulsification on the antibacterial activity of plant essential oils [J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(3): 195 − 203. [31] 肖小年, 盛丹梅, 周洁, 等. 大蒜油自微乳的抑菌作用[J]. 中国食品学报, 2021, 21(12): 73 − 80. XIAO Xiaonian, SHENG Danmei, ZHOU Jie, et al. Inhibitory effect of garlic oil self-microemulsion on bacteria [J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(12): 73 − 80. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220336






 下载:
下载: