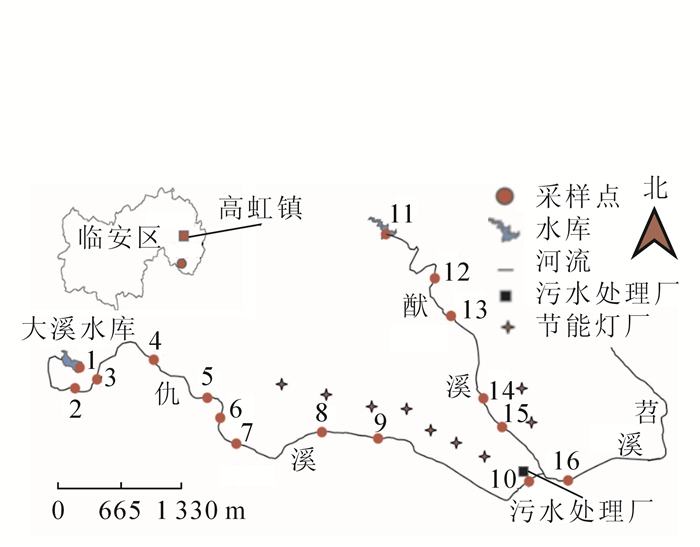
-
汞(Hg)是具有强烈毒性的重金属污染物之一, 也是唯一一种主要以气态形式存在于大气中的重金属污染物。所有的汞化合物对人类和动物都具有极强的毒性,其中以有机汞化合物的毒性最大[1]。甲基汞(MeHg)能够通过食物链以生物积累和生物放大作用在不同生物体中进行富集,当人们摄入甲基汞质量分数较高的鱼类或其他食物时,甲基汞会在人体内积累,对人类健康产生严重危害。汞在水生生态系统中具强生物富集特性,许多研究报道了汞在海洋或者湖泊等水系统中的分布、迁移以及形态转化过程[2-3]。近年来,陆地生态系统,特别是土壤中汞质量分数逐年增高, 并且此种污染是一个不可逆的过程[4]。2014年全国土壤污染调查公告显示,中国已有1.6%农田受汞污染[5],土壤汞污染所带来的问题已经对水体和农作物造成了严重威胁[6-7]。对于受汞污染的土壤,传统的治理方法包括固定法、淋洗法、客土法等物理化学方法,但是这些方法成本高,并且会造成二次污染[8]。植物修复是指将某种特定的植物种植在受污染的土壤中, 利用植物特有的吸收、降解、挥发、根滤、稳定等作用机制,从环境中富集或者吸收某种污染物, 而维持正常的代谢活动, 不对自身产生毒害作用[8]。近年来, 植物修复技术得到了广泛的应用,其费用低廉、不破坏场地结构、不会对地下水造成二次污染,而且能对环境起到美化作用。HORVAT等[9]报道显示:酸模Rumex induratus和欧夏至草Marrubium vulgare对汞污染土壤的去除能力为12.9和27.6 g·hm-2;而大麦Hordeum spp.,多叶羽扇豆Lupinus culinaris,鹰嘴豆Cicer arietinum等对汞的去除量仅分别为4.7,2.8和0.4 g·hm-2。与全球汞污染土壤的平均富集度(100.0 kg·hm-2)相比,可忽略不计[10]。中国学者也对汞污染土壤修复进行了研究。龙育堂等[11]尝试将污染水稻田改种旱作苎麻Boehmeria nivea,虽然苎麻地上组织中的汞质量分数不及水稻Oryza sativa高,但其土壤净化的速度要比种植水稻快8.5倍,无法在水生环境修复中应用。水稻植株可以从土壤中富集汞。水稻植株对汞的富集实际上是一个“根吸收-茎转运-叶赋存-子实累积”的动态过程[2, 12-13]。相比于在土壤中赋存时期较长的“旧汞”,水稻更易于吸收从大气中新沉降到土壤中的“新汞”[2]。此外,其他一些对汞有较强富集能力的植物主要包括悬钩子Rubus spp.和野嵩Artemisia argyi[14],乳浆大戟Euphorbia esula[15]和大米草瓜子Spartina anglica[16]等。硒(Se)是生物体内必需的一种微量元素,ZHANG等[17]的研究证明了土壤中的硒可以抑制植物对汞的吸收,并且硒可以在一定程度上减少汞对生物体的毒害作用[18-19]。张华等[20]在中国万山汞矿区对水稻的研究结果进一步表明:水稻根部土壤中硒质量分数的增加可能会对水稻茎、叶和果实对根围无机汞(IHg)和甲基汞的富集产生拮抗作用。节能灯生产过程中会使用大量的汞,从而造成当地环境汞污染。现有研究表明:节能灯生产地区水稻中汞的质量分数显著高于当地市售其他来源水稻中汞的质量分数[21]。因此,本研究选取浙江省杭州市临安区高虹镇典型节能灯生产聚集区2条河道内主要水生植物为研究对象,在研究区域内共采集了16个点的不同水草样品并对水草不同部位的无机汞、甲基汞和硒的质量分数进行了测定。通过分析这些数据,比较不同水草富集无机汞和甲基汞的能力差异,并寻找对汞富集能力较强的水草种类,同时分析水草中硒的质量分数对水草富集汞的影响,观察植物体内硒的存在是否对汞的富集起到了抑制作用。
-
根据高虹镇当地的地形和气候情况、产业分布特征和节能灯生产区的密集程度,以流经境内的仇溪和猷溪2条支流进行布点采样。采样时间为2016年5月。选取16个采样点,采样点1,2,3,4,5,6,11,12,13等因周围没有节能灯厂作为非污染对照点,采样点7,8,9,10和采样点14,15,16等因周围节能灯厂相对密集作为污染点,采样点10周围有污水处理厂(具体布样点见图 1)。水草样品选取当地主要物种,包括空心莲子草Alternanthera philoxeroides,双穗雀稗Paspalum paspaloides,一点红Emilia sonchifolia,石菖蒲Acorus tatarinowii和稗草Echinochloa crusgalli等5个种。在各个采样点,采集植株3~5株·种-1。采集时将水草连根拔起,整株放入无色透明的聚乙烯塑料袋中,运回实验室。用自来水和超纯水先后将样品冲洗干净,特别是将根表面的底泥沉积物洗净,并对水草的根、茎、叶各部分分袋装好,再放入冰箱冷冻保存。同时,在植物生长区周围采集沉积物,也装入聚乙烯袋中,放入冰箱保存。植物与沉积物都用Freezone冷冻干燥机(美国Labconco公司)对样品进行干燥处理,将已冻干的样品磨成粉过100目筛,然后放入无色透明的聚乙烯塑料袋密封保存待测。
-
样品甲基汞测定根据USEPA[22]和MENG等[2]建立的方法,准确称取样品0.1~0.2 g(精确到万分位)置于50.0 mL离心管中,加入5.0 mL质量分数为25%氢氧化钾溶液。将离心管放入水浴锅内消解3.0 h以上(消解温度为75~80 ℃),至完全溶解,取出离心管冷却至室温,缓缓滴加浓盐酸3.0~5.0 mL,以pH试纸测试溶液呈酸性。再加入10.0 mL二氯甲烷,称量,密封后充分振荡30 min。离心分离(3 000 r·min-1)25 min,抽掉上部废液,转移萃取液到50.0 mL离心管内,称量,加入适量超纯水(45.0 mL)。置水浴锅内,水浴升温50 ℃,气化二氯甲烷,以竹签去气泡,待气泡消失时,升温至不超过80 ℃,吹入氮气,约8 min。定容至50.0 mL,摇匀待测。
-
样品中无机汞测定采用差减法,即使用样品总汞质量分数减去甲基汞质量分数。样品总汞测定方法根据冯新斌等[1]和USEPA[23]建立的方法。用电子天平准确称取样品0.1~0.2 g(精确到万分位)于25.0 mL之酸净化过的比色管中,向比色管中加入5.0 mL工艺超纯硝酸,在95 ℃水浴锅消解6.0 h以上。待样品完全消解后,加入少许超纯水,再向比色管中加入体积分数为0.5%氯化溴。用超纯水准确定容至25.0 mL,摇匀,放置过夜待测。总汞的测定采用冷原子荧光光谱法,仪器采用Model Ⅲ(美国Brooks Rand公司)。
-
准确称取样品0.2 g(精确到千分位)于25.0 mL经净化处理的比色管中,向比色管中加入现配的王水10.0 mL,并在比色管口放上经处理的小漏斗,过夜。将比色管放入消解器进行消解,消解温度约130 ℃,消解约8.0 h,待样品完全消解后,向比色管中加入体积分数为1%的硝酸溶液定容至25.0 mL,摇匀。过滤至无色50.0 mL离心管中,再转移10.0 mL溶液于15.0 mL离心管内待测。硒元素的测定采用电感耦合等离子体发射光谱仪(Prodigy 7, 美国Leeman公司)。
-
采用生物样品标准物质Tort-3(加拿大NRCC公司)、方法空白、样品平行和加标回收率等方法进行质量控制。总汞测定方法的最低检出限为0.006 ng·g-1,甲基汞测定方法的最低检出限为0.002 ng·g-1。总汞与甲基汞的样品平行误差率分别为10.1%和12.9%,总汞与甲基汞的标准物质回收率分别为84.2%~102.0%和95.1%~109.0%。
-
每种植物的根、茎、叶为各个指标需要测定的样品,每种样品的值为选取的3个平行样品的平均值。文中数据用软件Excel 2013进行整理,采用SPSS 21.0软件进行数据分析。图表制作采用SigmaPlot 12.5和Excel 2013。
-
植物对汞富集的程度可用生物富集系数反映,其富集系数越大说明植物对汞富集能力越强。采用公式“生物富集系数=植物样品中根系的汞/沉积物中的汞”进行计算。
-
表 1和表 2分别表明了在各地区中空心莲子草、双穗雀稗、一点红、石菖蒲、稗草各部位的无机汞和甲基汞质量分数分布特征。其中无机汞质量分数为双穗雀稗>空心莲子草>稗草>石菖蒲>一点红,甲基汞质量分数为双穗雀稗≈空心莲子草>稗草>石菖蒲>一点红。由此说明:双穗雀稗不管是对无机汞还是甲基汞的富集能力都是较强的,高于其他品种水草对汞的富集能力。无机汞质量分数最高点出现在8号采样点。
表 1 不同植物组织中无机汞质量分数
Table 1. IHg concentrations in different plant tissues
序号 采样点位置 w无机汞/(ng·g-1) w无机汞/(ng·g-1) 空心莲子草 双穗雀稗 一点红 石菖蒲 稗草 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 果实 1 仇溪上游 72.900 7.660 47.800 95.300 20.500 59.400 3.620 32.700 30.700 9.450 44.300 8.160 2 仇溪上游 8.620 13.500 63.600 3.840 16.800 24.100 9.900 1.220 61.000 54.900 3 仇溪上游 285.000 14.600 55.600 15.600 139.000 63.900 41.300 4 仇溪上游 187.000 82.100 17.500 2.640 5 仇溪上游 6 仇溪上游 110.000 3.710 40.100 11.800 85.600 15.900 34.000 26.100 7 仇溪节能灯生产区 199.000 6.210 59.700 14.700 21.500 256.000 61.100 93.500 4.930 15.800 18.100 15.200 8 仇溪节能灯生产区 29.300 19.100 250.000 35 710.000 49.000 74.700 143.000 8.400 42.100 80.500 16.200 74.300 30.400 9 仇溪节能灯生产区 172.000 104.000 284.000 61.500 104.000 32.700 54.200 106.000 18.600 253.000 14.700 10 污水厂 45.900 8.430 89.400 19.200 39.900 17.200 494.000 28.300 39.100 9.650 11 猷溪上游 21.200 8.740 39.000 71.900 60.700 12 猷溪上游 67.800 2.470 13 猷溪上游 32.400 86.800 33.300 39.900 9.770 210.000 8.580 39.500 14 猷溪节能灯生产区 648.000 34.400 47.000 548.000 48.400 54.400 270.000 93.400 82.600 15 猷溪节能灯生产区 665.000 385.000 852.000 2 091.000 117.000 465.000 24.200 82.900 1 038.000 43.300 253.000 35.800 16 猷溪节能灯生产区 1 038.000 131.000 130.000 800.000 28.700 62.700 92.600 46.300 38.900 96.200 38.400 16.200 44.700 9.330 表 2 不同植物组织中甲基汞质量分数
Table 2. MeHg concentrations in different plant tissues
序号 采样点位置 w甲基汞/(ng·g-1) w甲基汞/(ng·g-1) 空心莲子草 双穗雀稗 一点红 石菖蒲 稗草 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 果实 1 仇溪上游 2.270 1.480 1.320 1.460 1.150 0.160 0.332 1.230 0.924 0.524 0.253 0.245 1.030 0.300 0.475 0.438 2 仇溪上游 0.806 0.292 0.727 4.630 3.570 2.250 1.610 1.800 4.250 2.980 1.380 3 仇溪上游 13.100 2.330 1.530 4.190 0.628 0.511 0.241 4 仇溪上游 1.560 0.230 1.330 1.650 0.321 0.077 0.516 0.584 0.849 1.550 0.226 5 仇溪上游 6 仇溪上游 5.170 5.440 17.000 7.280 3.140 1.340 29.000 10.900 10.400 14.300 7 仇溪节能灯生产区 7.730 2.760 1.870 2.440 1.710 0.547 3.990 1.220 1.090 3.590 1.840 1.140 8 仇溪节能灯生产区 4.740 3.240 6.120 33.200 1.980 1.210 0.209 0.267 0.939 5.430 0.942 0.408 0.428 9 仇溪节能灯生产区 8.010 7.560 14.000 4.890 2.330 0.397 0.529 17.000 3.870 4.500 3.880 10 污水厂 1.820 0.285 0.241 0.765 0.654 1.390 17.200 4.350 1.760 4.390 11 猷溪上游 0.226 0.136 0.076 12 猷溪上游 5.930 0.463 1.830 0.082 0.802 0.707 13 猷溪上游 8.420 0.816 1.470 4.030 2.420 0.844 2.390 11.600 3.110 1.110 14 猷溪节能灯生产区 15.900 1.550 4.870 32.800 4.520 1.130 7.440 5.320 1.770 15 猷溪节能灯生产区 10.200 9.540 0.018 46.300 2.110 2.690 0.621 0.851 6.630 0.527 1.420 0.511 16 猷溪节能灯生产区 6.490 3.150 4.490 31.100 7.940 4.950 0.872 0.451 0.522 1.080 1.490 0.522 3.310 图 2和图 3则反映了未污染地区和污染地区不同品种水草各部位之间总汞和甲基汞质量分数分布特征。其中除了一点红较为特殊,在未污染地区各部位甲基汞质量分数为叶>茎>根,总汞质量分数在根、茎、叶中无明显差异以外,其余品种水草在未污染地和污染地根部的总汞和甲基汞质量分数均明显高于茎和叶中总汞和甲基汞质量分数,说明这些品种水草主要还是从根部对汞进行富集。这表明水生植物对汞的吸收主要是根而不是茎或者叶。

图 2 未污染地各水草根、茎、叶中汞质量分数分布
Figure 2. Mercury concentration in root, stern and leaf of different aquatic plant in non-mercury contamination sites

图 3 污染地各水草根、茎、叶中汞质量分数分布
Figure 3. Mercury concentration in root, stern and leaf of different aquatic plant in mercury contamination sites
水草不同部位对汞的富集能力也有所不同。双穗雀稗、石菖蒲和稗草在未污染地和污染地各部位中甲基汞质量分数分布为根>茎>叶,空心莲子草各部位中甲基汞质量分数分布为根>叶>茎。空心莲子草、双穗雀稗、石菖蒲和稗草在未污染地和污染地各部位总汞分布为根>叶>茎,根部汞质量分数明显高于茎和叶汞质量分数,但茎和叶之间无明显差异。一点红比较特殊,在未污染地各部位甲基汞质量分数还有所不同,而在污染地各部位总汞和甲基汞质量分数均无明显差异。
表 3表明:这些水草对不同形态的汞表现出不同的富集特征,从未污染地和污染地对甲基汞和总汞的富集系数可知这些水草对甲基汞具有较强的富集能力,对总汞的富集能力相对较弱。其中双穗雀稗在污染地对甲基汞和总汞的富集能力均显著高于未污染地,而稗草和空心莲子草在未污染地已经呈现出较好的富集汞能力,所以在污染地并没有表现出明显强于未污染地的富集能力。石菖蒲在未污染地和污染地均没有表现出较强的富集能力。由此可得:双穗雀稗可作为该地区用来富集汞的潜在水草品种。
表 3 各水草根对不同形态汞的富集系数关系
Table 3. Bioaccumulation factor of different speciation mercury in aquatic plants from mercury contamination sites and nonmercury contamination sites
水草种类 汞的种类 未污染地富集系数 污染地富集系数 污染地与未污染地的比率/% 双穗雀稗根 总汞 0.574 6.400 11.100 总汞 1.470 0.338 0.200 稗草根 总汞 0.671 0.171 0.300 总汞 1.070 0.431 0.400 石菖蒲根 甲基汞 15.600 8.400 0.500 甲基汞 8.800 29.100 3.300 空心莲子草根 甲基汞 13.200 8.970 0.700 甲基汞 6.070 6.880 1.100 说明:生物富集系数指化学物质在生物体内的积累指标 -
图 4反映了5种水草根、茎、叶中硒质量分数的分布。双穗雀稗、一点红的根部硒质量分数最低,空心莲子草和稗草的叶中硒质量分数最低,但与根中硒质量分数无显著差异,总体来说水草根部的硒质量分数相比茎和叶较低(表 4)。

图 4 水草各部分中硒质量分数分布
Figure 4. Selenium concentration in root, stern and leaf of different aquatic plants
表 4 不同植物组织中硒质量分数分布
Table 4. Selenium concentration in different plant tissues
序号 采样点位置 w硒/(mg·kg-1) w硒/(mg·kg-1) 空心莲子草 双穗雀稗 一点红 石菖蒲 稗草 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 果实 1 仇溪上游 0.298 1.280 23.200 6.210 1.280 0.221 6.020 4.570 2.450 2.340 10.600 5.770 4.780 3.230 2 仇溪上游 7.510 13.700 4.240 5.090 7.150 1.330 4.530 7.360 3 仇溪上游 10.600 2.570 1.950 2.130 8.300 5.820 4 仇溪上游 12.100 9.410 6.690 5.370 4.440 2.080 7.580 4.850 6.660 5 仇溪上游 6 仇溪上游 7.480 3.880 7.650 2.860 7.110 4.890 6.050 7.810 7 仇溪节能灯生产区 8.580 7.900 4.210 5.330 6.650 5.620 0.702 2.280 6.910 1.000 5.680 8 仇溪节能灯生产区 2.880 2.450 5.960 3.070 3.410 1.590 5.340 7.140 3.480 0.177 8.310 4.780 9 仇溪节能灯生产区 1.950 2.570 7.750 3.490 9.620 5.570 6.200 7.810 10 污水厂 2.310 1.720 2.910 1.310 3.460 5.950 1.080 11 猷溪上游 5.180 4.960 6.440 12 猷溪上游 9.230 3.540 6.870 6.110 7.420 3.560 13 猷溪上游 2.510 5.980 6.540 8.390 3.580 2.430 5.400 2.660 14 猷溪节能灯生产区 2.920 6.680 3.150 10.300 5.940 15 猷溪节能灯生产区 4.750 3.990 4.920 2.520 4.440 6.640 4.310 4.930 6.610 16 猷溪节能灯生产区 2.290 6.450 5.550 11.600 2.680 11.400 10.700 5.980 2.310 1.780 不同水草相同部位硒质量分数不同,根部硒质量分数分布为空心莲子草>一点红>石菖蒲>稗草>双穗雀稗;茎中硒质量分数分布为空心莲子草>双穗雀稗>一点红>稗草>石菖蒲;叶中硒质量分数分布为双穗雀稗>空心莲子草>一点红>石菖蒲>稗草。同种水草不同部位硒质量分数也不同,其中双穗雀稗各部位硒质量分数分布为根<茎<叶,空心莲子草各部位硒质量分数分布为叶<根<茎,一点红各部位硒质量分数分布为根<叶<茎。总体来说,水草根部的硒质量分数相比茎和叶较低,即使部分水草根中硒质量分数高于叶中硒质量分数,但也无显著差异。
从图 5可得出:空心莲子草根、双穗雀稗、石菖蒲和稗草中甲基汞与硒之间呈负相关关系,但关系并不显著(R=-0.700,P>0.05,n=8;R=-0.637,P>0.05,n=9;R=-0.158,P>0.05,n=4;R=-0.589,P>0.05,n=8)。一点红根中甲基汞与硒之间呈正相关关系,但关系也不显著(R=0.427,P>0.05,n=5)。从图 6可知:空心莲子草、双穗雀稗、一点红、石菖蒲和稗草根中总汞与硒之间均呈负相关关系,但关系并不显著(R=-0.688,P=0.087>0.05,n=7;R=-0.297,P=0.476>0.05,n=8;R=-0.816,P=0.092>0.05,n=5;R=-0.461,P=0.434>0.05,n=5;R=-0.761,P=0.079>0.05,n=6)。

图 5 水草根中甲基汞和硒质量分数关系
Figure 5. Correlation between methyl mercury and selenium concentration in the roots of aquatic plants

图 6 水草根中无机汞和硒质量分数关系
Figure 6. Correlation between inorganic mercury and selenium concentration in the roots of aquatic plants
上述分析中空心莲子草、双穗雀稗、石菖蒲和稗草根中甲基汞和总汞与硒两者之间虽然没有呈显著关系,但是它们均显示负相关关系,说明当水草根部硒质量分数的增加很有可能可以降低水草对汞的富集。这表明:硒能对水生生物体中汞的富集产生抑制作用相一致。一点红根中甲基汞与硒之间没有呈负相关关系可能是由于本研究中采集到的一点红样品的数量过少导致。其他种水草未呈显著关系,可能是因为实验过程的误差和样品数量较少。
-
杭州市临安区高虹镇研究区域内未污染地和污染地5种水草除一点红较特殊以外,其余水草的根部总汞和甲基汞质量分数均显著高于茎和叶中总汞和甲基汞质量分数,说明这些水草主要还是从根部对汞进行富集。水草对不同形态的汞的富集能力也有所不同,所研究的这些品种水草对甲基汞的富集能力要比对总汞的富集能力强。双穗雀稗在污染地对总汞和甲基汞的富集能力均明显强于其他种的水草,并且双穗雀稗在污染地的富集能力显著强于未污染地,所以可以用来作为该地区修复汞污染地的潜在水草种类。
-
植物中硒与汞之间呈现负相关关系,说明硒质量分数的增加很可能抑制植物对汞的吸收。根系对汞吸收减小是硒和汞在根系环境中形成了难溶的汞硒(HgSe)复合物。一种可能的解释是,在营养栽培条件下,硒和汞更容易形成汞硒复合物,从而显著抑制了植物对汞的吸收;另一方面,汞离子(Hg2+)和亚硒酸离子(SeO32-)均是通过水通道进入植物细胞的,这就造成了两者的竞争吸收。所以硒的存在使植物对汞的吸收有所减少,从而减轻汞对植物或者人体的危害。
Mercury accumulation in five different aquatic plants
-
摘要: 为研究不同水草对汞的生物富集作用和硒元素对汞在水草中的富集之影响,选取杭州市临安区高虹镇典型节能灯生产集聚区2条河道内5种主要水生植物为研究对象,测定其不同部位的无机汞、甲基汞及硒质量分数。结果表明:水草对甲基汞的富集能力强于无机汞,且不同水草对无机汞或者甲基汞的富集能力也有较大差异。双穗雀稗Paspalum paspaloides在汞污染地区对无机汞的富集能力分别是稗草Echinochloa crusgalli,石菖蒲Acorus tatarinowii,一点红Emilia sonchifolia和空心莲子草Alternanthera philoxeroides的18.9,37.4,72.1和14.8倍;对甲基汞的富集能力分别是稗草、石菖蒲、一点红和空心莲子草的3.2,4.2,40.2和3.5倍,对汞的富集能力明显强于其他水草。环境汞质量分数对植物富集能力也有一定影响,双穗雀稗在汞污染地区对无机汞的富集能力是未污染地的11.1倍,对甲基汞的富集能力是未污染地的3.3倍,是可用来作为污染地汞富集植物的潜在品种。水草根中硒和汞质量分数之间呈负相关关系,说明硒对汞的吸收有抑制作用。Abstract: To study mercury (Hg) accumulation in aquatic plants and the role of selenium (Se) on Hg accumulation, five kinds of aquatic plants (Paspalum distichum, Echinochloa crusgalli, Acorus tatarinowii, Emilia sonchifolia, and Alternanthera philoxeroides) were collected from the Typical Energy-Saving Lamps Production Area in Gaohong Town, Lin'an District, Hangzhou City, Zhejiang Province. Inorganic Hg (IHg), methylmercury (MeHg), and Se concentrations in different plant tissues were analyzed. Results showed that aquatic plants could accumulated significantly higher (P < 0.01) of MeHg than IHg. The Hg accumulation in different aquatic plants was also different with the bioaccumulation factor (BAF) of IHg in P. distichum for the Hg contaminated area being 18.9 times higher than Echinochloa crusgalli, 37.4 times higher than Acorus tatarinowii, 72.1 times higher than Emilia sonchifolia, and 14.8 times higher than Alternanthera philoxeroides. The BAF of MeHg in P. distichum was 3.2 times higher than Echinochloa crusgalli, 4.2 times higher than Acorus tatarinowii, 40.2 times higher than Emilia sonchifolia, and 3.5 times higher than Alternanthera philoxeroides. The accumulation capability of total Hg in P. distichum for the Hg contaminated area was 11.1 times higher than in a non-contaminated area and for MeHg 3.3 times higher than in the non-contaminated area. Also the presence of Se showed less Hg in roots of aquatic plants meaning selenium could inhibit the accumulation of Hg by aquatic plants, although the correlation between Hg and Se in roots were not significantly correlated (P>0.05). Therefore, Paspalum distichum could be used as a potential species to uptake Hg from Hg contaminated rivers.
-
Key words:
- environmental chemistry /
- aquatic plants /
- selenium /
- methyl mercury /
- Paspalum distichum
-
表 1 不同植物组织中无机汞质量分数
Table 1. IHg concentrations in different plant tissues
序号 采样点位置 w无机汞/(ng·g-1) w无机汞/(ng·g-1) 空心莲子草 双穗雀稗 一点红 石菖蒲 稗草 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 果实 1 仇溪上游 72.900 7.660 47.800 95.300 20.500 59.400 3.620 32.700 30.700 9.450 44.300 8.160 2 仇溪上游 8.620 13.500 63.600 3.840 16.800 24.100 9.900 1.220 61.000 54.900 3 仇溪上游 285.000 14.600 55.600 15.600 139.000 63.900 41.300 4 仇溪上游 187.000 82.100 17.500 2.640 5 仇溪上游 6 仇溪上游 110.000 3.710 40.100 11.800 85.600 15.900 34.000 26.100 7 仇溪节能灯生产区 199.000 6.210 59.700 14.700 21.500 256.000 61.100 93.500 4.930 15.800 18.100 15.200 8 仇溪节能灯生产区 29.300 19.100 250.000 35 710.000 49.000 74.700 143.000 8.400 42.100 80.500 16.200 74.300 30.400 9 仇溪节能灯生产区 172.000 104.000 284.000 61.500 104.000 32.700 54.200 106.000 18.600 253.000 14.700 10 污水厂 45.900 8.430 89.400 19.200 39.900 17.200 494.000 28.300 39.100 9.650 11 猷溪上游 21.200 8.740 39.000 71.900 60.700 12 猷溪上游 67.800 2.470 13 猷溪上游 32.400 86.800 33.300 39.900 9.770 210.000 8.580 39.500 14 猷溪节能灯生产区 648.000 34.400 47.000 548.000 48.400 54.400 270.000 93.400 82.600 15 猷溪节能灯生产区 665.000 385.000 852.000 2 091.000 117.000 465.000 24.200 82.900 1 038.000 43.300 253.000 35.800 16 猷溪节能灯生产区 1 038.000 131.000 130.000 800.000 28.700 62.700 92.600 46.300 38.900 96.200 38.400 16.200 44.700 9.330 表 2 不同植物组织中甲基汞质量分数
Table 2. MeHg concentrations in different plant tissues
序号 采样点位置 w甲基汞/(ng·g-1) w甲基汞/(ng·g-1) 空心莲子草 双穗雀稗 一点红 石菖蒲 稗草 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 果实 1 仇溪上游 2.270 1.480 1.320 1.460 1.150 0.160 0.332 1.230 0.924 0.524 0.253 0.245 1.030 0.300 0.475 0.438 2 仇溪上游 0.806 0.292 0.727 4.630 3.570 2.250 1.610 1.800 4.250 2.980 1.380 3 仇溪上游 13.100 2.330 1.530 4.190 0.628 0.511 0.241 4 仇溪上游 1.560 0.230 1.330 1.650 0.321 0.077 0.516 0.584 0.849 1.550 0.226 5 仇溪上游 6 仇溪上游 5.170 5.440 17.000 7.280 3.140 1.340 29.000 10.900 10.400 14.300 7 仇溪节能灯生产区 7.730 2.760 1.870 2.440 1.710 0.547 3.990 1.220 1.090 3.590 1.840 1.140 8 仇溪节能灯生产区 4.740 3.240 6.120 33.200 1.980 1.210 0.209 0.267 0.939 5.430 0.942 0.408 0.428 9 仇溪节能灯生产区 8.010 7.560 14.000 4.890 2.330 0.397 0.529 17.000 3.870 4.500 3.880 10 污水厂 1.820 0.285 0.241 0.765 0.654 1.390 17.200 4.350 1.760 4.390 11 猷溪上游 0.226 0.136 0.076 12 猷溪上游 5.930 0.463 1.830 0.082 0.802 0.707 13 猷溪上游 8.420 0.816 1.470 4.030 2.420 0.844 2.390 11.600 3.110 1.110 14 猷溪节能灯生产区 15.900 1.550 4.870 32.800 4.520 1.130 7.440 5.320 1.770 15 猷溪节能灯生产区 10.200 9.540 0.018 46.300 2.110 2.690 0.621 0.851 6.630 0.527 1.420 0.511 16 猷溪节能灯生产区 6.490 3.150 4.490 31.100 7.940 4.950 0.872 0.451 0.522 1.080 1.490 0.522 3.310 表 3 各水草根对不同形态汞的富集系数关系
Table 3. Bioaccumulation factor of different speciation mercury in aquatic plants from mercury contamination sites and nonmercury contamination sites
水草种类 汞的种类 未污染地富集系数 污染地富集系数 污染地与未污染地的比率/% 双穗雀稗根 总汞 0.574 6.400 11.100 总汞 1.470 0.338 0.200 稗草根 总汞 0.671 0.171 0.300 总汞 1.070 0.431 0.400 石菖蒲根 甲基汞 15.600 8.400 0.500 甲基汞 8.800 29.100 3.300 空心莲子草根 甲基汞 13.200 8.970 0.700 甲基汞 6.070 6.880 1.100 说明:生物富集系数指化学物质在生物体内的积累指标 表 4 不同植物组织中硒质量分数分布
Table 4. Selenium concentration in different plant tissues
序号 采样点位置 w硒/(mg·kg-1) w硒/(mg·kg-1) 空心莲子草 双穗雀稗 一点红 石菖蒲 稗草 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 根 茎 叶 果实 1 仇溪上游 0.298 1.280 23.200 6.210 1.280 0.221 6.020 4.570 2.450 2.340 10.600 5.770 4.780 3.230 2 仇溪上游 7.510 13.700 4.240 5.090 7.150 1.330 4.530 7.360 3 仇溪上游 10.600 2.570 1.950 2.130 8.300 5.820 4 仇溪上游 12.100 9.410 6.690 5.370 4.440 2.080 7.580 4.850 6.660 5 仇溪上游 6 仇溪上游 7.480 3.880 7.650 2.860 7.110 4.890 6.050 7.810 7 仇溪节能灯生产区 8.580 7.900 4.210 5.330 6.650 5.620 0.702 2.280 6.910 1.000 5.680 8 仇溪节能灯生产区 2.880 2.450 5.960 3.070 3.410 1.590 5.340 7.140 3.480 0.177 8.310 4.780 9 仇溪节能灯生产区 1.950 2.570 7.750 3.490 9.620 5.570 6.200 7.810 10 污水厂 2.310 1.720 2.910 1.310 3.460 5.950 1.080 11 猷溪上游 5.180 4.960 6.440 12 猷溪上游 9.230 3.540 6.870 6.110 7.420 3.560 13 猷溪上游 2.510 5.980 6.540 8.390 3.580 2.430 5.400 2.660 14 猷溪节能灯生产区 2.920 6.680 3.150 10.300 5.940 15 猷溪节能灯生产区 4.750 3.990 4.920 2.520 4.440 6.640 4.310 4.930 6.610 16 猷溪节能灯生产区 2.290 6.450 5.550 11.600 2.680 11.400 10.700 5.980 2.310 1.780 -
[1] 冯新斌, 仇广乐, 付学吾, 等.环境汞污染[J].化学进展, 2009, 21(2/3):436-457. FENG Xinbin, QIU Guangle, FU Xuewu, et al. Mercury pollution in the environment[J]. Progr Chem, 2009, 21(2/3):436-457. [2] MENG Bo, FENG Xinbin, QIU Guangle, et al. The process of methylmercury accumulation in rice (Oryza sativa L.)[J]. Environ Sci Technol, 2011, 45(7):2711-2717. [3] WADE T L, SWEET S T, KLEIN A G. Assessment of sediment contamination in Casco Bay, Maine, USA[J]. Environ Pollut, 2008, 152(3):505-521. [4] 李怒云, 龙怀玉.植树造林与21世纪我国盐渍土开发利用的关系[J].北京林业大学学报, 2000, 22(3):99-100. LI Nuyun, LONG huaiyu. Trees planting and the development and utilization of saline soil areas[J]. J Beijing For Univ, 2000, 22(3):99-100. [5] 中华人民共和国环境保护部.环境保护部和国土资源部发布全国土壤污染状况调查公报[EB/OL]. (2017-03-21)2014-04-17. http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm. [6] MORENO-JIMÉNEZ E, GAMARRA R, CARPENA-RUIZ R O, et al. Mercury bioaccumulation and phytotoxicity in two wild plant species of Almadén area[J]. Chemosphere, 2006, 63(11):1969-1973. [7] QIU Guangle, FENG Xinbin, LI Ping, et al. Methylmercury accumulation in rice (Oryza sativa L.) grown at abandoned mercury mines in Guizhou, China[J]. J Agric Food Chem, 2008, 56(7):2465-2468. [8] 骆永明.污染土壤修复技术研究现状与趋势[J].化学进展, 2009, 21(2/3):558-565. LUO Yongming. Current research and development in soil remendiation technologies[J]. Progr Chem, 2009, 21(2/3):558-565. [9] HORVAT M, NOLDE N, FAJON V, et al. Total mercury, methylmercury and selenium in mercury polluted areas in the province Guizhou, China[J]. Sci Total Environ, 2003, 304(1):231-256. [10] RODRÍGUEZ L, RINCON J, ASENCIO I, et al. Capability of selected crop plants for shoot mercury accumulation from polluted soils:phytoremediation perspectives[J]. Int J Phytoremed, 2007, 9(1):1-13. [11] 龙育堂, 刘世凡, 熊建平, 等.苎麻对稻田土壤汞净化效果研究[J].农业环境保护, 1994, 13(1):30-33. LONG Yutang, LIU Shifan, XIONG Jianping, et al. Study on the effect of ramie on the purification of mercury in paddy soil[J]. Agro-Environ Prot, 1994, 13(1):30-33. [12] MENG Mei, LI Bing, SHAO Junjuan, et al. Accumulation of total mercury and methylmercury in rice plants collected from different mining areas in China[J]. Environ Pollut, 2014, 184(1):179-186. [13] LIU Jinling, FENG Xinbin, QIU Guangle, et al. Prediction of methyl mercury uptake by rice plants (Oryza sativa L.) using the diffusive gradient in thin films technique[J]. Environ Sci Technol, 2012, 46(20):11013-11020. [14] 赵甲亭, 李云云, 高愈希, 等.贵州万山汞矿地区耐汞野生植物研究[J].生态毒理学报, 2014, 9(5):881-887. ZHAO Jiating, LI Yunyun, GAO Yuxi, et al. Study of mercury resistant wild plants growing in the mercury mine area of Wanshan District, Guizhou Province[J]. Asian J Ecotox, 2014, 9(5):881-887. [15] 王明勇, 乙引.一种新发现的汞富集植物:乳浆大戟[J].江苏农业科学, 2010(2):354-356. WANG Mingyong, YI Yin. A newly discovered mercury enrichment plants of Euphorbia esula Linn.[J]. Jiangsu Agric Sci, 2010(2):354-356. [16] 徐小蓉.万山汞矿区耐汞植物筛选及耐性机理研究[D].贵阳: 贵州师范大学, 2008. XU Xiaorong. The Selection of Hg-Tolerance Plants and the Study of the Tolerance Mechanisms in the Wanshan Mine[D]. Guiyang: Guizhou Normal University, 2008. [17] ZHANG Hua, FENG Xinbin, ZHU Jianming, et al. Selenium in soil inhibits mercury uptake and translocation in rice (Oryza sativa L.)[J]. Environ Sci Technol, 2012, 46(18):10040-10046. [18] 杜式华, 于志洁.汞与硒在植物体内的相互作用[J].环境科学, 1987, 8(6):43-46, 77. DU Shihua, YU Zhijie. The interaction of mercury and selenium in plants[J]. J Environ Sci, 1987, 8(6):43-46, 77. [19] THANGAVEL P, SULTHANA A S, SUBBURAM V. Interactive effects of selenium and mercury on the restoration potential of leaves of the medicinal plant Portulaca oleracea Linn.[J]. Sci Total Environ, 1999, 243/244(1):1-8. [20] 张华, 冯新斌, 王祖光, 等.硒汞相互作用及机理研究进展[J].地球与环境, 2013, 41(6):696-708. ZHANG Hua, FENG Xinbin, WANG Zuguang, et al. Advances in research on the mechanism of selenium-mercury interactions[J]. Earth Environ, 2013, 41(6):696-708. [21] LIANG Peng, FENG Xinbin, ZHANG Chan, et al. Human exposure to mercury in a compact fluorescent lamp manufacturing area:by food (rice and fish) consumption and occupational exposure[J]. Environ Pollut, 2015, 198(1):126-132. [22] USEPA. Method 1630: Methylmercury in Water by Distillation, Aqueous Ethylation, Purge and Trap, and CVAFS (EPA-821-R-01-020)[R]. Washington D C: United States Environmental Protection Agency, 2001. [23] USEPA. Method 1631: Mercury in Water by Oxidation, Purge and Trap, and Cold Vapor Atomic Fluorescence Spectrometry (EPA 821-R-02-019)[R]. Washington D C: United States Environmental Protection Agency, 2002 -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2018.05.001







 下载:
下载: