-
植物胚性感受态为植物细胞或组织脱分化能力或潜力,胚性感受态的高低直接决定了植物体细胞胚诱导的难易程度[1]。研究发现,大多数植物的组织或细胞维持高水平胚性感受态的时间极短[2-3]。胚性感受态水平的高低与基因型、外植体的取材部位、生理学年龄等密切相关[4]。在黑核桃Juglans nigra中,授粉后3~4周的幼胚开始具有体胚发生能力,授粉后6~7周时幼胚体胚发生频率最高,此后,体胚发生能力逐渐下降[5]。在梨Pyrus中,具有胚性感受态的时间极短,只有当梨幼胚发育期为鱼雷胚至子叶胚时,才有少量体胚的诱导与发生[6]。榧树Torreya grandis隶属于裸子植物红豆杉科Taxaceae榧属Torreya常绿乔木。香榧Torreya grandis ‘Merrillii’是实生榧树中优良变异类型或优株经人工嫁接繁殖而成的优良品种,为中国特有的珍稀干果和木本油料植物,具有重要的经济、社会和生态价值[7]。由于传统嫁接繁殖难以满足目前市场的巨大需求,近年来,研究人员开展了香榧植株体胚发生及再生体系的建立等研究[8-11]。但由于缺乏对香榧种子内幼胚发育过程及体胚诱导及发生规律的深入了解,导致其体胚发生及再生体系难以稳定,有效繁殖系数低。本研究以不同发育阶段的香榧幼胚为外植体,开展胚性愈伤组织及体细胞胚诱导研究,通过对不同发育时期来源的幼胚进行诱导率分析,同时辅以幼胚内源激素的变化规律,拟阐明香榧幼胚发育状态与其胚性感受态之间的相关性,为建立香榧稳定、高效体胚发生及植株再生体系提供良好的技术平台,同时也为后期香榧遗传转化体系的建立打下良好的基础。
-
于2014年7月5日至8月23日,选取浙江农林大学试验基地中良好的香榧植株(图 1A)。香榧种子于5月10日突破种鳞,以此日期为起点计算,即种子突破种鳞后第8周至第15周(以下简称第8周至第15周),分8次采集发育正常、大小适中的种子带回实验室待处理。
-
将8次采集的香榧种子用解剖刀去除香榧种子的假种皮,放入添加洗涤剂的清水中搓洗数次并漂洗干净,在自来水流水下冲洗1~2 h后用吸水纸将种子表面水分吸干。在超净工作台上用体积分数为75%乙醇表面灭菌处理好的香榧种子3 min,无菌水冲洗3~4次,再用稀释10倍的次氯酸钠(NaClO)溶液(每50 mL加1滴吐温)真空抽滤20 min,无菌水冲洗5~6次,无菌吸水纸吸干种子表面水分后等用。用无菌修枝剪从表面灭菌后的种子顶端(俗称榧眼端)纵向剪开,在体视显微镜(Zeiss Stereo Discovery V12)下用解剖针剥取完整幼胚,待用。
-
将8个不同发育时期的香榧幼胚(每次剥取0.2 g左右),立即用液氮速冻,放入-70 ℃的低温冰箱内以备内源激素质量分数测定。内源激素质量分数测定时每0. 1 g样品加入1 mL内含1 mmol·L-1二叔丁基对甲苯酚的80%甲醇提取液,弱光下冰浴研磨冰冻鲜样成匀浆,转入离心管中,再用1 mL提取液分次冲洗研钵,一并转入离心管中。4 ℃下提取4 h,1 000 g离心15 min取上清液,残渣加入1 mL提取液4 ℃下提取1 h,合并上清液。上清液过18C固相萃取柱后,用氮气吹干。过柱后的样品用pH 7.4的磷酸缓冲液溶解后,将样品甲脂化,即用氮气吹干,之后再用甲醇溶解,在冰浴条件下加过量的重氮甲烷反应至黄色,10 min后加半滴0.2 mol·L-1乙酸甲醇破坏过量的重氮甲烷(黄色消失),用氮气吹干,磷酸缓冲液溶解后进行酶联吸附法(ELSA)测定ABA和IAA质量分数(分母为幼胚鲜质量)。每个处理重复3次。
-
将8个不同发育时期的香榧幼胚取出后,接种在胚性愈伤组织及体胚诱导培养基中。培养基成分如下:①以1/2 SH为基本培养基[12],附加0.1 mg·L-1萘乙酸(NAA),2 g·L-1活性碳,30 g·L-1蔗糖;②1/2 SH基本培养基,附加0.1 mg·L-1 NAA,0.5 g·L-1谷氨酰胺,2 g·L-1活性碳,30 g·L-1蔗糖;③1/2 SH基本培养基(对照)。培养基附加4 g·L-1琼脂,pH 5.7,暗培养。每处理接种20个幼胚,重复3次。
-
每天观察幼胚生长情况,当幼胚暗培养4周时,在体视显微镜下观察胚性愈伤组织、体胚诱导以及幼胚萌发情况,统计各处理下胚性愈伤组织诱导率、体胚发生率以及幼胚直接萌发率。实验数据采用SigmaPlot 8.0和SPSS 17.0进行统计分析,Duncan新复极差检验法进行多重比较。
-
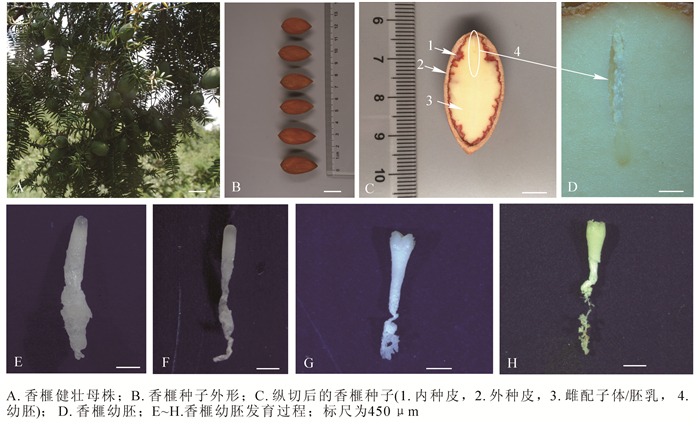
观察发现,成熟的香榧种子具假种皮,绿色纤维质(图 1A)。剥去假种皮,可见棕褐色外种皮,坚硬木质化(图 1B,图 1C箭头2所示)。内种皮暗红色,褶皱膜质,内陷成脊状(图 1C,箭头1所示)。胚乳单倍体,乳白色,为主要可食用部位(图 1C,箭头3所示)。香榧幼胚位于种子榧眼端雌配子体腔内,细小不明显(图 1C,椭圆所示,图 1D),幼胚胚体和胚柄系统相连,胚柄系统靠近珠孔端,胚头部远离珠孔端。香榧胚发育经历多胚时期、胚胎选择时期和优势胚完全发育等3个时期。通过胚胎选择,多个香榧幼胚最后仅有1个发育较好,其他幼胚在不同发育阶段终止发育而萎缩。香榧早期幼胚为棒状(图 1E, F),随着幼胚发育成熟,头部逐渐膨大,直至子叶展开,胚柄萎缩脱落(图 1G,H)。
-
不同发育时期香榧幼胚的内源IAA及ABA质量分数具显著性差异(P<0.05)。香榧幼胚内源IAA的质量分数在胚珠突破种鳞后第8周处于最大值,达53.90 ng·g-1,第9周稍有下降,但与第8周之间无显著性差异,之后迅速下降至44.14 ng·g-1。随着胚龄的逐渐增加,内源IAA质量分数总体呈小幅波动的下降趋势,第15周最低,为35.60 ng·g-1(图 2)。

图 2 香榧幼胚胚龄对其内源IAA及ABA质量分数的影响
Figure 2. Effect of developmental stages on endogenous IAA and ABA content of immature embryo in Torreya grandis 'Merrillii'
香榧幼胚内源ABA质量分数的测定结果表明:幼胚胚龄对其内源ABA的质量分数同样具有显著影响(P<0.05)。在种鳞突破种皮后的第8至第15周内,随着胚龄的增加,内源ABA质量分数呈先下降后上升的总趋势,其中第8周至第10周,内源ABA质量分数先下降后上升,但变化幅度比较小;第10周到第12周处于快速上升期,从第10周的89.80 ng·g-1上升到第12周的144.67 ng·g-1;第13至15周内源ABA处于变化平缓期,且维持在较高水平,其中第14周和第15周内源ABA质量分数无显著差异,第15周达到最大值,为160.20 ng·g-1(图 2)。
-
不同发育阶段香榧幼胚的胚性感受态具显著差异;同时,不同离体培养条件对香榧幼胚的胚性感受态激发也有显著差异(表 1,图 3,图 4)。将香榧幼胚接种于1/2 SH基本培养基中培养,当幼胚胚龄较小时,可产生极少量胚性愈伤组织,但从第10周开始,胚性愈伤组织诱导率均为0,但各胚龄幼胚均未诱导直接产生体胚。将幼胚接种于附加0.1 mg·L-1NAA的1/2 SH基本培养基上培养,随着幼胚胚龄的增加,胚性愈伤组织诱导率先上升后下降,其中第8周幼胚的胚性愈伤组织诱导率为48.1%,第9周时略有升高,达到最高值,为48.3%,随后逐渐下降,第14至第15周胚性愈伤组织诱导率为0;将香榧幼胚置于1/2 SH基本培养基附加0.1 mg·L-1NAA的培养基中培养,随着胚龄的增加,诱导率也呈先上升后下降的趋势,第8周体胚诱导率为0,第9周体胚诱导率上升为5.8%,至第10周体胚诱导率达到最高,为42.7%,后随着胚龄的增加,体胚诱导率逐渐下降,第14周至第15周体胚诱导率为0(图 3)。
表 1 胚龄及萘乙酸对香榧幼胚胚性感受态的影响
Table 1. Effect of developmental stages and NAA on embryo genic frequency of Torreya grandis 'Merrillii' immature embryo
处理 ρ萘乙酸/(mg·L-1) 胚珠突破种鳞/周 胚性愈伤组织诱导率/% 体胚直接发生率/% 幼胚萌发率/% 1 0 8 5.1 ± 0.8 e 0f 0 k 2 0.1 43.1 ± 0.3 b 0f 0 k 3 0 9 1.2 ± 0.1 f 0f 0 k 4 0.1 48.3 ± 2.6 a 5.8 ± 0.7 e 0 k 5 0 10 0g 0f 5.4 ± 0.8 j 6 0.1 47.4 ± 1.5 ab 42.7 ± 1.3 a 0k 7 0 11 0g 0f 9.8 ± 2.5 P 8 0.1 30.1 ± 0.9 c 39.3 ± 0.2 b 7.2 ± 0.9 i 9 0 12 0g 0f 21.3 ± 1.8 d 10 0.1 13.5 ± 1.1 d 18.6 ± 2.1 c 15.2 ± 1.3 g 11 0 13 0g 0f 44.2 ± 2.4 c 12 0.1 2.1 ± 0.3 f 7.7 ± 0.1 d 19.7 ± 0.7 f 13 0 14 0g 0f 65.1 ± 1.2 a 14 0.1 0g 0f 20.9 ± 0.5 de 15 0 15 0g 0f 63.7 ± 0.9 b 16 0.1 0g 0f 20.3 ± 2.8 ef 
图 3 胚龄对胚性愈伤组织及体胚直接发生的影响
Figure 3. Effect of immature embryo developmental stages on embryogenic callus induction and direct somatic embryogenesis (SH+0.1 mg·L-1 NAA)

图 4 胚龄及培养条件对香榧幼胚萌发的影响
Figure 4. Effect of immature embryo developmental stages and media on in vitro germination
第8周至第15周的幼胚进行离体萌发试验发现,不同外植体发育阶段及培养条件对萌发率具有显著影响(图 4)。将幼胚培养于1/2 SH基本培养基中,萌发率随着胚龄的增加而升高,第8周至第9周幼胚萌发率为0,从第10周开始,萌发率逐渐上升,第14周时达最高值,为65.1%,之后略有下降。而当幼胚培养于附加0.1 mg·L-11/2 SH培养基NAA中进行萌发培养时,香榧幼胚极易产生愈伤组织而不能正常萌发形成有效苗(图 5)。
-
体细胞胚胎发生在植物组织培养过程中,外植体材料的基因型、发育阶段以及生理状态等决定了其胚性感受态的强弱。对于多数植物来说,特定阶段幼胚的胚性感受态明显强于其他阶段[13]。目前,已有多种裸子植物经诱导成功获得了体细胞胚[14]。与被子植物不同,裸子植物体细胞胚诱导对外植体的要求更加严格,一般情况下,以胚性感受态较高的幼胚为外植体进行体胚诱导。如,在火炬松Pinus taeda,华北落叶松Larix principis-rupprechtii等针叶树,需采用各发育阶段的幼胚为外植体进行体胚诱导[15-19]。除此以外,部分研究还采用了未成熟的雌配子体为外植体成功获得了体细胞胚[20-22]。本研究采用香榧胚珠突破种鳞后第8~15周的幼胚为外植体,第9周幼胚胚性愈伤组织诱导率最高,达54.3%,第11周幼胚的体胚直接发生率最高,达48.4%,表明不同发育时期对香榧幼胚胚性感受态具显著影响。然而,尽管幼胚在某些阶段(如子叶胚早期、子叶胚晚期等)具有良好的胚性感受态,但对于绝大多数植物来说,植物组织由于幼胚胚性感受态表现出的细胞全能性仍需要合适的条件下才能受到激发。本研究中将香榧幼胚培养于附加0.1 mg·L-1 NAA的SH基本培养基时,无论是胚性愈伤组织诱导率还是体细胞胚直接发生率,都显著高于在SH基本培养基中的诱导结果,说明香榧幼胚胚性感受态也需要特定条件(外源NAA)激发。
幼胚胚性感受态需在特定条件下才能被激活的现象与植物幼胚体的生理状态密切相关[18, 23]。植物的内源激素是影响组织胚性感受态的最重要因素之一。以香雪兰Freesia refracta花序为外植体进行体细胞胚诱导,花序的形态学上端无体细胞形成,而下端可分化出体细胞胚。检测结果表明,体细胞胚诱导前的花序形态学上下两端内源IAA质量分数无明显差别,但培养后形态学下端(体细胞胚发生端)IAA质量分数明显高于上端,表明内源IAA质量分数是香雪兰花序诱导产生体细胞胚的主导因子之一[24]。本研究第8周至第11周幼胚的内源IAA质量分数较高,此时极易诱导胚性愈伤组织或体细胞胚,说明高质量分数内源IAA可能提高幼胚的胚性感受态,使幼胚易于受外源激素诱导并脱分化。现有研究表明,ABA对于植物胚的正常发育和防止早萌具有重要作用[25]。不仅如此,ABA对胚发育调节作用与胚的发育程度有关,果针入土后10 d的花生幼胚,在无外源植物生长调节物质的培养基中能够正常发育,而果针入土后20 d的花生幼胚需要越来越高的外源ABA维持才能正常发育[26]。本研究中香榧幼胚第8~11周幼胚内源ABA质量分数较低,此时幼胚的胚性感受态较高,随着胚龄增加,ABA质量分数快速上升并维持在较高水平,但幼胚胚性感受态逐渐降低,可能与ABA可以促进香榧胚胎发育成熟有关,此现象与一定质量分数ABA促进华北落叶松、云杉Picea等裸子植物体胚成熟相似[19, 27]。
综上所述,香榧第8~12周幼胚具有较高的胚性感受态,同时,通过对幼胚内源激素的测定,对维持外植体高胚性感受态,开展香榧胚性愈伤组织及体胚发生培养条件的筛选提供了技术指导。香榧幼胚发育状态与胚性感受态之间的相关性是以幼胚为外植体进行胚性愈伤组织及体细胞胚的重要环节。由此掌握精确幼胚取样时间,准确采样,极大缩短体细胞胚诱导及培养的周期,大大降低培养成本,可为香榧遗传转化体系的建立提供良好的技术平台。
Immature embryo development and embryogenic frequency in Torreya grandis 'Merrillii'
-
摘要: 以突破种鳞第8周至第15周种子的香榧Torreya grandis ‘Merrillii’幼胚为外植体,研究了香榧幼胚胚龄、生长素等对香榧胚性愈伤组织以及体细胞胚直接发生的影响,筛选出高胚性感受态的香榧幼胚胚龄,并根据幼胚内源吲哚乙酸(IAA)和脱落酸(ABA)质量分数检测结果,初步确定了高胚性感受态的香榧幼胚生理特点。结果表明:在SH附加0.1 mg·L-1 NAA培养基中培养,第9周幼胚的胚性愈伤组织发生率最高,为48.3%,第10周幼胚的体胚直接发生率最高,为42.7%;而培养于SH基本培养基中的第14周幼胚直接萌发率最高,为65.1%。香榧不同胚龄幼胚内源ABA及IAA质量分数检测结果表明:不同发育时期香榧幼胚的内源IAA及ABA质量分数具显著差异(P < 0.05)。其中香榧第8周幼胚内源IAA的质量分数最高,为53.90 ng·g-1,随着胚龄的逐渐增加,内源IAA质量分数呈下降趋势,第15周内源IAA质量分数最低,为35.60 ng·g-1。内源ABA质量分数随着胚龄的增加呈先缓慢下降,再快速上升,后下降,其中第15周达到最大值,为160.20 ng·g-1。通过对香榧幼胚离体培养及内源激素的测定,发现香榧第8~12周幼胚具有较高的胚性感受态。该研究结果对维持香榧幼胚高胚性感受态,开展香榧胚性愈伤组织及体胚发生培养条件的优化提供了技术指导。Abstract: To obtain high embryogenic frequency in the immature embryo developmental stage, immature embryos of Torreya grandis 'Merrillii' from seeds (8 to 15 weeks after ovule breakthrough from the scales) were sampled as explants to optimize the best developmental stage for somatic embryogenesis. Endogenous Indole-3-acetic Acid (IAA) and Abscisic Acid (ABA) of immature embryos were also analyzed using enzyme-linked immunosorbent assay (ELISA) method. Results showed that the embryogenic callus frequency (up to 48.3%) and direct somatic embryogenesis frequency (up to 42.7%) were highest with immature embryos from seeds at 9 weeks after scale breakthrough on Schenk and Hilderbrandt (SH) basal medium supplemented with 0.1 mg·L-1 1-Naphthaleneacetic acid (NAA). In vitro germination frequency was highest (up to 65.1%) with immature embryos from seeds at 14 weeks after scale breakthrough. Significant differences (P < 0.05) among development stages of different immature embryos were found. With the development of immature embryos, endogenous IAA decreased gradually being highest with immature embryos from seeds at 8 weeks after scale breakthrough[up to 53.90 ng·g-1 fresh weight (FW)]. Meanwhile, endogenous ABA initially decreased followed by a rapid increase with the highest content being 160.20 ng·g-1 FW for immature embryos from seeds at 15 weeks after scale breakthrough. This study revealed that with immature embryos of seeds from 8 to 12 weeks, embryogenic frequency was high which could help optimize embryogenic callus induction and somatic embryo genesis in Torreya grandis 'Merrillii'.
-
表 1 胚龄及萘乙酸对香榧幼胚胚性感受态的影响
Table 1. Effect of developmental stages and NAA on embryo genic frequency of Torreya grandis 'Merrillii' immature embryo
处理 ρ萘乙酸/(mg·L-1) 胚珠突破种鳞/周 胚性愈伤组织诱导率/% 体胚直接发生率/% 幼胚萌发率/% 1 0 8 5.1 ± 0.8 e 0f 0 k 2 0.1 43.1 ± 0.3 b 0f 0 k 3 0 9 1.2 ± 0.1 f 0f 0 k 4 0.1 48.3 ± 2.6 a 5.8 ± 0.7 e 0 k 5 0 10 0g 0f 5.4 ± 0.8 j 6 0.1 47.4 ± 1.5 ab 42.7 ± 1.3 a 0k 7 0 11 0g 0f 9.8 ± 2.5 P 8 0.1 30.1 ± 0.9 c 39.3 ± 0.2 b 7.2 ± 0.9 i 9 0 12 0g 0f 21.3 ± 1.8 d 10 0.1 13.5 ± 1.1 d 18.6 ± 2.1 c 15.2 ± 1.3 g 11 0 13 0g 0f 44.2 ± 2.4 c 12 0.1 2.1 ± 0.3 f 7.7 ± 0.1 d 19.7 ± 0.7 f 13 0 14 0g 0f 65.1 ± 1.2 a 14 0.1 0g 0f 20.9 ± 0.5 de 15 0 15 0g 0f 63.7 ± 0.9 b 16 0.1 0g 0f 20.3 ± 2.8 ef -
[1] 由香玲, 谭啸, 戴金玲, 等.胁迫诱导植物体细胞发生的研究进展[J].西北植物学报, 2010, 30(9):1929-1934. YOU Xiangling, TAN Xiao, DAI Jinling, et al. Progress on the stress induction of plant somatic embryogenesis[J]. Acta Bot Boreal-Occident Sin, 2010, 30(9):1929-1934. [2] ARNOLD S, SABALA I, BOZHKOV P, et al. Developmental pathways of somatic embryogenesis[J]. Plant Cell, Tissue Organ Cult, 2002, 69(3):233-249. [3] GUAN Yuan, LI Shuigen, FAN Xiaofen, et al. Application of somatic embryogenesis in woody plants[J]. Front Plant Sci, 2016, 7:938. doi:10.3389/fpls. 2016. 00938. [4] NIC-CAN G I, GALAZ-ÁVALOS R M, DE-LA-PEÑA C, et al. Somatic embryogenesis:identified factors that lead to embryogenic repression:a case of speciesof the same genus[J]. PLoS One, 2015. doi:10.1371/journal.pone. 0126414. [5] 汤浩茹, 王永清, 任正隆.核桃体细胞胚发生与转基因研究进展[J].林业科学, 2000, 36(3):102-110. TANG Haoru, WANG Yongqing, REN Zhenglong. An overview of progress on somatic emrbyogenesis and transformation in walnut[J]. Sci Silv Sin, 2000, 36(3):102-110. [6] 刘淑芳, 续海红.不同发育期梨胚的再生能力[J].江苏农业科学, 2012, 40(7):63-64. LI Shufang, XU Haihong. Regeneration frequency of embryo in different developmental stages[J]. Jiangsu Agric Sci, 2012, 40(7):63-64. [7] 黎章矩, 戴文圣.中国香榧[M].北京:科学出版社, 2007. [8] 姜新兵, 陈力耕, 何新华.香榧体细胞胚发生的研究[J].园艺学报, 2004, 31(5):654-656. JIANG Xinbing, CHEN Ligeng, HE Xinhua. Studies on the somatic embryogenesis of Torreya grandis[J]. Acta Hortic Sin, 2004, 31(5):654-656. [9] 刘海琳, 陈立耕, 童品璋, 等.香榧茎段离体培养再生植株的研究[J].果树学报, 2007, 24(4):477-482. LIU Hailin, CHEN Ligeng TONG Pinzhang, et al. In vitro organogenesis and plant regeneration from stem segments of Torreya grandis[J]. J Fruit Sci, 2007, 24(4):477-482. [10] 姚进, 黄坚钦, 胡恒康, 等.香榧体细胞胚发生的初步研究[J].浙江农林大学学报, 2013, 30(1):129-135. YAO Jin, HUANG Jianqin, HU Hengkang, et al. Somatic emryogenesis of Torreya grandis 'Merrillii'[J]. J Zhejiang A & F Univ, 2013, 30(1):129-135. [11] 项伟波, 赵金凯, 吴家胜, 等.香榧体细胞胚发生、发育的形态与细胞学观察[J].园艺学报, 2015, 42(8):1477-1486. XIANG Weibo, ZHAO Jinkai, WU Jiasheng, et al. Morphological and cytological observation of somatic emryogenesis and development in Torreya grandis 'Merrillii'[J]. Acta Hortic Sin, 2015, 42(8):1477-1486. [12] SCHENK T, SCHENK R U, HILDEBRANDT A C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures[J]. Can J Bot, 1972, 50(1):199-204. [13] 盛德策, 李凤兰, 刘忠华.植物体细胞胚发生的细胞生物学研究进展[J].西北植物学报, 2008, 28(1):204-215. SHENG Dece, LI Fenglan, LIU Zhonghua. Advances in the cytobiology of plant somatic embryogenesis[J]. Acta Bot Boreal-Occident Sin, 2008, 28(1):204-215. [14] STASOLLA C, YEUNG E C. Recent advances in conifer somatic embryogenesis:improving somatic embryo quality[J]. Plant Cell Tissue Organ Cult, 2003, 74(1):15-35. [15] NISKANEN A, LU J, SEITZ S, et al. Effect of parent genotype on somatic embryogenesis in Scots pine (Pinus sylvestris)[J]. Tress Physiol, 2004, 24(11):1259-1265. [16] LARA-CHAVEZ A, FLINN B S, EGERTSDOTTER U. Initiation of somatic embryogenesis from immature zygotic embryos of Oocarpa pine (Pinus oocarpa Schiede ex Schlectendal)[J]. Tree Physiol, 31(5):539-554. [17] PULLMAN G S, CHOPRA R, CHASE K M. Loblolly pine (Pinus taeda L.) somatic embryogenesis:improvements in embryogenic tissue initiation by supplementation of medium with organic acids, vitamins B12 and E[J]. Plant Sci, 2006, 170(3):648-658. [18] PULLMAN G S, ZENG X Y, COPELAND-KAMP B, et al. Conifer somatic embryogenesis:improvements by supplementation of medium with oxidation-reduction agents[J]. Tree Physiol, 2015, 35(2):1-16. [19] 齐力旺, 韩一凡, 李玲, 等.华北落叶松体细胞胚胎发生及遗传转化实验系统的建立[J].实验生物学报, 2000, 33(4):357-365. QI Liwang, HAN Yifan, LI Ling, et al. The somatic embryogenesis and establishment of transformation experiment system in Larix principis-rupprechth[J]. Acta Biol Exp Sin, 2000, 33(4):357-365. [20] KROGSTRUP P. Embryolike structures from cotyledons and ripe embryos of Norway spruce (Picea abies)[J]. Can J For Res, 1986, 16(3):664-668. [21] LELU-WALTER MA, BERNIER-CARDOU M, KLIMASZEWSKA K. Clonal plant production from self-and cross-pollinated seed families of Pinus sylvestris L. through somatic embryogenesis[J]. Plant Cell Tiss Org Cult, 2008, 92(1):31-45. [22] BECWAR M R, NAGMANI R, WANN S R. Initiation of embryogenic cultures and somatic embryo development in loblolly pine (Pinus taeda)[J]. Can J For Res, 1990, 20(6):810-817. [23] ZHANG Qixiang, HU Hengkang, HUANG Youjun, et al. The relationship between developmental stages of zygotic embryos at explanting and embryogenic frequency on hickory (Carya cathayensis Sarg.)[J]. Sci Hortic, 2012, 139:66-70. [24] 王丽, 鲍晓明, 黄百渠, 等.香雪兰外植体形态学极性决定的体细胞胚胎发生[J].植物学报, 1998, 40(2):138-143. WANG Li, BAO Xiaoming, HUANG Baiqu, et al. Somatic embryogenic potential determined by the morphological polarity of the explant in tissue cultures of Freesia refracta[J]. Acta Bot Sin, 1998, 40(2):138-143. [25] 王颖, 刘春朝, 陈秀兰. ABA促进针叶树体细胞胚胎分化[J].植物生理学通讯, 2002, 3(6):273-278. WANG Ying, LIU Chunzhao, CHEN Xiulan. Somatic embryogenesis in conifers by ABA[J]. Plant Physiol Commun, 2002, 3(6):273-278. [26] 林鹿, 傅家瑞. ABA对花生胚离体发育的调节[J].中国油料, 1996, 18(1):4-7. LIN Lu, FU Jiarui. Regulation by ABA on development of peanut embryos in vitro[J]. Chin Oil Sci, 1996, 18(1):4-7. [27] IRAQI D, TREMBLAY F M. The role of sucrose during maturation of black spruce (Picea mariana) and white spruce (Picea glauca) somatic embryos[J]. Physiol Plant, 2001, 111:381-388. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.2018.05.010







 下载:
下载: