-
夏蜡梅Sinicalycanthus chinensis为蜡梅科Calycanthaceae夏蜡梅属Sinocalycanthus落叶灌木,花型独特,观赏价值高,为中国特有珍稀野生花卉,属于国家二级保护植物[1]。同科蜡梅属Calycanthus植物光叶红蜡梅Calycanthus floridus var. glaucus为美国蜡梅C. floridus一变种,与美国蜡梅的区别主要是叶片、叶柄及幼枝无毛或近无毛。广泛的杂交有助于扩大植物的基因库[2], LASSEIGNE等[3]最早获得了夏蜡梅与美国蜡梅的属间杂种,并通过反复杂交和进一步回交选育出了不同花色的品种。夏蜡梅与光叶红蜡梅亲缘关系近,但在花被片形状、大小和颜色方面差别较大。夏蜡梅花大,有内、外两型花被片,外被片呈倒卵状椭圆形或倒卵形,白色、边缘淡紫红色,内被片肉质贝壳状,中部以上淡黄色、中部以下为黄白色并在腹面基部具淡紫红色斑点[4];光叶红蜡梅花褐紫色,具清香[5]。夏蜡梅与光叶红蜡梅花期均为每年的4—5月初夏时节。研究发现:夏蜡梅的主要传粉昆虫为蜂类,而光叶红蜡梅主要传粉昆虫为甲虫类[6]。植物花的特征涉及传粉生物与进化生态,传粉者对不同花部特征的偏好是近缘物种之间分离和分化的一种重要机制,尤其是花色的分化。花色进化的假设当中,“传粉者选择假说”受到大部分学者的支持,即传粉者对花色的选择性和偏向性导致物种之间花色不同[7]。花色的多样性是植物多样性中最为复杂的性状之一[8]。
广泛靶向代谢组学利用多反应监测(MRM)模型,定性、定量检测样本中代谢物含量,具有高效、高灵敏、高覆盖的特点[9−10]。因此,利用广泛靶向代谢组学对植物中花色素相关代谢产物进行鉴定与分析,可以深入解析植物不同花色形成的物质基础。鉴于此,本研究以夏蜡梅、光叶红蜡梅、光叶红蜡梅×夏蜡梅杂交后代为材料,比较杂交后代与双亲之间花色表型与代谢物之间的差异,并对差异代谢通路进行富集,为深入探究不同品种花色形成的分子机制提供参考。
-
材料为浙江农林大学平山试验基地种植的夏蜡梅、光叶红蜡梅、光叶红蜡梅(♀)×夏蜡梅(♂)杂交后代,共3组样品。
-
在相同的光源下,以白色A4纸为背景,用英国皇家园艺学会比色卡(RHSCC)与新鲜植物花瓣的花色进行比对,并记录对应数值。使用CR-10型便携式色差仪(日本柯尼卡美能达公司)测定花瓣颜色,根据所测明度(L*)、红度(a*)、黄度(b*),计算彩度(C*)和色相角(h),公式为:C*=(a*2+b*2)1/2,h=$ {\mathrm{t}\mathrm{a}\mathrm{n}}^{-1} $(b*/a*)。测量时,每个品种取3株不同个体上3朵盛开期的花朵(共9朵)置于白色A4纸上,以色差仪集光孔对准测量,其中夏蜡梅因其内外轮花瓣颜色不同,故对内外轮花瓣分开进行表型测定。每朵花测量5次取平均值。
-
3组样品分别取5株个体上生长发育一致的花混合,放入液氮速冻后于−80 ℃保存,用于代谢组分析,其中夏蜡梅采用的混合样品包括内轮和外轮花瓣,反映的是花器官整体的色素。将生物样品放置于冻干机(Scientz-100F)中真空冷冻干燥,然后利用研磨仪(MM 400,Retsch)研磨(30 Hz,90 s)至粉末状后称取100 mg的粉末,溶解于1.2 mL质量分数为70%的甲醇提取液中,每30 min涡旋1次,每次持续30 s,共涡旋6次,样本置于4 ℃冰箱过夜;待到离心(12 000 r·min−1,600 s)后,吸取上清,用微孔滤膜(0.22 μm孔径)过滤样品,并保存于进样瓶中,用于超高效液相色谱-串联质谱(UPLC-MS/MS)分析。
-
数据采集仪器系统主要包括超高效液相色谱(UPLC)和串联质谱(MS/MS)。
液相条件为:色谱柱为AgilentSB-C18 1.8 µm,2.1 mm×100.0 mm;流动相条件A相为超纯水(加入质量分数为0.1%的甲酸),B相为乙腈(加入质量分数为0.1%的甲酸);洗脱梯度的体积比在0 min时B相5%,9.00 min内B相体积比例线性增加到95%,并维持在95% 1.00 min,10.00~11.10 min时B相体积比降为5%,并以5%平衡至14.00 min;流速为0.35 mL·min−1;柱温为40 ℃;进样量为4 μL。
质谱条件为:离子源温度为550 ℃,涡轮喷雾;离子喷雾电压(IS) 5 500 V (正离子模式)/−4 500 V (负离子模式);离子源气体Ⅰ (GSⅠ)、气体Ⅱ (GSⅡ)和帘气(CUR)分别设置为0.345、0.414和0.172 MPa,碰撞诱导电离参数设置为高。在QQQ和LIT模式下分别用10和100 μmol·L−1聚丙二醇溶液进行仪器调谐和质量校准。QQQ扫描使用MRM模式,并将碰撞气体(氮气)设置为中等。
-
代谢物定性分析基于迈维生物技术有限公司的自建数据库(MWDB)、公共数据库代谢物信息和二级谱信息完成。利用三重四级杆质谱的多反应监测模式(MRM)对代谢物进行定量分析。不同样品代谢物数据利用软件Analyst 1.6.3处理后进行质谱定性定量分析。检测到的代谢物采用主成分分析(PCA)法分析。分别提取所有样品自变量与因变量中的成分,通过最小二乘判别分析(PLS-DA)计算成分间的相关性来寻找差异代谢物。利用差异倍数值(FC)来筛选差异代谢物。筛选log2FC≥2.0或log2FC≤0.5的代谢物为差异代谢物。最后利用京都基因和基因组数据库数据库(KEGG)对差异代谢物进行注释,并对注释结果按照KEGG数据库中通路类型进行分类和富集分析。
-
比色结果(表1)显示:光叶红蜡梅(186A)和杂交后代(N77A)的RHSCC相对较为接近,夏蜡梅外轮花瓣(76D)、夏蜡梅内轮花瓣(8B)与光叶红蜡梅和杂交后代的RHSCC差距相对较大。L*从0到100表示明度由暗到明的变化,结果显示L*由高到低依次为夏蜡梅外轮花瓣、夏蜡梅内轮花瓣、杂交后代、光叶红蜡梅。a*由负值到正值,代表绿色逐渐减弱、红色逐渐增强,结果显示杂交后代a*高于光叶红蜡梅,光叶红蜡梅与夏蜡梅内轮花瓣a*无显著差异,但显著高于夏蜡梅外轮花瓣(P<0.05)。b*的增加代表蓝色逐渐减弱、黄色逐渐增强,结果显示夏蜡梅内轮花瓣b*最高,其次是夏蜡梅外轮花瓣,而光叶红蜡梅和杂交后代的b*最低。C*表示颜色的强度或饱和度,结果显示夏蜡梅内轮花瓣C*最大,其次是杂交后代,夏蜡梅外轮花瓣和光叶红蜡梅C*最小。h是对颜色色调的描述,即所处的光谱颜色的位置,其中h=0,紫红色;h=90,黄色;h=180,绿色,h由高到低的顺序依次为夏蜡梅内轮花瓣、夏蜡梅外轮花瓣、光叶红蜡梅、杂交后代。
表 1 夏蜡梅、光叶红蜡梅及其杂交后代盛开期花色表型数据
Table 1. Flower color phenotype data of S. chinensis, C. floridus var. glaucus and their hybrid progenies during blooming period
植物材料 RHSCC CIELab颜色系统 明度(L*) 红度(a*) 黄度(b*) 彩度(C*) 色相角(h) 夏蜡梅外轮花瓣 76D 70.81±9.44 a 5.41±4.12 c 12.09±2.66 b 13.24±4.90 c 1.15±0.57 b 夏蜡梅内轮花瓣 9B 64.20±10.11 b 7.49±3.19 bc 36.74±11.62 a 37.49±12.05 a 1.37±1.30 a 光叶红蜡梅 186A 23.31±2.47 d 10.73±2.86 b 5.16±2.10 c 11.91±3.55 c 0.45±0.63 c 杂交后代 N77A 29.72±6.19 c 26.45±7.37 a 4.02±2.34 c 26.76±7.74 b 0.15±0.31 d 说明:RHSCC表示英国皇家园艺学会比色卡。差异显著分析使用LSD法,同列不同小写字母表示差异显著(P<0.05)。 -
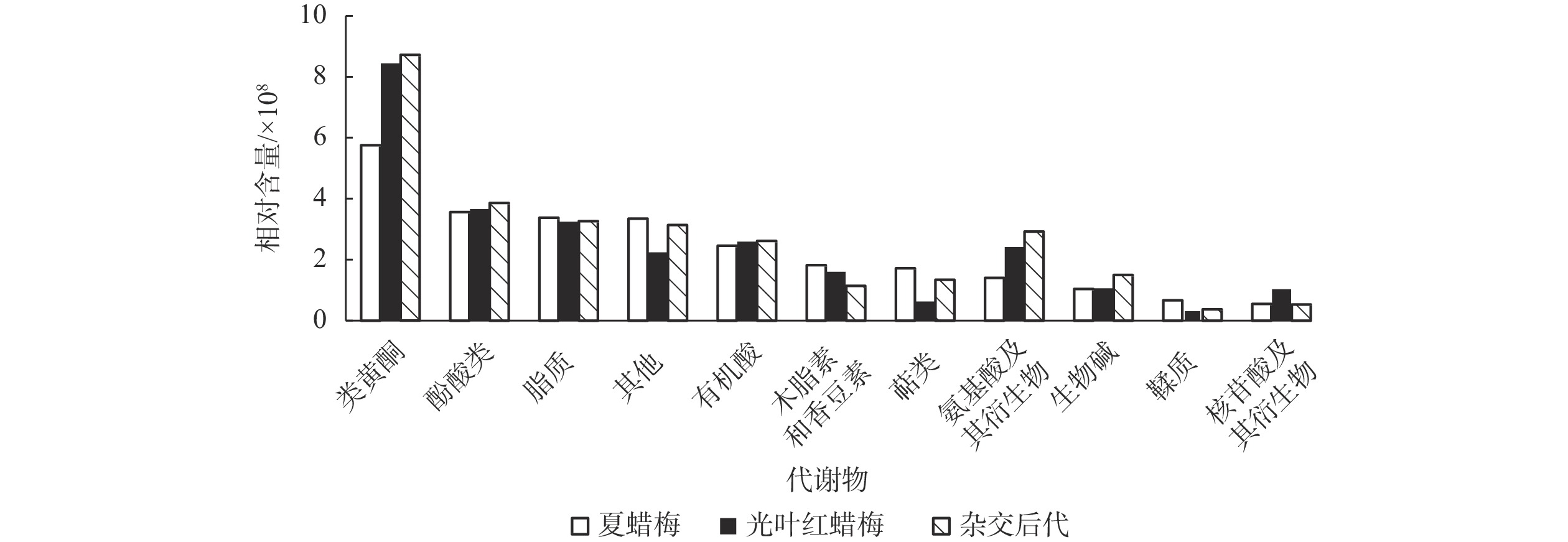
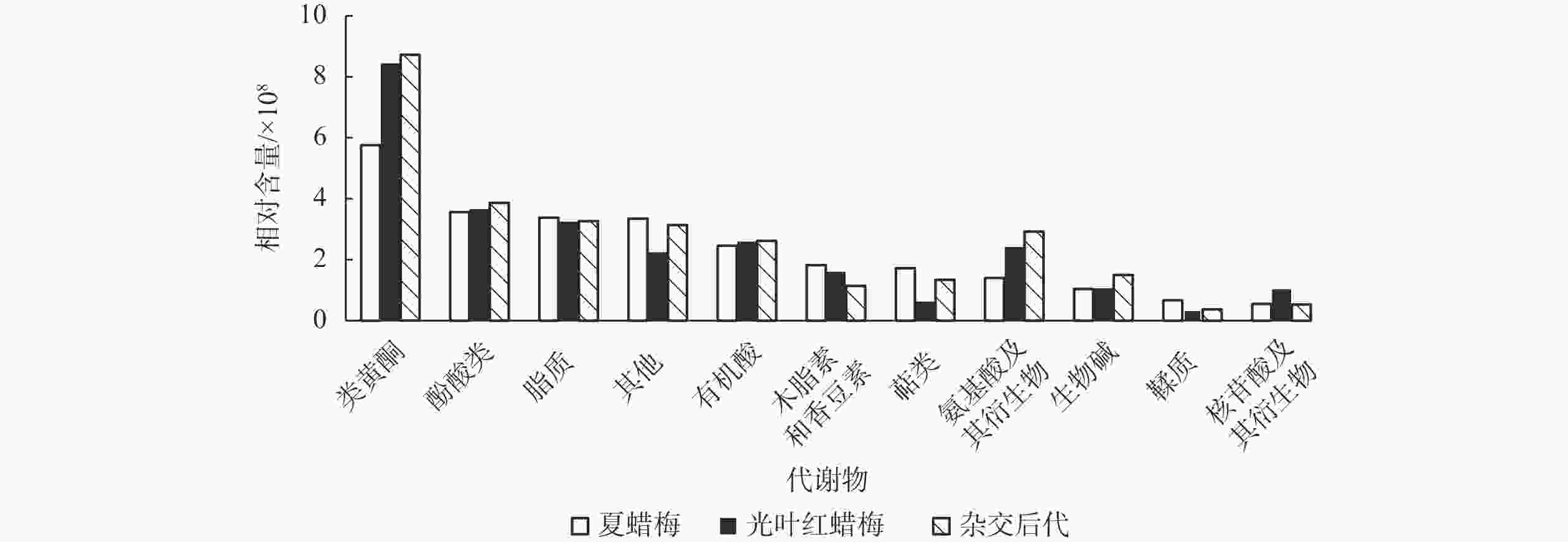
广泛靶向代谢组分析共检测到1 059种代谢物,其中差异代谢物种类如表2所示。将3种植物中所有差异代谢物进行分类,比较其不同代谢物相对含量的差异,如图1所示:3种植物花瓣中类黄酮的相对含量均为最高,除类黄酮外,酚酸类、脂质的相对含量也较高。3种植物中鞣质、核苷酸及其衍生物相对含量均较低。
表 2 差异代谢物数目统计表
Table 2. Statistical table of the number of differential metabolites
全部差异代谢物数量/种 差异代谢物上调数量/种 差异代谢物下调数量/种 夏蜡梅 光叶红蜡梅 夏蜡梅 光叶红蜡梅 夏蜡梅 光叶红蜡梅 光叶红蜡梅 589 263 326 杂交后代 476 386 175 170 301 216 -
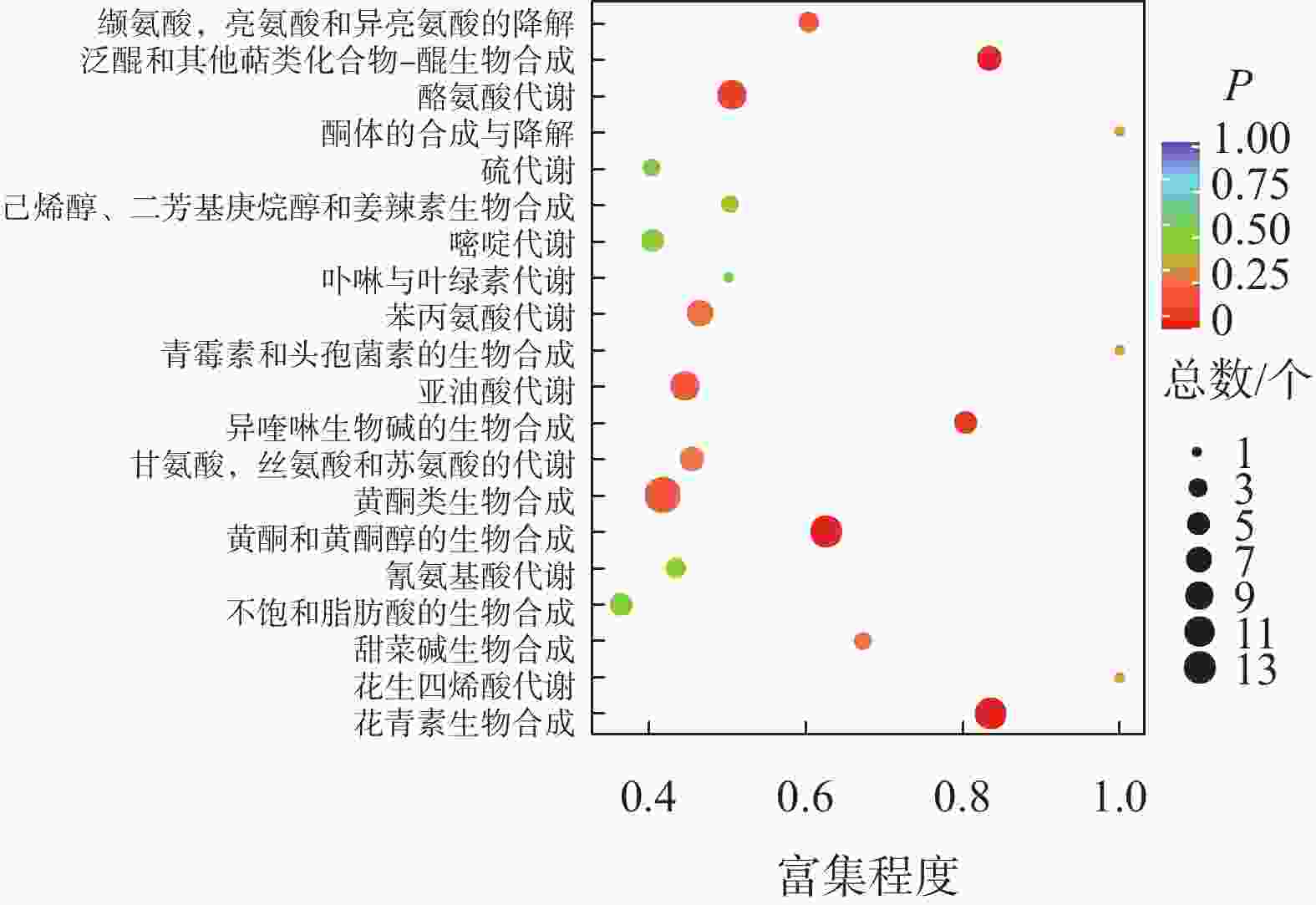
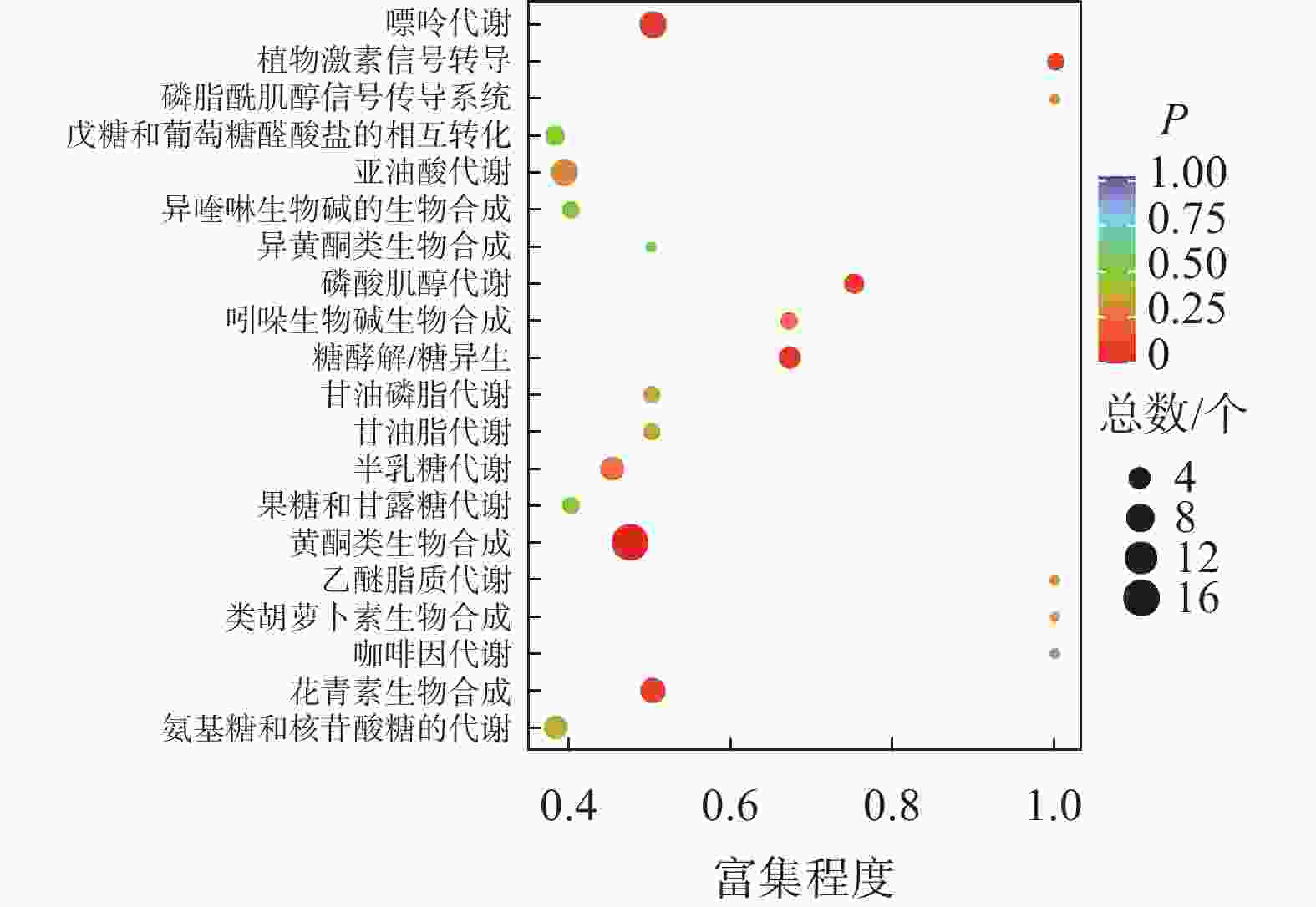
如图2所示:夏蜡梅与光叶红蜡梅差异表达的代谢物富集程度显著的途径为黄酮类生物合成、花青素合成、异喹啉生物碱的生物合成等。如表3所示:注释在黄酮类生物合成途径的代谢物共25个,其中15个上调,10个下调;注释在花青素合成的代谢物共8个,其中7个上调,1个下调;注释在异喹啉生物碱的生物合成的代谢物共4个,其中3个上调,1个下调。如图3所示:夏蜡梅与杂交后代差异表达代谢物质富集显著的途径为花青素合成、黄酮和黄酮醇类生物合成、泛醌和其他萜类醌生物合成等。注释在花青素合成的代谢物共10个,其中9个上调,1个下调;注释在黄酮和黄酮醇类生物合成的代谢物共11个,全部上调;注释在泛醌和其他萜类醌生物合成的代谢物共5个,其中1个上调,4个下调(表3)。如图4所示:光叶红蜡梅与杂交后代差异表达代谢物质富集显著的途径为黄酮类生物合成、糖酵解/糖异生、磷酸肌醇代谢等。注释在黄酮类生物合成的代谢物共16个,其中8个上调,8个下调;注释在糖酵解/糖异生的代谢物共4个,其中2个上调,2个下调;注释在磷酸肌醇代谢的代谢物共3个,其中2个上调,1个下调(表3)。
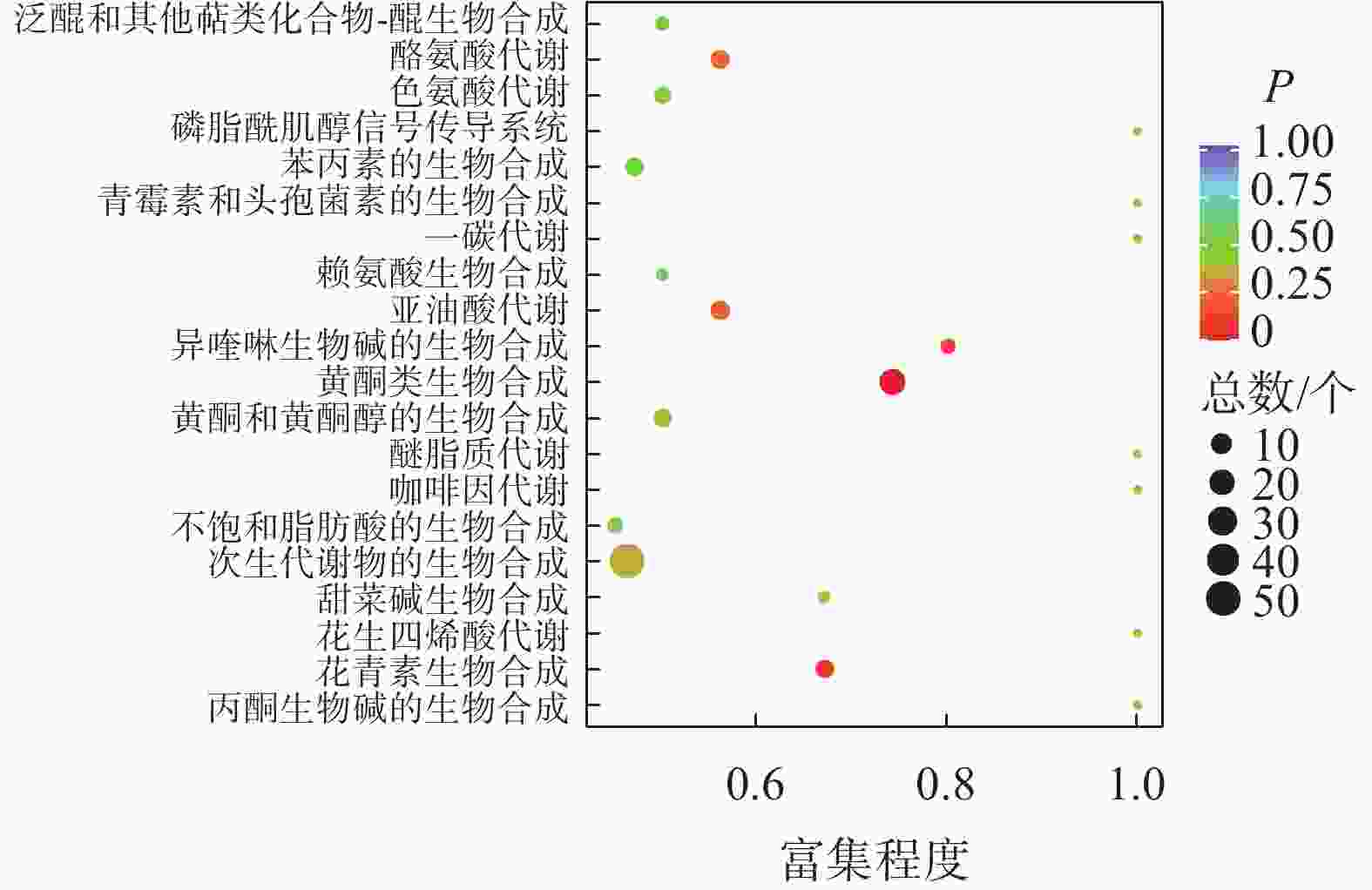
图 2 夏蜡梅与光叶红蜡梅差异代谢物KEGG富集图
Figure 2. S. chinensis and C. floridus var. glaucus differential metabolite KEGG enrichment map
表 3 注释在富集显著合成途径的代谢物
Table 3. Annotate metabolites in a significant pathway of enrichment
物质 一级分类 二级分类 在3种植物中的表达情况 黄酮类生物合成途径 3,4,2′,4′,6′-五羟基查尔酮-4′-O-葡萄糖苷 3,4,2′,4′,6′-
pentahydroxychalcone-4′-O-glucoside类黄酮 查尔酮 夏蜡梅>光叶红蜡梅 3,4,2′,4′,6′-五羟基查尔酮 3,4,2′,4′,6′-pentahydroxychalcone 类黄酮 查尔酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 柚皮素查尔酮 naringenin chalcone 类黄酮 查尔酮 夏蜡梅>光叶红蜡梅 根皮苷phloretin-2′-O-glucoside (phlorizin) 类黄酮 查尔酮 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 柚皮素-7-O-新橙皮糖苷 (柚皮苷) naringenin-7-O-
neohesperidoside (naringin)类黄酮 二氢黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 高圣草酚homoeriodictyol 类黄酮 二氢黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 柚皮素-7-O-葡萄糖苷 (樱桃苷) naringenin-7-O-glucoside (prunin) 类黄酮 二氢黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 异樱花素 isosakuranetin(5,7-dihydroxy-4′-methoxyflavanone) 类黄酮 二氢黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 3-O-乙酰短叶松黄烷酮 3-O-acetylpinobanksin 类黄酮 二氢黄酮醇 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 短叶松素 pinobanksin 类黄酮 二氢黄酮醇 夏蜡梅>光叶红蜡梅 二氢杨梅素(蛇葡萄素) dihydromyricetin (ampelopsin) 类黄酮 二氢黄酮醇 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 二氢槲皮素(花旗松素) dihydroquercetin(taxifolin) 类黄酮 二氢黄酮醇 夏蜡梅<光叶红蜡梅 香橙素 (二氢山奈酚) aromadendrin (dihydrokaempferol) 类黄酮 二氢黄酮醇 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 绿原酸 (3-O-咖啡酰奎宁酸) chlorogenic acid (3-O-caffeoylquinic acid) 酚酸类 酚酸类 夏蜡梅>光叶红蜡梅 五羟黄酮 tricetin (5,7,3′,4′,5′-pentahydroxyflavone) 类黄酮 黄酮 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 高良姜素 galangin (3,5,7-trihydroxyflavone) 类黄酮 黄酮 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 儿茶素 catechin 类黄酮 黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 3′,4,4′,5,7-五羟基黄烷 3′,4,4′,5,7-pentahydroxyflavan (luteoforol) 类黄酮 黄酮 夏蜡梅<光叶红蜡梅 橙皮素 hesperetin 类黄酮 黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 木犀草素 luteolin (5,7,3′,4′-tetrahydroxyflavone) 类黄酮 黄酮 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 山奈酚 kaempferol (3,5,7,4′-tetrahydroxyflavone) 类黄酮 黄酮醇 夏蜡梅>杂交后代>光叶红蜡梅 表没食子儿茶素 epigallocatechin 类黄酮 黄烷醇类 夏蜡梅>光叶红蜡梅 没食子儿茶素 gallocatechin 类黄酮 黄烷醇类 夏蜡梅>光叶红蜡梅 表儿茶素 epicatechin 类黄酮 黄烷醇类 夏蜡梅<光叶红蜡梅 阿夫儿茶精 afzelechin (3,5,7,4′-tetrahydroxyflavan) 类黄酮 黄烷醇类 夏蜡梅>光叶红蜡梅 5-O-对香豆酰奎宁酸 5-O-p-coumaroylquinic acid 酚酸类 酚酸类 光叶红蜡梅>杂交后代 花青素合成途径 矢车菊素-3-O-桑布双糖苷 cyanidin-3-O-sambubioside
[cyanidin-3-O-(2″-O-xylosyl) glucoside]类黄酮 花青素 夏蜡梅>光叶红蜡梅;夏蜡梅>杂交后代 矢车菊素-3-O- (2″-O-葡萄糖基)葡萄糖苷 cyanidin-3-O-
(2″-O-glucosyl) glucoside类黄酮 花青素 夏蜡梅>光叶红蜡梅 矢车菊素-3-O- (6″-O-对香豆酰)葡萄糖苷 cyanidin-3-O-
(6″-O-p-coumaroyl) glucoside类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 矢车菊素-3,5-二-O-葡萄糖苷 cyanidin-3,5-O-diglucoside (cyanin) 类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 矢车菊素-3-O-葡萄糖苷 cyanidin-3-O-glucoside (kuromanin) 类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 矢车菊素-3-O-芸香糖苷cyanidin-3-O-rutinoside (keracyanin) 黄酮 花青素 夏蜡梅>杂交后代 矢车菊素-3-O- (2″-O-葡萄糖基)葡萄糖苷 cyanidin-3-O-
(2″-O-glucosyl) glucoside黄酮 花青素 夏蜡梅>杂交后代 天竺葵素-3-O-芸香糖苷 pelargonidin-3-O-rutinoside 类黄酮 花青素 夏蜡梅<杂交后代;夏蜡梅<光叶红蜡梅 芍药花素 3-O-葡萄糖苷 peonidin-3-O-glucoside 类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 天竺葵素-3-O-葡萄糖苷 pelargonidin-3-O-glucoside 类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 飞燕草素-3-O-芸香糖苷delphinidin-3-O-rutinoside 黄酮 花青素 夏蜡梅>杂交后代 异喹啉生物碱的生物合成途径 原儿茶醛 protocatechualdehyde 酚酸类 酚酸类 夏蜡梅<光叶红蜡梅 多巴胺 dopamine 生物碱 生物碱 夏蜡梅>光叶红蜡梅 L-酪胺 L-tyramine 氨基酸及
其衍生物氨基酸及
其衍生物夏蜡梅>光叶红蜡梅 3,4-二羟基-L-苯丙氨酸 3,4-dihydroxy-L-phenylalanine 氨基酸及
其衍生物氨基酸及
其衍生物夏蜡梅>光叶红蜡梅 黄酮和黄酮醇类生物合成途径 西伯利亚落叶松黄酮 laricitrin 黄酮 黄酮醇 夏蜡梅>杂交后代 山奈酚-3-O-鼠李糖苷 (阿福豆苷)(番泻叶山奈苷)
kaempferol-3-O-rhamnoside (afzelin)(kaempferin)黄酮 黄酮醇 夏蜡梅>杂交后代 芹菜素-7-O-葡萄糖苷 apigenin-7-O-glucoside (cosmosiin) 黄酮 黄酮 夏蜡梅>杂交后代 槲皮素-3-O-鼠李糖苷(槲皮苷) quercetin-3-O-rhamnoside (quercitrin) 黄酮 黄酮醇 夏蜡梅>杂交后代 山奈酚-3-O-半乳糖苷(三叶豆苷) kaempferol-3-O-galactoside (trifolin) 黄酮 黄酮醇 夏蜡梅>杂交后代 山奈酚-3-O-葡萄糖苷(紫云英苷)(黄芪苷)
kaempferol-3-O-glucoside (astragalin)黄酮 黄酮醇 夏蜡梅>杂交后代 木犀草素-7-O-新橘皮糖苷 (忍冬苷) luteolin-7-O-neohesperidoside (lonicerin) 黄酮 黄酮 夏蜡梅>杂交后代 槲皮素-3-O-桑布双糖苷 quercetin-3-O-sambubioside 黄酮 黄酮醇 夏蜡梅>杂交后代 槲皮素-3-O-(2″-O-木糖基)芸香糖苷 quercetin-3-O-(2″-O-xylosyl) rutinoside 黄酮 黄酮醇 夏蜡梅>杂交后代 泛醌和其他萜类醌生物合成 对羟基苯甲酸 4-hydroxybenzoic acid 酚酸类 酚酸类 夏蜡梅>杂交后代 高龙胆酸 homogentisic acid 酚酸类 酚酸类 夏蜡梅<杂交后代 3-[(1-羧乙烯基)氧基]苯甲酸 3-[(1-carboxyvinyl) oxy]benzoic acid 酚酸类 酚酸类 夏蜡梅<杂交后代 D-δ-生育三烯酚 δ-tocotrienol 其他类 维生素 夏蜡梅<杂交后代 甲基萘醌 (维生素 K2) menaquinone (vitamin K2) 其他类 维生素 夏蜡梅<杂交后代 糖酵解/糖异生 磷酸二羟基丙酮 dihydroxyacetone phosphate 其他类 糖及醇类 光叶红蜡梅<杂交后代 D-葡萄糖 D-glucose 其他类 糖及醇类 光叶红蜡梅>杂交后代 3-磷酸-D-甘油酸 3-phospho-D-glyceric acid 其他类 糖及醇类 光叶红蜡梅<杂交后代 熊果苷 arbutin 酚酸类 酚酸类 光叶红蜡梅>杂交后代 磷酸肌醇代谢 磷酸二羟基丙酮 dihydroxyacetone phosphate 其他类 糖及醇类 光叶红蜡梅<杂交后代 肌醇 inositol 其他类 糖及醇类 光叶红蜡梅>杂交后代 D-葡萄糖醛酸 D-glucoronic acid 其他类 糖及醇类 光叶红蜡梅>杂交后代 -
如表4所示:花青素调控的颜色从粉红色到蓝紫色,3种植物中花青素的相对含量由高到低依次为杂交后代、光叶红蜡梅、夏蜡梅;查尔酮调控的颜色为深黄色,3种植物中查尔酮相对含量由高到低依次为夏蜡梅、杂交后代、光叶红蜡梅;黄酮和黄酮醇调控的颜色为淡黄色或近乎无色,3种植物中黄酮的相对含量由高到低依次为杂交后代、光叶红蜡梅、夏蜡梅,黄酮醇的相对含量由高到低依次为光叶红蜡梅、杂交后代、夏蜡梅。
表 4 主要呈色物质的相对含量
Table 4. Relative content of main coloring substances
植物 相对含量 花青素 黄酮 黄酮醇 查尔酮 夏蜡梅 4.40×107 2.71×108 9.38×107 7.02×106 光叶红蜡梅 6.21×107 3.68×108 2.92×108 4.94×106 杂交后代 7.51×107 3.78×108 2.64×108 5.28×106 -
双变量Pearson检验结果(表5)显示:黄酮与L*、h呈显著负相关(P<0.05);黄酮醇与L*呈极显著负相关(P<0.01);花青素与h呈显著负相关(P<0.05);查尔酮与L*呈极显著负相关(P<0.01)。
表 5 色素成分与花色表型间的相关性
Table 5. Correlation between pigment components and flower color phenotypes
花色表型 黄酮 黄酮醇 花青素 查尔酮 L* −0.978* −0.994** −0.887 −0.994** a* 0.779 0.659 0.924 −0.645 b* −0.751 −0.743 −0.714 0.741 C* −0.252 −0.339 −0.094 0.347 h −0.977* −0.936 −0.978* 0.930 说明:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。 -
植物花色的形成是多种因子协同作用的结果,涉及多种代谢物质,其中最主要的是色素。色素有许多种类,主要包括类胡萝卜素、类黄酮和生物碱等三大类[11−13]。类黄酮是一类具有苯基苯并吡喃基本结构的植物次生代谢产物,广泛存在于植物体内,它产生的颜色范围最广,从淡黄色到蓝紫色,是各种观赏植物花瓣中最重要的色素之一,在菊花Chrysanthemum morifolium[14]、大丽花Dahlia pinnata[15]、月季Rosa chinensis[16]等花瓣中是主要色素。在黄酮类化合物中,主要有红色系和纯黄系。其中,红色系主要包括花青素,它能调控的颜色从粉红色到蓝紫色[17];其他黄酮类化合物主要属于纯黄系列,如深黄色的查尔酮,淡黄色或近乎无色的黄酮和黄酮醇等。本研究中夏蜡梅内轮花瓣黄色,光叶红蜡梅和杂交后代花紫红色,对花瓣代谢物中的花青素、黄酮、黄酮醇和查尔酮相对含量分析表明:3种植物花瓣中的类黄酮组分与花色表型密切相关。黄酮与L*呈负相关,表明黄酮相对含量越高则花瓣明度越低,与h呈负相关;黄酮醇与L*呈极显著负相关,说明黄酮醇相对含量越高则花瓣明度越低;花青素与h呈负相关;查尔酮与L*呈极显著负相关表明黄酮醇相对含量越高则花瓣明度越低。
类黄酮是控制植物花色的主要色素之一,其中花青素在类黄酮中占据重要地位。矢车菊素是花青素中呈现紫色的主要色素[15],本研究中,3种植物共筛选出10种矢车菊素差异代谢物,紫红色花的光叶红蜡梅和杂交后代中矢车菊素相对含量显著高于夏蜡梅,说明矢车菊素在光叶红蜡梅、杂交后代紫红色花的形成中扮演重要作用。查尔酮能使花瓣呈现深黄色,3种植物共筛选出14种查尔酮差异代谢物,查尔酮相对含量由高到低依次为夏蜡梅、杂交后代、光叶红蜡梅,故推测查尔酮是夏蜡梅内轮花瓣呈现深黄色的主要物质。
夏蜡梅与光叶红蜡梅的杂交后代花部性状介于双亲之间,花大、呈不同程度的紫红色[18]。研究植物花色遗传规律有助于了解杂交后代的选育过程,对提高杂交后代品质以及培育不同色系的新品种具有重要意义。SHUPERT等[19]利用3个回交群体研究了月季粉色性状的遗传规律,发现粉色由1个主要的共显性基因控制。薛莉[20]研究发现:植物杂交后代的花色遗传为少数基因控制的质量性状,色素含量遗传为多基因控制的数量性状。目前夏蜡梅与光叶红蜡梅杂交后代花色遗传机制尚不明确,后续研究可根据本研究结果在花色表型与分子标记之间建立关联,以更加全面地了解杂交后代花色的遗传变异。
Flower color phenotype and pigment accumulation characteristics of Sinicalycanthus chinensis, Calycanthus floridus var. glaucus and their hybrid progenies
-
摘要:
目的 对夏蜡梅Sinicalycanthus chinensis、光叶红蜡梅 Calycanthus floridus var. glaucus及两者杂交后代的花色变化进行比较和分析,明确导致花色差异的代谢物质基础。 方法 利用广泛靶向代谢组学方法,对夏蜡梅、光叶红蜡梅及两者杂交后代花瓣中相关代谢产物进行测定,筛选差异代谢物,并对差异代谢物参与的代谢通路进行分析,解析花瓣呈现不同颜色的代谢物质基础。 结果 ①花色表型测量显示:夏蜡梅内外轮花瓣明度(L*)、黄度(b*)、色相角(h)显著高于光叶红蜡梅(P<0.05),夏蜡梅外轮花瓣红度(a*)显著低于光叶红蜡梅,夏蜡梅内轮花瓣彩度(C*)显著高于光叶红蜡梅(P<0.05)。杂交后代花瓣L*显著低于夏蜡梅内外轮花瓣,也显著高于光叶红蜡梅,a*显著高于双亲,b*显著低于夏蜡梅内外轮花瓣,C*显著低于夏蜡梅内轮花瓣,也显著高于夏蜡梅外轮花瓣和光叶红蜡梅,h显著低于双亲(P<0.05)。②通过广泛靶向代谢组学分析,3种花瓣中共检测到1 059种代谢物,3种花瓣差异代谢物中类黄酮相对含量最高。③KEGG代谢通路富集分析显示:注释在代谢途径、次生代谢物的生物合成和黄酮类生物合成中的代谢物数量最多。④比较3种植物中主要呈色物质的相对含量,其花青素和黄酮相对含量由高到低依次为杂交后代、光叶红蜡梅、夏蜡梅;查尔酮相对含量由高到低依次为夏蜡梅、杂交后代、光叶红蜡梅;黄酮醇的相对含量由高到低依次为光叶红蜡梅、杂交后代、夏蜡梅。⑤对色素成分与花色表型的相关性分析显示:黄酮与L*、h呈显著负相关(P<0.05);黄酮醇与L*呈极显著负相关(P<0.01);花青素与h呈显著负相关(P<0.05);查尔酮与L*呈极显著负相关(P<0.01)。 结论 夏蜡梅、光叶红蜡梅及其杂交后代花瓣花色表型与代谢物质存在明显差异,3种植物之间主要以类黄酮为主的差异代谢物。图4表5参20 Abstract:Objective This paper, with a comparative analysis conducted of the changes of flower color of the Sinicalycanthus chinensis, the Calycanthus floridus var. glaucus and their hybrid progenies, is aimed to analyze the different metabolite basis of the flower color. Method Targeted metabolomics methods were adopted to determine the content of related metabolites in the petals of S. chinensis, C. floridus var. glaucus, and their hybrid progenies, screen the differential metabolites and decide the metabolic pathways involved in the differential metabolites before identification and analysis were performed to analyze the metabolite basis of petals showing different colors. Result (1) In terms of the flower color phenotype, the lightness (L*) values, yellowness (b*) values and hue angles (h) of the inner and outer petals of S. chinensis were significantly higher than those of C. floridus var. glaucus (P<0.05). The redness (a*) values of outer petals of S. chinensis were significantly lower than those of C. floridus var. glaucus; the chroma (C*) values of inner petals of S. chinensis were significantly higher than those of C. floridus var. glaucus (P<0.05). L* values of the hybrid offsprings were significantly lower than those of the inner and outer petals of S. chinensis, but significantly higher than those of C. floridus var. glaucus; a* values of the hybrid progenies were significantly higher than those of the parents, b* values were significantly lower than those of the inner and outer petals of S. chinensis while C* values were significantly lower than those of the inner and outer petals of S. chinensis; C* values of the hybrid progenies were significantly lower than those of the inner petals of S. chinensis, and significantly higher than those of the outer petals of S. chinensis and C. floridus var. glaucus. whereas h were significantly lower than those of the parents (P<0.05). (2) A total of 1 059 metabolites were detected by widely targeted metabolomics with the relative content of flavonoids being the highest among the three different metabolites of the petals. (3) With KEGG metabolic pathway enrichment analysis performed on the differential metabolites, it was shown that among the 3 groups, the number of metabolites annotated in metabolic pathways, biosynthesis of secondary metabolites, and flavonoid biosynthesis was the largest. (4) The comparison of the relative contents of the main coloring substances in the three plants showed that the relative contents of anthocyanins and flavonoids dropped from high to low in the descending order of hybrid progenies, C. floridus var. glaucus and S. chinensis while the relative contents of flavonols dropped from high to low in the descending order of C. floridus var. glaucus, hybrid progenies and S. chinensis. (5) The analysis of the correlation between pigment components and flower color phenotypes showed that flavones were negatively correlated with L* value, but negatively correlated with h (P<0.05) whereas there was a very significant negative correlation between flavonols and L* value (P<0.01); Anthocyanins were negatively correlated with h (P<0.05) while chalcones and L* value showed an extremely significant negative correlation (P<0.01). Conclusion There were significant differences in petal flower color phenotype and metabolites among S. chinensis, C. floridus var. glaucus, and hybrid progenies. The significant differences in metabolites, mainly flavonoids, and their main annotation pathways among the three were clarified, laying a foundation for further study in mechanism of the flower colors of these three plants. [Ch, 4 fig. 5 tab. 20 ref.] -
表 1 夏蜡梅、光叶红蜡梅及其杂交后代盛开期花色表型数据
Table 1. Flower color phenotype data of S. chinensis, C. floridus var. glaucus and their hybrid progenies during blooming period
植物材料 RHSCC CIELab颜色系统 明度(L*) 红度(a*) 黄度(b*) 彩度(C*) 色相角(h) 夏蜡梅外轮花瓣 76D 70.81±9.44 a 5.41±4.12 c 12.09±2.66 b 13.24±4.90 c 1.15±0.57 b 夏蜡梅内轮花瓣 9B 64.20±10.11 b 7.49±3.19 bc 36.74±11.62 a 37.49±12.05 a 1.37±1.30 a 光叶红蜡梅 186A 23.31±2.47 d 10.73±2.86 b 5.16±2.10 c 11.91±3.55 c 0.45±0.63 c 杂交后代 N77A 29.72±6.19 c 26.45±7.37 a 4.02±2.34 c 26.76±7.74 b 0.15±0.31 d 说明:RHSCC表示英国皇家园艺学会比色卡。差异显著分析使用LSD法,同列不同小写字母表示差异显著(P<0.05)。 表 2 差异代谢物数目统计表
Table 2. Statistical table of the number of differential metabolites
全部差异代谢物数量/种 差异代谢物上调数量/种 差异代谢物下调数量/种 夏蜡梅 光叶红蜡梅 夏蜡梅 光叶红蜡梅 夏蜡梅 光叶红蜡梅 光叶红蜡梅 589 263 326 杂交后代 476 386 175 170 301 216 表 3 注释在富集显著合成途径的代谢物
Table 3. Annotate metabolites in a significant pathway of enrichment
物质 一级分类 二级分类 在3种植物中的表达情况 黄酮类生物合成途径 3,4,2′,4′,6′-五羟基查尔酮-4′-O-葡萄糖苷 3,4,2′,4′,6′-
pentahydroxychalcone-4′-O-glucoside类黄酮 查尔酮 夏蜡梅>光叶红蜡梅 3,4,2′,4′,6′-五羟基查尔酮 3,4,2′,4′,6′-pentahydroxychalcone 类黄酮 查尔酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 柚皮素查尔酮 naringenin chalcone 类黄酮 查尔酮 夏蜡梅>光叶红蜡梅 根皮苷phloretin-2′-O-glucoside (phlorizin) 类黄酮 查尔酮 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 柚皮素-7-O-新橙皮糖苷 (柚皮苷) naringenin-7-O-
neohesperidoside (naringin)类黄酮 二氢黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 高圣草酚homoeriodictyol 类黄酮 二氢黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 柚皮素-7-O-葡萄糖苷 (樱桃苷) naringenin-7-O-glucoside (prunin) 类黄酮 二氢黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 异樱花素 isosakuranetin(5,7-dihydroxy-4′-methoxyflavanone) 类黄酮 二氢黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 3-O-乙酰短叶松黄烷酮 3-O-acetylpinobanksin 类黄酮 二氢黄酮醇 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 短叶松素 pinobanksin 类黄酮 二氢黄酮醇 夏蜡梅>光叶红蜡梅 二氢杨梅素(蛇葡萄素) dihydromyricetin (ampelopsin) 类黄酮 二氢黄酮醇 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 二氢槲皮素(花旗松素) dihydroquercetin(taxifolin) 类黄酮 二氢黄酮醇 夏蜡梅<光叶红蜡梅 香橙素 (二氢山奈酚) aromadendrin (dihydrokaempferol) 类黄酮 二氢黄酮醇 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 绿原酸 (3-O-咖啡酰奎宁酸) chlorogenic acid (3-O-caffeoylquinic acid) 酚酸类 酚酸类 夏蜡梅>光叶红蜡梅 五羟黄酮 tricetin (5,7,3′,4′,5′-pentahydroxyflavone) 类黄酮 黄酮 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 高良姜素 galangin (3,5,7-trihydroxyflavone) 类黄酮 黄酮 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 儿茶素 catechin 类黄酮 黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 3′,4,4′,5,7-五羟基黄烷 3′,4,4′,5,7-pentahydroxyflavan (luteoforol) 类黄酮 黄酮 夏蜡梅<光叶红蜡梅 橙皮素 hesperetin 类黄酮 黄酮 夏蜡梅<光叶红蜡梅;光叶红蜡梅>杂交后代 木犀草素 luteolin (5,7,3′,4′-tetrahydroxyflavone) 类黄酮 黄酮 夏蜡梅>光叶红蜡梅;光叶红蜡梅<杂交后代 山奈酚 kaempferol (3,5,7,4′-tetrahydroxyflavone) 类黄酮 黄酮醇 夏蜡梅>杂交后代>光叶红蜡梅 表没食子儿茶素 epigallocatechin 类黄酮 黄烷醇类 夏蜡梅>光叶红蜡梅 没食子儿茶素 gallocatechin 类黄酮 黄烷醇类 夏蜡梅>光叶红蜡梅 表儿茶素 epicatechin 类黄酮 黄烷醇类 夏蜡梅<光叶红蜡梅 阿夫儿茶精 afzelechin (3,5,7,4′-tetrahydroxyflavan) 类黄酮 黄烷醇类 夏蜡梅>光叶红蜡梅 5-O-对香豆酰奎宁酸 5-O-p-coumaroylquinic acid 酚酸类 酚酸类 光叶红蜡梅>杂交后代 花青素合成途径 矢车菊素-3-O-桑布双糖苷 cyanidin-3-O-sambubioside
[cyanidin-3-O-(2″-O-xylosyl) glucoside]类黄酮 花青素 夏蜡梅>光叶红蜡梅;夏蜡梅>杂交后代 矢车菊素-3-O- (2″-O-葡萄糖基)葡萄糖苷 cyanidin-3-O-
(2″-O-glucosyl) glucoside类黄酮 花青素 夏蜡梅>光叶红蜡梅 矢车菊素-3-O- (6″-O-对香豆酰)葡萄糖苷 cyanidin-3-O-
(6″-O-p-coumaroyl) glucoside类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 矢车菊素-3,5-二-O-葡萄糖苷 cyanidin-3,5-O-diglucoside (cyanin) 类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 矢车菊素-3-O-葡萄糖苷 cyanidin-3-O-glucoside (kuromanin) 类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 矢车菊素-3-O-芸香糖苷cyanidin-3-O-rutinoside (keracyanin) 黄酮 花青素 夏蜡梅>杂交后代 矢车菊素-3-O- (2″-O-葡萄糖基)葡萄糖苷 cyanidin-3-O-
(2″-O-glucosyl) glucoside黄酮 花青素 夏蜡梅>杂交后代 天竺葵素-3-O-芸香糖苷 pelargonidin-3-O-rutinoside 类黄酮 花青素 夏蜡梅<杂交后代;夏蜡梅<光叶红蜡梅 芍药花素 3-O-葡萄糖苷 peonidin-3-O-glucoside 类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 天竺葵素-3-O-葡萄糖苷 pelargonidin-3-O-glucoside 类黄酮 花青素 夏蜡梅>杂交后代;夏蜡梅>光叶红蜡梅 飞燕草素-3-O-芸香糖苷delphinidin-3-O-rutinoside 黄酮 花青素 夏蜡梅>杂交后代 异喹啉生物碱的生物合成途径 原儿茶醛 protocatechualdehyde 酚酸类 酚酸类 夏蜡梅<光叶红蜡梅 多巴胺 dopamine 生物碱 生物碱 夏蜡梅>光叶红蜡梅 L-酪胺 L-tyramine 氨基酸及
其衍生物氨基酸及
其衍生物夏蜡梅>光叶红蜡梅 3,4-二羟基-L-苯丙氨酸 3,4-dihydroxy-L-phenylalanine 氨基酸及
其衍生物氨基酸及
其衍生物夏蜡梅>光叶红蜡梅 黄酮和黄酮醇类生物合成途径 西伯利亚落叶松黄酮 laricitrin 黄酮 黄酮醇 夏蜡梅>杂交后代 山奈酚-3-O-鼠李糖苷 (阿福豆苷)(番泻叶山奈苷)
kaempferol-3-O-rhamnoside (afzelin)(kaempferin)黄酮 黄酮醇 夏蜡梅>杂交后代 芹菜素-7-O-葡萄糖苷 apigenin-7-O-glucoside (cosmosiin) 黄酮 黄酮 夏蜡梅>杂交后代 槲皮素-3-O-鼠李糖苷(槲皮苷) quercetin-3-O-rhamnoside (quercitrin) 黄酮 黄酮醇 夏蜡梅>杂交后代 山奈酚-3-O-半乳糖苷(三叶豆苷) kaempferol-3-O-galactoside (trifolin) 黄酮 黄酮醇 夏蜡梅>杂交后代 山奈酚-3-O-葡萄糖苷(紫云英苷)(黄芪苷)
kaempferol-3-O-glucoside (astragalin)黄酮 黄酮醇 夏蜡梅>杂交后代 木犀草素-7-O-新橘皮糖苷 (忍冬苷) luteolin-7-O-neohesperidoside (lonicerin) 黄酮 黄酮 夏蜡梅>杂交后代 槲皮素-3-O-桑布双糖苷 quercetin-3-O-sambubioside 黄酮 黄酮醇 夏蜡梅>杂交后代 槲皮素-3-O-(2″-O-木糖基)芸香糖苷 quercetin-3-O-(2″-O-xylosyl) rutinoside 黄酮 黄酮醇 夏蜡梅>杂交后代 泛醌和其他萜类醌生物合成 对羟基苯甲酸 4-hydroxybenzoic acid 酚酸类 酚酸类 夏蜡梅>杂交后代 高龙胆酸 homogentisic acid 酚酸类 酚酸类 夏蜡梅<杂交后代 3-[(1-羧乙烯基)氧基]苯甲酸 3-[(1-carboxyvinyl) oxy]benzoic acid 酚酸类 酚酸类 夏蜡梅<杂交后代 D-δ-生育三烯酚 δ-tocotrienol 其他类 维生素 夏蜡梅<杂交后代 甲基萘醌 (维生素 K2) menaquinone (vitamin K2) 其他类 维生素 夏蜡梅<杂交后代 糖酵解/糖异生 磷酸二羟基丙酮 dihydroxyacetone phosphate 其他类 糖及醇类 光叶红蜡梅<杂交后代 D-葡萄糖 D-glucose 其他类 糖及醇类 光叶红蜡梅>杂交后代 3-磷酸-D-甘油酸 3-phospho-D-glyceric acid 其他类 糖及醇类 光叶红蜡梅<杂交后代 熊果苷 arbutin 酚酸类 酚酸类 光叶红蜡梅>杂交后代 磷酸肌醇代谢 磷酸二羟基丙酮 dihydroxyacetone phosphate 其他类 糖及醇类 光叶红蜡梅<杂交后代 肌醇 inositol 其他类 糖及醇类 光叶红蜡梅>杂交后代 D-葡萄糖醛酸 D-glucoronic acid 其他类 糖及醇类 光叶红蜡梅>杂交后代 表 4 主要呈色物质的相对含量
Table 4. Relative content of main coloring substances
植物 相对含量 花青素 黄酮 黄酮醇 查尔酮 夏蜡梅 4.40×107 2.71×108 9.38×107 7.02×106 光叶红蜡梅 6.21×107 3.68×108 2.92×108 4.94×106 杂交后代 7.51×107 3.78×108 2.64×108 5.28×106 表 5 色素成分与花色表型间的相关性
Table 5. Correlation between pigment components and flower color phenotypes
花色表型 黄酮 黄酮醇 花青素 查尔酮 L* −0.978* −0.994** −0.887 −0.994** a* 0.779 0.659 0.924 −0.645 b* −0.751 −0.743 −0.714 0.741 C* −0.252 −0.339 −0.094 0.347 h −0.977* −0.936 −0.978* 0.930 说明:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。 -
[1] 张忠钊, 谢文远, 张培林. 天台县大雷山夏蜡梅群落学特征分析[J]. 浙江农林大学学报, 2021, 38(2): 262 − 270. ZHANG Zhongzhao, XIE Wenyuan, ZHANG Peilin. Community characteristics of Sinocalycanthus chinensis in Dalei Mountains of Tiantai County [J]. Journal of Zhejiang A&F University, 2021, 38(2): 262 − 270. [2] 戴思兰, 黄河, 付建新, 等. 观赏植物分子育种研究进展[J]. 植物学报, 2013, 48(6): 589 − 607. DAI Silan, HUANG He, FU Jianxin, et al. Advances in molecular breeding of ornamental plants [J]. Chinese Bulletin of Botany, 2013, 48(6): 589 − 607. [3] LASSEIGNE F T, FANTZ P R, RAULSTON J C, et al. Sinocalycalycanthus raulstonii (Calycanthaceae): a new intergeneric hybrid between Sinocalycanthus chinensis and Calycanthus floridus [J]. HortScience, 2001, 36(4): 765 − 767. [4] 张若蕙. 浙江珍稀濒危植物: 夏蜡梅[M]. 杭州: 浙江科学技术出版社, 1994: 154 − 156. ZHANG Ruohui. A Rare and Endangered Plant in Zhejiang: Sinicalycanthus chinensis [M]. Hangzhou: Zhejiang Science and Technology Publishing House, 1994: 154 − 156. [5] 王文鹏, 周莉花, 刘华红, 等. 夏蜡梅与美国蜡梅属间杂交障碍的组织学机理[J]. 园艺学报, 2013, 40(10): 1943 − 1950. WANG Wenpeng, ZHOU Lihua, LIU Huahong, et al. Histological mechanism of reproductive barrier in intergeneric cross between Sinocalycanthus chinensis and Calycanthus floridus var. oblongifolius [J]. Acta Horticulturae Sinica, 2013, 40(10): 1943 − 1950. [6] 黄耀辉. 夏蜡梅传粉系统和不同交配后代适合度的研究[D]. 杭州: 浙江农林大学, 2016. HUANG Yaohui. Pollinator System and the Fitness of Filial Generation in Different Controlled Pollination of Sinocalycanthus chinensis [D]. Hangzhou: Zhejiang A&F University, 2016. [7] FENSTER C B, ARMBRUSTER W S, WILSON R, et al. Pollination syndromes and floral specialization [J]. Annual Review of Ecology,Evolution,and Systematics, 2004, 35: 375 − 403. [8] 黄双全, 郭友好. 传粉生物学的研究进展[J]. 科学通报, 2000, 45(3): 225 − 237. HUANG Shuangquan, GUO Youhao. Research progress in pollination biology [J]. Chinese Science Bulletin, 2000, 45(3): 225 − 237. [9] ROBERTS L D, SOUZA A L, GERSZTEN R E, et al. Targeted metabolomics [J/OL]. Current Protocols in Molecular Biology, 2012, 30(1): Unit 30.2[2022-08-01]. doi: 10.1002/0471142727.mb3002s98. [10] CHEN Wei, GONG Liang, GUO Zilong, et al. A novel integrated method for large-scale detection, identification, and quantification of widely targeted metabolites: application in the study of rice metabolomics [J]. Molecular Plant, 2013, 6(6): 1769 − 1780. [11] TANAKA Y, TSUDA S, KUSUMI T. Metabolic engineering to modify flower color [J]. Plant and Cell Physiology, 1998, 39(11): 1119 − 1126. [12] 赵昶灵, 郭维明, 陈俊愉. 植物花色呈现的生物化学、分子生物学机制及其基因工程改良[J]. 西北植物学报, 2003, 23(6): 1024 − 1035. ZHAO Changling, GUO Weiming, CHEN Junyu. Biochemical and molecular biological mechanisms of plant flower color and its genetic engineering improvement [J]. Acta Botanica Boreali-Occidentalia Sinica, 2003, 23(6): 1024 − 1035. [13] WILLIAMS C A, GRAYER R J. Anthocyanins and other flavonoids [J]. Natural Product Reports, 2004, 21(4): 539 − 573. [14] CHEN Sumei, LI Chonghui, ZHU Xirong, et al. The identification of flavonoids and the expression of genes of anthocyanin biosynthesis in the chrysanthemum flowers [J]. Biologia Plantanum, 2012, 56(3): 458 − 464. [15] THILL J, MIOSIC S, AHMED R, et al. ‘Le Rouge et le Noir’: a decline in flavone formation correlates with the rare color of black dahlia (Dahlia variabilis Hort. ) flowers [J/OL]. BMC Plant Biology, 2012, 12(1): 225[2022-08-01]. doi:10.1186/1471-2229-12-225. [16] SCHMITZER V, VEBERIC R, OSTERC G, et al. Color and phenolic content changes during flower development in groundcover rose [J]. Journal of the American Society for Horticultural Science, 2010, 135(3): 195 − 202. [17] 陈建, 吕长平, 陈晨甜, 等. 不同花色非洲菊品种花色素成分初步分析[J]. 湖南农业大学学报(自然科学版), 2009, 35(增刊1): 73 − 76. CHEN Jian, LU Changping, CHEN Chentian, et al. Preliminary analysis of anthocyanin components in different gerbera varieties [J]. Journal of Hunan Agricultural University (Natural Sciences), 2009, 35(suppl 1): 73 − 76. [18] 王文鹏, 周莉花, 赵宏波, 等. 蜡梅与光叶红蜡梅和夏蜡梅属间杂交亲和性初步研究[J]. 浙江农林大学学报, 2015, 32(5): 756 − 762. WANG Wenpeng, ZHOU Lihua, ZHAO Hongbo, et al. Intergeneric cross-compatibility from pollen-pistil interactions of three Calycanthaceae species [J]. Journal of Zhejiang A&F University, 2015, 32(5): 756 − 762. [19] SHUPERT D, ANDERSON N, BYRNE D. The inheritance of several traits in three diploid interspecific rose populations [J]. HortScience, 2004, 39(4): 807 − 808. [20] 薛莉. 红花草莓种质创新及花色形成机理研究[D]. 沈阳: 沈阳农业大学, 2016. XUE Li. Study on Germplasm Innovation and Molecular Mechanism of Flower Color Formation in Red-flowered Strawberry [D]. Shenyang: Shenyang Agricultural University, 2016. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220543






 下载:
下载: