-
在全球范围内,土壤盐渍化是威胁农业的主要问题之一。据统计,全球20%的耕地面积受到了不同程度的盐渍化危害[1]。土壤盐渍化会对植物形成盐胁迫,引起离子失衡和高渗透胁迫来影响植物。在盐胁迫下,植物组织中的离子浓度增加产生离子毒害,还会使体内活性氧的产生和清除失调,造成活性氧的过量积累,导致细胞膜受损,植物正常生长发育受阻,甚至还会导致植物体死亡[2−4]。盐胁迫严重降低了农作物的产量和品质,减轻或解决盐胁迫对作物的伤害对粮食安全有重要意义。
钙(Ca)是植物生长发育所必需的营养元素之一,其作为第二信使在维持植物细胞膜的结构和功能完整性、稳定细胞壁结构、调节离子转运和选择性以及控制离子交换行为的过程中起着至关重要的作用[4]。有研究表明:当植物受到盐胁迫时,过量的钠离子(Na+)降低了钙离子(Ca2+)向植物生长区域的运输和迁移,而适量施加外源Ca2+不仅可以缓解因钙不足造成的矿质营养缺乏,还能增强植物体内细胞膜的稳定性和抗氧化酶活性,从而提高植物对逆境胁迫的抗性[5]。张胜珍等[6]研究发现:在150 mmol·L−1氯化钠(NaCl)胁迫下,20 mmol·L−1氯化钙(CaCl2)浸种可显著提高荆芥Nepeta cataria幼苗的抗氧化酶活性,有效缓解荆芥种子受到伤害。ZHAO等[7]发现:在高温和强光交叉胁迫下,Ca2+预处理小麦Triticum aestivum可通过减少氧离子(O2 −)的产生、抑制膜脂过氧化和延缓细胞的电解质渗漏来保护光合作用系统免受氧化损伤。赵腾飞等[8]研究表明:外源施加CaCl2可提高铅(Pb)胁迫下小麦的抗氧化酶活性、降低丙二醛(MDA)含量、恢复小麦根系活力,一定程度上缓解了Pb对小麦的毒害作用。王宝增等[9]研究表明:对盐胁迫下的小麦幼苗施加CaCl2可使其脯氨酸含量增加,过氧化物酶活性增强,MDA降低,提高了小麦幼苗的耐盐性。因此,选用CaCl2作为缓解小麦盐胁迫的外源物质具有一定的可行性。
小麦是世界上的主要粮食作物之一,中国产量和种植面积仅次于水稻Oryza sativa和玉米Zea mays,占全国粮食作物面积的21.4%。衰老是小麦生长发育的最后阶段,是在细胞水平、组织水平、器官水平和整个有机体水平上共同协作完成的,是积极主动的过程[10]。在衰老过程中,小麦器官和细胞会经历一系列复杂的生理和生物生化变化,将营养物质,特别是氮(N)从叶片中重新分配到正在发育的籽粒中被认为是叶片衰老的主要功能。有研究表明:谷物中大约80%的N是由衰老过程中叶绿体蛋白的回收提供的[11]。小麦早衰会引起叶片提早黄化,光合效率下降,降低籽粒千粒重,影响产量。也有学者表明:小麦叶片衰老推迟1 d,可增产2%[12]。
本研究以小麦加倍单倍体群体(DH)[13]中的叶片早衰株系DH70和叶片延迟衰老株系DH106为研究材料,分析2个株系小麦在正常环境、盐胁迫以及施加外源CaCl2等不同处理下的幼苗形态指标、抗氧化酶活性、MDA等生理指标之间的差异,为探讨小麦早衰株系和延迟衰老株系对盐胁迫的抗性差异以及筛选外源CaCl2缓解的最佳浓度提供理论依据。
-
以小麦DH群体的2个株系DH70 (早衰)和DH106 (延迟衰老)为研究材料,于2021年4—6月在浙江省农产品品质改良技术研究重点实验室进行试验。选取颗粒饱满大小一致的小麦种子于100、200、300、400 mmol·L−1 NaCl溶液下处理7 d。试验发现400 mmol·L−1 NaCl处理下小麦种子基本不发芽,100、200、300 mmol·L−1 NaCl处理均抑制了小麦的发芽及幼苗的生长,其中300 mmol·L−1 NaCl处理下抑制效果最明显,2个株系间差异最大,且不会导致小麦死亡。因此选择300 mmol·L−1 NaCl为最佳处理浓度。
-
取大小相似、颗粒饱满、无病虫害的2个DH株系的小麦种子若干,在体积分数为75%的乙醇中浸泡1 min,倒掉乙醇后用纯水冲洗2遍,再将种子放于体积分数为5%的次氯酸钠溶液中消毒30 min,消毒后用纯水冲洗3遍,使种子表面无残留的次氯酸钠溶液。将消毒完的小麦种子用吸水纸吸去多余水分,整齐排列在装有湿润双层滤纸的培养皿中,室温下发芽。待种子露白时,挑选露白程度一致的小麦种子放置于18 cm×12 cm×12 cm的发芽盒中进行试验,共设7个处理,3次重复,每个处理30粒小麦种子,以纯水和300 mmol·L−1NaCl溶液处理做为对照1 (ck1)和对照2 (ck2),CaCl2缓解浓度为5、10、20、40、60 mmol·L−1,具体处理见表1。
表 1 试验处理
Table 1. Treatment
处理 处理浓度 ck1 纯水 ck2 300 mmol·L−1NaCl 处理1 300 mmol·L−1NaCl + 5 mmol·L−1CaCl2 处理2 300 mmol·L−1NaCl + 10 mmol·L−1CaCl2 处理3 300 mmol·L−1NaCl + 20 mmol·L−1CaCl2 处理4 300 mmol·L−1NaCl + 40 mmol·L−1CaCl2 处理5 300 mmol·L−1NaCl + 60 mmol·L−1CaCl2 -
小麦种子发芽标准为胚芽长至种子长度的1/2,胚根与种子一样长视为该种子发芽。发芽率=(7 d内发芽种子数/供试种子总数)×100%;发芽势=(3 d内发芽种子数/供试种子总数) ×100%;发芽指数=∑(Gt/Dt),其中Gt表示t日的发芽数,Dt表示t日相应的发芽天数;活力指数=发芽指数×幼苗鲜质量。
-
处理14 d后,每个重复随机选取5株正常生长的小麦幼苗,分别测定苗长(从苗基部到叶尖)、胚芽鞘长、总根长以及鲜质量。
-
处理14 d后,每个重复称取0.5 g小麦嫩叶放入研钵中,加入10 mL磷酸缓冲液(50 mmol·L−1,pH 7.8),在冰上研磨成匀浆,匀浆倒入10 mL离心管中,以10 000 r·min−1的转速低温(4 ℃)离心20 min,离心后取上清液即为粗酶液,用于超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性及MDA的测定。SOD活性采用氮蓝四唑法测[14];POD活性采用愈创木酚法测定[15];CAT活性采用紫外吸收法测定[16];MDA采用硫代巴比妥酸法测定[17]。
-
采用Excel 2010、SPSS 19.0等对所测得的各项生理指标进行单因素方差(one-way ANOVA)分析。
-
由表2可知:300 mmol·L−1 NaCl处理下株系DH70和DH106的发芽率、发芽势、发芽指数以及活力指数与ck1相比均显著降低(P<0.05),株系DH70分别降低了70.4%、15.2%、40.9%和64.2%;株系DH106分别降低了67.7%、12.3%、36.3%和59.5%。施加不同浓度CaCl2后,2个株系小麦的发芽率、发芽势以及发芽指数与ck2相比均有不同程度的上升,且都以40 mmol·L−1 CaCl2的处理效果最佳。在40 mmol·L−1 CaCl2处理下,株系DH70的发芽率、发芽势、发芽指数以及活力指数比ck2分别显著提高了182.8%、33.4%、53.8%和125.7% (P<0.05),且发芽势较ck1相比提高了13.0%;株系DH106的发芽率、发芽势、发芽指数以及活力指数比ck2分别显著提高了159.3%、38.9%、50.0%和103.6% (P<0.05),且发芽势较ck1相比提高了16.3%。由此可见,300 mmol·L−1 NaCl处理显著抑制了2个株系小麦种子的萌发,而不同浓度的CaCl2处理均可不同程度缓解盐胁迫带来的伤害,其中以浓度40 mmol·L−1 CaCl2缓解效果最佳,但2个株系的缓解效应没有明显的差异。
表 2 CaCl2对盐胁迫下小麦种子萌发的影响
Table 2. Effect of CaCl2 on wheat seed germination under salt stress
处理 株系DH70 株系DH106 发芽率/% 发芽势/% 发芽指数 活力指数 发芽率/% 发芽势/% 发芽指数 活力指数 ck1 97.8±1.9 f 45.8±3.1 d 22.4±0.6 a 2.3±0.2 a 98.9±1.9 f 43.1±2.9 b 22.6±0.6 a 2.4±0.3 a ck2 28.9±3.9 a 38.6±2.2 f 13.5±0.4 d 0.8±0.3 e 32.2±2.0 a 35.8±1.2 c 14.4±0.5 d 1.0±0.2 e 处理1 47.8±1.9 b 38.3±1.9 ef 14.3±0.5 cd 1.0±0.2 e 46.7±3.1 b 36.2±3.3 c 15.1±0.4 d 1.1±0.5 de 处理2 63.3±3.3 c 40.9±1.3 ef 15.6±0.5 bcd 1.1±0.4 de 64.4±1.8 c 40.8±2.2 b 16.6±0.6 bc 1.2±0.2 cde 处理3 74.4±1.9 d 46.1±3.1 d 17.1±0.5 bc 1.3±0.2 cd 76.7±6.6 d 44.9±2.3b 18.3±0.5 cd 1.4±0.2 c 处理4 82.2±5.1 e 51.6±2.0 c 20.1±0.6 a 1.9±0.2 b 83.3±3.3 e 50.2±1.4 a 21.4±0.5 ab 2.0±0.4 b 处理5 66.7±3.3 c 41.8±1.8 e 17.3±0.5 b 1.4±0.2 c 64.3±8.4 c 49.4±2.4 a 17.5±0.5 cd 1.3±0.2 cd 说明:数据为平均值±标准差;不同小写字母表示同一株系在不同处理间差异显著(P<0.05)。 由表3可以看出:盐胁迫显著降低了株系DH70和DH106的苗长、总根长以及鲜质量,但是对胚芽鞘长影响不大,说明300 mmol·L−1 NaCl处理明显抑制了2个株系的幼苗生长。相比ck1,株系DH70苗长、总根长和鲜质量分别显著下降了53.0%、64.7%和40.5% (P<0.05);株系DH106的苗长、总根长和鲜质量分别显著下降了48.4%、63.4%及36.4% (P<0.05)。施加不同浓度CaCl2后,相比ck2,2个株系的苗长、总根长和鲜质量都有不同程度的增加,且都以40 mmol·L−1 CaCl2处理效果最佳,在该处理下,株系DH70的苗长、总根长和鲜质量比ck2分别提高了128.6%、165.0%及50.8%;株系DH106的苗长、总根长和鲜质量比ck2分别提高了101.2%、157.7%及37.1%。由此可得,300 mmol·L−1 NaCl显著抑制了2个株系小麦幼苗生长及生物量的积累(P<0.05),而施加不同浓度的CaCl2可不同程度缓解盐胁迫的抑制,且以施加40 mmol·L−1 CaCl2缓解的效果最好。株系DH70在苗长、总根长和鲜质量上得到的缓解效应高于DH106。
表 3 CaCl2对盐胁迫下小麦幼苗生长的影响
Table 3. Effect of CaCl2 on the growth of wheat seedlings under salt stress
处理 株系DH70 株系DH106 鲜质量/g 苗长/cm 胚芽鞘长/cm 总根长/cm 鲜质量/g 苗长/cm 胚芽鞘长/cm 总根长/cm ck1 0.103±0.003 a 15.5±0.8 a 5.8±0.3 a 42.7±3.4 a 0.105±0.002 a 14.5±0.7 a 4.8±0.3 a 45.3±1.7 a ck2 0.061±0.002 e 7.1±0.4 d 5.5±0.4 a 15.1±0.6 f 0.067±0.010 d 7.5±0.7 e 4.8±0.5 a 16.6±0.8 f 处理1 0.067±0.008 de 9.2±0.6 c 5.7±0.3 a 21.6±0.9 e 0.076±c0.002 d 10.2±0.9 d 5.0±0.1 a 22.5±1.7 e 处理2 0.069±0.001 d 11.5±0.7 b 5.9±0.3 a 28.2±0.6 d 0.074±0.002 cd 12.0±0.3 bc 5.0±0.4 a 29.2±1.2 d 处理3 0.077±0.006 c 12.7±0.8 b 5.7±0.6 a 33.4±0.9 c 0.079±0.003 c 12.3±0.6 b 4.5±0.4 a 33.4±0.8 c 处理4 0.092±0.005 e 16.2±0.9 a 5.7±0.3 a 40.0±0.6 b 0.091±0.001 b 15.0±0.7 a 4.9±0.3 a 42.8±0.7 b 处理5 0.082±0.002 c 15.4±1.3 b 5.9±0.3 a 34.5±0.9 b 0.075±0.006 c 14.9±0.5 a 4.8±0.1 a 34.7±1.2 c 说明:数据为平均值±标准差;不同小写字母表示同一株系在不同处理间差异显著(P<0.05)。 -
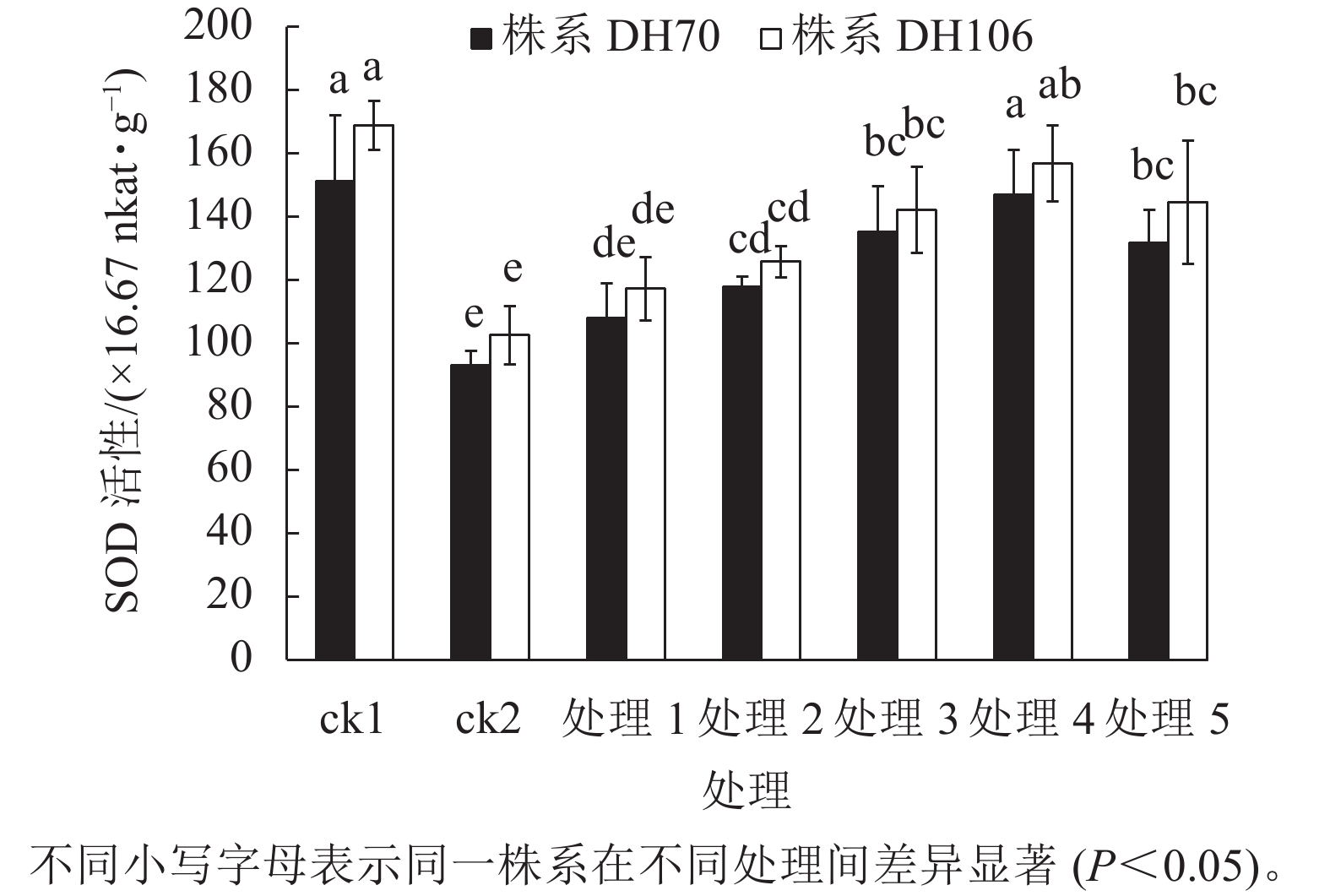
从图1可以看出:在盐胁迫下,2个株系的SOD活性与ck1相比均显著下降(P<0.05),株系DH70和DH106的SOD活性较ck1分别下降了38.5%、39.3%。施加不同浓度CaCl2后,2个株系的SOD活性均有提升。在5、10、20、40、60 mmol·L−1 CaCl2处理下,株系DH70的SOD活性较ck2相比分别提高了16.0%、26.9%、45.4%、58.0%、41.7%,株系DH106的SOD活性较ck2相比分别提高了14.3%、22.7%、38.6%、52.9%、40.9%,2个株系的SOD活性都在CaCl2浓度为40 mmol·L−1时达到最高,即该浓度的CaCl2对盐胁迫的缓解效果最佳,而当浓度达60 mmol·L−1时,SOD活性下降,说明过高浓度的CaCl2缓解能力反而下降,且株系DH70比株系DH106具有更高的缓解效应。
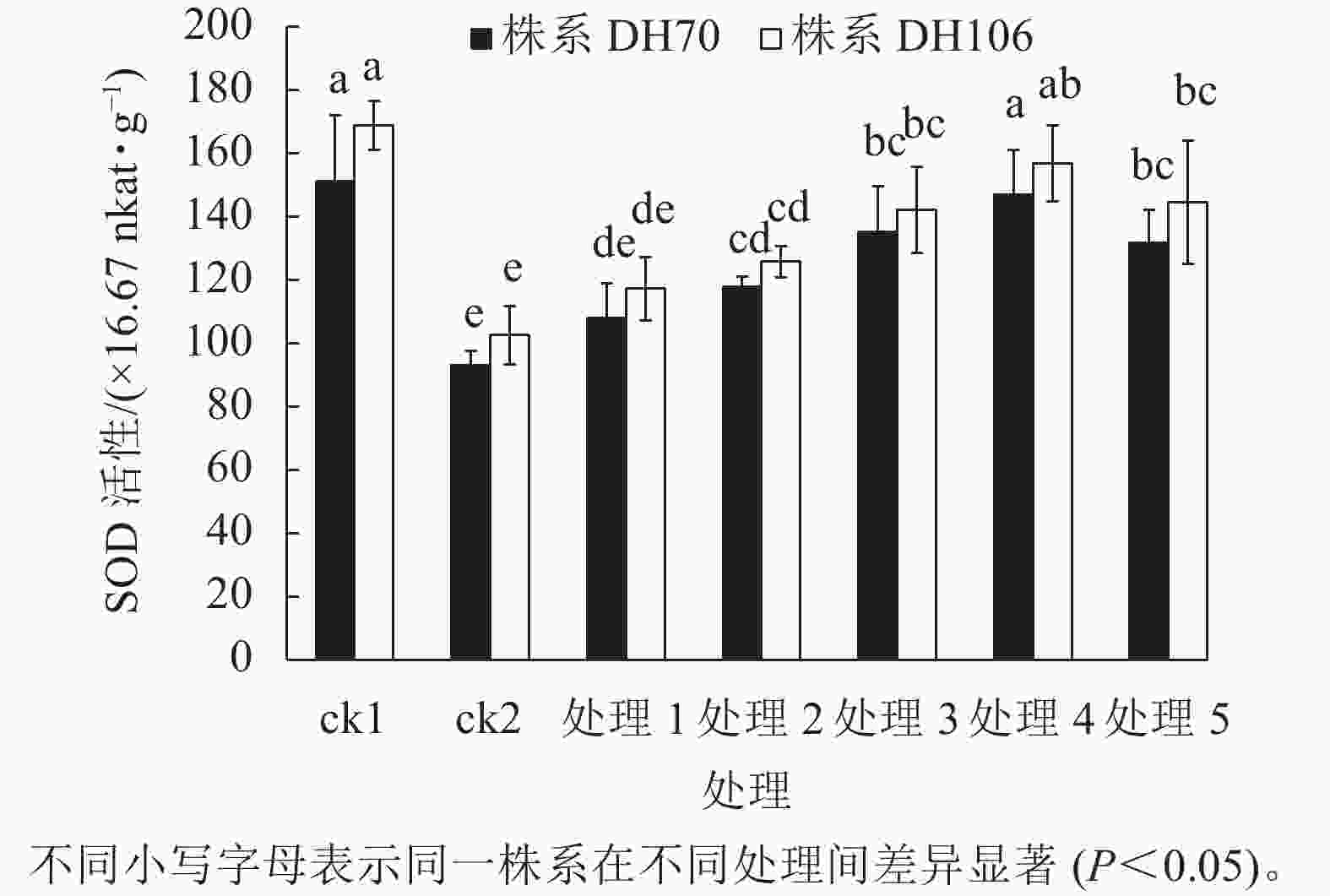
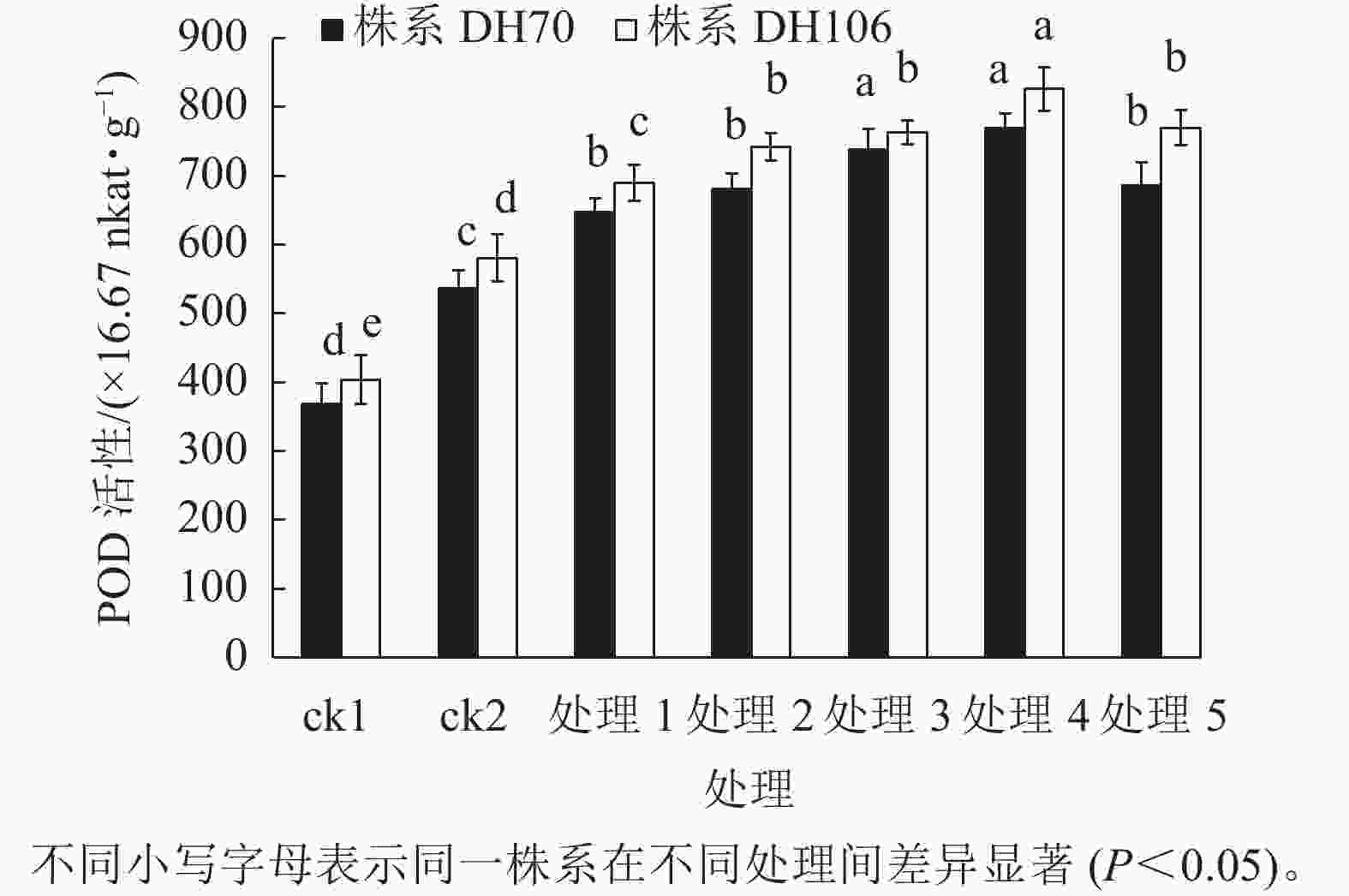
图 1 外源CaCl2对盐胁迫下幼苗SOD活性的影响
Figure 1. Effect of exogenous CaCl2 on SOD activity of seedlings under salt stress
由图2可知:盐胁迫显著提高了小麦幼苗的POD活性(P<0.05),株系DH70的POD活性较ck1相比增加了45.5%,株系DH106的POD活性较ck1相比增加了43.9%。在5、10、20、40、60 mmol·L−1 CaCl2处理后,小麦幼苗的POD活性均得到了提升,株系DH70的POD活性较ck2分别提高了20.7%、27.0%、37.6%、43.5%、27.8%,株系DH106的POD活性较ck2分别提高了18.8%、27.8%、31.4%、42.3%、32.5%,都以40 mmol·L−1 CaCl2处理缓解效果最好。当CaCl2浓度达60 mmol·L−1时,小麦POD活性开始下降,说明缓解效果减弱。由图3可以看出:各处理下CAT活性的变化趋势与POD活性的变化趋势相似,都呈先提高后下降的趋势。在300 mmol·L−1的盐胁迫下,小麦CAT活性较ck1显著提高(P<0.05),株系DH70的CAT活性提高了61.3%,株系DH106的CAT活性提高了56.4%。CaCl2处理提高了小麦CAT活性,其中40 mmol·L−1 CaCl2处理缓解效果最佳。在5、10、20、40、60 mmol·L−1 CaCl2处理后,株系DH70的CAT活性较ck2相比分别提高了4.1%、8.4%、13.3%、21.8%、10.7%,其中只有40 mmol·L−1 CaCl2处理达到了显著水平(P<0.05);株系DH106的CAT活性较ck2相比分别提高了6.1%、17.9%、22.4%、35.7%、18.9%。
-
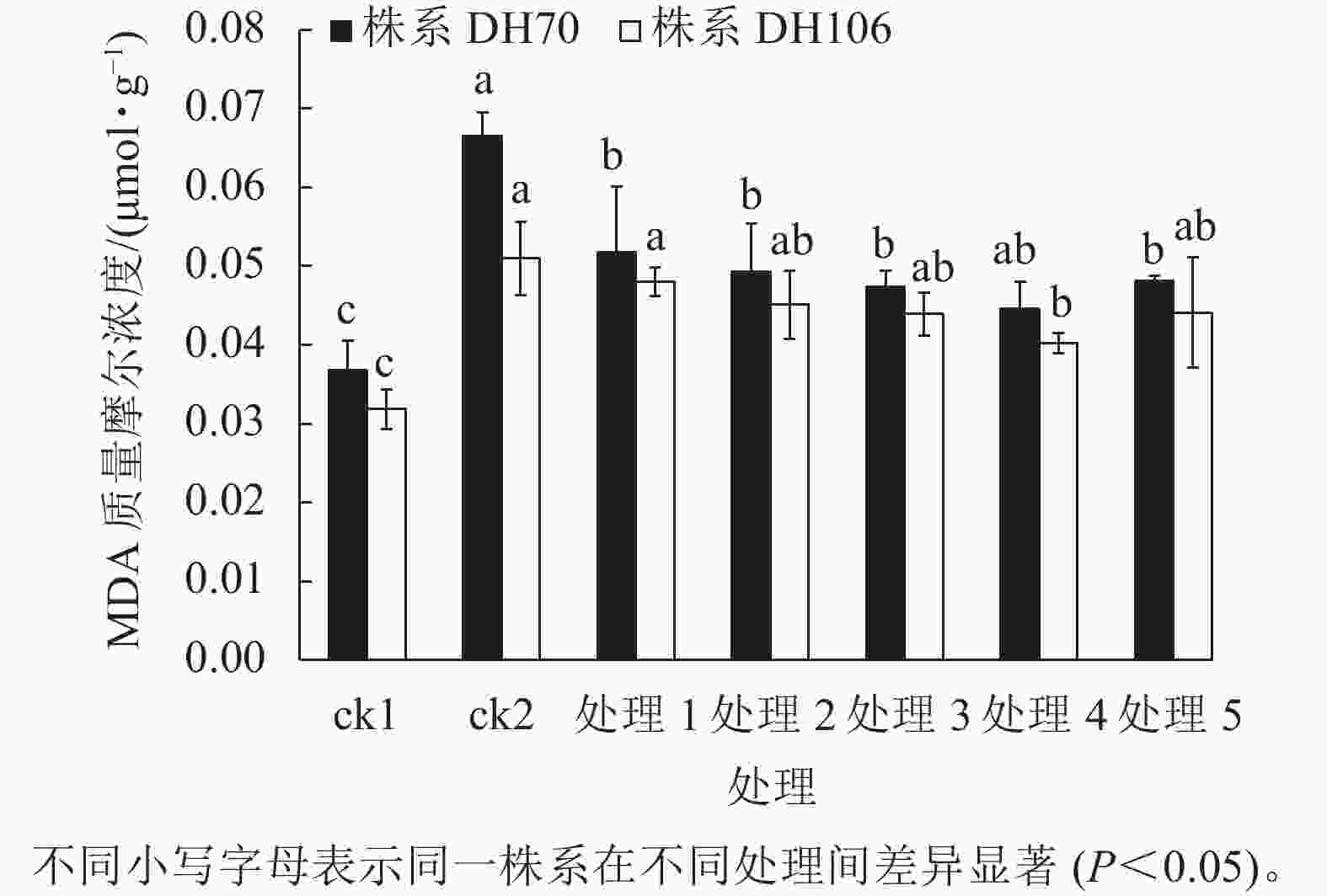
由图4可以看出:300 mmol·L−1盐胁迫使小麦幼苗的MDA质量摩尔浓度显著增高(P<0.05),说明在盐胁迫下细胞受损严重,株系DH70和DH106在盐胁迫下的MDA比ck1分别显著增加了81.0%和60.2% (P<0.05)。CaCl2处理可缓解小麦细胞损伤,减少MDA的积累,且以浓度为40 mmol·L−1时效果最佳,达到了显著水平(P<0.05)。在5、10、20、40、60 mmol·L−1 CaCl2处理后,株系DH70的MDA质量摩尔浓度较ck2相比分别减少了22.2%、25.9%、28.7%、33.0%、27.7%,株系DH106的MDA质量摩尔浓度较ck2相比分别减少了5.8%、11.6%、13.9%、21.1%、13.5%,说明CaCl2缓解效应在不同小麦株系中存在差异,株系DH70响应稍强于DH106。
-
本研究表明:盐胁迫显著降低了2个株系小麦的发芽率、发芽势、发芽指数、苗长、根长以及鲜质量,这与QUAN等[18]的研究结果相一致,说明盐胁迫抑制了小麦种子的萌发及生长,且早衰株系DH70的下降幅度要大于延迟衰老株系DH106。外源施加Ca2+可有效缓解盐胁迫对小麦的抑制作用,显著提高小麦种子的萌发率和生长能力,其最佳缓解浓度为40 mmol·L−1,且对株系DH70的缓解效应强于株系DH106。表明早衰型小麦的耐盐性要低于延迟衰老型的小麦,但早衰型小麦受到外源物质的缓解作用要比延迟衰老型小麦强。
活性氧(ROS)是植物在细胞代谢过程中的天然副产物,并且在细胞信号传导和体内平衡中具有重要作用,盐胁迫等极端的环境条件会导致植物体内ROS水平急剧增加,从而导致脂肪、蛋白质和核酸的恶化,最终导致植物死亡[19]。因此细胞需要形成一个平衡的系统来抵御ROS的影响,如抗氧化防御系统,抗氧化酶包括SOD、POD、CAT等。SOD可以与抗坏血酸过氧化物酶(APX)、POD和CAT共同作用清除ROS,使自由基活性氧维持在一个对植物细胞无害的水平,减轻ROS对植物的伤害。在本研究中,施加不同浓度CaCl2使得小麦幼苗的SOD、POD和CAT活性较ck2均显著提高,说明外源CaCl2处理可以显著提高逆境胁迫中植物体内的抗氧化酶活性,一定程度缓解盐胁迫对植物的伤害,这与刘艺平等[20]、宋珊珊等[21]、刘丽云等[22]的研究结果一致。随着CaCl2浓度的增加,小麦幼苗的抗氧化酶活性均呈先上升后下降的变化趋势,且在CaCl2浓度为40 mmol·L−1时达到最大。本研究表明:不同浓度CaCl2处理对盐胁迫下2个株系小麦幼苗抗氧化酶活性的缓解效应不同,对株系DH70的缓解作用要强于株系DH106,说明早衰型小麦受到的缓解作用比延迟衰老型小麦强。植物体中MDA质量摩尔浓度的高低可以反映细胞膜受损的程度即植物在逆境胁迫下受到的伤害程度。本研究中,盐胁迫显著提高了小麦幼苗中的MDA质量摩尔浓度,说明在盐胁迫下小麦细胞膜受到了明显的伤害,且株系DH70的MDA质量摩尔浓度上升幅度显著大于株系DH106,表明早衰型小麦的抗盐性低于延迟衰老型小麦。CaCl2处理显著缓解了盐胁迫对细胞膜的伤害,且表现为早衰型小麦DH70的响应强于延迟衰老型小麦DH106,CaCl2浓度为40 mmol·L−1时缓解效果最佳。在本研究中,CaCl2浓度达60 mmol·L−1时,其缓解能力下降,说明过高浓度的CaCl2处理抑制植物生长,这可能是由于细胞质中维持了过多的钙离子从而伤害了细胞质活性。
本研究结果表明:施加外源CaCl2浓度为40 mmol·L−1时,对盐胁迫的缓解效果最佳,这与闫振等[23]对蔷薇Hulthemia berberifolia的最适缓解浓度为10 mmol·L−1有所不同,推测CaCl2对盐胁迫下不同植物的缓解效果不同,因此研究所得的最适调控浓度也不同;与侯颖等[24]研究所得的对盐胁迫下小麦的最适调控浓度为6 mmol·L−1也不相同,说明即使研究材料同为小麦,若基因型不同,受到CaCl2的缓解效果也不尽相同。
综上所述,2个基因型的小麦株系在300 mmol·L−1盐胁迫下生长受到了明显的抑制,且表现出早衰型小麦DH70受到盐胁迫的伤害大于延迟衰老型小麦DH106。不同浓度的CaCl2处理均增强了小麦幼苗的抗氧化酶活性,提高了小麦幼苗的耐盐性,减轻了小麦所受盐害,且各浓度的CaCl2处理对盐胁迫的缓解效果存在差异,以40 mmol·L−1的浓度缓解效果最佳。
Alleviative effect of exogenous calcium ions on growth physiology of different senescence types of wheat seedlings under salt stress
-
摘要:
目的 探讨延迟衰老型小麦Triticum aestivum与早衰型小麦的耐盐性,确定钙缓解小麦盐胁迫的最佳浓度及其机制。 方法 选用小麦加倍单倍体群体(DH)中的早衰株系DH70和延迟衰老株系DH106作为材料,以预实验所筛选的300 mmol·L−1盐溶液对小麦进行胁迫,比较2个株系之间的耐盐性,再以不同浓度(5、10、20、40、60 mmol·L−1)氯化钙(CaCl2)溶液对盐胁迫下的小麦进行处理,确定CaCl2溶液缓解盐胁迫的最佳浓度。 结果 ①300 mmol·L−1盐溶液胁迫显著抑制了小麦种子的萌发和幼苗的生长,且延迟衰老型小麦DH106表现出更好的耐盐性(P<0.05)。②施加不同浓度CaCl2溶液均一定程度上缓解了盐害,使2个株系小麦的发芽率、苗长、根长和鲜质量等指标较300 mmol·L−1 盐胁迫处理均显著增加(P<0.05),超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性较盐胁迫处理显著提高(P<0.05),而丙二醛(MDA)质量摩尔浓度较盐胁迫处理显著下降(P<0.05),并且以40 mmol·L−1 CaCl2处理缓解效果最佳。③在40 mmol·L−1 CaCl2处理下,早衰株系DH70的SOD、POD活性分别提高了58.0%、43.5%,MDA质量摩尔浓度下降了33.0%,延迟衰老株系DH106的SOD、POD活性分别提高了52.9%、42.3%,MDA质量摩尔浓度下降了21.1%。 结论 盐胁迫显著抑制了小麦的正常生长发育,且延迟衰老型小麦表现出较好的耐盐性。外源施加CaCl2可提高小麦抗氧化酶活性、降低MDA质量摩尔浓度,增强小麦耐盐能力,并且以浓度为40 mmol·L−1处理效果最佳。图4表3参24 Abstract:Objective This study, with an exploration of the salt tolerance of delayed aging wheat (Triticum aestivum) and premature aging wheat, is aimed to determine the optimal concentration and mechanism of calcium to alleviate salt stress in wheat. Method First, with the premature senescence strain DH70 and delayed senescence strain DH106 in the wheat doubled haploid (DH) population selected as materials, the wheat was subjected to stress with a 300 mmol·L−1 salt solution selected from the preliminary experiment before a comparison was made of the salt tolerance between the two materials. Then, different concentrations (5, 10, 20, 40, 60 mmol·L−1) of calcium chloride solution were used to treat wheat under salt stress before the optimal concentration of calcium chloride solution to alleviate salt stress was determined. Result (1) The stress of 300 mmol·L−1 salt solution significantly inhibited the germination of wheat seeds and the growth of seedlings, and the delayed aging type of wheat DH106 showed better salt tolerance (P<0.05). (2)The application of different concentrations of CaCl2 solution alleviated the salt injury to a certain extent, so that the germination rate, seedling length, root length and fresh weight of the two materials of wheat were significantly increased compared with those with 300 mmol·L−1 salt stress treatment (P<0.05) and the activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) were significantly increased compared with those after salt treatment (P<0.05), while the content of malondialdehyde (MDA) was significantly decreased compared with that after salt treatment (P<0.05), with the best relief effect achieved with 40 mmol·L−1 CaCl2 treatment. (3)Under the treatment of 40 mmol·L−1 CaCl2, the SOD and POD activities of the premature aging strain DH70 increased by 58.0% and 43.5%, respectively, while the MDA content decreased by 33.0% and the SOD and POD activities of the delayed aging strain DH106 increased by 52.9% and 42.3%, respectively, whereas the MDA content decreased by 21.1%. Conclusion Salt stress significantly inhibited the normal growth and development of wheat, and delayed senescence type wheat showed good salt tolerance exogenous application of CaCl2 can increase wheat antioxidant enzyme activity, reduce MDA content, and enhance wheat salt tolerance. And the best treatment effect is achieved with a concentration of 40 mmol·L−1 CaCl2. [Ch, 4 fig. 3 tab. 24 ref.] -
Key words:
- wheat /
- premature senescence /
- delayed aging /
- salt stress /
- calcium ion /
- relieve
-
表 1 试验处理
Table 1. Treatment
处理 处理浓度 ck1 纯水 ck2 300 mmol·L−1NaCl 处理1 300 mmol·L−1NaCl + 5 mmol·L−1CaCl2 处理2 300 mmol·L−1NaCl + 10 mmol·L−1CaCl2 处理3 300 mmol·L−1NaCl + 20 mmol·L−1CaCl2 处理4 300 mmol·L−1NaCl + 40 mmol·L−1CaCl2 处理5 300 mmol·L−1NaCl + 60 mmol·L−1CaCl2 表 2 CaCl2对盐胁迫下小麦种子萌发的影响
Table 2. Effect of CaCl2 on wheat seed germination under salt stress
处理 株系DH70 株系DH106 发芽率/% 发芽势/% 发芽指数 活力指数 发芽率/% 发芽势/% 发芽指数 活力指数 ck1 97.8±1.9 f 45.8±3.1 d 22.4±0.6 a 2.3±0.2 a 98.9±1.9 f 43.1±2.9 b 22.6±0.6 a 2.4±0.3 a ck2 28.9±3.9 a 38.6±2.2 f 13.5±0.4 d 0.8±0.3 e 32.2±2.0 a 35.8±1.2 c 14.4±0.5 d 1.0±0.2 e 处理1 47.8±1.9 b 38.3±1.9 ef 14.3±0.5 cd 1.0±0.2 e 46.7±3.1 b 36.2±3.3 c 15.1±0.4 d 1.1±0.5 de 处理2 63.3±3.3 c 40.9±1.3 ef 15.6±0.5 bcd 1.1±0.4 de 64.4±1.8 c 40.8±2.2 b 16.6±0.6 bc 1.2±0.2 cde 处理3 74.4±1.9 d 46.1±3.1 d 17.1±0.5 bc 1.3±0.2 cd 76.7±6.6 d 44.9±2.3b 18.3±0.5 cd 1.4±0.2 c 处理4 82.2±5.1 e 51.6±2.0 c 20.1±0.6 a 1.9±0.2 b 83.3±3.3 e 50.2±1.4 a 21.4±0.5 ab 2.0±0.4 b 处理5 66.7±3.3 c 41.8±1.8 e 17.3±0.5 b 1.4±0.2 c 64.3±8.4 c 49.4±2.4 a 17.5±0.5 cd 1.3±0.2 cd 说明:数据为平均值±标准差;不同小写字母表示同一株系在不同处理间差异显著(P<0.05)。 表 3 CaCl2对盐胁迫下小麦幼苗生长的影响
Table 3. Effect of CaCl2 on the growth of wheat seedlings under salt stress
处理 株系DH70 株系DH106 鲜质量/g 苗长/cm 胚芽鞘长/cm 总根长/cm 鲜质量/g 苗长/cm 胚芽鞘长/cm 总根长/cm ck1 0.103±0.003 a 15.5±0.8 a 5.8±0.3 a 42.7±3.4 a 0.105±0.002 a 14.5±0.7 a 4.8±0.3 a 45.3±1.7 a ck2 0.061±0.002 e 7.1±0.4 d 5.5±0.4 a 15.1±0.6 f 0.067±0.010 d 7.5±0.7 e 4.8±0.5 a 16.6±0.8 f 处理1 0.067±0.008 de 9.2±0.6 c 5.7±0.3 a 21.6±0.9 e 0.076±c0.002 d 10.2±0.9 d 5.0±0.1 a 22.5±1.7 e 处理2 0.069±0.001 d 11.5±0.7 b 5.9±0.3 a 28.2±0.6 d 0.074±0.002 cd 12.0±0.3 bc 5.0±0.4 a 29.2±1.2 d 处理3 0.077±0.006 c 12.7±0.8 b 5.7±0.6 a 33.4±0.9 c 0.079±0.003 c 12.3±0.6 b 4.5±0.4 a 33.4±0.8 c 处理4 0.092±0.005 e 16.2±0.9 a 5.7±0.3 a 40.0±0.6 b 0.091±0.001 b 15.0±0.7 a 4.9±0.3 a 42.8±0.7 b 处理5 0.082±0.002 c 15.4±1.3 b 5.9±0.3 a 34.5±0.9 b 0.075±0.006 c 14.9±0.5 a 4.8±0.1 a 34.7±1.2 c 说明:数据为平均值±标准差;不同小写字母表示同一株系在不同处理间差异显著(P<0.05)。 -
[1] ZHAO Shuangshuang, ZHANG Qikun, LIU Mingyue, et al. Regulation of plant responses to salt stress [J/OL]. International Journal of Molecular Sciences, 2021, 22(9): 4609[2022-10-20]. doi:10.3390/ijms22094609. [2] 赵野, 刘威, 王贺, 等. 外源CaCl2对盐胁迫下西伯利亚白刺活性氧代谢的影响[J]. 植物生理学报, 2021, 57(5): 1105 − 1112. ZHAO Ye, LIU Wei, WANG He, et al. Effects of exogenous CaCl2 on reactive oxygen species metabolism in Nitraria sibirica under NaCl stress [J]. Plant Physiology Journal, 2021, 57(5): 1105 − 1112. [3] 赵宝泉, 邢锦城, 王静, 等. 水杨酸对盐胁迫下杭白菊幼苗生长和生理特性的影响[J]. 吉林农业大学学报, 2020, 42(4): 370 − 379. ZHAO Baoquan, XING Jincheng, WANG Jing, et al. Effects of exogenous salicylic acid on growth and physiological properties of Chrysanthemum morifolium seedlings under salt stress [J]. Journal of Jilin Agricultural University, 2020, 42(4): 370 − 379. [4] TIAN Xianyi, HE Mingrong, WANG Zhenlin, et al. Application of nitric oxide and calcium nitrate enhances tolerance of wheat seedlings to salt stress [J]. Plant Growth Regulation, 2015, 77(3): 343 − 356. [5] STEINHORST L, HE Gefeng, MOORE L K, et al. A Ca2+-sensor switch for tolerance to elevated salt stress in Arabidopsis [J]. Developmental Cell, 2022, 57(17): 2081 − 2094. [6] 张胜珍, 马艳芝. 氯化钙对盐胁迫下荆芥种子萌发及幼苗生理特性的影响[J]. 中国农业科技导报, 2021, 23(7): 65 − 71. ZHANG Shengzhi, MA Yanzhi. Effects of CaCl2 on seed germination and seedling physiological characteristics of Schizonepeta tenuifolia Briq. under salt stress [J]. Journal of Agricultural Science and Technology, 2021, 23(7): 65 − 71. [7] ZHAO Huijie, TAN Jifang. Role of calcium ion in protection against heat and high irradiance stress-induced oxidative damage to photosynthesis of wheat leaves [J]. Photosynthetica, 2005, 43(3): 473 − 476. [8] 赵腾飞, 刘颖, 王尔美, 等. 外源钙离子对铅胁迫下小麦膜脂过氧化和根系活力的影响[J]. 安徽农业大学学报, 2017, 44(3): 508 − 512. ZHAO Tengfei, LIU Ying, WANG Ermei, et al. Effects of exogenous Ca2+ on membrane lipid peroxidation and root activity of wheat under lead stress [J]. Journal of Anhui Agricultural University, 2017, 44(3): 508 − 512. [9] 王宝增, 孙国微. 外源钙对小麦幼苗耐盐性的影响[J]. 湖北农业科学, 2009, 48(5): 1070 − 1072. WANG Baozeng, SUN Guowei. Influence of exogenous calcium on salt tolerance of wheat seedlings [J]. Hubei Agricultural Sciences, 2009, 48(5): 1070 − 1072. [10] 张强. 小麦叶片衰老基因TaLS-2D的图位克隆[D]. 北京: 中国农业科学院, 2018. ZHANG Qiang. Map-based Cloning of Leaf Senescence Gene TaLS-2D in Hexaploid Wheat (Triticum aestivum L.) [D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. [11] SULTANA N, ISLAM S, JUHASZ A, et al. Wheat leaf senescence and its regulatory gene network [J]. The Crop Journal, 2021, 9(4): 703 − 717. [12] 刘道宏. 植物叶片的衰老[J]. 植物生理学通讯, 1983(2): 14 − 19. LIU Daohong. Senescence of plant leaves [J]. Plant Physiology Communications, 1983(2): 14 − 19. [13] 王中秋. 普通小麦-野生二粒小麦染色体臂置换系在小麦遗传育种中的应用[D]. 杭州: 浙江农林大学, 2019. WANG Zhongqiu. Application of Chromosome Arm Substitution Lines of Triticum dicoccoides in the Background of Common Wheat in Wheat Genetics and Breeding [D]. Hangzhou: Zhejiang A&F University, 2019. [14] STEWART R R C, BEWLEY J D. Lipid peroxidation associated with accelerated aging of soybean axes [J]. Plant Physiology, 1980, 65(2): 245 − 248. [15] NICKEL K S, CUNNINGHAM B A. Improved peroxidase assay method using leuco 2,3',6-trichloroindophenol and application to comparative measurements of peroxidatic catalysis [J]. Analytical Biochemistry, 1969, 27(2): 292 − 299. [16] PATRA H K, KAR M, MISHRA D. Catalase activity in leaves and cotyledons during plant development and senescence [J]. Biochemie und Physiologie der Pflanzen, 1978, 172(4): 385 − 390. [17] HEATH R L, PACKER L. Photoperoxidation in isolated chloroplasts (Ⅰ) Kinetics and stoichiometry of fatty acid peroxidation [J]. Archives of Biochemistry and Biophysics, 1968, 125(1): 189 − 198. [18] QUAN Xiaoyan, LIANG Xiaoli, LI Hongmei, et al. Identification and characterization of wheat germplasm for salt tolerance [J/OL]. Plants, 2021, 10(2): 268[2022-10-20]. doi:10.3390/plants10020268. [19] KAPOOR D, SINGH S, KUMAR V, et al. Antioxidant enzymes regulation in plants in reference to reactive oxygen species (ROS) and reactive nitrogen species (RNS) [J/OL]. Plant Gene, 2019, 19: 100182[2022-10-20]. doi:10.1016/j.plgene.2019.100182. [20] 刘艺平, 苏少文, 张琳, 等. 外源钙对盐胁迫下荷花生理特性的影响[J]. 河南农业大学学报, 2020, 54(4): 604 − 612. LIU Yiping, SU Shaowen, ZHANG Lin, et al. Effects of exogenous calcium on the physiological characteristics of lotus under salt stress [J]. Journal of Henan Agricultural University, 2020, 54(4): 604 − 612. [21] 宋珊珊, 杨方圆, 杨莎, 等. 钙离子对盐胁迫下花生根系发育的调控[J]. 植物生理学报, 2021, 57(7): 1547 − 1558. SONG Shanshan, YANG Fangyuan, YANG Sha, et al. Regulation of calcium ion on root development of peanut under salt stress [J]. Plant Physiology Journal, 2021, 57(7): 1547 − 1558. [22] 刘丽云, 王明友. CaCl2对盐胁迫下小麦种子萌发及生理效应的影响[J]. 河南农业科学, 2010(1): 5 − 7. LIU Liyun, WANG Mingyou. Effect of CaCl2 on germination of wheat seeds under salt stress [J]. Journal of Henan Agricultural Sciences, 2010(1): 5 − 7. [23] 闫振, 李进, 阿丽努尔·阿卜来提, 等. 外源钙对盐胁迫下单叶蔷薇种子萌发和幼苗生长的影响[J]. 草地学报, 2022, 30(5): 1185 − 1193. YAN Zhen, LI Jin, Alinuer Abulaiti, et al. Effects of exogenous calcium on seed germination and seedling growth of Hulthemia berberifolia under salt stress [J]. Acta Agrestia Sinica, 2022, 30(5): 1185 − 1193. [24] 侯颖, 谢震. 盐胁迫下氯化钙对小麦种子萌发及幼苗生长的影响[J]. 商丘师范学院学报, 2021, 37(3): 44 − 48. HOU Ying, XIE Zhen. Effect of calcium chloride on wheat seed germination and seedling growth under salt stress [J]. Journal of Shangqiu Normal University, 2021, 37(3): 44 − 48. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220677






 下载:
下载: