-
土壤是动植物活动以及微生物进行物质交换的场所,是人类赖以生存的最重要的物质基础之一[1−2]。工矿“三废”大量排放、长期不合理施肥、大气沉降等原因导致农田土壤环境质量问题日趋严峻[3−4],土壤重金属污染是其中之一。重金属不能自然降解,隐蔽性强,来源复杂,在输入源基础上不断富集,通过土壤迁移到地下水和农作物中,进一步通过食物链危害动物和人体健康[5−6]。农田土壤重金属污染来源众多,既与区域地球化学过程和成土环境有关,又受到采矿、农业生产和交通运输等人为活动的影响,造成不同重金属元素的污染程度和空间分布存在较大差异[7]。因此,有必要对农田周围土壤的重金属污染程度以及污染来源进行调查评价[8]。
土壤重金属污染评价方法较多,可分为3类,包括以单因子指数法[9]、内梅罗综合指数法[10]、地积累指数法[11]、潜在生态风险指数法[12]等为代表的指数法,以健康风险评价模型[13]为代表的模型模拟法,以及基于地理信息系统(GIS)进行空间分析的GIS分析法[14]。这些评价方法通过土壤重金属质量分数变化和内在关联性,量化重金属的累积情况,从而对土壤重金属污染情况进行分等定级,但目前尚未形成统一的标准和方法[15−16]。因此,应根据不同土壤状况,综合运用多种评价方法或模型并改进,从而提高土壤重金属评价分析的精度和科学性[17]。
矿山开发过程中的污染物排放,以及过度施肥、畜禽养殖和生活污水排放等原因,导致浙江省丽水市莲都区耕地受到不同程度的重金属污染,其中以莲都区某乡耕地土壤重金属污染问题最为突出。为了解区域重金属污染基本情况,实现区域土壤风险基本管控,本研究利用空间分析研究区土壤重金属污染状况,评估研究区内重金属污染带来的潜在生态风险[18],通过主成分分析法对研究区潜在污染源进一步识别[19],为后续全面开展土壤安全管理和污染综合治理提供科学依据。
-
研究区位于浙江省丽水市莲都区某乡(28°32′28″~28°38′28″N,119°53′18″~119°59′45″E),总面积为64.14 km2,区域土壤为红壤类,黄红壤亚类,地形以山地丘陵为主。气候属中亚热带季风气候类型,温暖湿润,雨量充沛,四季分明,具有明显的山地立体气候特征,年平均气温为17.8 ℃,年平均降水量为1 568.4 mm,年日照时数为1 676.6 h。土壤基本理化性质:有机质34.26 g·kg−1、全氮2.08 g·kg−1、pH 5.06、速效钾166.59 mg·kg−1、有效磷51.98 mg·kg−1、碱解氮95.89 mg·kg−1。
-
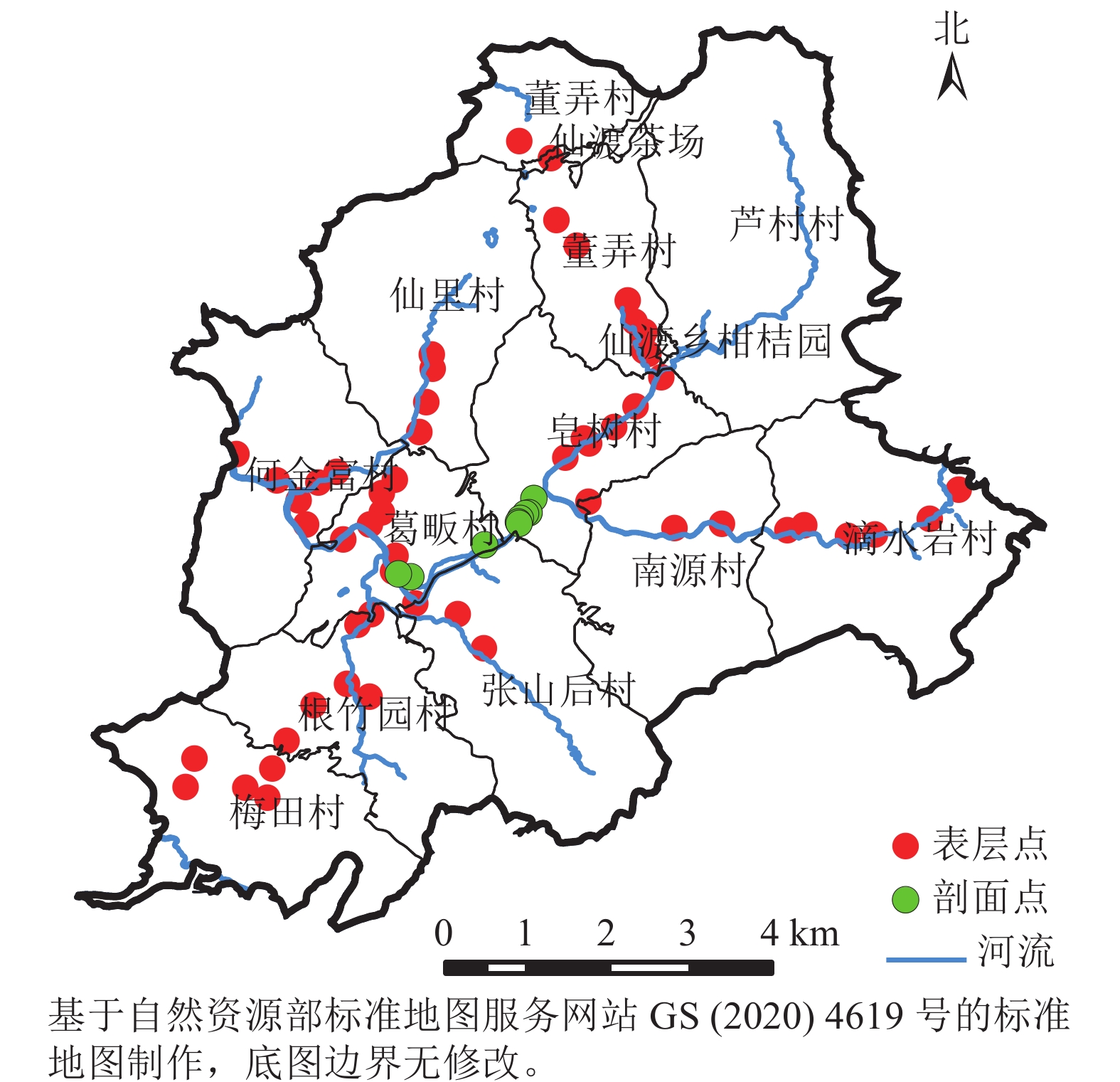
根据研究区耕地沿河流分布的特点,在河流两侧设置采样点(图1),原则上河流距离采样点位置不超过1 km,点位间距约1 km。为探究土壤重金属垂直分布特征,在养猪场排放沼液区域布设10个剖面点位(P1~P10),点位相距约0.1 km。共采集66份土壤样品,其中0~20 cm耕层土壤样品56份,0~100 cm剖面土壤样品10份。为保证土壤样品代表性,在5 m×5 m正方形区域内采集5~8个独立样品,按照四分法混样后装入布袋,每个土样约1 kg,采样时用GPS记录点位坐标。土壤样品自然风干后挑拣出石子、动植物残体等,混匀磨碎后分别过2.00和0.15 mm筛备用。测试指标包括土壤有机质、全氮、pH、速效钾、有效磷、碱解氮,以及砷(As)、汞(Hg)、镉(Cd)、铅(Pb)、铬(Cr)等5种重金属元素。
有机质采用重铬酸钾外加热法测定;土壤pH采用pH计法(土水质量比为1∶2)测定;全氮用半微量凯氏定氮法测定;碱解氮采用氢氧化钠(NaOH)碱解扩散法测定;有效磷采用碳酸氢钠(NaHCO3)浸提-钼锑抗分光光度法测定;速效钾采用乙酸铵(NH4OAc)浸提-火焰光度测定[20]。土壤Cd、Pb和Cr采用离子体质谱法(ICP-MS)测定;As和Hg采用原子荧光光谱法(AFS)测定。以国家标准物质土壤标准样作为质量控制,测定结果的相对标准偏差<5%。
-
以GB 15618—2018《土壤环境质量 农用地土壤污染风险管控标准》中的农用地污染风险筛值(Cd、Pb、Cr、Hg、As的风险筛值分别为0.3、70.0、150.0、1.3、40.0 mg·kg−1,pH≤5.5)[21]为参照值,采用单项污染指数(Pi)和内梅罗指数(P综合)对研究区土壤重金属进行污染评价,评价分级参见文献[22]。以浙江省土壤背景值(Cd、Pb、Cr、Hg、As的背景值分别为0.07、23.70、52.90、0.09、9.20 mg·kg−1)为参照值[23],采用地积累指数(Igeo)评价土壤重金属污染的地积累指数,评价分级参见文献[24]。以GB 15618—2018中的农用地污染风险筛值[21]为标准,采用潜在生态风险指数[某一重金属的潜在生态危害系数($E_{\rm{r}}^i $)和综合潜在生态风险指数(IR)]评价土壤重金属污染的潜在生态风险[25−26],并用生态风险预警指数(IER)进行土壤重金属污染的预警评估,其中Cd、Pb、Cr、Hg、As的毒性系数分别为30、5、2、40、10,评价等级参见文献[16]。
-
采用Excel 2016和SPSS 22.0对土壤重金属进行统计分析,运用ArcGIS 10.5绘制土壤采样分布图和重金属空间分布图,利用Origin Pro 2021绘制土壤重金属分布箱体图和剖面图,用主成分分析法分析土壤重金属来源。
-
由表1表明:研究区土壤Cd、Pb、Cr、Hg、As平均质量分数分别为0.39、69.41、40.38、0.10和3.36 mg·kg−1。与农田评价标准(GB 15618—2018)对比发现,研究区大部分土壤Cr、Hg、As质量分数低于土壤污染风险筛选值;土壤Cd和Pb超标率分别为60.71%和39.29%,但均低于农用地土壤污染风险管控值。土壤Cr和As平均质量分数未超过浙江省土壤环境背景值,Cd、Pb和Hg平均质量分数均分别为背景值的5.63、2.93和1.11倍。从5种重金属的变异系数来看,Cr和As元素的变异系数大于100%,属于强变异,表明受到人类干扰较大;Cr、Hg、Pb变异系数为10%~100%,属于中等变异。土壤中Cr和As的偏度系数和峰度系数显著高于其他土壤重金属,但平均质量分数低于污染风险筛选值,表明土壤中Cr和As在局部区域呈现高累积状态。
表 1 土壤重金属统计分析
Table 1. Descriptive statistics of heavy metals in soil
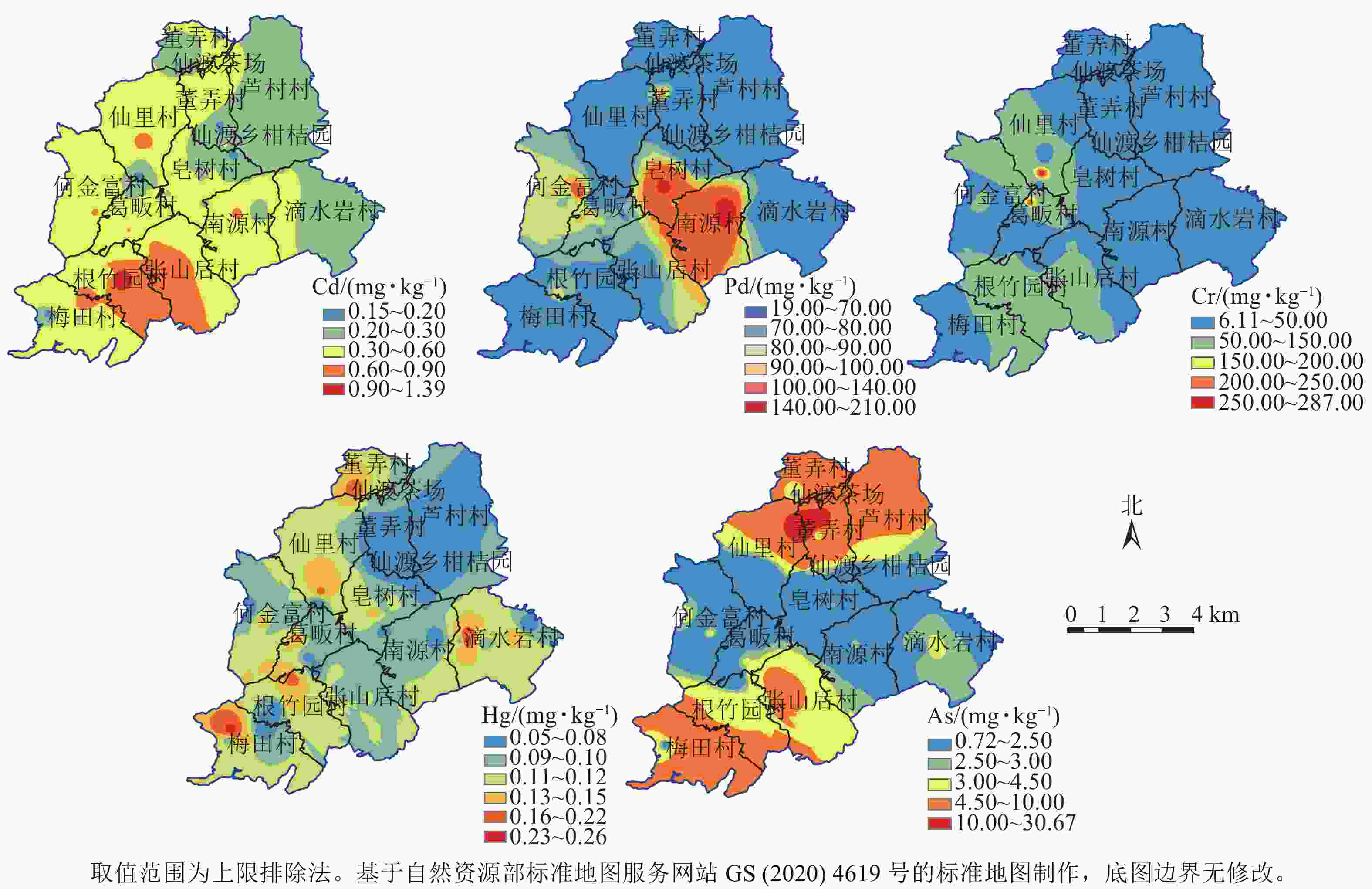
统计指标 重金属质量分数/(mg·kg−1) Cd Pb Cr Hg As 平均值 0.39 69.41 40.38 0.10 3.36 最小值 0.15 18.99 6.07 0.05 0.71 最大值 1.39 210.45 287.20 0.26 30.67 标准差 0.22 36.79 49.72 0.05 4.19 变异系数/% 55.61 53.00 123.14 47.08 124.69 偏度 2.11 1.61 3.88 1.55 5.27 峰度 6.83 3.61 16.65 2.62 33.53 图2表明:所有土壤Cd的质量分数高于浙江省土壤环境背景值,平均质量分数超过风险筛选值,但低于风险管控值。土壤Pb平均质量分数高于浙江省土壤环境背景值,但低于农用地土壤污染风险筛选值;部分样品Pb质量分数高于风险筛选值但低于风险管控值。部分土壤样品Hg质量分数高于浙江省土壤环境背景值,但均低于风险筛选值。大部分Cr和As质量分数低于浙江省土壤环境背景值。
从图3可知:土壤Cd总体污染程度为轻微污染,轻中度污染区主要分布在张山后村西南部和根竹园村东部附近。土壤Pb污染区域集中在南源村、皂树村中南部、何金富村、葛畈村中南部以及张山后村东部区域。土壤Cr仅在仙里村南部和葛畈村北部附近轻微污染。全域土壤重金属Hg和As无污染风险。
-
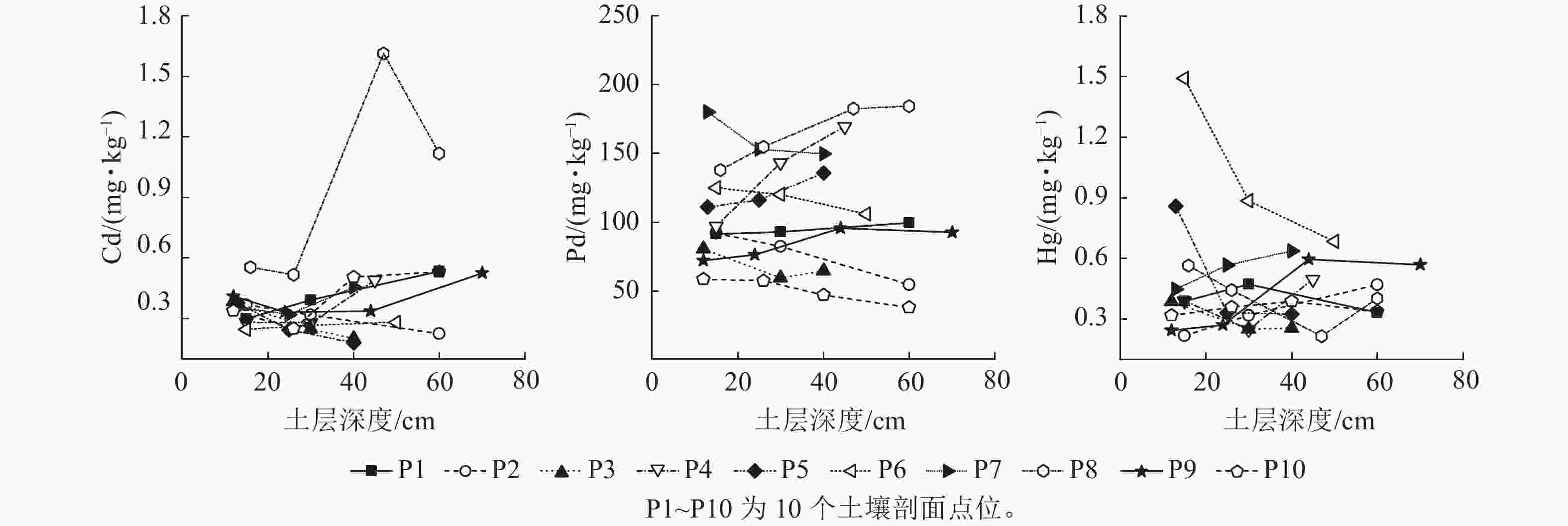
从图4可见:各层剖面土壤Cd质量分数总体趋势为:P2、P3和P5点位各层土壤Cd质量分数随土壤深度增加而降低,P1、P4、P6、P7和P8点位各层土壤Cd质量分数随土层深度的增加而增加,P9和P10点位中间层Cd质量分数低于表层和底层土壤。不同深度土壤Pb的变化趋势为:P1、P4、P5、P8点位土壤Pb质量分数随土层深度的增加而增加,P2、P3、P6、P7和P10点位土壤Pb质量分数随土壤深度增加呈降低趋势,P9点位中层土壤Pb质量分数高于表层和底层土壤。土壤Hg质量分数变化总体趋势为:P2和P7点位土壤Hg质量分数随土层深度增加而增加,P3、P5、P6和P8点位土壤Hg质量分数随土层深度增加而降低,P1、P9和P10点位中间层土壤Hg质量分数均高于表层和底层,P4点位中间层土壤Hg质量分数低于表层和底层。不同土层中Cd、Pb和Hg质量分数变化趋势无明显规律,这与前期农业生产中养殖粪便的施用以及山涧溪水的淋溶有关。剖面点位土壤中Cr和As质量分数均低于环境风险筛选值。
外源输入和成土母质是引起农田土壤重金属、污染的2个重要因素,剖面检测结果表明:不同深度土壤均有重金属污染,为分析污染来源,将重金属质量分数最低的土层重金属质量分数认定为由成土母质因素引起,以重金属质量分数最低土层的重金属质量分数除以最高土层的重金属元素质量分数得到土壤母质因素对土壤污染的贡献率。外源污染Cd、Pb和Hg输入对土壤污染贡献率分别约12.0%~65.7%、8.2%~42.6%和18.3%~62.3%。
-
以GB 15618—2018农用地风险筛选值为标准,计算单项污染指数(Pi)和内梅罗综合污染指数(P综合)。土壤Cd、Pb、Cr、Hg和As的Pi平均值分别为1.31、0.99、0.27、0.08和0.08 (表2),其中Cd的Pi>1,属轻微污染,其余重金属Pi<1,无污染。(P综合)为0.38~3.40,平均值1.10,属轻度污染。
表 2 土壤重金属污染指数
Table 2. Heavy metal pollution index in soils
统计指标 单项污染指数(Pi) 内梅罗综合
污染指(P综合)Cd Pb Cr Hg As 平均值 1.31 0.99 0.27 0.08 0.08 1.10 最小值 0.50 0.27 0.04 0.04 0.02 0.38 最大值 4.64 3.01 1.91 0.20 0.77 3.40 标准差 0.73 0.53 0.33 0.04 0.10 0.56 变异系数/% 55.61 53.00 123.14 47.08 124.69 50.57 由表3可知:39.29%点位的土壤Cd的Pi≤1,超标点位占比60.71%,其中轻微污染、轻度污染、中度污染的点位占比分别为44.64%、14.29%和1.79%。60.71%的点位土壤Pb的Pi≤1,超标点位占比39.29%,其中轻微污染、轻度污染、中度污染的点位占比分别为33.93%、3.57%和1.79%。96.43%的点位土壤Cr的Pi≤1,超标点位占比3.57%,属于轻微污染。Hg和As土壤点位Pi≤1,全部为无污染。由此推断Cd和Pb是研究区土壤污染累积最严重的重金属。从P综合看,P综合≤0.7的点位占比仅为23.21%,超标点位占比76.79%,其中尚清洁、轻度污染、中度污染、重度污染的点位占比分别为28.57%、42.86%、3.57%和1.79%。总体来看,研究区土壤环境污染较严重,需要采取修复措施,减轻土壤污染程度。
表 3 土壤重金属污染点位分布
Table 3. Distribution of heavy metal pollution points based on the pollution index method
单项污染指数(Pi) 污染等级 点位占比/% 内梅罗综合污
染指数(P综合)污染等级 点位占比/% Cd Pb Cr Hg As Pi≤1 无污染 39.29 60.71 96.43 100 100 P综合≤0.7 清洁 23.21 1<Pi≤2 轻微污染 44.64 33.93 3.57 0 0 0.7< P综合≤1.0 尚清洁 28.57 2<Pi≤3 轻度污染 14.29 3.57 0 0 0 1.0<P综合≤2.0 轻度污染 42.86 3<Pi≤5 中度污染 1.79 1.79 0 0 0 2.0<P综合≤3.0 中度污染 3.57 Pi>5 重度污染 0 0 0 0 0 P综合>3.0 重度污染 1.79 -
由表4可知:土壤Cd、Pb、Cr、Hg和As的地积累指数(Igeo)平均值分别为1.74、0.79、−1.49、−0.56、−2.49,其中土壤Cd和Pb的Igeo>0,分别为中度污染和无污染-中度污染;Cr、Hg和As的Igeo≤0,无污染。土壤Cd的Igeo点位全部超标,其中无污染-中度污染、中度污染、中度污染-强污染、强污染分别为16.07%、55.36%、25.00%和3.57%。土壤Pb的Igeo点位超标率为85.71%,其中无污染-中度污染、中度污染、中度污染-强污染分别为46.43%、33.93%和5.36%。土壤Cr、Hg和As的Igeo点位超标率分别为8.93%、17.86%和1.79%。总体而言,研究区在人类活动的影响下,土壤Cd和Pb呈现高度富集;土壤Cr、Hg和As存在轻微富集现象。
表 4 土壤重金属地积累指数法点位分布
Table 4. Statistical table of evaluation characteristic values of accumulation index of heavy metal elements
重金属 地积累指数(Igeo) 地积累指数(Igeo)点位比率/% 变化范围 平均值 标准差 Igeo≤0 0<Igeo≤1 1<Igeo≤2 2<Igeo≤3 3<Igeo≤4 Cd 0.51~3.73 1.74 0.69 0 16.07 55.36 25.00 3.57 Pb −0.90~2.57 0.79 0.71 14.29 46.43 33.93 5.36 0 Cr −3.71~1.86 −1.49 1.13 91.07 5.36 3.57 0 0 Hg −1.53~0.94 −0.56 0.60 82.14 17.86 0 0 0 As −4.28~1.15 −2.49 1.03 98.21 1.79 0 0 0 -
由表5可知:土壤Cd、Pb、Cr、Hg和As的潜在生态危害指数($E_{\rm{r}}^i $)平均值分别为39.45、4.96、0.54、3.09和0.84,土壤Pb、Cr、Hg和As的所有点位$E_{\rm{r}}^i $≤40,处于轻微水平风险。土壤Cd的$E_{\rm{r}}^i $最高,平均为39.45,变化幅度较大,最大为139.30,最小为14.94,达到中等和较强生态风险的样点占比分别为26.79%和3.57%。该区域IR为18.80~149.55,平均为48.87,变异系数差异性较大,但所有样点的IR均<150,处于轻微风险,主要贡献因子为土壤Cd。该区域IER为−3.99~1.21,平均为−2.26,处于无风险至轻度预警级。采用潜在生态风险指数法和生态风险预警指数法均表明:研究区土壤重金属处于轻微污染级别。
表 5 土壤重金属潜在生态风险评价
Table 5. Evaluation of potential ecological risks of heavy metal elements
重金属 潜在生态危害指数($E_{\rm{r}}^i $) 潜在生态危害指数($E_{\rm{r}}^i $)点位比率/% 变化范围 平均值 标准差 变异系数/% $E_{\rm{r}}^i $≤40 40<$E_{\rm{r}}^i $≤80 80<$E_{\rm{r}}^i $≤160 Cd 14.94~139.30 39.45 21.93 55.61 69.64 26.79 3.57 Pb 1.36~15.03 4.96 2.63 53.00 0 0 0 Cr 0.08~3.83 0.54 0.66 123.14 0 0 0 Hg 1.43~7.97 3.09 1.45 47.08 0 0 0 As 0.18~7.67 0.84 1.05 124.69 0 0 0 -
通过主成分分析(表6)进一步确认土壤中5种重金属的具体来源,共提取3个主成分,累积贡献率为69.037%。第1主成分(PC1)累积贡献率为25.899%,Hg和Cr具有较大载荷,分别为0.749和0.668。第2主成分(PC2)累积贡献率为22.636%,As和Cd具有较大载荷,分别为0.887和0.505。第3主成分(PC3)累积贡献率为20.502%,Pb具有较大载荷,为0.891。
表 6 土壤重金属主成分分析
Table 6. PCA result of heavy metals in soil
成分 初始特征值 提取平方和载入 旋转成分矩阵 特征值 贡献率/% 累积贡
献率/%特征值 贡献率/% 累积贡
献率/%重金属 PC1 PC2 PC3 1 1.295 25.899 25.899 1.295 25.899 25.899 Cd 0.446 0.505 0.440 2 1.132 22.636 48.535 1.132 22.636 48.535 Pb −0.079 −0.017 0.891 3 1.025 20.502 69.037 1.025 20.502 69.037 Cr 0.668 0.178 −0.263 4 0.862 17.230 86.268 Hg 0.749 −0.273 0.151 5 0.687 13.732 100.000 As −0.100 0.887 −0.046 -
本研究采用多种土壤重金属污染评价方法,但各方法的评价结果存在一定差异性。以GB 15618—2018中的风险筛选值作为背景值时,单项污染指数法结果显示Cd属轻微污染,内梅罗综合污染指数属轻度污染。采用浙江省背景值为标准进行评价时,地积累指数法结果显示Cd属中度污染,Pb属无污染-中度污染。以GB 15618—2018中的风险筛选值作为背景值时,潜在生态风险指数法分析结果显示5种重金属为轻微水平风险,生态风险显示为无风险至轻度预警级。从评价结果来看,潜在风险指数法对于Cd应比较灵敏,而单项污染指数法、内梅罗指数法和地积累指数法对5种重金属均比较灵敏,这主要是不同方法的侧重性与不同背景值选择的结果[27−28]。内梅罗指数法能全面反映各重金属对土壤的不同作用,以避免由于平均作用削弱高水平金属权重现象的发生,但易受高水平或低水平因子的影响[29]。地积累指数法考虑了成岩作用对土壤背景值的影响,但只能给出各采样点某种重金属的污染指数,无法对元素间或区域间环境质量进行比较分析[11]。潜在生态风险指数法及生态风险预警指数法将环境生态效应与毒理学联系起来,但易忽略重金属复合污染时不同金属之间的加权或拮抗作用[30]。
-
从研究区土壤重金属的主成分分析结果来看,土壤Hg和Cr在第1主成分具有较大载荷。本研究中大部分土壤Hg和Cr的质量分数低于浙江省土壤环境背景值,但土壤Cr变异系数较大,表明Cr受到人类活动影响较大,如农药化肥施用、畜禽粪便排放等人为因素[31]。同时土壤Cr也受到土壤地球化学作用的影响,与成土母质的影响密切相关[32]。不同耕层中Hg质量分数变化趋势较为混乱,这与前期农业生产中养殖粪便的施用以及山涧溪水的淋溶有关[33]。由此推断,土壤Hg和Cr受到人为和自然双重因素的影响。
本研究土壤As平均质量分数低于浙江省土壤环境背景值,但土壤As变异系数较大,受到人为影响较大;土壤Cd平均质量分数高于浙江省土壤环境背景值,具有明显的富集现象,原因是20世纪钼矿开采导致土壤存在Cd污染。已有研究表明,土壤As因含As农药和有机肥的使用而增加,约70%的化肥农药会随着雨水的下渗造成土壤中As和Cd大量累积[34−35]。污水排放、矿山开采等人类活动所产生的Cd是土壤Cd的重要来源[12, 36]。因此,土壤As和Cd与农业、钼矿开采等有关。
土壤Pb平均质量分数高于浙江省土壤环境背景值,部分区域Pb呈现高度富集,且土壤Pb剖面的混乱与养殖粪便施用有关。穆虹宇等[37]研究发现:虽然猪粪中Pb的超标率仅为2.58%,但Pb的生态毒性较大,同一区域连续大量施用猪粪,会造成土壤Pb累积。因此,土壤Pb受到畜禽粪便施用的影响。
-
研究区土壤Hg和Cr受到人为和自然双重因素影响,土壤Cd、Pb和As与矿山开发过程中污染物排放和畜禽粪便施用等人类活动有关。研究区土壤总体为轻微污染,土壤Cd的污染指数为轻微污染,内梅罗指数法为轻度污染,土壤Cd和Pb的地积累指数分别处于中度污染和无污染-中度污染,潜在生态风险指数处于轻微水平风险,生态风险预警指数处于轻度预警级别。Cd和Pb是研究区农田土壤健康最主要的生态环境因子,后续应加强治理和动态监测,保障农产品安全。
Spatial distribution and pollution assessment of heavy metals in typical cultivated soils in southwest Zhejiang Province
-
摘要:
目的 采集分析丽水市莲都区某乡土壤样品,了解全乡农田重金属污染情况,为后续开展土壤安全管理和污染综合治理提供科学依据。 方法 采用主成分分析法进行来源解析,运用单项污染指数法、内梅罗指数法、地积累指数法、潜在生态风险指数法及生态风险预警指数进行土壤重金属污染评价。 结果 土壤镉(Cd)和铅(Pb)超标率(风险筛选值)分别为60.71%和39.29%,但均低于农用地土壤污染风险管控值。土壤Cd污染指数(Pi)为1.31,属于轻微污染,其余重金属小于1,无污染;内梅罗指数(P综合)为1.10,属于轻度污染。土壤Cd和Pb的地积累指数(Igeo)分别为1.74和0.79,属中度污染和无污染-中度污染;其余重金属均处于清洁水平。5种重金属的潜在生态危害系数(Ei r)均值小于40,处于轻微水平风险;生态风险指数(IR)为48.87,属于轻微风险。土壤生态风险预警指数(IER)处于轻度预警级别。汞(Hg)和铬(Cr)受到人为和自然双重因素影响,Cd、Pb和砷(As)主要受矿山开发过程中污染物排放和畜禽粪便施用等人类活动影响。 结论 研究区土壤总体为轻微污染,Cd和Pb是研究区农田土壤最重要的生态环境因子,后续应加强治理和动态检测,保障农产品安全。 图4表6参37 Abstract:Objective The heavy metal contamination of farmland in one town of Liandu District, was comprehensively mapped through soil sample collection and analysis, providing a scientific basis for subsequent comprehensive soil safety management and comprehensive pollution management. Method The principal component analysis (PCA), single-factor pollution index method (Pi), the Nemero index method (Pc), the land accumulation index method (Igeo), the potential ecological risk index method (IR) and ecological risk early warning index (IER) were used to analyze pollution assessment, and source analysis of heavy metal pollution in the study area. Result The exceedance rates of Cd and Pb (risk screening value) were 60.71% and 39.29%, respectively, but both were lower than the risk control value of soil pollution on agricultural land. The average value Pi of Cd was 1.31, indicating a slightly polluted level, while Pi value of the other heavy metals was less than 1, indicating in the clean. Pc value was 1.10, indicating a slightly polluted level. The Igeo value of Cd and Pb was 1.74 and 0.79, indicating in moderate pollution and no pollution-moderate pollution respectively, the rest of the heavy metals was in the clean. The average potential ecological hazard coefficient $E_{\rm{r}}^i $ of five heavy metals was less than 40, indicating a slight ecological risk. The average value of IR was 48.87, indicating a slight ecological risk. IER reached the slight early warning. Hg and Cr were influenced by both human and natural factors, while Cd, Pb and As were mainly caused human activities such as mining pollution and livestock manure application. Conclusion The soil in the study area is generally slightly polluted. Cd and Pb are the most important ecological elements in agricultural soils, and subsequent treatment and dynamic detection should be increased to ensure the safety of agricultural products. [Ch, 4 fig. 6 tab. 37 ref.] -
Key words:
- heavy metals in soil /
- spatial analysis /
- risk assessment /
- source apportionment
-
表 1 土壤重金属统计分析
Table 1. Descriptive statistics of heavy metals in soil
统计指标 重金属质量分数/(mg·kg−1) Cd Pb Cr Hg As 平均值 0.39 69.41 40.38 0.10 3.36 最小值 0.15 18.99 6.07 0.05 0.71 最大值 1.39 210.45 287.20 0.26 30.67 标准差 0.22 36.79 49.72 0.05 4.19 变异系数/% 55.61 53.00 123.14 47.08 124.69 偏度 2.11 1.61 3.88 1.55 5.27 峰度 6.83 3.61 16.65 2.62 33.53 表 2 土壤重金属污染指数
Table 2. Heavy metal pollution index in soils
统计指标 单项污染指数(Pi) 内梅罗综合
污染指(P综合)Cd Pb Cr Hg As 平均值 1.31 0.99 0.27 0.08 0.08 1.10 最小值 0.50 0.27 0.04 0.04 0.02 0.38 最大值 4.64 3.01 1.91 0.20 0.77 3.40 标准差 0.73 0.53 0.33 0.04 0.10 0.56 变异系数/% 55.61 53.00 123.14 47.08 124.69 50.57 表 3 土壤重金属污染点位分布
Table 3. Distribution of heavy metal pollution points based on the pollution index method
单项污染指数(Pi) 污染等级 点位占比/% 内梅罗综合污
染指数(P综合)污染等级 点位占比/% Cd Pb Cr Hg As Pi≤1 无污染 39.29 60.71 96.43 100 100 P综合≤0.7 清洁 23.21 1<Pi≤2 轻微污染 44.64 33.93 3.57 0 0 0.7< P综合≤1.0 尚清洁 28.57 2<Pi≤3 轻度污染 14.29 3.57 0 0 0 1.0<P综合≤2.0 轻度污染 42.86 3<Pi≤5 中度污染 1.79 1.79 0 0 0 2.0<P综合≤3.0 中度污染 3.57 Pi>5 重度污染 0 0 0 0 0 P综合>3.0 重度污染 1.79 表 4 土壤重金属地积累指数法点位分布
Table 4. Statistical table of evaluation characteristic values of accumulation index of heavy metal elements
重金属 地积累指数(Igeo) 地积累指数(Igeo)点位比率/% 变化范围 平均值 标准差 Igeo≤0 0<Igeo≤1 1<Igeo≤2 2<Igeo≤3 3<Igeo≤4 Cd 0.51~3.73 1.74 0.69 0 16.07 55.36 25.00 3.57 Pb −0.90~2.57 0.79 0.71 14.29 46.43 33.93 5.36 0 Cr −3.71~1.86 −1.49 1.13 91.07 5.36 3.57 0 0 Hg −1.53~0.94 −0.56 0.60 82.14 17.86 0 0 0 As −4.28~1.15 −2.49 1.03 98.21 1.79 0 0 0 表 5 土壤重金属潜在生态风险评价
Table 5. Evaluation of potential ecological risks of heavy metal elements
重金属 潜在生态危害指数($E_{\rm{r}}^i $) 潜在生态危害指数($E_{\rm{r}}^i $)点位比率/% 变化范围 平均值 标准差 变异系数/% $E_{\rm{r}}^i $≤40 40<$E_{\rm{r}}^i $≤80 80<$E_{\rm{r}}^i $≤160 Cd 14.94~139.30 39.45 21.93 55.61 69.64 26.79 3.57 Pb 1.36~15.03 4.96 2.63 53.00 0 0 0 Cr 0.08~3.83 0.54 0.66 123.14 0 0 0 Hg 1.43~7.97 3.09 1.45 47.08 0 0 0 As 0.18~7.67 0.84 1.05 124.69 0 0 0 表 6 土壤重金属主成分分析
Table 6. PCA result of heavy metals in soil
成分 初始特征值 提取平方和载入 旋转成分矩阵 特征值 贡献率/% 累积贡
献率/%特征值 贡献率/% 累积贡
献率/%重金属 PC1 PC2 PC3 1 1.295 25.899 25.899 1.295 25.899 25.899 Cd 0.446 0.505 0.440 2 1.132 22.636 48.535 1.132 22.636 48.535 Pb −0.079 −0.017 0.891 3 1.025 20.502 69.037 1.025 20.502 69.037 Cr 0.668 0.178 −0.263 4 0.862 17.230 86.268 Hg 0.749 −0.273 0.151 5 0.687 13.732 100.000 As −0.100 0.887 −0.046 -
[1] 刘平. 银北灌区土壤-水-作物系统的重金属来源解析及生态健康风险的时空预测研究[D]. 银川: 宁夏大学, 2022. LIU Ping. Source Analysis, Ecological and Health Risk Prediction of Heavy Metals in Farmland Soil, Irrigation Water, and Maize in the Irrigation Area of Northern Yinchuan [D]. Yinchuan: Ningxia University, 2022. [2] GUAN Qingyu, WANG Feifei, XU Chuanqi, et al. Source apportionment of heavy metals in agricultural soil based on PMF: a case study in Hexi Corridor, northwest China [J]. Chemosphere, 2018, 193: 189 − 197. [3] 蔡美芳, 李开明, 谢丹平, 等. 我国耕地土壤重金属污染现状与防治对策研究[J]. 环境科学与技术, 2014, 37(增刊2): 223 − 230. CAI Meifang, LI Kaiming, XIE Danping, et al. The status and protection strategy of farmland soils polluted by heavy metals [J]. Environmental Science & Technology, 2014, 37(suppl 2): 223 − 230. [4] 曾思燕, 于昊辰, 马静, 等. 中国耕地表层土壤重金属污染状况评判及休耕空间权衡[J]. 土壤学报, 2022, 59(4): 1036 − 1047. ZENG Siyan, YU Haochen, MA Jing, et al. Identifying the status of heavy metal pollution of cultivated land for tradeoff spatial fallow in China [J]. Acta Pedologica Sinica, 2022, 59(4): 1036 − 1047. [5] 陈卫平, 杨阳, 谢天, 等. 中国农田土壤重金属污染防治挑战与对策[J]. 土壤学报, 2018, 55(2): 261 − 272. CHEN Weiping, YANG Yang, XIE Tian, et al. Challenges and countermeasures for heavy metal pollution control in farmlands of China [J]. Acta Pedologica Sinica, 2018, 55(2): 261 − 272. [6] QIN Guowei, NIU Zhaodong, YU Jiangdong, et al. Soil heavy metal pollution and food safety in China: effects, sources and removing technology [J/OL]. Chemosphere, 2021, 267: 129205[2023-06-10]. doi: 10.1016/j.chemosphere.2020.129205. [7] 徐建明, 何丽芝, 唐先进, 等. 中国重金属污染耕地土壤安全利用存在问题与建议[J]. 土壤学报, 2023, 60(5): 1289 − 1296. XU Jianming, HE Lizhi, TANG Xianjin, et al. Problems and suggestions on safe utilization of heavy metal(loid)-contaminated farmlands in China [J]. Acta Pedologica Sinica, 2023, 60(5): 1289 − 1296. [8] 张小敏, 张秀英, 钟太洋, 等. 中国农田土壤重金属富集状况及其空间分布研究[J]. 环境科学, 2014, 35(2): 692 − 703. ZHANG Xiaomin, ZHANG Xiuying, ZHONG Taiyang, et al. Spatial distribution and accumulation of heavy metal in arable land soil of China [J]. Environmental Science, 2014, 35(2): 692 − 703. [9] WANG Weili, JIANG Ronggen, LIN Cai, et al. Multivariate statistical analysis of potentially toxic elements in the sediments of Quanzhou Bay, China: spatial relationships, ecological toxicity and sources identification [J/OL]. Environmental Research, 2022, 213: 113750[2023-06-10]. doi: 10.1016/j.envres.2022.113750. [10] FU Kaizhe, AN Mengyang, SONG Yanwei, et al. Soil heavy metals in tropical coastal interface of eastern Hainan Island in China: Distribution, sources and ecological risks [J/OL]. Ecological Indicators, 2023, 154: 110659[2023-06-10]. doi: 10.1016/j.ecolind.2023.110659. [11] 杨宇, 郭婷婷, 刘孝利, 等. 南方典型矿区农业小流域耕地土壤重金属空间分布特征及污染评价[J]. 环境科学, 2023, 44(3): 1602 − 1610. YANG Yu, GUO Tingting, LIU Xiaoli, et al. Spatial distribution characteristics and assessment of heavy metal pollution in cultivated soil of agricultural small watershed in typical mining area in south China [J]. Environmental Science, 2023, 44(3): 1602 − 1610. [12] YÜKSEL B, USTAOĞLU F, TOKATLI C, et al. Ecotoxicological risk assessment for sediments of Çavuşlu stream in Giresun, Turkey: association between garbage disposal facility and metallic accumulation [J]. Environmental Science and Pollution Research, 2022, 29(12): 17223 − 17240. [13] WU Jin, LI Jiao, TENG Yanguo, et al. A partition computing-based positive matrix factorization (PC-PMF) approach for the source apportionment of agricultural soil heavy metal contents and associated health risks [J/OL]. Journal of Hazardous Materials, 2020, 388: 121766[2023-06-10]. doi: 10.1016/j. jhazmat. 2019.121766. [14] LIAO Shiyan, JIN Gaoqi, KHAN M A, et al. The quantitative source apportionment of heavy metals in peri-urban agricultural soils with UNMIX and input fluxes analysis [J/OL]. Environmental Technology and Innovation, 2021, 21: 101232[2023-06-10]. doi: 10.1016/j.eti.2020.101232. [15] 马佳燕, 马嘉伟, 柳丹, 等. 杭嘉湖平原水稻主产区土壤重金属状况调查及风险评价[J]. 浙江农林大学学报, 2021, 38(2): 336 − 345. MA Jiayan, MA Jiawei, LIU Dan, et al. Survey and risk assessment of soil heavy metals in the main rice producing areas in Hangjiahu Plain [J]. Journal of Zhejiang A&F University, 2021, 38(2): 336 − 345. [16] 张云芸, 马瑾, 魏海英, 等. 浙江省典型农田土壤重金属污染及生态风险评价[J]. 生态环境学报, 2019, 28(6): 1233 − 1241. ZHANG Yunyun, MA Jin, WEI Haiying, et al. Heavy metals in typical farmland soils of Zhejiang Province: levels, sources and ecological risks [J]. Ecology and Environmental Sciences, 2019, 28(6): 1233 − 1241. [17] 杜贯新, 闫百泉, 孙雨, 等. 松嫩平原黑土区西北部阿荣旗黑土重金属分布特征、评价及预警[J]. 地质科学, 2022, 57(2): 606 − 621. DU Guanxin, YAN Baiquan, SUN Yu, et al. Distribution characteristics, evaluation and early warning of heavy metals in Arongqi black soil in northwest of Songnen black soil region [J]. Chinese Journal of Geology, 2022, 57(2): 606 − 621. [18] MA Jiawei, CHEN Li, CHEN Hansong, et al. Spatial distribution, sources, and risk assessment of potentially toxic elements in cultivated soils using isotopic tracing techniques and Monte Carlo simulation [J/OL]. Ecotoxicology and Environmental Safety, 2023, 259: 115044[2023-06-10]. doi: 10.1016/j.ecoenv.2023.115044. [19] 周翰鹏. 矿区周边土壤重金属污染优先控制因子及健康风险评价研究[D]. 包头: 内蒙古科技大学, 2022. ZHOU Hanpeng. Research on Priority Control Factors and Health Risk Assessment of Heavy Metal Pollution in Soil around Mining Areas [D]. Baotou: Inner Mongolia University of Science & Technology, 2022. [20] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Rukun. Methods for Agricultural Chemistry Analysis of Soil [M]. Beijing: China Agricultural Science and Technology Press, 2000. [21] 生态环境部. 土壤环境质量 农用地土壤污染风险管控标准 (试行): GB 15618—2018[S]. 北京: 中国标准出版社, 2018. Ministry of Ecology and Environment. Soil Environment Quality Risk Control Standard for Soil Contamination of Agriculture Land (Trial Implementation): GB 15618−2018 [S]. Beijing: China Standards Press, 2018. [22] 李文琦, 吴涛, 蒋国俊, 等. 浙江省金华市农用地重金属污染及安全利用分区[J]. 浙江师范大学学报 (自然科学版), 2022, 45(1): 88 − 96. LI Wenqi, WU Tao, JIANG Guojun, et al. On evaluation and safe utilization subregion of heavy metal polluted agricultural land in Jinhua [J]. Journal of Zhejiang Normal University (Natural Sciences), 2022, 45(1): 88 − 96. [23] 中国环境监测总站. 中国土壤元素背景值[M]. 北京: 中国环境科学出版, 1990. China Environmental Monitoring Station. Background Values of Soil Elements in China [M]. Beijing: China Environmental Science Press, 1990. [24] 刘孝严, 樊亚男, 刘鹏, 等. 基于文献计量分析的长江经济带农田土壤重金属污染特征[J]. 环境科学, 2022, 43(11): 5169 − 5179. LIU Xiaoyan, FAN Ya’ nan, LIU Peng, et al. Characteristics of heavy metal pollution in farmland soil of the Yangtze River economic belt based on bibliometric analysis [J]. Environmental Science, 2022, 43(11): 5169 − 5179. [25] 周杨, 周文斌, 马嘉伟, 等. 缙云县某复垦地块土壤环境质量调查及生态风险评价[J]. 浙江农林大学学报, 2022, 39(2): 388 − 395. ZHOU Yang, ZHOU Wenbin, MA Jiawei, et al. Soil environmental quality investigation and ecological risk assessment of a reclamation land in Jinyun County [J]. Journal of Zhejiang A&F University, 2022, 39(2): 388 − 395. [26] 赵靓, 梁云平, 陈倩, 等. 中国北方某市城市绿地土壤重金属空间分布特征、污染评价及来源解析[J]. 环境科学, 2020, 41(12): 5552 − 5561. ZHAO Liang, LIANG Yunping, CHEN Qian, et al. Spatial distribution, contamination assessment, and sources of heavy metals in theurban green space soils of a city in North China [J]. Environmental Science, 2020, 41(12): 5552 − 5561. [27] JIN Gaoqi, FANG Wei, SHAFI M, et al. Source apportionment of heavy metals in farmland soil with application of APCS-MLR model: a pilot study for restoration of farmland in Shaoxing City Zhejiang, China [J/OL]. Ecotoxicology and Environmental Safety, 2019, 184: 109495[2023-06-10]. doi: 10.1016/j.ecoenv.2019.109495. [28] CHAI Lei, WANG Yuhong, WANG Xin, et al. Pollution characteristics, spatial distributions, and source apportionment of heavy metals in cultivated soil in Lanzhou, China [J/OL]. Ecological Indicators, 2021, 125: 107507[2023-06-10]. doi: 10.1016/j.ecolind.2021.107507. [29] ZHAO Keli, ZHANG Luyao, DONG Jiaqi, et al. Risk assessment, spatial patterns and source apportionment of soil heavy metals in a typical Chinese hickory plantation region of southeastern China [J/OL]. Geoderma, 2020, 360: 114011[2023-06-10]. doi: 10.1016/j.geoderma.2019.114011. [30] FEI Xufeng, LOU Zhaohan, XIAO Rui, et al. Source analysis and source-oriented risk assessment of heavy metal pollution in agricultural soils of different cultivated land qualities [J/OL]. Journal of Cleaner Production, 2022, 341: 130942[2023-06-10]. doi: 10.1016/j.jclepro.2022.130942. [31] 吕悦风, 孙华. 浙北某县域耕地土壤重金属空间分异特征、污染评价及来源分析[J]. 农业环境科学学报, 2019, 38(1): 95 − 102. LÜ Yuefeng, SUN Hua. Spatial differentiation characteristics, pollution evaluation, and source analysis of heavy metals in farmland soil in a county in northern Zhejiang Province, China [J]. Journal of Agro-Environment Science, 2019, 38(1): 95 − 102. [32] BHUIYANMA H, KARMAKER S C, BODRUD-DOZA M, et al. Enrichment, sources and ecological risk mapping of heavy metals in agricultural soils of dhaka district employing SOM, PMF and GIS methods [J/OL]. Chemosphere, 2021, 263: 128339[2023-06-10]. doi: 10.1016/j.chemosphere.2020.128339. [33] SHI Taoran, MA Jin, WU Fuyong, et al. Mass balance-based inventory of heavy metals inputs to and outputs from agricultural soils in Zhejiang Province, China [J]. Science of the Total Environment, 2019, 649: 1269 − 1280. [34] ZHANG Qiaochu, WANG Chengchen. Natural and human factors affect the distribution of soil heavy metal pollution: a review [J]. Water,Air,and Soil Pollution, 2020, 231: 1 − 13. [35] 陈文轩, 李茜, 王珍, 等. 中国农田土壤重金属空间分布特征及污染评价[J]. 环境科学, 2020, 41(6): 2822 − 2833. CHEN Wenxuan, LI Qian, WANG Zhen, et al. Spatial distribution characteristics and pollution evaluation of heavy metals in arable land soil of China [J]. Environmental Science, 2020, 41(6): 2822 − 2833. [36] CHANG Chunying, YU Huanyun, CHEN Junjian, et al. Accumulation of heavy metals in leaf vegetables from agricultural soils and associated potential health risks in the Pearl River Delta, south China [J]. Environmental Monitoring and Assessment, 2014, 186: 1547 − 1560. [37] 穆虹宇, 庄重, 李彦明, 等. 我国畜禽粪便重金属含量特征及土壤累积风险分析[J]. 环境科学, 2020, 41(2): 986 − 996. MU Hongyu, ZHUANG Zhong, LI Yanming, et al. Heavy metal contents in animal manure in China and the related soil accumulation risks [J]. Environmental Science, 2020, 41(2): 986 − 996. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20230389






 下载:
下载: