-
园林植物是维系城市生态平衡的重要因素,自然环境的干旱胁迫会使植物体内细胞脱水,造成水分亏缺而导致植物受害[1]。干旱胁迫是众多环境胁迫因子中最常见的一种[2],对植物的生长发育会产生不同程度的影响。在现代化的城市绿化中,选择观赏性好、抗性强的观赏植物,对节约水资源改善土壤干旱、半干旱的现状具有重要意义。植物挥发性有机化合物(volatile organic compounds,简称VOCs)通常指分子质量小于250,沸点小于340 ℃,从植物地上部分(如叶、花和芽等)表面散发的多种微浓度的挥发性次生代谢物质[3]。植物VOCs在生态系统中占有重要地位,它是重要的化学信息传递物质[4-5],在调节植物的生长、发育和繁衍,抵御环境胁迫及预防动物和昆虫的危害等[3-10]方面具有重要作用。非生物胁迫会明显影响植物VOCs的合成与释放,Ibrahim等[11]和Hartikainen等[12]均研究发现,高温胁迫会诱导欧洲白桦Betula pendula和欧洲山杨Populus tremula释放大量的异戊二烯、萜类和C6绿叶性气体(green leaf volatiles,GLVs);光照—黑暗转换处理会诱导欧洲黑杨Populus deltoides叶片大量释放己烯醛和乙醛等[13]。干旱对VOCs释放规律的影响呈现多样性,Staudt等[14]在对栓皮栎Quercus suber的研究中发现,适度干旱胁迫导致单萜类化合物的释放量增加30%,而Lavoir等[15]发现,干旱胁迫下冬青栎Quercus ilex。释放的单萜是对照处理的55%。Blanch等[16]研究发现干旱导致冬青栎萜烯类释放量增加33%,而相同干旱条件下地中海白松Pinus halepensis萜烯类释放量降低了38%。迷迭香 Rosemarinus offcinalis,又名情人草,原产地为欧洲、北非及地中海沿岸,主要分布在法国、突尼斯、摩洛哥和保加利亚。迷迭香枝叶气味浓烈,抗旱性极强,是一种被广泛应用的园林芳香植物,可用于花坛绿地片植、丛植、孤植或作为配材,用于镶边,亦可用作小绿篱或花篱,国外多用于花境配材。近几年,迷迭香的研究多集中在其有效成分提取工艺[17]、抗氧化物功能[18]和精油组分分析[19]等方面。关于干旱胁迫下迷迭香VOCs释放规律与抗旱机制之间的关系未见报道。因此,本研究采用称量控水法模拟干旱胁迫,利用动态顶空气体循环法和热脱附-气相色谱-质谱联用技术(TDC-GC-MS)测定了干旱胁迫及复水后迷迭香VOCs成分的变化;同时,测定了迷迭香叶片脂氧合酶(LOX)活性的变化,以期从迷迭香释放VOCs角度揭示它对干旱胁迫的适应机制,为进一步研究植物释放VOCs对非生物胁迫的响应机制提供理论依据。
HTML
-
供试材料为迷迭香2年生实生苗(江苏省宿迁谊园花卉盆景苗木公司提供),苗高约为20 cm。2012年4月栽置于盛有培养土[m(泥炭): m(沙土): m(蛭石)=1: 2: 1,干质量1.8 kg]的花盆中(盆径为18 cm,盆高为20 cm),1株·盆-1,盆栽苗置于温室中,在充足的水分条件下培养恢复1个月后实施控水处理。选取长势一致、枝条数相同的盆栽苗24盆,分别进行干旱胁迫处理,设正常浇水(对照,75%田间持水量)、轻度干旱(60% 田间持水量)、中度干旱(40% 田间持水量)和重度干旱(20% 田间持水量)等4种处理,6盆·处理-1。采用称量法控制土壤水分含量,每天傍晚进行称量并补充各处理消耗的水分。4 d测定1次脂氧合酶活性,重复3次。干旱胁迫处理24 d后,对重度干旱进行复水处理,每天测定脂氧合酶活性,复水共6 d。
-
酶液提取:称取迷迭香枝条第5~8片叶片0.5 g,加入适量预冷的0.05 mol·L-1的pH 7.8磷酸缓冲溶液,充分冰浴研磨后,定容至25.0 mL。4 ℃下1万r·min-1离心20 min,回收上清液用于脂氧合酶活性测定,重复3次。
脂氧合酶活性的测定参照Hatanaka等[20]的方法。底物配制:将0.1 mL吐温20加入到2.0 mL 0.2 mol·L-1的硼酸缓冲液(pH 9.0)中并混匀,滴加0.1 mL亚油酸后充分混匀,再加入0.2 mL 1.0 mol·L-1 氢氧化钠溶液并保证此时的溶液澄清,然后加入上述硼酸缓冲液18.0 mL,再加水定容至50.0 mL,-20 ℃保存备用。3.0 mL反应体系中含有0.1 mL底物、2.8 mL磷酸缓冲液(0.1 mol·L-1,pH 7.0)和0.1 mL酶液,测定反应体系3 min内在234 nm波长处吸光度的变化。酶活性定义:234 nm波长处,以亚油酸为底物,3.0 mL反应体系吸光度1 min增加0.1为1个酶活单位。
-
VOCs的采集:干旱胁迫处理24 d及复水第6天,选取株型相似、枝条数相同的迷迭香,3盆·处理-1,采用QC-2型大气采样仪通过动态顶空气体循环采集法收集VOCs,气体流量0.1 m3·min-1,采样时间20 min。采用TDS-GC-MS分析迷迭香VOCs成分。仪器及参数设置条件参照Gao等[21]的方法。
TDS(TD3型,GERSTEL,德国)工作条件:载气压力20 kPa;进样口温度250 ℃;热脱附温度250 ℃,10 min;冷阱温度-100 ℃,3 min;进样时冷阱骤然升至260 ℃。
GC(7890A型,Agilent,美国)工作条件:色谱柱为30 m × 250 μm × 0.25 μm的HP-5MS柱;升温程序:初始温度40 ℃,保持4 min后,以6 ℃·min-1速率升至250 ℃,保持3 min后,以10 ℃·min-1的速率升至270 ℃,保持5 min。
MS(5975C型,Agilent,美国)工作条件:电力方式为EI,电子能量为70 eV,质量范围为28~450,接口温度为280 ℃,离子源温度为230 ℃,四级杆温度为150 ℃。
-
采用NIST2008谱库检索,采用峰面积表示VOCs成分的相对含量。使用Oringin 8.0和SPSS软件进行数据处理、图表制作及统计分析,方差分析采用Duncan新复极差法。
1.1. 供试材料及处理
1.2. 实验方法
1.3. VOCs采集及分析方法
1.4. 数据分析
-
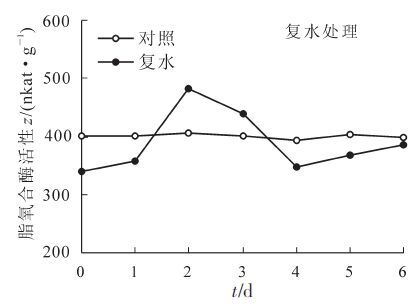
不同强度的干旱胁迫处理对迷迭香脂氧合酶活性存在显著差异(P<0.05,图 1)。轻度干旱处理的脂氧合酶活性与对照无显著差异;中度干旱和重度干旱处理16 d和12 d时,脂氧合酶活性达到最大值,与对照相比分别增加了0.96和1.04倍(P<0.01),随后脂氧合酶活性开始下降。
复水后,脂氧合酶活性开始增加(图 2),复水第1天脂氧合酶活性比未复水时增加9.2%,但仍低于对照;第2天脂氧合酶活性达到最大值,与对照相比增加了17.7%;复水第4天,脂氧合酶活性又下降到对照的91.2%,至复水第6天,脂氧合酶活性较第4天稍有增加,但仍低于对照。
-
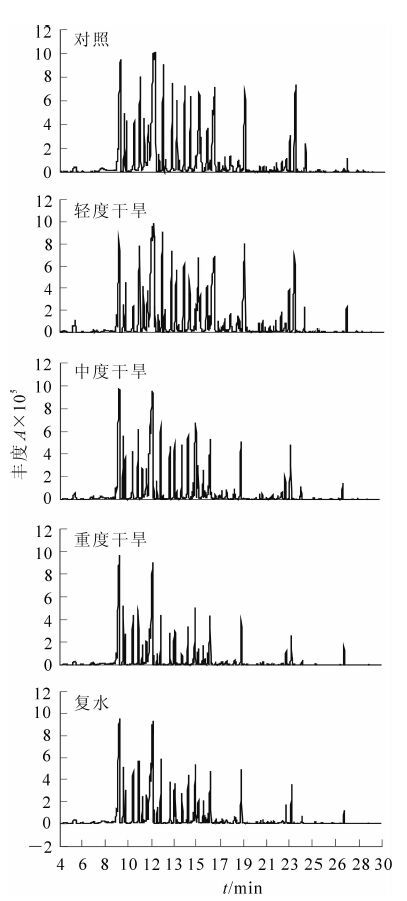
采用TDS-GC-MS联用技术对不同干旱胁迫处理及复水后迷迭香释放的VOCs组分进行分析(图 3),共鉴定出了57种化合物(表 1)。轻度、中度、重度干旱处理的迷迭香VOCs总量分别是对照的99.2%,67.2%和43.2%;随着干旱胁迫程度的增加,轻度干旱、中度干旱、重度干旱各处理萜烯类总量下降,但其相对含量增加,与对照相比分别增加了14.4%,17.0%和23.7%,其中单萜相对含量与对照相比分别增加了21.9%,28.2%和37.2%;与对照相比,各干旱处理迷迭香醇类总量及相对含量均下降;对照、轻度干旱、中度干旱、重度干旱各处理的迷迭香酮类相对含量分别为15.28%,12.70%,18.30%,14.22%;各处理的迷迭香醛类相对含量均高于对照;干旱胁迫下新增加了10种物质,其中新增加了2种C6绿叶性气体(GLVs):2-己烯醛和叶醇;3种醛类化合物:2-己烯醛、山梨醛和癸醛。

Figure 3. Total ion current of volatile organic compounds (VOCs) of Rosemarinus offcinalis under drought
t/min 挥发性有机物 分子式 分子量 峰面积A×106 对照 轻度干旱 中度干旱 重度干旱 复水 5.18 3-己烯-2-酮 3-hene-2-one C6H10O 98 2.47 ± 0.03 8.58 ± 0.01 5.40 ± 0.11 1.40 ± 0.01 2.28 ± 0.01 6.66 2-己烯醛(E)-2-hexenal C6H10O 98 - - 1.03 ± 0.01 1.09 ± 0.02 - 6.78 叶醇 leaf alcohol C6H12O 100 - 1.07 ± 0.02 1.17 ± 0.02 0.89 ± 0.01 0.63 ± 0.01 7.42 α-薇烯α-pinene C10H16 136 3.79 ± 0.03 0.78 ± 0.02 3.83 ± 0.10 1.66 ± 0.11 1.40 ± 0.04 8.19 山梨醛 sorba ehyde C6H8O 96 - - - 0.51 ± 0.00 - 8.47 三环烯 tricyclene C10H16 136 - - 0.56 ± 0.00 0.74 ± 0.01 0.70 ± 0.01 8.69 侧柏烯thujene C10H16 136 9.68 ± 0.23 7.74 ± 0.41 6.64 ± 0.21 6.02 ± 0.12 7.71 ± 0.19 8.91 β薇烯β-pinene C10H16 136 79.85 ± 3.44 48.72 ± 2.68 73.56 ± 4.95 76.26 ± 6.18 78.93 ± 5.36 9.24 樟烯 camphene C10H16 136 16.82±1.11 8.82± 0.89 16.41±1.55 15.13±2.02 16.83±2.58 9.39 伞柳醇 umbellulol C10H16O l52 l2.50±l.87 15.12±2.07 9.64±1.01 6.56±0.66 7.99±0.89 10.00 桧稀 sabinene C10H16 136 15.46±1.29 9.52±1.06 14.30±2.03 12.48±1.69 14.21±1.87 10.52 月桂烯myrcene C10H16 136 50.11±3.48 53.59±4.08 26.28±2.22 14.81±1.23 19.90±2.10 10.80 水芹稀 phellandrene C10H16 l36 l8.93±l.07 l7.50±2.04 8.78±0.67 4.64±0.2l 6.79±0.24 10.88 蒈烯 3-carene C10H16 l36 - - 1.19±0.02 0.79±0.00 0.75±0.00 11.12 α-萜品烯 α-terpinene C10H16 136 23.81±2.34 21.41±2.45 10.65±1.67 5.49±0.19 8.16±0.98 11.37 伞花经o-cymene C10H14 134 - 93.77±7.33 55.02±3.89 19.40±1.22 36.31±1.32 11.56 a-萜品醇 a-terpineol C10H1O 154 96.79±7.92 7.80±0.11 1.08±0.01 20.77±2.03 25.12±1.98 11.99 罗勒烯ocimene C10H16 136 4.82±0.66 11.63±0.98 6.35±0.93 3.51±0.06 5.48±0.08 12.35 β萜品烯β-terpinene C10H16 136 50.44±4.22 52.84±3.98 19.77±1.76 10.44±1.05 16.44±1.08 13.08 萜品油烯terpinolene C10H12 132 32.63±2.87 33.23±3.48 15.09±0.94 7.91±0.56 11.70±1.86 13.44 里那醇linalool C10H18O 154 32.06±3.04 29.88±2.65 15.82±1.44 6.08±0.72 9.43±0.57 13.59 蒿萜酮eucarvone C10H16O 140 3.42±0.22 2.25±0.43 1.71±0.18 0.43±0.01 8.64±1.00 14.07 菊油环丽 chrysanthenone C10H14O 150 39.76±2.94 29.38±1.69 17.32±1.03 6.31±0.08 7.23±0.11 14.39 松香芹醇pinocarveol C10H16O 152 1.11±0.02 1.78±0.03 1.46±0.01 0.62±0.00 1.02±0.02 14.53 棒脑 camphor C10H16O 152 26.99±1.93 19.95±2.03 20.43±1.49 7.91±0.99 11.96±1.02 14.74 异龙脑 isoborneol C10H18O 154 0.56±0.00 0.56±0.01 0.71±0.01 20.20±2.03 0.54±0.00 14.93 松香芹酮pinocarvone C10H14O 150 2.12±0.02 4.71±0.08 3.36±0.05 1.26±0.11 2.12±0.12 15.21 龙脑 borneol C10H18O 154 44.98±2.87 39.91±3.18 47.86±3.96 2.81±0.02 29.22±2.77 15.28 松莰酮 pinocamphone C10H16O 152 4.18±0.44 1.13±0.04 3.18±0.62 2.94±0.17 3.78±0.32 15.34 4-萜品醇 4-carvomenthenol C10H18O 154 10.84±0.87 12.45±1.03 7.97±0.06 8.34±0.33 4.85±0.11 15.64 2-薇烯-4-酮 2-pinen-4-one C10H14O 150 1.09±0.09 - 0.91±0.00 2.86±0.11 - 15.81 草蒿脑estragole C10H12O 148 - - 2.04±0.04 3.22±0.05 3.30±0.03 15.87 顺式萜品醇cis-terpineol C10H18O 154 17.34±1.22 14.03±1.83 9.11±0.79 - 6.98±0.77 16.03 癸醒 n-decanal C10H20O 156 - - 1.32±0.22 - - 16.06 桃金娘烯醇myrtenol C10H16O 152 3.14±0.19 4.94±0.36 1.62±0.09 - - 16.28 反式马鞭草烯酮 rans - verbenone C10H14O 150 24.59±1.43 24.21±2.64 34.97±2.92 21.18±1.88 26.42±1.59 16.33 2-烯丙基-4-甲基苯酚 2-allyl-4-methylphenol C10H12O 148 - - 0.91±0.00 3.22±0.11 0.90±0.01 16.77 香茅醇 citronellol C10H20O 198 2.13±0.23 2.78±0.09 1.21±0.11 0.79±0.01 1.16±0.04 16.92 百里香酚甲醚 ethylthymylether C10H16O 164 - 0.48±0.00 - - - 17.08 蒈醇 caranol C10H18O 154 1.75±0.12 1.28±0.07 0.96±0.06 - 0.44±0.00 17.29 桃金娘院醇myrtanol C10H16O 136 4.17±0.11 4.01±0.21 2.76±0.22 - 1.44±0.02 17.70 香叶醇lemonol C10H18O 154 8.37±0.17 12.45±0.88 4.44±0.65 1.98±0.06 2.24±0.06 18.27 梓檬醒guaniol C10H16O 152 3.52±0.33 17.39±0.32 0.84±0.00 2.29±0.17 1.77±0.03 18.34 香芹酮carvone C10H14O 150 3.31±0.21 - 2.94±0.07 2.34±0.08 1.80±0.07 18.41 菊酸甲酯 methyl chrysanthemate C10H18O2 182 1.43±0.04 3.94±0.15 1.31±0.06 0.56±0.00 0.92±0.02 18.87 乙酸龙脑酯bornyl acetate C10H20O2 196 44.36±3.77 70.24±7.86 22.72±2.83 14.18±1.93 21.38±1.77 19.06 菊酸乙酯 chrysanthenyl acetate C12H18O2 194 0.74±0.01 1.31±0.10 1.03±0.07 - - 20.06 乙酸桃金娘烯酯 myrtenyl acetate C12H18O2 194 1.46±0.10 2.76±0.21 0.65±0.02 - 0.49±0.01 20.35 冰片烯bornylene C10H16 136 1.28 ± 0.04 2.96 ± 0.05 1.27 ± 0.01 0.49 ± 0.00 0.70 ± 0.04 20.90 香茅醇乙酸酯 citronellyl acetate C10H18 138 0.49 ± 0.03 6.75 ± 0.31 0.43 ± 0.02 - 0.53 ± 0.01 21.23 乙酸异洋薄荷酯 isopulegol acetate C10H18O 154 3.32 ± 0.21 1.61 ± 0.01 0.61 ± 0.01 0.41 ± 0.00 0.58 ± 0.01 21.82 乙酸香叶酯 geraniol acetate C10H14O 150 2.64 ± 0.20 2.78 ± 0.25 0.90 ± 0.02 - 1.00 ± 0.11 22.20 顺式马鞭草烯酮 cis-verbenone C10H14O 150 10.45 ± 1.03 7.40 ± 0.31 5.16 ± 0.43 0.72 ± 0.05 1.36 ± 0.07 22.46 丁香油酚甲醚 eugenol methylether C10H14O2 178 9.52 ± 0.67 13.70 ± 1.02 5.19 ± 0.48 3.03 ± 0.28 4.45 ± 0.22 22.93 反式石竹烯 trans-caryophyllene C15H24 204 44.75 ± 3.89 39.11 ± 2.77 20.27 ± 1.88 8.09 ± 0.88 12.75 ± 1.11 23.64 香叶基丙酮 dihydropseudoionon C13H220 194 1.35 ± 0.21 1.07 ± 0.07 0.92 ± 0.01 - - 23.72 顺式石竹烯 cis-caryophyllene C15H24 204 6.71 ± 0.44 6.06 ± 0.28 2.83 ± 0.10 1.16 ± 0.05 1.75 ± 0.06 说明:"-"表示未检测到化合物 Table 1. Main components of the volatile organic compounds (VOCs) from Rosemarinus offcinalis
复水后,迷迭香VOCs总量与重度干旱相比增加了29.4%,为对照的55.3%;萜烯类和单萜类相对含量与对照相比分别增加了21.7%和33.3%,两者与重度干旱相比分别下降了1.8%和3.8%;醛类化合物释放总量及相对含量与对照和重度干旱相比均显著降低,醇类和酮类化合物释放量与重度干旱相比变化不显著。
2.1. 脂氧合酶的变化
2.2. 迷迭香VOCs成分分析
-
脂氧合酶通过催化具有顺,顺-1,4-戊二烯结构的不饱和脂肪酸的加氧反应,生成含氧挥发性有机化合物(oxygenated volatile hydrocarbons,OVOCs),其中包括绿叶性气体(GLVs)[3]。动物取食、病原菌侵害和机械损伤均能诱导植物大量释放GLVs[22-23],这些化合物都具有提高植物受损伤器官抵御细菌侵害的功能,可以作为植物体内的信号物质来增加防御,提高植物体的抗逆性[24-25]。干旱胁迫诱导产生大量活性氧(reactive oxygen species,ROS),活性氧破坏细胞膜结构,使得细胞内游离不饱和脂肪酸增加,进而促使脂氧合酶活性升高,催化产生大量的OVOCs。本研究发现,随着干旱胁迫的进行,各处理的脂氧合酶活性均增加。在对挥发性有机化合物(VOCs)各组分进行分析时发现,干旱诱导产生了3种醛类物质和2种C6-GLVs,这些物质的相对含量增加,这与脂氧合酶活性增加呈现相关性;并且轻度干旱和中度干旱处理的3-己烯-2-酮含量明显高于对照,此时这2个处理的脂氧合酶活性也高于对照,两者存在相关性;复水后,脂氧合酶活性降低,干旱胁迫诱导产生的2-己烯醛、山梨醛和癸醛也同时消失。轻度干旱处理酯类相对含量是对照的1.66倍,而中度干旱和重度干旱处理的酯类相对含量均下降,可能是因为轻度干旱下脂氧合酶活性最高,催化生成大量酯类,另一种可能的原因是,迷迭香体内具有储存VOCs的结构[26],轻度干旱下酯类物质储存结构中释放出来,而中度干旱和重度干旱处理储存的VOCs在干旱早期或已经释放,具体原因有待于进一步研究。
萜烯类化合物是植物次生代谢产生的种类最多、释放量最大的VOCs,对植物体起到重要的保护作用[22, 27]。本研究发现各干旱处理的迷迭香萜烯类百分含量均有较大增加,一方面是因为萜类化合物沸点较低,干旱诱导气孔关闭时,它们可以通过非气孔途径向外界排放[28];另一方面,当非生物胁迫发生时,植物体内会通过增加萜烯类化合物的释放来缓解胁迫压力[3, 27-28]。Simpraga等[29]在对欧洲山毛榉Fagus sylvatica的研究中发现,停止浇水10 d后,山毛榉净光合速率下降,几天之后单萜类的释放总量减少,但分配到单萜合成途径中碳的比例却是增加的,说明植物体能够通过增加单萜类的释放来降低光合氧化伤害[30];Lavoir等[15]发现:干旱胁迫下冬青栎释放的单萜是对照处理的55%。本研究同样表明:各干旱处理单萜类释放总量均减少,但单萜类相对含量却随着干旱程度的加深呈现明显的增加趋势,说明迷迭香能够通过增加单萜类的释放来抵御干旱胁迫。
综上所述:干旱能够诱导脂氧合酶酶活性增加,催化合成更多的GLVs及醛类VOCs;干旱导致迷迭香VOCs释放总量下降,却诱导迷迭香合成新的VOCs成分,且萜烯类的释放比例呈增加的趋势。研究表明:迷迭香能够通过增加GLVs、醛类和萜烯类化合物的释放来有效缓解干旱胁迫造成的伤害,提高迷迭香的抗旱性。园林植物在生长发育的过程中,不可避免的会受到环境的胁迫,而干旱胁迫是最常见的一种,研究园林植物的抗旱性机理对于园林植物的养护管理意义重大,并且,迷迭香VOCs的释放规律研究可以为迷迭香的园林配置,尤其是芳香植物园配置提供科学依据。












 DownLoad:
DownLoad: