-
空心莲子草Alternanthera philoxeroides隶属于苋科Amaranthaceae莲子草属Alternanthera,是一种水陆两栖的多年生宿根草本植物,也是全球恶性杂草之一[1]。该草于20世纪30年代传入中国,由于适应性强、生长繁殖迅速以及强烈的化感作用,从而使它成功入侵到陆地和水域生态系统[2-5]。目前,在中国华东、华中、华南和西南等20多个省市和自治区均发现其不同程度的入侵[6-7]。因此,开展空心莲子草防治研究对保护中国水域、湿地和陆地环境具有重要意义。目前,对空心莲子草的防治主要有人工、化学和生物防除等手段,然而人工防除无法在短时间内进行大面积清除,同时也会消耗大量的人力和物力;通过喷洒除草剂进行化学防除虽然能进行有效控制,然而除草剂会对其他生物产生危害并污染环境[8];利用曲纹叶甲Agasicles hygrophila进行生物防治,由于它不耐寒冷和高温,因此繁殖率较低,不能产生足够的数量来控制空心莲子草[9]。植物的化感物质是一类可降解的天然产物,利用它防治杂草和入侵植物可降低对环境的危害,然而关于这方面的研究工作还较少。张红等[10]利用31种植物地上部分的水浸提液处理高寒草场主要杂草箭叶橐吾Ligularia sagitata,发现23种供体材料对其种子萌发均具有明显的抑制作用。黄荆条Vitex negundo茎、叶提取液均能抑制恶性杂草飞机草Eupatorium odoratum的生长,同时其光合作用明显降低[11]。目前,有关化感物质防治空心莲子草的研究仅见于刘雨芳等[12]的相关报道。为了进一步丰富具有潜在利用价值的植物资源,更充分地了解其作用机制,同时避免提取液不能充分提取化感物质的缺陷,本研究采用具有化感作用的苦楝Melia azedarach和水芹菜Oenanthe javanica粉末直接处理空心莲子草,从植株生长和生理生化指标等方面对其抑制机制予以揭示。
HTML
-
2012年8月初,选取扦插生根、长势一致的空心莲子草(高度约20 cm)并移栽至塑料筐内(长×宽为60 cm×40 cm),每加熟化红壤土10 kg·筐-1。土壤pH值为6.15,有机质质量分数1.57%,碱解氮107.82 mg·kg-1,速效磷 5.20 mg·kg-1,速效钾76.01 mg·kg-1。共移栽30筐,移栽空心莲子草15株·筐-1,加水至淹没土壤以模拟其沼生环境,并置于遮阳30%的智能大棚内缓苗15 d备用。
6月中旬分别于临安顺溪农田沟边和浙江农林大学校园坡地,采集处于营养生长期的供试材料水芹菜整个植株和苦楝当年生枝叶,去杂洗净后置于烘箱中烘至恒量,粉碎装入密封塑料袋备用。8月中旬,分别将30,60,120和240 g苦楝和水芹菜粉末均匀撒入塑料框内并搅入水中以覆盖表层,用以处理恢复生长且长势一致的空心莲子草。以不施加粉末处理为对照。各处理采用随机抽样的方法确定,3筐·处理-1。分别在处理3,6,9和12 d时,测定植株的叶绿素和可溶性蛋白质量分数、丙二醛(MDA)质量摩尔浓度以及超氧化物歧化酶(SOD)和过氧化物酶(POD)活性。在处理12 d时,测定植物的生长状况和光合性能。
-
空心莲子草的高度利用刻度尺测量,并直接计数根蘖数。采用YMJ-C叶面积仪测量植株叶面积后,将叶片在105 ℃烘箱内杀青30 min,80 ℃烘至恒量,并用天平称量其质量,利用质量/叶面积计算比叶重。将植株杀青后烘至恒量测量其生物量,并计算平均单株生物量。
-
①称取空心莲子草植株叶片0.5 g,加入5 mL体积分数为95%乙醇,在黑暗处静提至叶片完全变白,采用Arnon法[13]测定叶绿素质量分数。②称取空心莲子草叶片0.5 g,加入适量预冷的0.05 mol·L-1磷酸缓冲溶液(pH 7.8),冰浴研磨后,定容至25 mL。在4 ℃条件下,1万 r·min-1离心20 min,取上清液用于丙二醛和可溶性蛋白质量分数以及酶活性的测定。③可溶性蛋白的测定采用考马斯亮蓝法[14]进行,测定595 nm处的吸光度,计算可溶性蛋白质量分数。丙二醛质量摩尔浓度测定参照Zhang等[15]的方法,取上述酶提取液1 mL,加入三氯乙酸和硫代巴比妥混合液4 mL,沸水浴15 min,冰浴速冷,离心后取上清液分别测定450,532和600 nm处的吸光值,计算丙二醛质量摩尔浓度。④参照Giannopolitis等[16]的方法测定超氧化物歧化酶活性,测定560 nm处的吸光度,以抑制NBT光氧化还原50%的酶量为1个酶活性单位(1 U=16.67 nkat)。参照Chance等[17]的方法测定过氧化物酶活性,以时间扫描方式测定4 min内470 nm处吸光度的变化,取线性部分计算1 min吸光度变化值。
-
在上午9: 00-11: 00,利用美国Li-COR公司生产的Li-6400便携式光合分析仪测定空心莲子草的光饱和点约为1 000 μmol·m-2·s-1。在此光强下,测定各处理植株的净光合速率(Pn),蒸腾速率(Tr),气孔导度(Cond),胞间二氧化碳摩尔分数(Ci)等指标。
-
试验数据用SPSS 17.0软件进行方差分析,用Origin 8.0进行作图。
1.1. 实验材料与处理
1.2. 研究方法
1.2.1. 生长状况测定
1.2.2. 生理生化指标测定
1.2.3. 光合性能测定
1.2.4. 实验数据处理
-
采用苦楝枝叶粉末处理后,在较低用量时(30 g)能微弱促进空心莲子草生长,但是差异不显著。当施用量增加后,植株高度显著降低,在施用量为60,120和240 g时,植株高度分别比对照降低了16.7%(P<0.05),25.4%(P<0.01)和33.2%(P<0.01)。苦楝粉末对空心莲子草根蘖数、比叶质量和单株生物量亦有相似影响,并且随着施用量增加,抑制作用逐渐增强(表 1)。
植物 用量/g 株高/cm 根蘖数 比叶质量/(mg▪cm-2) 单株生物量/g 苦楝 对照 29.5±2.3 3.67±0.16 2.92±0.25 4.15±0.21 30 29.9±1.8 4.13±0.21 3.30±0.29 4.22±0.25 60 24.6±2.1* 3.00±0.13SS 3.00±0.17 3.75±0.18 120 22.0±1.7▪ 2.67±0.15** 2.43±0.15* 2.58±0.15** 240 19.7±1.4 1.00±0.07SS 2.01±0.13SS 1.31±0.07** 水芹菜 对照 29.5±2.3 3.67±0.16 2.92±0.25 4.15±0.21 30 25.4±1.9* 2.67±0.14SS 3.17±0.21 4.16±0.24 60 25.1±1.7* 2.67±0.15** 3.16±0.19 4.15±0.27 120 18.3±1.4** 2.67±0.11SS 2.81±0.16 2.54±0.16** 240 — — — — 说明:*表示P<0.05,差异显著;**表示P<0.01,差异极显著。一:施加240 g 水芹菜植株粉末后,空心莲子草死亡,因此未测量相应指标。 Table 1. Effects of the two plant species on the growth of Alternanthera philoxeroides
对空心莲子草分别施加30,60和120 g水芹菜粉末后,植株高度分别降低了13.9%(P<0.05),14.9%(P<0.05)和28.0%(P<0.01)。对于根蘖数而言,3种施用量均能显著降低植株根蘖萌生,但3者间没有差异。120 g水芹菜粉末能明显抑制空心莲子草生物量增加,与对照相比降低了38.8%(P<0.01)。当施用量增加到240 g时,植株死亡(表 1)。
-
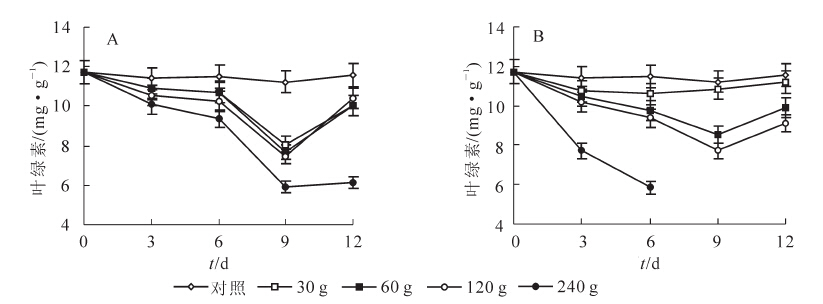
采用30,60,120和240 g苦楝粉末处理空心莲子草后,其叶绿素质量分数随处理时间延长而逐渐降低,其中在第9天时叶绿素质量分数降至最低,与对照相比分别降低了28.1%(P<0.01),31.6%(P<0.01),33.4%(P<0.01)和47.1%(P<0.01)(图 1A)。
施加30 g水芹菜粉末后,空心莲子草叶绿素质量分数显著低于对照,但随着处理时间延长,叶绿素质量分数无明显变化。当施用量增加到60和120 g,处理9 d时空心莲子草叶绿素质量分数最低,与对照相比分别降低了24.1%(P<0.01)和31.2%(P<0.01)。当施加量为240 g时,叶绿素质量分数显著降低,在处理6 d时降低了49.3%(P< 0.01)(图 1B)。
苦楝植株粉末处理后,空心莲子草的光合性能受到明显影响,其中净光合速率、气孔导度和蒸腾速率极显著降低,而胞间二氧化碳摩尔分数则极显著升高。当施加量为240 g时,光合参数受到的影响最大,净光合速率、气孔导度和蒸腾速率分别比对照降低了71.2%,73.5%和68.3%,胞间二氧化碳摩尔分数比对照增加了39.6%,方差分析表明差异均达到极显著水平(P<0.01,表 2)。
植物 处理/g 净光合速率/(μmol▪m-2▪s-1) 气孔导度/(mol▪m-2▪s-1) 胞间CO2摩尔分数/(μmol▪mol-1) 蒸腾速率/(mmol▪m-2▪s-1) 苦楝 对照 7.40±0.41 0.083±0.005 180.2±6.12 2.52±0.23 30 7.68±0.38 0.062±0.003** 191.7±3.26 2.02±0.16* 60 6.47±0.23* 0.045±0.002** 215.6±1.79** 1.52±0.02** 120 4.02±0.31** 0.029±0.001** 237.3±0.13** 1.06±0.19** 240 2.13±0.22** 0.022±0.001** 251.6±4.61** 0.80±0.06** 水芹菜 对照 7.40±0.41 0.083±0.005 180.2±6.12 2.52±0.23 30 7.06±0.41 0.075±0.006 197.4±2.05** 2.35±0.18 60 6.82±0.39 0.042±0.002** 221.3±3.78** 1.40±0.01** 120 5.76±0.19** 0.038±0.002** 249.4±1.62** 1.35±0.11** 240 — — — — 说明:* 表示 P<0.05,差异显著;**表示P<0.01,差异极显著。一:施加240 g水芹菜植株粉末后,空心莲子草死亡,因此未测量相应指标。 Table 2. Effects of the two plant species on photosynthetic parameters of A.philoxeroides
施加水芹菜粉末对空心莲子草的影响与施加苦楝相类似,当施加量为120 g时,空心莲子草净光合速率、气孔导度和蒸腾速率分别降低了22.2%,54.2%和46.4%,胞间二氧化碳摩尔分数增加了38.4%,方差分析表明差异均达到极显著水平(P<0.01,表 2)。
-
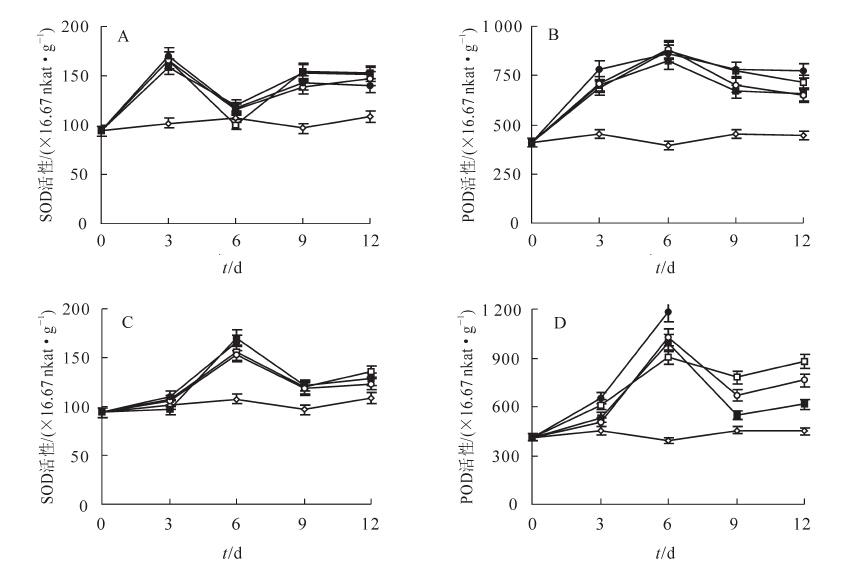
采用30,60,120和240 g苦楝粉末处理空心莲子草3 d时,超氧化物歧化酶活性达到最大值,与对照相比分别增加了62.6%(P<0.01),56.0%(P<0.01),62.6%(P<0.01)和67.6%(P<0.01,图 2A);处理6 d时过氧化物酶活性达到最大值,与对照相比分别增加了1.2倍(P<0.01),1.1倍(P<0.01),1.3倍(P<0.01)和1.2倍(P<0.01,图 2B)。

Figure 2. Effects of the two plant species on antioxidant enzyme activity in Alternanthera philoxeroides
水芹菜粉末处理与苦楝处理的结果相似,但空心莲子草超氧化物歧化酶和过氧化物酶活性均在处理6 d时达到最大值,并且差异均达到极显著水平(P<0.01,图 2C和图 2D)。
-
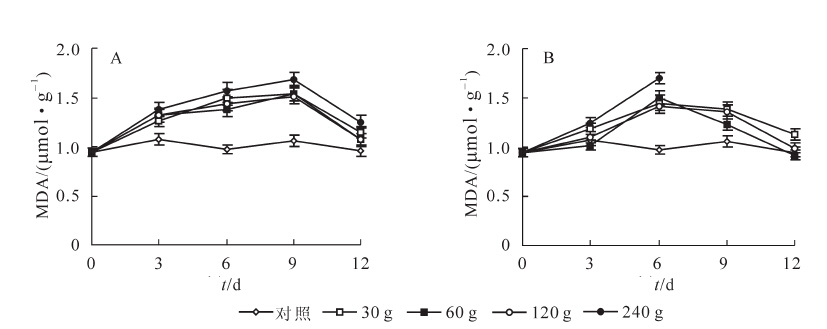
对空心莲子草分别施加苦楝和水芹菜粉末后,其丙二醛质量摩尔浓度显著增加,其中240 g粉末处理后,丙二醛质量摩尔浓度分别在处理9 d和6 d时达到最大值,与对照相比分别增加了58.1%(P<0.01)和75.3%(P<0.01,图 3)。
-
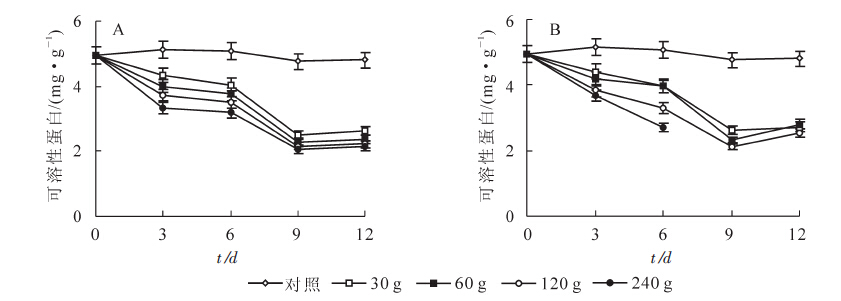
采用苦楝和水芹菜粉末处理空心莲子草后,随着粉末施用量增加可溶性蛋白质量分数显著降低,其中当施用量为240 g时,可溶性蛋白质量分数最低。随着处理时间延长,可溶性蛋白逐渐降低,在处理9 d时,质量分数最低,其中30,60,120和240 g苦楝粉末处理后分别降低了47.2%(P<0.01),51.9%(P<0.01),54.6%(P<0.01)和57.2%(P<0.01)(图 4A);30,60和120 g水芹菜粉末处理后分别降低了44.8%(P<0.01),51.6%(P<0.01)和55.6%(P<0.01)。 240 g水芹菜粉末处理9 d时空心莲子草死亡,在处理6 d时可溶性蛋白质量分数降低了47.0%(P<0.01,图 4B)。
2.1. 2种植物处理对空心莲子草生长的影响
2.2. 2种植物处理对空心莲子草光合性能的影响
2.3. 2种植物处理对空心莲子草抗氧化酶活性的影响
2.4. 2种植物处理对空心莲子草丙二醛质量摩尔浓度的影响
2.5. 2种植物处理对空心莲子草可溶性蛋白的影响
-
利用水和甲醇浸提苦楝果实,其水浸提液可抑制小麦Triticum aestivum和玉米Zea mays 种子萌发,而甲醇提取液在比例为10%时便可完全抑制种子萌发[18]。采用乙醇进行提取,其提取液能明显抑制青萍Lemna minor生长,并且随着处理浓度增加抑制作用明显增强,当质量浓度达到200 g·L-1时可完全抑制青萍生长[19]。水芹菜浸提液能明显抑制斜生栅藻Scenedesmus obliquus和小球藻Chlorella vulgaris生长,其细胞数和叶绿素质量分数明显降低,并且细胞的超微结构发生改变,叶绿体片层肿胀甚至解体,核膜破裂,核质外渗[20-21]。采用苦楝和水芹菜粉末直接处理空心莲子草亦有相似结果,其生长被明显抑制,根蘖数、叶绿素质量分数和光合能力明显降低,同时240 g水芹菜粉末处理9 d便可杀死空心莲子草。
光合作用是植物体内最基本的物质和能量代谢过程,可为植物的化感物质所影响。再力花Thalia dealbata地下部水浸提液能抑制荇菜Nymphoides peltatum,苦草Vallisneria natans,水田芥Nasturtium officinale,芦苇Phragmites australis和黄菖蒲Iris pseudacorus幼苗生长[22],同时植株体内的叶绿素和净光合速率明显降低[23]。黄荆条茎、叶提取液均能抑制飞机草的光合作用,受其影响,飞机草的最大净光合速率、光饱和点和表观量子效率均明显降低,而光补偿点则明显增加[11]。采用2种化感物质2,6-二叔丁基苯酚和邻苯二甲酸二甲酯直接处理茄子Solanum melongena幼苗,其叶绿素、光合速率、气孔导度均明显降低,而胞间二氧化碳浓度则明显升高。此外,茄子叶片PSⅡ的最大光化学效率与电子传递效率也明显降低,这表明化感物质对植物光合作用中电子的产生与传递具有明显的抑制作用[24]。空心莲子草经苦楝和水芹菜粉末处理后,其叶绿素和光合性能也具有相似变化。叶绿素质量分数降低会影响空心莲子草对光能的捕获和转化能力,气孔导度降低限制了二氧化碳进入叶片,胞间二氧化碳升高则表明二氧化碳的同化能力受阻,因此这就导致了空心莲子草的净光合速率下降,从而减少了能量供应,进而影响植株的生长发育。苦楝和水芹菜粉末处理12 d时,空心莲子草叶绿素质量分数又有所升高,这可能与处理时间延长后粉末中化感物质降解有关。
再力花水浸提液处理荇菜、苦草、水田芥、芦苇和黄菖蒲后,其植株体内的超氧化物歧化酶、过氧化物酶和过氧化氢酶活性以及丙二醛均显著提高,同时丙二醛质量分数随浸提液浓度增大而逐渐增加[23]。辣椒Capsicum annumm根系分泌物的潜在化感物质2,6-二叔丁基苯酚、邻苯二甲酸二异丁酯和邻苯二甲酸二丁酯处理生菜Lactuca sativa幼苗后,其体内的超氧化物歧化酶、过氧化物酶、过氧化氢酶、多酚氧化酶和抗坏血酸氧化酶活性均随处理浓度的增加而先增加后降低,当浓度为12 mg·L-1时,抗氧化酶活性均达到最大值[25]。苦楝和水芹菜粉末处理空心莲子草后,其体内的超氧化物歧化酶和过氧化物酶活性以及丙二醛质量分数均随处理时间延长而呈现出先增加后降低的趋势。超氧化物歧化酶和过氧化物酶是植物细胞内清除活性氧的主要抗氧化酶,可为活性氧所诱导产生,其活性增加表明植物体内产生了大量的活性氧,同时植物将本应用于生长的能量转变为清除活性氧的消耗上来[26],从而影响其正常生长。植物体内过量的活性氧会破坏细胞内的生物大分子和质膜,同时质膜过氧化产生的丙二醛会进一步对细胞造成损伤。因此,活性氧损伤和清除活性氧消耗可能是苦楝和水芹菜影响空心莲子草生长的另一原因。
苦楝和水芹菜粉末通过降低光合性能和诱导氧化胁迫而抑制空心莲子草生长,因此,这2种植物对防治空心莲子草等入侵和有害生物具有潜在的应用价值。比较而言,水芹菜的防治效果较好。












 DownLoad:
DownLoad: