-
在温室、大棚等设施栽培系统中,温度、湿度、通气状况等均与露地栽培条件不同[1],土壤缺少雨水淋洗,且设施栽培又具有高度集约化、高复种指数、高肥料施用量的特点,与之相适宜的水肥管理措施的缺乏和特殊的生态环境导致产生诸多土壤问题,其中土壤次生盐渍化问题较为突出。土壤次生盐渍化已经成为了设施栽培中普遍存在问题,导致蔬菜作物产量和品质下降,对设施蔬菜生产的可持续发展产生了严重不利的影响。黄瓜 Cucumis sativus在中国蔬菜设施栽培中占有重要地位,是设施栽培的主要蔬菜之一,对土壤次生盐渍化敏感[2]。土壤次生盐渍化导致黄瓜植株生长受到抑制,盐和盐离子的大量积累诱导植物体发生生化反应,如活性氧(reactive oxygen species,ROS)积累等,造成脂质过氧化反应产生,使植物受到氧化胁迫伤害[3-4]。ROS最重要的形式是羟基自由基、单线态氧、超氧阴离子和过氧化氢。植物可产生一系列的内源机制,如低分子量的非酶抗氧化物质和酶的组分,来保护植物抵御ROS的毒害作用[5]。超氧化物歧化酶(superoxide dismutase,SOD)是一种金属蛋白,催化超氧化物自由基歧化形成过氧化氢和氧气[6],然后过氧化氢被过氧化氢酶(catalase,CAT)和多种过氧化物酶(peroxidases,POD)所清除,转化成水和氧气。SOD,POD,CAT是细胞膜系统免受ROS伤害的保护酶[7-8],在植物体中广泛存在,其活性的高低可在一定程度上反应植物抗逆性的强弱。盐胁迫还导致黄瓜果实品质变差,如可溶性蛋白、总糖、抗坏血酸(Vc)等均受到显著影响,产量下降[9],因此,选育耐盐黄瓜品种和研究其耐盐机制是十分重要的。在前人研究基础上,本研究以黄瓜为材料,采用营养液水培,研究了盐(NaCl)胁迫对黄瓜幼苗叶片、根系和韧皮部渗出液SOD,POD和CAT同工酶活性表达的影响,以期为黄瓜设施栽培及耐盐性强黄瓜品种的选育提供理论依据和支撑。
HTML
-
试验研究于2013年9月至2014年12月在浙江农林大学官塘玻璃温室内进行。供试黄瓜品种为盐敏感的‘津优1号’Cucumis sativus ‘Jinyou No. 1’,天津科润农业科技股份有限公司黄瓜研究所研制;较耐盐的‘新泰密刺’Cucumis sativus‘Xintai Mici’,山东新泰市黄瓜研究所选育。种子在28 ℃恒温培养箱中催芽,露白后播于装有m(草炭)∶m(蛭石)∶m(珍珠岩)=2∶1∶1的育苗盘中育苗。待幼苗3叶1心时,挑选生长一致的幼苗定植于水培槽内。采用Hoagland营养液培养,气泵通气(40 min·h-1),预培养3 d后开始处理。共设4个处理,分别为:①‘津优1号’-正常营养液栽培(J);②‘新泰密刺’-正常营养液栽培(X);③‘津优1号’-营养液添加75.0 mmol·L-1盐栽培(salt-J);④‘新泰密刺’-营养液添加75.0 mmol·L-1 盐栽培(salt-X)。为了保证处理浓度的稳定性,处理期间2 d更换1次营养液。试验设3次重复。处理后第3 天取样(叶片、韧皮部渗出液和根系)测定相关指标。使用消毒后的锋利刀片切割黄瓜植株的茎,收集茎中韧皮部渗出液,具体收集步骤参考MITCHELL等[10]方法。
-
活性聚丙烯酰胺凝胶电泳(PAGE)参数:100 V,4 ℃运行60 min;200 V,4 ℃运行180 min。除在整个电泳过程中不使用SDS,其他电泳缓冲液和凝胶配置参考LAEMMLI[11]的方法。
-
使用质量分数为7.5%聚丙烯酰胺凝胶分离POD,活性染色采用FIELDING等[12]方法。凝胶首先孵育在25.0 mmol·L-1磷酸钾缓冲液(pH 7.0)中反应15 min,然后逐渐降低pH值,随后凝胶浸没在新鲜配制的25.0 mmol·L-1磷酸钾缓冲液中,轻摇,直到POD同工酶条带清晰可见。使用质量分数为10.0%聚丙烯酰胺凝胶分离SOD。活性染色采用BEAUCHAMP等[13]方法。凝胶在36.0 mmol·L-1磷酸钾缓冲液中平衡30 min;在蒸馏水中漂洗1 min;然后浸没在36.0 mmol·L-1磷酸钾缓冲液(pH 7.8)(2.5 mmol·L-1 氯化硝基四氮唑蓝NBT)中,轻摇10~20 min,紫色背景下表现出无色条带即为SOD酶带。使用质量分数为7.5%聚丙烯酰胺凝胶分离CAT。活性染色采用WOODBURY等[14]方法。凝胶在0.003% 过氧化氢中孵育10~15 min,蒸馏水漂洗2次,然后在质量分数为1%氯化铁和1%铁氰化钾中孵育10~15 min,蓝色背景下出现无色条带即为CAT酶带,凝胶用自来水漂洗干净。
1.1. 材料培养及处理
1.2. 同工酶PAGE电泳
1.3. 染色方法
-
从图 1A可知:在叶片中检测到了9条SOD同工酶条带,即Sl-1,Sl-2,Sl-3,Sl-4,Sl-5,Sl-6,Sl-7,Sl-8,Sl-9(迁移率分别为32.08%,33.02%,38.68%,43.40%,47.17%,57.55%,60.38%,67.92%和71.70%)。与对照相比,盐胁迫下,除Sl-7外,其他8条SOD同工酶在 ‘津优1号’ 中的表达均有所增强;叶片中检测到的9条SOD同工酶在‘新泰密刺’中表达均被抑制。正常栽培条件下,‘津优1号’中SOD同工酶表达量显著弱于 ‘新泰密刺’。由图 1B可以看出:在韧皮部渗出液中检测到了3条SOD同工酶条带,分别为Sp-1,Sp-2,Sp-3,迁移率分别为45.28%,60.38%和62.66%。与对照相比,盐胁迫条件下,3条SOD同工酶在‘津优1号’中表达均明显受到抑制,而在‘新泰密刺’中表达则均有增强。正常栽培下,‘津优1号’和‘新泰密刺’中SOD同工酶表达无显著差异。如图 1C所示:在根系中检测到6条SOD同工酶条带,即Sr-1,Sr-2,Sr-3,Sr-4,Sr-5,Sr-6。与对照相比,在胁迫条件下,Sr-1,Sr-2和Sr-3在‘津优1号’中的表达受到抑制,Sr-4和Sr-5表达明显增强,而Sr-6表达无变化;Sr-1,Sr-2,Sr-3和Sr-6在‘新泰密刺’中的表达受到抑制,Sr-4和Sr-5表达无明显变化。正常栽培条件下,与‘新泰密刺’相比,‘津优1号’中的SOD同工酶表达相对较弱。
-
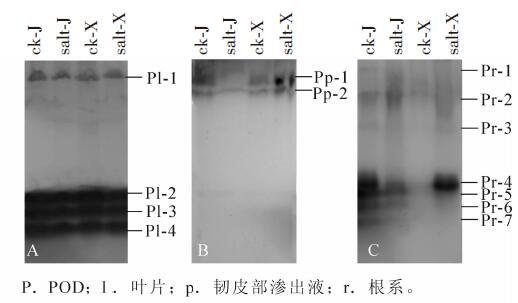
从图 2A可以看出:在叶片中检测到了4条POD同工酶条带,即Pl-1,Pl-2,Pl-3,Pl-4(迁移率分别为8.42%,38.95%,41.05%和46.32%)。与对照相比,在盐胁迫条件下,4条POD同工酶条带在‘津优1号’和‘新泰密刺’中的表达均受到抑制。正常营养液栽培条件下,POD同工酶表达在两品种间无明显差异。如图 2B所示:在韧皮部渗出液中检测到了2条POD同工酶条带,即Pp-1和Pp-2(迁移率分别为7.37%和11.58%)。与对照相比,在盐胁迫下,‘津优1号’中的2条POD同工酶表达均受到了明显抑制,而在‘新泰密刺’中表达则明显的加强。正常营养液栽培条件下,‘津优1号’韧皮部渗出液中的POD同工酶表达强于‘新泰密刺’。

Figure 2. Effect of NaCl stress on the expression of POD isozymes in cucumber seedling leaf, phloem exudates and root
在根系中检测到了7条POD同工酶条带(图 2C),即Pr-1,Pr-2,Pr-3,Pr-4,Pr-5,Pr-6,Pr-7(迁移率分别为8.42%,11.58%,21.05%,31.58%,35.79%,41.05%和44.21%)。与对照比较,除了Pr-2外,‘津优1号’品种中检测到的其他6条POD同工酶条带的表达在盐胁迫条件下均受到了明显抑制,而Pr-2在盐胁迫下表达显著增强;在‘新泰密刺’中,盐胁迫下,Pr-1,Pr-2,Pr-3,Pr-4,Pr-5和Pr-6的表达均显著增强,Pr-7条带在正常栽培和盐处理中几乎不可见。正常栽培条件下,‘津优1号’韧皮部渗出液中的POD同工酶表达强于‘新泰密刺’。
-
从图 3A可以看出:在4个处理中叶片均检测到2条CAT同工酶条带,即Cl-1,Cl-2(迁移率分别为6.68%和2.75%)。与对照相比,在胁迫条件下,‘津优1号’中Cl-1表达明显增强,‘新泰密刺’中Cl-1表达显著减弱,而Cl-2在2个品种中均无明显变化。正常栽培条件下,‘津优1号’叶片中的CAT同工酶表达相对‘新泰密刺’明显较弱。如图 3B所示:在幼苗韧皮部渗出液4个处理中只检测到1条CAT同工酶条带,即Cp-1。与对照相比,胁迫条件下‘津优1号’CAT同工酶表达明显受到了抑制,‘新泰密刺’则略有增强。正常栽培条件下,‘津优1号’韧皮部渗出液中的CAT同工酶表达相对‘新泰密刺’略弱。由图 3C可知:根系4个处理中只检测到1条CAT同工酶条带,即Cr-1。与对照相比,胁迫条件下2个黄瓜品种CAT同工酶均明显增强。正常栽培条件下,‘津优1号’ 根系中的CAT同工酶表达比‘新泰密刺’强。
2.1. 盐(NaCl)胁迫对超氧化物歧化酶(SOD)同工酶表达的影响
2.2. 盐胁迫对过氧化物酶(POD)同工酶表达的影响
2.3. 盐胁迫对过氧化氢酶(CAT)同工酶表达的影响
-
过量盐分对植物造成渗透胁迫和干扰营养离子平衡,盐分通过抑制和诱导多种酶系统表达和活力等,从而影响植物的生长。植物对逆境胁迫的响应之一就是通过抗氧化酶表达和活性进行调节,抗氧化酶调节在一定程度上可以缓解植物的过量盐分积累对植物造成的毒害[15]。在正常生长的植物体内,活性氧(ROS)的形成和淬灭之间是保持动态平衡的,而当植物遭受盐分等环境胁迫时,其动态平衡被打破,ROS积累导致细胞膜质氧化,引起植物的氧化损伤[16]。植物体内ROS的清除主要依靠以SOD,POD,CAT等抗氧化酶系统[17],在保护机体免受ROS侵害方面发挥重要作用。
叶片和根系分别是植物进行光合作用、水分和营养吸收的重要器官,韧皮部是维管系统的重要组成部分,是输导养分,并有支持、储藏等功能的复合组织,三者在植物的生命活动和对外界的响应过程中起着至关重要的作用。因而,本研究对氯化钠胁迫下黄瓜幼苗叶片、韧皮部渗出液及根系3个部位的抗氧化酶同工酶的表达情况进行了研究,从而更全面地反映不同耐盐性的黄瓜品种在抗氧化酶同工酶表达上的差异和特点。植物遭受逆境引发ROS水平升高的同时,植物体内的抗氧化酶发生变化。SOD活性增加,将超氧阴离子自由基快速歧化为过氧化氢和分子氧,减少膜脂过氧化对植物造成的伤害[18]。POD和CAT是植物体内担负清除过氧化氢的主要酶类,广泛存在于植物,虽然这2种酶的底物都是过氧化氢,但是CAT催化过氧化氢生成水和氧气,POD催化过氧化氢氧化其他底物后生成水[19]。本研究中,在75.0 mmol·L-1的盐胁迫下,‘津优1号’SOD同工酶在叶片中表达增强,韧皮部渗出液中下降,根系中无明显规律。周珩等[20]研究表明:在盐敏感的黄瓜品种‘津春2号’叶片SOD活性在盐胁迫下上升,与本研究中SOD同工酶表达变化相一致。而在耐盐性较强的‘新泰密刺’叶片和韧皮部中SOD同工酶表达与‘津优1号’完全相反,在根系6条SOD同工酶条带中有2条相同条带与‘津优1号’表达一致,均受到抑制。对于POD同工酶,2个品种在叶片中的表达趋势一致,均下降,在韧皮部渗出液和根系(除1条条带外)中相反。对于CAT同工酶,2个品种在叶片和韧皮部渗出液中表达变化趋势相反,而在根系中均表现出上升的趋势。DUAN等[21]研究发现:盐胁迫下3 d后两耐盐性不同的黄瓜品种‘津春2号’和‘长春密刺’根系CAT活性均升高,与本试验中根系CAT同工酶盐胁迫下的表达趋势一致。
综上可知:在2个耐盐性不同的黄瓜品种中,SOD同工酶在韧皮部、POD同工酶在韧皮部和根系及CAT同工酶在叶片和韧皮部中表达趋势相反,在一定程度上说明3种同工酶分别在黄瓜幼苗的这些部分与其耐盐性有密切关系。韧皮部渗出液中3种同工酶变化趋势在2个品种中均完全相反,说明韧皮部在黄瓜幼苗耐盐性的响应中具有重要意义,为通过韧皮部鉴定不同黄瓜品种的盐耐性提供了借鉴,以及为黄瓜的耐盐性研究提供了新的思路。同时我们还得出,品种耐盐性不同,抗氧化酶同工酶变化趋势相反有一定的组织或器官特异性,如POD同工酶仅在韧皮部渗出液和根系中变化趋势相反,为我们通过研究特定组织或器官的抗氧化酶同工酶变化判断植物耐盐性提供了重要依据和参考,但植物的耐盐性是一个复杂的数量性状,其精确的机制尚需进一步研究。












 DownLoad:
DownLoad: