-
在资源综合利用和固碳减排的背景下,大量的农林废弃物作为生物质原料正在得到开发利用,国内关于生物质原料的研究以农林废弃物中的秸秆较为成熟,其提高土壤肥力和改善土壤生态环境的效应受到学界广泛认可,在农田土壤中的应用普遍。众多研究表明:秸秆作为生物质原料对土壤微生物的数量和活性具有显著影响[1-4],可有效提高土壤碳氮磷钾等养分含量[5-8]。但也有研究发现:作为营养元素循环及形态转换的重要承担者,土壤微生物在驱动养分周转的同时也会对土壤二氧化碳(CO2)的释放产生影响[9-11]。因此,秸秆施用虽然补充了土壤养分,但也在一定程度上造成CO2排放增加。杨树Populus具有生长快、成材早、产量高、易于更新等特点,是世界中纬度平原地区栽培面积最大、木材产量最高的速生用材树种之一[12]。作为重要的多功能用材和生态公益树种,中国杨树人工林面积居世界首位,杨树人工林的大量采伐和生产利用,使得采伐剩余物利用空间和潜力巨大。目前对林业采伐剩余物利用的研究,仅有少量针对杉木Cunninghamia lanceolata[13-15]、桉树Eucalyptus[16-17]和松树Pinus[18-19]等的报道,针对杨树人工林采伐剩余物利用的研究更是鲜有。本研究以农业剩余物还田后在土壤中发挥的效应为参考,以南方地区重点推广的杨树‘南林895杨’Populus × euramericana‘Nanlin -895’采伐剩余物和水稻Oryza sativa秸秆为研究对象,比较施用杨树不同组分(树枝、树皮、树叶)和水稻秸秆后,森林土壤的生物化学性质差异,旨在探究杨树采伐剩余物对森林土壤养分和CO2释放的综合效应,以期为杨树采伐剩余物还林提供理论依据。
HTML
-
2018年10月于江苏省宿迁市泗洪县陈圩林场采集‘南林895杨’采伐剩余物及试验地周围农田水稻。所采原材料按杨树树皮、树枝、树叶、水稻秸秆分类,用去离子水洗净,70 ℃恒温烘干后粉碎过2 mm筛,密封保存备用。生物质原料基本性质见表1。
生物质原料 pH 全碳/(g·kg−1) 全氮/(g·kg−1) 碳氮比 全磷/(g·kg−1) 全钾/(g·kg−1) 树枝 6.16±0.08 b 481.87±2.72 a 5.53±0.21 c 87.45±3.37 b 0.87±0.01 b 4.65±0.06 c 树皮 5.60±0.08 c 465.50±9.15 b 3.70±0.14 d 126.26±7.51 a 0.30±0.02 d 3.10±0.04 d 树叶 5.49±0.12 c 415.17±4.50 c 14.07±0.26 a 29.46±0.29 c 0.69±0.01 c 6.31±0.45 b 水稻秸秆 6.41±0.07 a 417.77±4.30 c 11.90±0.36 b 35.16±0.83 c 0.97±0.01 a 19.83±0.44 a 说明:同列不同小写字母表示不同生物质原料性质间差异显著(P<0.05) Table 1. Basic properties of biomass materials used in this study
2019年3月于江苏省宿迁市泗洪县陈圩林场采集‘南林895杨’中龄林(12年生)林地0~20 cm表层土壤,土壤母质为洪泽湖淤积土,土壤质地为黏土。剔除动植物残体及小石子等杂质,过2 mm筛后置于4 ℃冰箱保存备用。土壤基本理化性质如下:土壤容重为(1.42±0.02) g·cm−3;pH为7.18±0.05;阳离子交换量为(31.02±0.66) cmol·kg−1;全碳和全氮质量分数分别为(9.77±0.01)和(1.13±0.01) g·kg−1,碳氮比为9.44±0.25;全磷和全钾质量分数分别为(0.35±0.00)和(9.52±0.75) g·kg−1。
-
试验共设置5个处理:土壤(对照,ck)、土壤+杨树树皮(BR)、土壤+杨树树枝(TR)、土壤+杨树树叶(LR)、土壤+水稻秸秆(SR),每个处理3个重复。室内培养方法参考ZIMMERMAN[20]和闫德智等[21],并依据陈圩林场杨树人工林单位面积凋落物(20 g·kg−1)的实际情况,控制各处理中生物质原料质量分数(2%),混合均匀后装入自制的聚乙烯塑料盒(口径8 cm,高12 cm),采用称量法用无菌水调节土壤含水量至田间持水量的60%,加盖密封后在25 ℃恒温培养箱中暗培养180 d。培养期间,保持土壤含水量为田间持水量的60%。为维持土壤良好的通气条件,1周通气1次,时长20 min。
采取破坏性取样测定土壤生物化学性质,取样时间为培养的0、7、15、30、60、90、120、180 d。基于密闭箱法原理采取放回式取样测定土壤CO2,具体操作步骤为:用30 mL针筒从密闭培养罐上端采集0时刻的15 mL气样,1 h后采集第2针气体15 mL,所取气体均储存于事先抽真空的锡纸气体采样袋中,在3 d内测定。取样后的培养罐重新密封放回恒温培养箱,留待下一次采样。取样时间为培养后的第1、3、5、7、10、13、16、19、22、25、30、35、40、47、54、61、70、79、88、99、110、121、134、149、165、180 天。
-
生物质原料和供试土壤的pH(记为pH1和pH2)利用pH仪测定,其中生物质原料与去离子水的质量体积比为1.0∶20.0,土壤与去离子水质量体积比为1.0∶2.5,参照LY/T 1239−1999《森林土壤pH值的测定》进行。生物质原料和土壤的全碳(TC1和TC2)、全氮(TN1和TN2)及碳氮比(C1/N1和C2/N2)用元素分析仪(Vario MACRO Cube, Elementar, 德国)测定。生物质原料和土壤的全磷(TP1和TP2)和全钾(TK1和TK2)采用浓硫酸-高氯酸消煮法提取,其中全磷采用钼锑抗比色法测定,全钾用原子吸收分光光度计测定,参照LY/T 1232−1999《森林土壤全磷的测定》和LY/T 1234−1999《森林土壤全钾的测定》进行。按1.0∶5.0的质量体积比用2 mol·L−1 氯化钾溶液提取土壤无机氮,其中铵态氮(NH4 +-N)采用靛酚蓝比色法,硝态氮(NO3 −-N)采用紫外分光光度法进行测定,参照鲍士旦[22]和GB/T 32737−2016《土壤硝态氮的测定 紫外分光光度法》进行。用盐酸-硫酸双酸提取,钼锑抗比色法测定土壤有效磷(AP),参照LY/T 1233−1999《森林土壤有效磷的测定》进行。用1 mol·L−1乙酸铵提取,原子吸收分光光度计测定土壤速效钾(AK),参照LY/T 1236−1999《森林土壤速效钾的测定》进行。用1 mol·L−1乙酸铵交换法测定并计算土壤阳离子交换量(CEC),参照LY/T 1243−1999《森林土壤阳离子交换量的测定》进行。土壤微生物生物量碳(MBC)和微生物生物量氮(MBN)采用氯仿熏蒸-K2SO4浸提法提取,其中MBC利用TOC仪测定,MBN利用流动分析仪测定[23-24]。计算MBC=(熏蒸后土壤有机碳-熏蒸前土壤有机碳)/0.45。其中:MBC为土壤微生物生物量碳质量分数(mg·kg−1),0.45为熏蒸提取法提取液的有机碳增量换算成土壤微生物生物量碳的换算系数。计算MBN=(熏蒸后微生物量氮−熏蒸前土壤微生物量氮)/0.25。其中:MBN为微生物生物量氮质量分数(mg·kg−1),0.25为微生物体氮的矿化系数,即矿化得到的微生物体氮是微生物体总氮的0.25倍。
-
采用气相色谱仪(Agilent 7890A, 美国)测定CO2气体质量分数(mg·kg−1)。载气为5%的氩甲烷,流速为40 mL·min−1,色谱柱和ECD检测器的温度设置为40和300 ℃,炉温和FID检测器的温度设置为40和200 ℃。计算CO2日释放速率:
$F = 24\dfrac{{\rho \dfrac{{\Delta c}}{{\Delta t}}V\dfrac{{273}}{{273 + T}}}}{W} $ 。其中:F为气体日释放速率(mg·kg−1·d−1);ρ为标准状态下气体的质量浓度(g·L−1);∆c为培养瓶内CO2气体质量分数变化量(mg·kg−1),∆t为单位时间(h),∆c/∆t表示单位时间内培养瓶内CO2气体质量分数变化量(mg·kg−1·h−1);V为培养瓶中气体的有效空间体积(L);W是培养瓶内样品的质量(kg);T为培养温度(℃)。温室气体累积排放量:$S = \displaystyle \sum\limits_{i = 1}^n {\dfrac{{{F_{\left( {i + 1} \right)}} + {F_i}}}{2}} \left[ {{t_{\left( {i + 1} \right)}} - {t_i}} \right] $ ,n=180。其中:s为气体的累积排放量(mg·kg−1);Fi为培养第i天的气体日释放速率;ti为采样时的培养天数(d)[25]。 -
数据统计分析使用Excel 2010和SPSS 20.0,多重比较采用最小显著差异法(LSD,α=0.05),图表绘制使用Excel 2010和Origin 2018。数据为平均值±标准误。
1.1. 材料
1.2. 试验设计
1.3. 测定方法
1.3.1. 生物原料和土壤特性测定
1.3.2. 土壤CO2日释放速率和累积释放量的测定
1.4. 数据分析
-
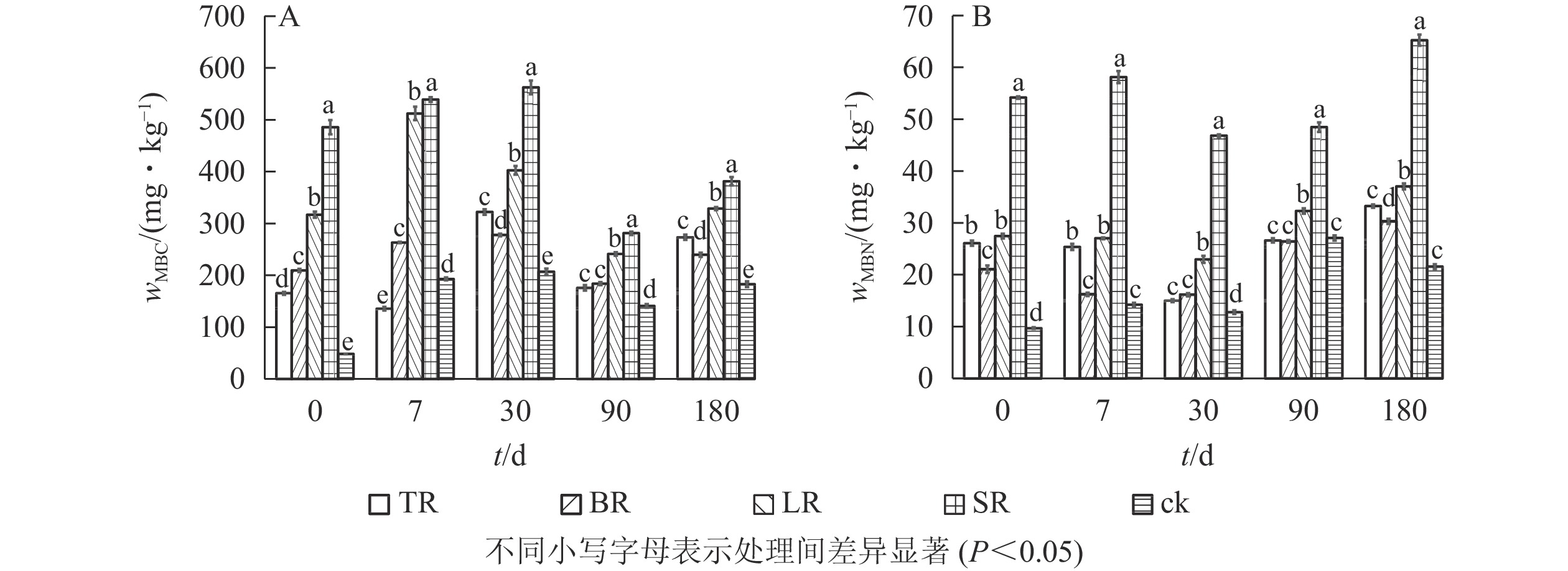
土壤中添加不同生物质原料显著影响土壤微生物生物量(图1,P<0.05)。由图1A可知:在培养的各阶段,SR的土壤MBC质量分数始终高于其他处理(P<0.05),与对照相比,各处理组土壤MBC质量分数均显著升高(P<0.05)。培养结束时,各处理的土壤MBC质量分数分别比对照增加了50.00%、31.00%、80.00%和109.00%,说明添加4种生物质原料均能提高土壤MBC质量分数。
由图1B可知:与对照相比,培养结束后各处理组土壤MBN显著增加(P<0.05),其中SR的土壤MBN质量分数显著高于其他处理,各处理的土壤MBN质量分数分别比对照增加了54.00%、40.00%、72.00%和203.00%,说明4种生物质原料的施用均能增加土壤MBN质量分数。
相关性分析表明(表2):施用生物质原料180 d后,土壤MBC与TN1、TP1、TK1存在极显著正相关(P<0.01),与TC1和C1/N1存在极显著负相关(P<0.01);土壤MBN与TC1、C1/N1存在显著负相关(P<0.05),与TK1存在极显著正相关(P<0.01)。
土壤指标 生物质原料性质 TC1 TN1 C1/N1 TP1 TK1 MBC −0.822** 0.846** −0.903** 0.732** 0.889** MBN −0.629* 0.556 −0.637* 0.655* 0.998** NH4 +-N 0.777** −0.904** 0.825** −0.273 −0.181 NO3 −-N −0.826** 0.733** −0.752** 0.541 0.938** AP −0.225 0.564 −0.692* 0.812** 0.194 AK −0.584* 0.532 −0.632* 0.709** 0.990** CO2日释放速率 0.851** −0.914** 0.927** −0.610* −0.658* 说明:*表示显著相关(P<0.05),**表示极显著相关(P<0.01) Table 2. Correlations between properties of biomass materials and properties of soil
-
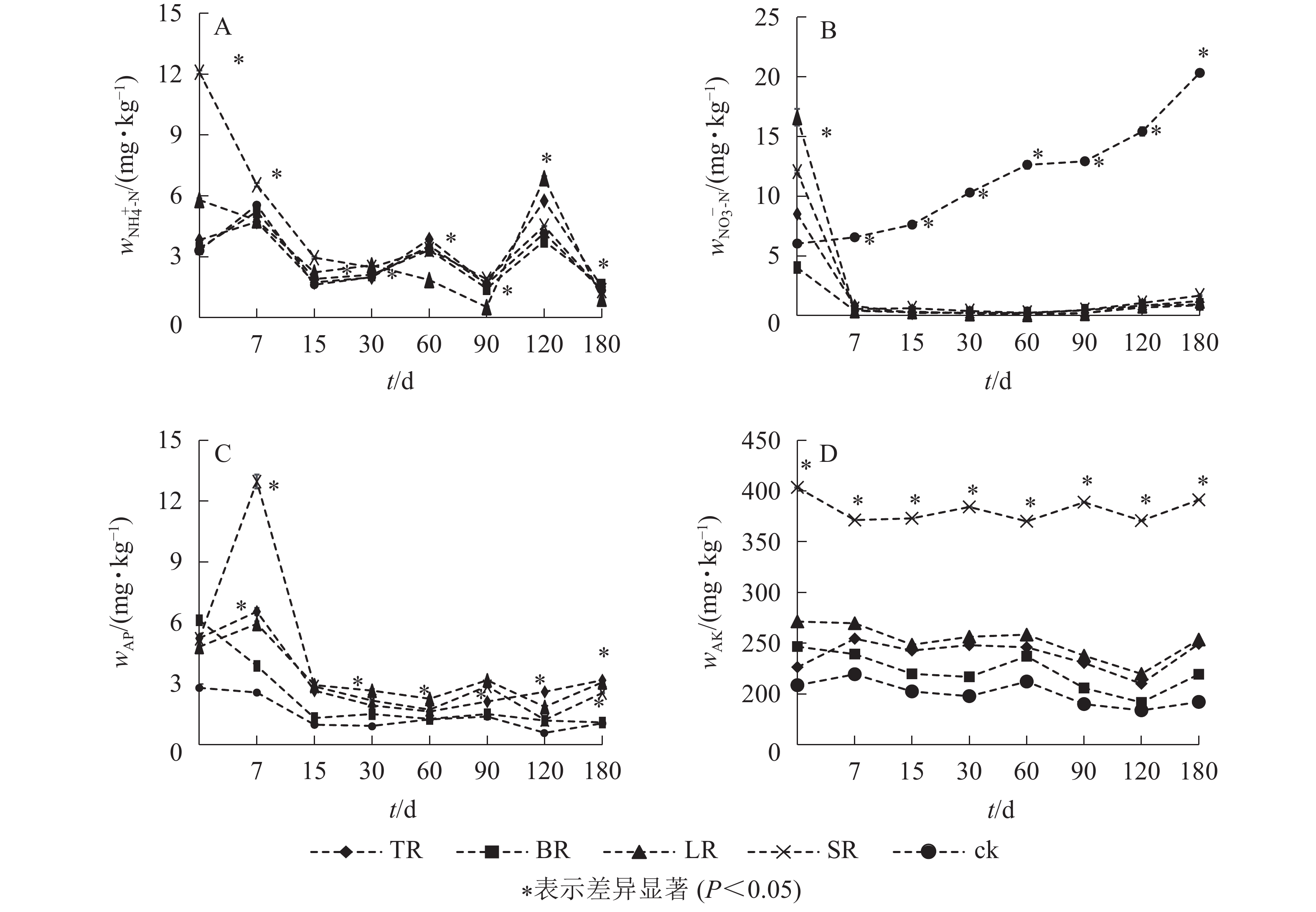
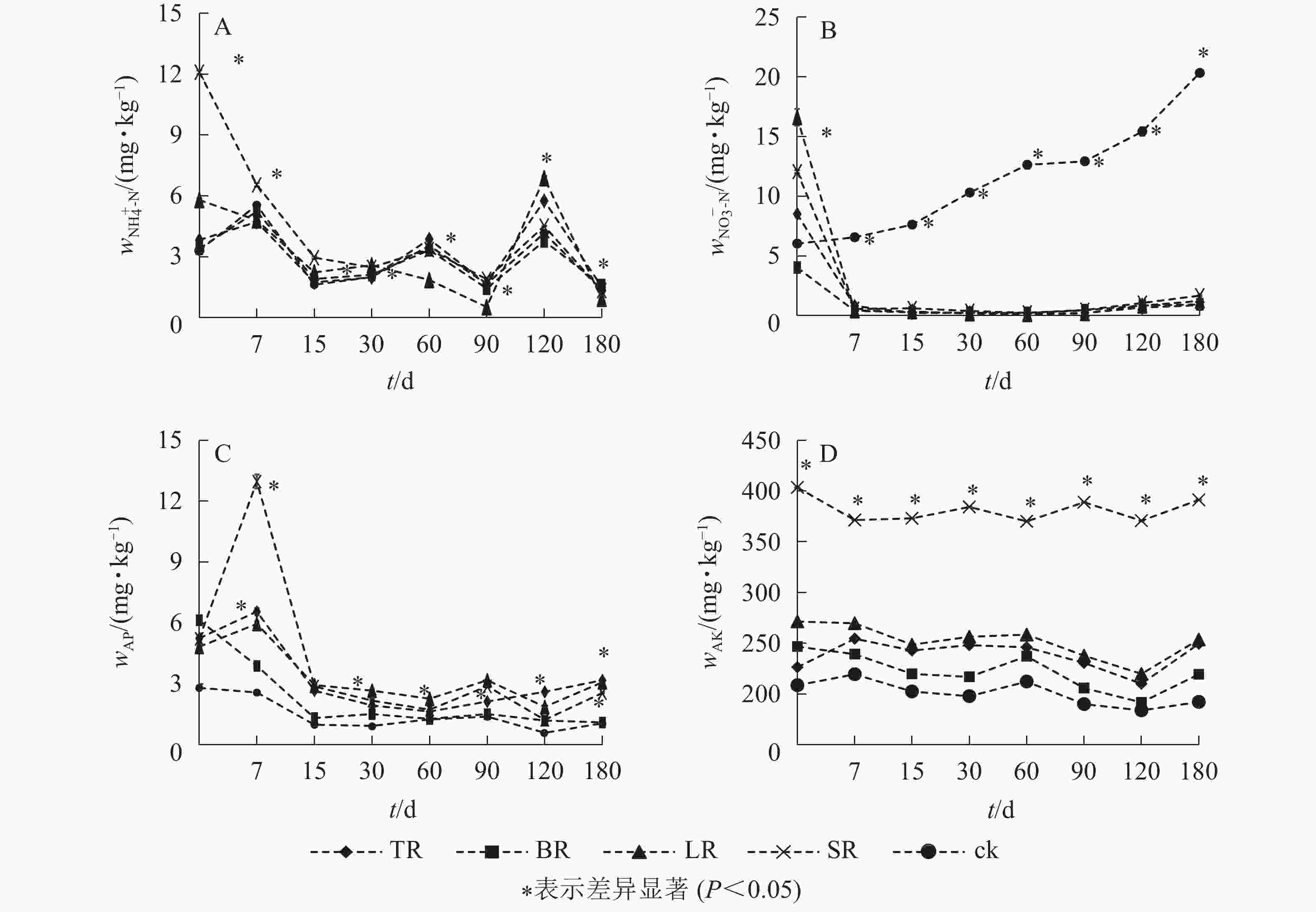
不同生物质原料对土壤速效养分的影响动态相似,但不同养分间存在差异(图2)。培养初期,SR土壤NH4 +-N质量分数下降最显著;培养中后期,不同处理的NH4 +-N质量分数均呈先上升后下降的趋势;培养结束时,不同处理的土壤NH4 +-N质量分数均明显减少,从大到小依次为BR、TR、对照、SR、LR(图2A)。除对照的土壤NO3 −-N质量分数随培养时间增加始终呈上升趋势,其他处理土壤NO3 −-N质量分数均表现为培养初期显著下降,培养60 d时降到最低,培养结束时略有增加,从大到小依次为对照、SR、LR、BR、TR(图2B)。
由图2C可知:土壤有效磷质量分数表现为培养初期下降明显,初期至中后期上下波动,中后期有所上升。培养结束后,TR、BR、LR和SR的土壤有效磷质量分数分别比对照增加了202.00%、4.73%、192.00%和143.00%。图2D表明:整个培养过程中,速效钾质量分数波动幅度相对较小,各处理组的土壤速效钾质量分数均高于对照。SR的土壤速效钾质量分数始终显著高于其他处理(P<0.05),培养结束时,各土壤的速效钾质量分数从大到小依次为SR、LR、TR、BR、对照。
结合表2可知:土壤NH4 +-N与TC1和C1/N1呈极显著正相关 (P<0.01),与TN1呈极显著负相关(P<0.01);土壤NO3 −-N与TN1呈极显著正相关(P<0.01),与TC1和C1/N1呈极显著负相关(P<0.01)。同时,土壤AP、AK分别与TP1、TK1存在极显著正相关(P<0.01)。说明生物质原料的施用对土壤无机氮、有效磷和速效钾的变化有直接影响。由表3可知:培养期间(0、7、30、90和180 d),土壤性状间存在一定的相关性,其中,土壤AP、AK均分别与土壤MBC、MBN和NH4 +-N存在极显著正相关(P<0.01)。
土壤指标 MBC MBN NH4 +-N NO3 −-N AP AK MBN 0.630** NH4 +-N 0.364** 0.203 NO3 −-N −0.243* −0.152 0.265* AP 0.400** 0.377** 0.577** −0.120 AK 0.737** 0.867** 0.412** −0.204 0.419** CO2日释放速率 0.504** 0.284* 0.267* −0.256* 0.680** 0.318** 说明:*表示显著相关(P<0.05),**表示极显著相关(P<0.01) Table 3. Correlations between properties of soil with biomass material additions
-
土壤添加不同生物质原料后土壤CO2日释放速率的变化趋势基本相同(图3),培养第1 天出现峰值,随培养时间增加逐渐下降。培养30 d后TR、BR和对照的土壤CO2日释放速率逐渐趋于稳定。培养的前47 d内,SR、LR的土壤CO2日释放速率较高,培养61 d后趋于稳定(图3A)。
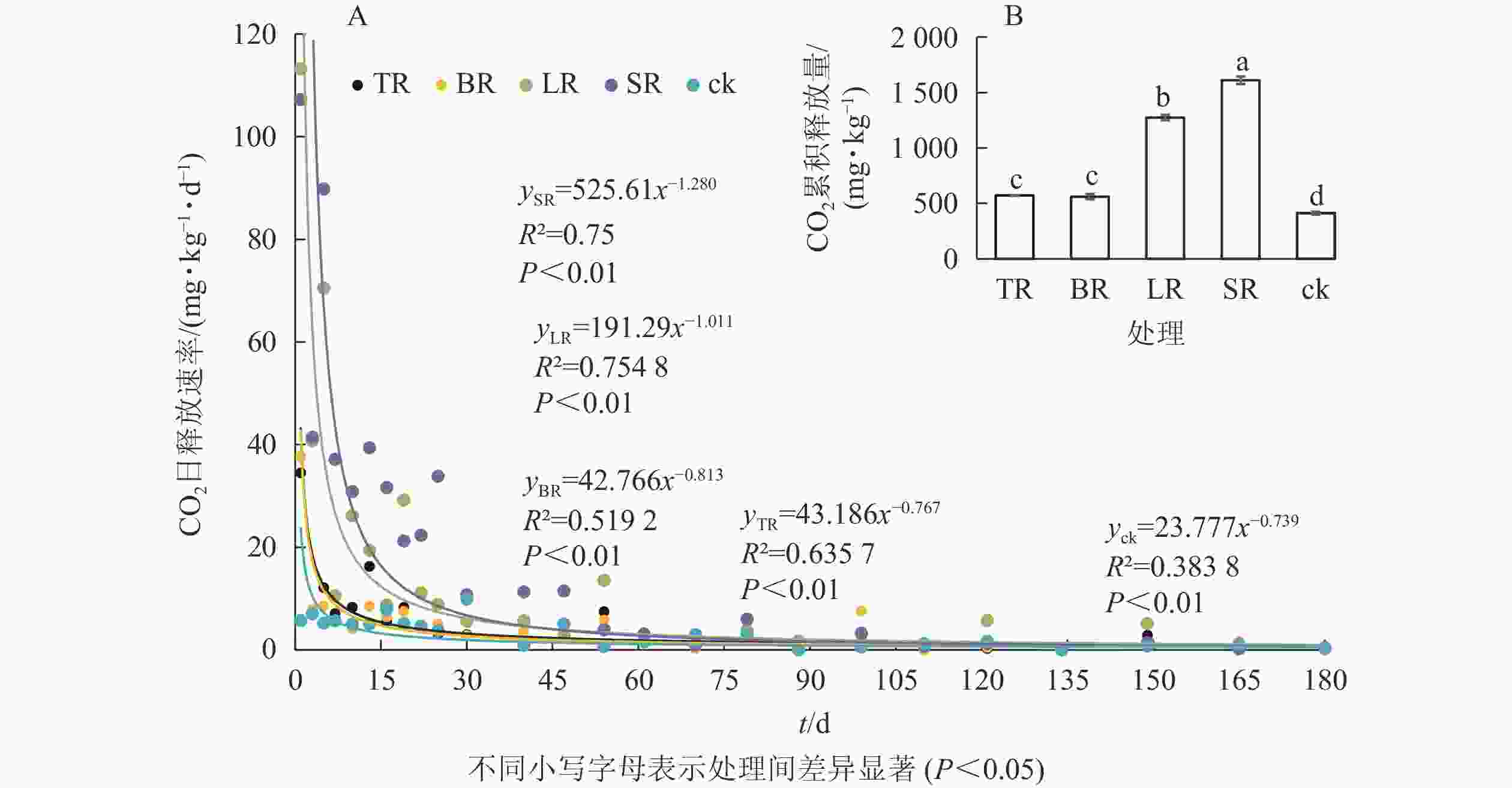
Figure 3. Effects of biomass material additions on CO2 daily emission rate (A) and cumulative emission (B) in the soil during the incubation period
从图3B看,培养结束(180 d)时,不同处理的土壤CO2累积释放量从大到小依次为SR、LR、TR、BR、对照。与对照相比,TR、BR、LR、SR的土壤CO2累积释放量分别提高了38.92%、36.43%、209.88%和291.36%。
土壤CO2日释放速率与TC1和C1/N1呈极显著正相关(P<0.01),与TN1呈极显著负相关(P<0.01,表2),与土壤MBC、AP、AK呈极显著正相关(P<0.01,表3),说明土壤呼吸与生物质原料的碳氮质量分数及微生物活动密切联系,且受土壤有效养分的调控。
2.1. 生物质原料添加对土壤微生物生物量的影响
2.2. 生物质原料添加对土壤速效养分的影响
2.3. 生物质原料添加对土壤CO2释放的影响
-
土壤微生物的数量和活性直接或间接地反映了土壤有效养分的供给能力。一方面,土壤微生物是养分循环的重要因子,生物质原料进入土壤后,土壤中的氮磷钾等元素可能以各种形态存在,其有效性受微生物矿化-固持作用的控制。研究认为:有机物料的碳氮比是影响其还田后土壤氮素矿化固持的重要因子之一[26-27],土壤微生物活动是氮素循环的重要驱动力,但有机物料适宜的碳氮比才有利于微生物的活动[28-29]。KUMAR等[30]认为碳氮比为25是氮素转化的关键值,低于25的碳氮比有利于微生物吸收利用氮素,高于25则相反。本研究发现:在培养初期,施用生物质原料的土壤无机氮质量分数均明显下降,同时土壤微生物生物量碳氮均显著增加。这是因为随着生物质的施入,土壤养分供给充足,促进了微生物活性;但由于4种添加物的碳氮比均较高,微生物为了维持生长代谢的碳氮平衡,需要吸收土壤中的无机氮,即土壤无机氮被微生物固持,土壤无机氮质量分数降低,与闫德智等[21]和李涛等[31]的结果一致。至培养中后期,随着碳源的消耗,微生物活动减缓,当土壤碳氮比下降到一定程度后,微生物矿化释放无机态氮素,土壤无机氮质量分数略有回升。另一方面,土壤微生物本身是土壤碳氮能源库,土壤微生物量碳氮的增减揭示了碳氮进入土壤后生物固持和释放的本质。张静等[32]研究表明:当玉米Zea mays秸秆还田量为9 000 kg·hm−2时,麦地的微生物生物量碳显著提高,为下一茬作物储备了丰富的碳源。本研究发现:与对照相比,杨树材料的施用明显增加了土壤微生物生物量碳氮;同时,相关性分析可知:土壤MBC、MBN与生物质原料具有显著相关关系,说明杨树采伐剩余物可以作为生物质原料来提高土壤的碳氮储备量。添加生物质后,土壤有效磷的变化趋势与无机氮相似,均为先降低后逐渐趋于稳定,推测可能与磷的生物固持有关[33-36]。对于森林土壤来说,碳磷比是影响磷矿化的关键,本研究处理初期,磷及碳磷比较高,微生物吸收固定土壤中的有效磷,培养后期,磷的矿化作用开始增强,有效磷质量分数有所上升,与SAGGER等[37]和DIETER等[38]的观点一致。
本研究中各处理土壤的速效钾质量分数与土壤微生物生物量质量分数具有对应关系,但整体变化幅度较小,原因可能是土壤自身速效钾质量分数较高,固钾能力较弱或固钾需求已经满足。黄帅等[39]的研究也证明土壤固钾率与速效钾质量分数和钾离子饱和度均呈极显著负相关。本研究为土壤空白试验,不存在植物对土壤速效钾的吸收利用,不需要消耗大量交换性钾,因此在微生物代谢周转过程中,矿化产生速效钾的质量分数也相对较少。
就提升土壤铵态氮和有效磷质量分数而言,施用杨树树皮和树枝的效果优于秸秆和对照;对于提高硝态氮质量分数,虽然3种杨树材料的施用效果较秸秆差,但树叶和树皮的施用效果优于树枝;从速效钾质量分数来看,杨树材料的施用效果均明显优于对照。因此,施用杨树采伐剩余物对土壤中氮素的转化具有积极影响,在无机氮质量分数较高的土壤中,施用碳氮比较高的树皮和树枝原料有利于微生物对土壤氮素的固定,虽然降低了氮素有效性,但一定程度上避免了氮素的流失;当土壤无机氮质量分数较低时,选择碳氮比较低的树叶原料,微生物能更快地矿化释放无机氮供植物利用。本研究还发现:施用杨树采伐剩余物也具有提高土壤有效磷和速效钾质量分数的潜力,不同杨树材料中以树枝和树叶的施用效果更好。
-
土壤有机碳的矿化受微生物活动的密切影响,研究[40]表明:土壤呼吸释放的CO2约50%~70%来自微生物对有机质的分解。秸秆还田试验[41-42]表明:土壤呼吸与土壤微生物量碳存在显著正相关关系。本研究中,不同处理土壤CO2日释放速率均表现为初期较快、中期逐渐减缓、培养后期趋于稳定的趋势,该动态规律与朱文玲[43]的研究结果一致,并与本研究中土壤微生物生物量碳氮的变化趋势相对应。
目前关于有机物料还田是否能减少CO2的排放还存在一定争议。众多研究[11,44-45]认为:生物质原料的添加提供了更多土壤呼吸和CO2释放所需的碳素,使CO2排放量增加,存在负面的环境效应。本研究也发现:添加4种生物质材料后,土壤CO2日释放速率和累积释放量均高于对照。从土壤CO2日释放速率来看,秸秆和树叶施入后,土壤矿化速率高于树枝和树皮原料。从累积释放量来看,虽然培养初期添加树叶使土壤有机碳的矿化量更大,但长期培养过程中添加秸秆对有机碳的矿化效果更明显,即4种材料的施用都会给环境带来的一定程度的负面影响,但相比秸秆,添加杨树采伐剩余物后土壤CO2排放量明显要低。也有研究[46-47]证实,有机物料的施用能减少碳排放,这可能与施用方式、施用量及生物质原料和土壤性质不同有关。
本研究以目前在农田土壤中广泛应用的秸秆原料为参照,证明了杨树采伐剩余物既能满足土壤有效养分的补充,又能相对控制CO2排放,具有作为生物质原料还林的巨大潜力。基于中国气候条件、土壤类型和植被种类,有必要对杨树采伐剩余物的施用量和施用方式进行长期田间综合试验和评价,探究其在土壤中施用的现实意义。同时,除监测CO2释放外,还有必要在施用过程中进一步测定甲烷(CH4)和氧化亚氮(N2O) 等重要温室气体,以明确杨树采伐剩余物施用的生态环境效应,真正实现林业的绿色可持续发展。











 DownLoad:
DownLoad: