-
近年来,随着中国人口老龄化进程加速及生活方式转型,心血管疾病发病率与死亡率呈持续上升趋势。世界卫生组织研究显示:心血管疾病已连续10 a位居中国居民死因首位,对公共卫生系统构成了重大挑战[1]。在众多心血管疾病的发生发展过程中,心肌纤维化(MF)作为关键病理基础通过胶原异常沉积和细胞外基质(ECM)重构,使心脏中纤维组织增加,正常心肌细胞减少,导致心脏收缩舒张功能受损[2]。目前如卡托普利、达格列净等西药治疗在一定程度上可减慢心肌纤维化的进程,但其副作用明显,且患者需要长期服用。因此,寻找中药治疗心肌纤维化成为一种疾病防治的新思路。
芦丁(rutin)又称芸香苷,属于黄酮类物质,是一种广泛分布于茶叶、槐米、陈皮等中药以及柑橘Citrus reticulata、藜麦Chenopodium quinoa、野菜等食品中的天然化合物[3−5],具有抗氧化、抗炎、治疗糖尿病、抗肿瘤和抗血管生成等作用[6−7]。最近研究发现:芦丁还具有防治器官纤维化和心血管疾病的作用。如王斌等[8]研究认为:芦丁可以通过抑制TGF-β1/Smad3信号通路改善大鼠Rattus norvegicus肾间质纤维化;储金秀等[9]研究表明:芦丁能拮抗血管紧张素Ⅱ (AngⅡ)的作用,使大鼠心脏肥大程度降低,并且能抑制蛋白激酶C (PKC)活性,从而起到防治心血管疾病的作用。芦丁在心血管疾病防治方面表现出优良的效果,但其抗心肌纤维化相关分子机制研究较少,因此有必要探究芦丁防治心肌纤维化的潜在作用机制。本研究通过网络药理学探究芦丁抗心肌纤维化的作用机制,并通过分子对接和体外细胞学对核心靶点及关键信号通路进行初步验证,为芦丁心血管类疾病的临床治疗提供新的理论依据。
-
从有机小分子生物活性数据库(Pub Chem)获取芦丁分子结构,通过Swiss Target Prediction数据库、中药系统药理学数据库(TCMSP)、中医药整合药理学研究平台(TCMIP)和中药百科全书数据库(ETCM),合并筛选人类基因后得到芦丁的候选靶点。
-
在人类基因数据库(Gene Cards)、在线人类孟德尔遗传数据库(OMIM)、药物数据库(Drug Bank)中检索“myocardial fibrosis”,将所得到的靶点信息进行整合去重后为心肌纤维化疾病靶点。将两者共同靶点作为芦丁抗心肌纤维化的靶点。
-
为筛选核心靶点,在蛋白质互作数据库(STRING)中,构建人类(homo sapiens)蛋白互作网络图。利用Cytoscape 3.10.1软件中的CytoNCA插件计算网络的拓扑学性质,绘制蛋白互作网络图和柱状图,得到芦丁-心肌纤维化的核心靶点。
-
通过R软件中的clusterProfiler包,设置P<0.001为筛选条件进行基因本体论和京都基因与基因组百科全书富集分析。
-
从有机小分子生物活性数据库获取芦丁分子结构。从蛋白质结构数据库(PDB)下载核心靶蛋白(IL-6、TNF、TP53、SRC、EGFR、IL1B、INS等)的3维结构,在AutoDockTools 1.5.6软件预处理后AutoDock Vina模拟分子对接[10],Pymol软件进行3维复合物可视化。
-
小鼠Mus musculus心肌成纤维细胞(CFs)由德国哥廷根大学许惺博教授捐赠。
-
芦丁(上海普优文生物科技有限公司,纯度98%,153-18-4),卡托普利(上海源叶生物技术有限公司,纯度98%,S30916),DMEM培养基(VivaCell公司,06-
1055 -57-1),胎牛血清(BI)、胰酶(索莱宝公司,T1320-100),全蛋白提取试剂盒(中国南京凯基生物发展有限公司,KGP2100),PAGE凝胶快速制备试剂盒、电泳缓冲液、转膜缓冲液(上海雅酶生物科技有限公司,PG113、PS105S、PS109S),聚偏二氟乙烯(PVDF)膜(Millipore公司),CCK-8试剂、质量分数为4%的多聚甲醛、DAPI染色液、10×TBST (with Tween-20,北京赛文创新生物科技有限公司,SC119-2、SL101-01、SL111-01、SW111-02),TRizol (Invitrogen公司,15596026 ),HiScriptⅢ All-in-one RT SuperMix Perfect for Qpcr (南京诺唯赞生物科技股份有限公司,R333-0)。 -
超低温冰箱(上海申力科技有限公司),恒温水浴锅(金坛市仪器制造有限公司,HH-3A),离心机(Thermo公司,
75002401 ),酶标仪(PerkinElmer公司,TY2017011463),GE化学发光检测仪(GE公司,Amersham ImageQuant 800)。 -
按照牛丕莲等[11]的方法,用含有体积分数为10% 的胎牛血清和质量分数为1%的双抗高糖DMEM,在37 ℃,体积分数为5% 的二氧化碳培养箱中培养小鼠心肌成纤维细胞。
-
小鼠心肌成纤维细胞纤维化模型建立[11]:用10 ng·mL−1转化生长因子(TGF-β1)处理48 h,建立心肌纤维化细胞模型。
取生长状态良好的小鼠心肌成纤维细胞,按1×105个·mL−1 接种到6孔板中,待贴壁后进行实验,分为对照组(ck)、TGF组、阳性对照(卡托普利,Captopril)组、芦丁(200 μg·mL−1)组,每组设置3个复孔。其中对照组加入完全培养基;TGF组加入10 ng·mL−1转化生长因子;阳性组加入10 ng·mL−1 转化生长因子+终质量浓度为10 μmol·L−1的卡托普利;芦丁组加入10 ng·mL−1 转化生长因子+终质量浓度为200 μg·mL−1的芦丁后培养48 h后进行后续实验。
-
采用CCK-8法测定细胞活性,取对数生长期的小鼠心肌成纤维细胞,按5×104个·mL−1接种在96孔板中,培养12 h,分别用0、5、25、50、100、200、300、500和800 μg·mL−1芦丁处理48 h后,每孔加入10 μL的CCK-8试剂。将CCK-8和DMEM同时添加到没有细胞的孔中(空白对照)。然后用酶标仪测量其在450 nm处的吸光度[D(450)],每组设置6个复孔。采用以下公式计算细胞活性:细胞活性=(给药处理细胞的D(450)−空白对照的D(450))/[给药质量浓度为0的D(450)−空白对照的D(450)]。确认无毒药物浓度后,相同细胞浓度铺板培养12 h,设置对照组、模型组(10 ng·mL−1 TGF-β1)、给药组(10 ng ·mL−1 TGF-β1+25、50、100、200、300 μg·mL−1芦丁)处理48 h后按相同方法测试其在450 nm处吸光度[D(450)]。
-
将对数生长期的小鼠心肌成纤维细胞按1×105个·mL−1接种于含有无菌载玻片的6孔板中,分组给药后培养48 h,用质量分数为4%的多聚甲醛固定10 min。体积分数为0.1%的Triton X-100渗透性小鼠心肌成纤维细胞阻断10 min,质量分数为5%的牛血清白蛋白(BSA)封闭60 min。然后,α-平滑肌肌动蛋白(α-SMA)和纤连蛋白(FN)抗体(体积比1∶500)孵育过夜,二抗(体积比1∶500)在黑暗中孵育1 h。4′,6-联脒-2-苯基吲哚二盐酸盐(DAPI)染色10 min,封片后在荧光显微镜下观察并拍照。
-
为评估芦丁对于心肌纤维化相关基因表达情况的影响,将对数生长期的小鼠心肌成纤维细胞按1×105个·mL−1接种于6孔板中,分组给药培养48 h后,利用TRizol试剂收集细胞,提取细胞总RNA,按照试剂盒说明书将其反转录为cDNA,RT-qPCR检测采用ChamQ通用SYBR qPCR Master Mix,反应条件按照牛丕莲等[11]的研究。记录Ct值,进一步分析RNA的表达情况。引物序列见表1。
基因 引物序列(5′→3′) 基因 引物序列(5′→3′) GAPDH F: GCAAATTCAACGGCACAGTCAAG MMP-2 F: CCATGCGGAAGCCAAGATGTG R: TCGCTCCTGGAAGATGGTGATG R: GGTTTCAGGGTCCAGGTCAGG Col1a1 F: AGGCGAACAAGGTGACAGAGG Vim F: CTGCTGGAAGGCGAGGAGAG R: GGAGAACCAGGAGAACCAGGAG R: TCAACCGTCTTAATCAGGAGTGTTC MMP-9 F: AATAAAGACGACATAGACGGCATCC Acta2 F: ATGACCCAGATTATGTTTGAGACCT R: AGTTGTGGTGGTGGCTGGAG R: TCCAGAGTCCAGCACAATACCAG Table 1. Primer sequences for RT-qPCR
-
将对数生长期的小鼠心肌成纤维细胞按1×105个·mL−1接种于6孔板中分组给药培养48 h后,用细胞全蛋白提取试剂盒提取细胞全蛋白,通过二喹啉甲酸法(BCA)定量后100 ℃水浴至变性,进行SDS-PAG电泳,然后将其转移至聚偏二氟乙烯(PVDF)膜。用含吐温的Tris缓冲盐溶液(TBST)配成质量分数为5%的脱脂牛奶,在室温封闭1 h后,一抗4 ℃ 孵育过夜后用1×TBST洗涤,对应二抗(抗兔或抗小鼠,体积比 1꞉
10000 )在室温孵育1 h,1×TBST洗膜后用增强型化学发光试剂(ECL)于化学发光成像仪中显影。用Image J对蛋白条带灰度值进行定量分析。 -
每个实验进行3次重复,得到的实验结果使用GraphPad Prism 9.0软件进行统计分析。数据结果以平均值±标准差表示。数据比较采用单因素方差分析,显著性水平为0.05。
-
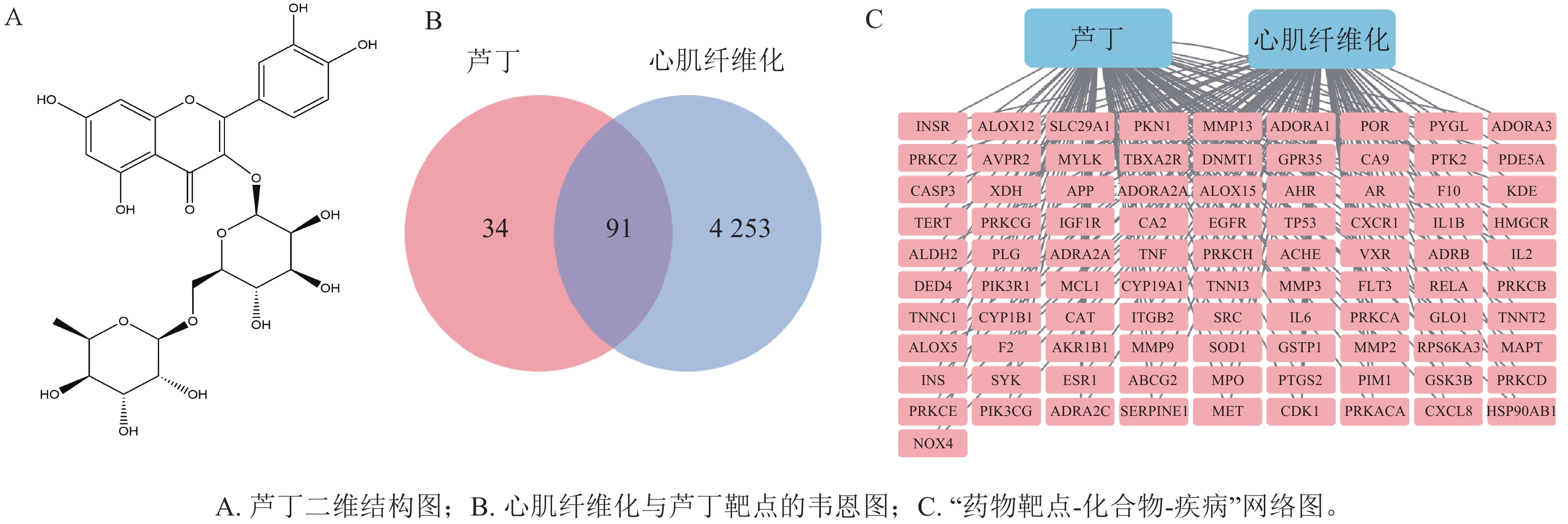
从有机小分子生物活性数据库获取芦丁的结构(图1A)。在中药系统药理学数据库、Swiss Target Prediction数据库、中医药整合药理学研究平台和中药百科全书数据库中共得到芦丁 127个作用靶点。在人类基因数据库、在线人类孟德尔遗传数据库、药物数据库中检索“myocardial fibrosis”,共得到4 344个心肌纤维化疾病靶点。图1B所示:重叠靶点共有91个,导入Cytoscape软件,构建“药物靶点-化合物-疾病”网络(图1C)。
-
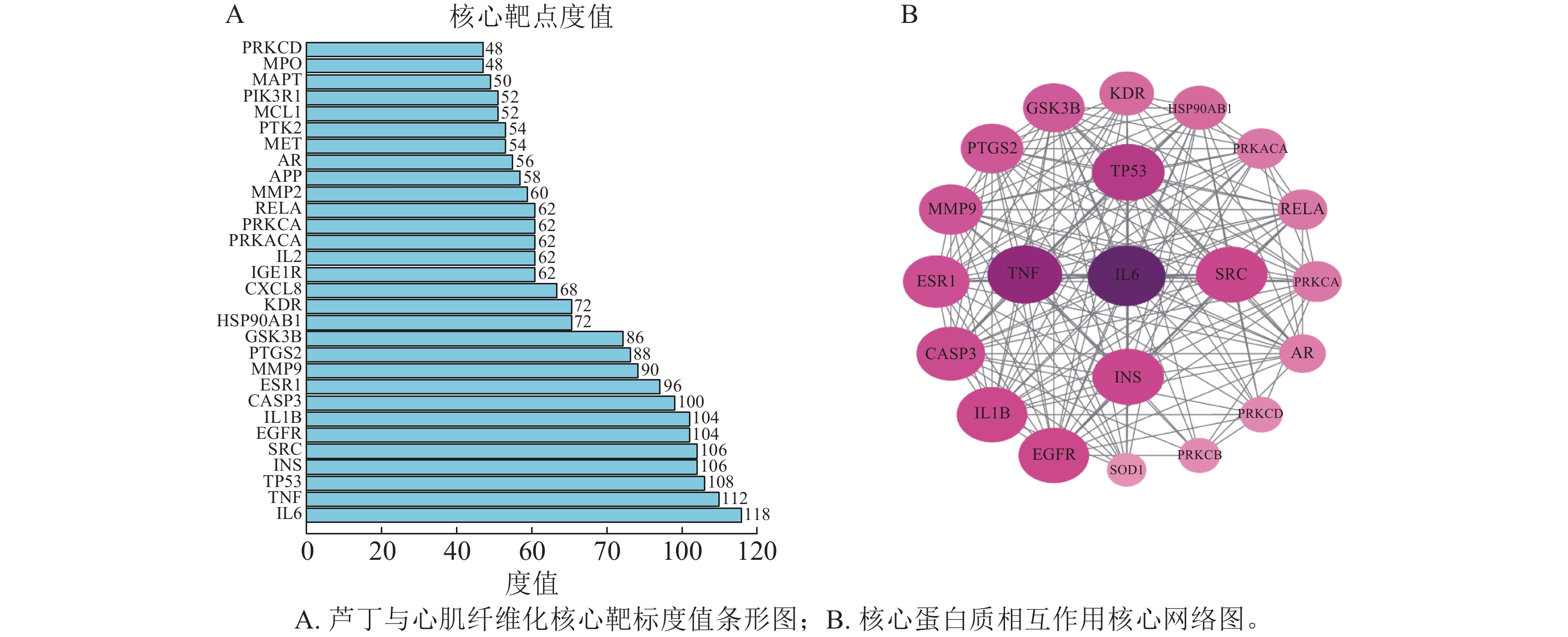
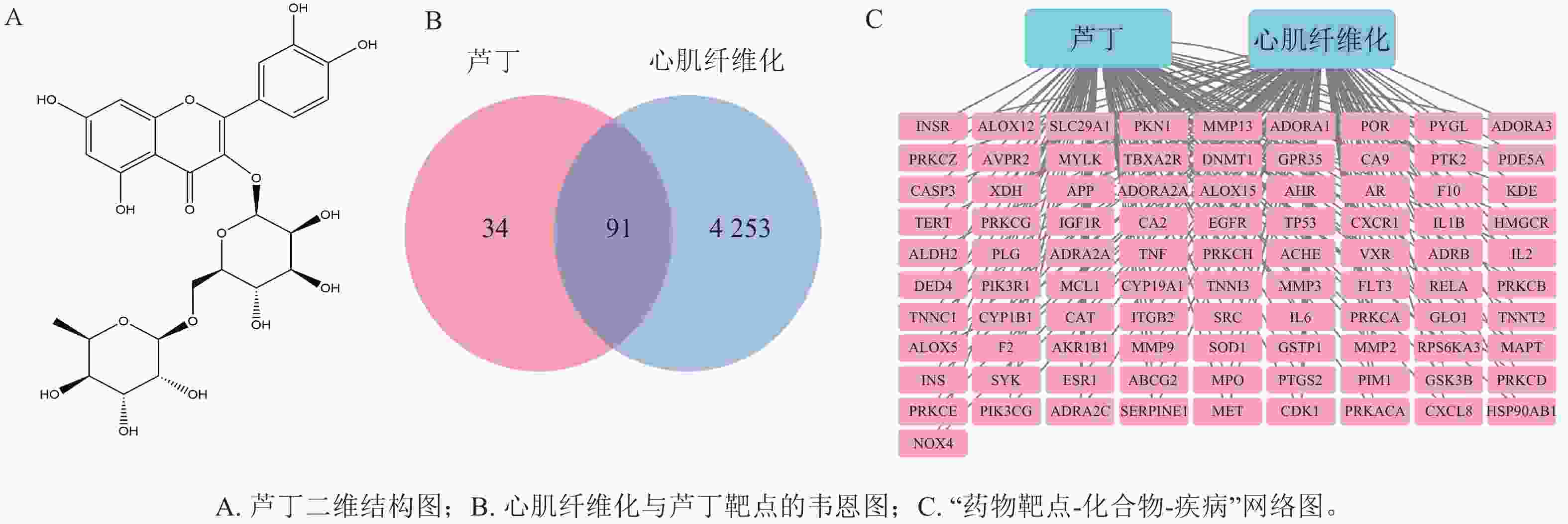
在蛋白质互作数据库中制作蛋白互作网络图(附图),共90个节点1 818条边。用CytoNCA插件,对度值(degree)、介度中心性(betweenness centrality)以及紧密度中心性(closeness centrality)进行计算,并对这些靶点进行排序,排名前10位的靶点为关键靶点(图2A)。绘制核心靶点互作网络图(图2B)。可见IL6等可能为芦丁防治心肌纤维化的主要作用靶点。
-
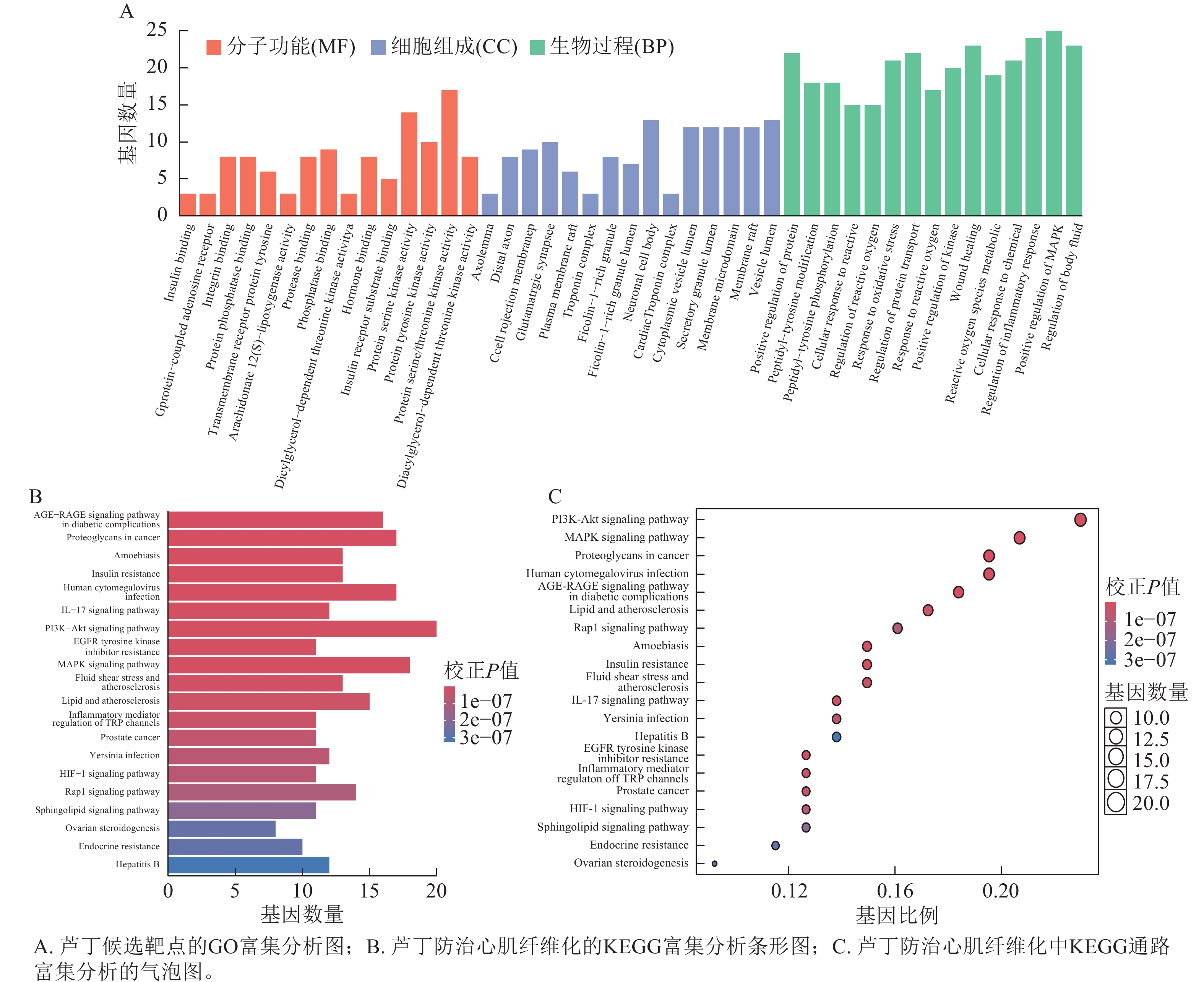
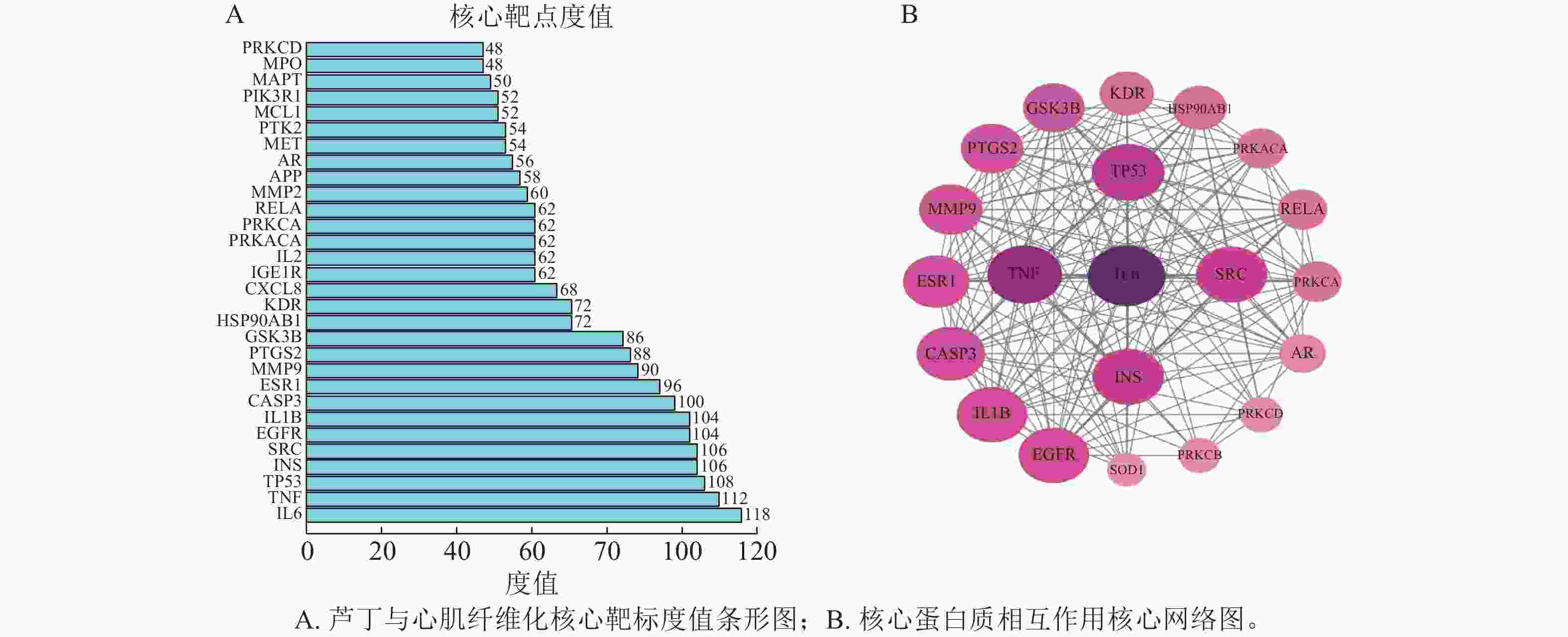
以P<0.05为筛选条件,对91个共同靶点进行GO和KEGG富集分析,以揭示关键候选靶点的作用功能与途径。其中分子功能(MF) 91条,主要涉及蛋白丝氨酸/苏氨酸激酶活性;生物过程(BP)
1178 条,主要涉及正向调节MAPK级联反应等;细胞组成(CC) 38条,主要涉及囊泡腔等1307 个条目(图3A)。KEGG细胞通路富集共得到167个条目,选取P<0.05前20条进行条形图和气泡图的绘制(图3B、C)。芦丁抗心肌纤维化主要涉及PI3K-AKT和MAPK信号通路,以及癌症、脂质和动脉粥样硬化以及神经退行性疾病等通路。其中核心靶点蛋白TNF、TP53与MAPK信号通路中的蛋白密切相关,说明芦丁可能作用于MAPK信号通路起到治疗心肌纤维化的作用。为了研究MAPK通路中芦丁对心肌纤维化的特异性影响,鉴定了参与MAPK信号通路的芦丁靶点基因,包括JNK、ERK。后续将通过体外细胞实验来证明。 -
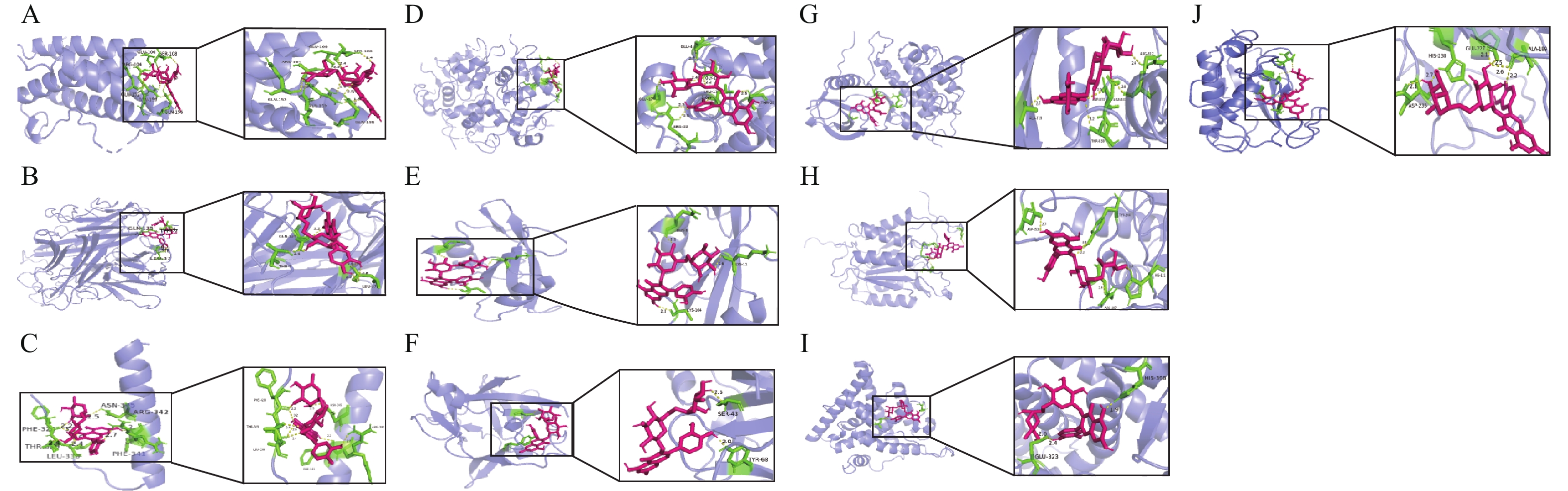
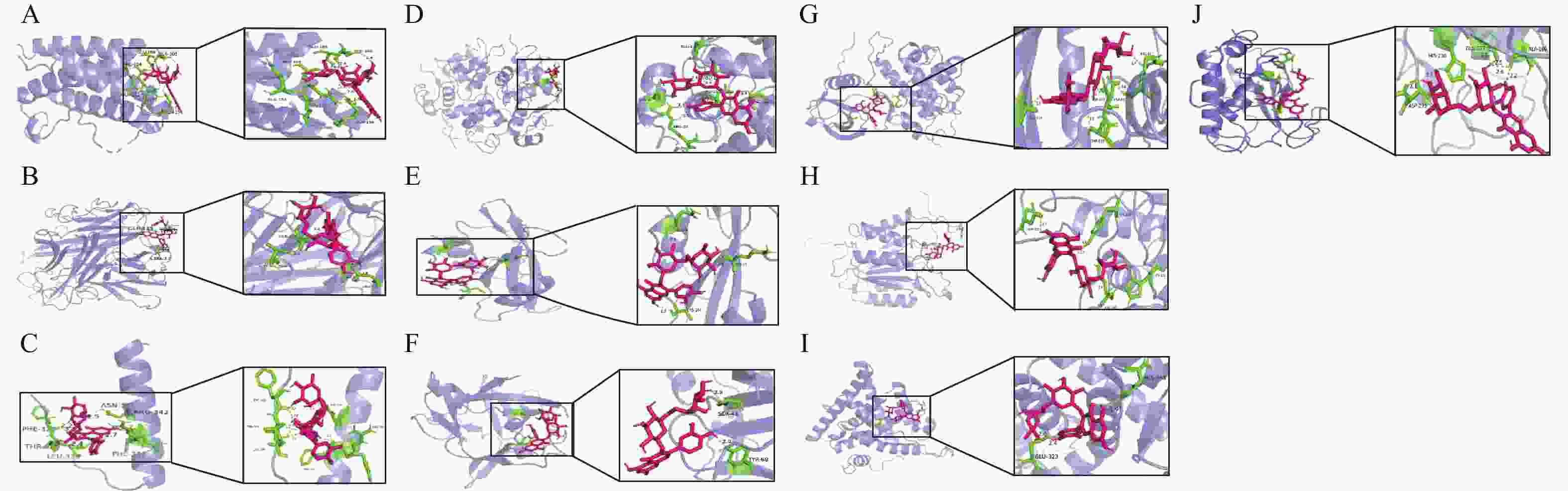
用分子对接技术模拟芦丁与核心靶蛋白的相互作用(图4)。根据分子对接理论,结合自由能越小,配体与受体结合越稳定,相互作用的可能性越大。当配体与受体结合能小于−5 kcal·mol−1时,结合稳定。芦丁与排名前10个核心靶点对接结合能均小于−5 kcal·mol−1 (表2),表明芦丁与核心靶点蛋白均结合稳定,芦丁可能会影响体内这些靶点蛋白的表达。
靶点名称 靶点PDB-ID 对接结合能/(kcal·mol−1) 靶点名称 靶点PDB-ID 对接结合能/(kcal·mol−1) IL6 1ALU −8.0 TNF 1A8M −7.5 P53 1AIE −7.7 INS 6H3M −7.5 SRC 1O43 −6.6 IL1B 6Y8M −6.6 EGFR 1M17 −9.9 CASP3 3J30 −8.3 ESR1 1XPC −7.2 MMP9 4XCT −9.4 Table 2. Energy of rutin to the core protein in the molecular docking
-
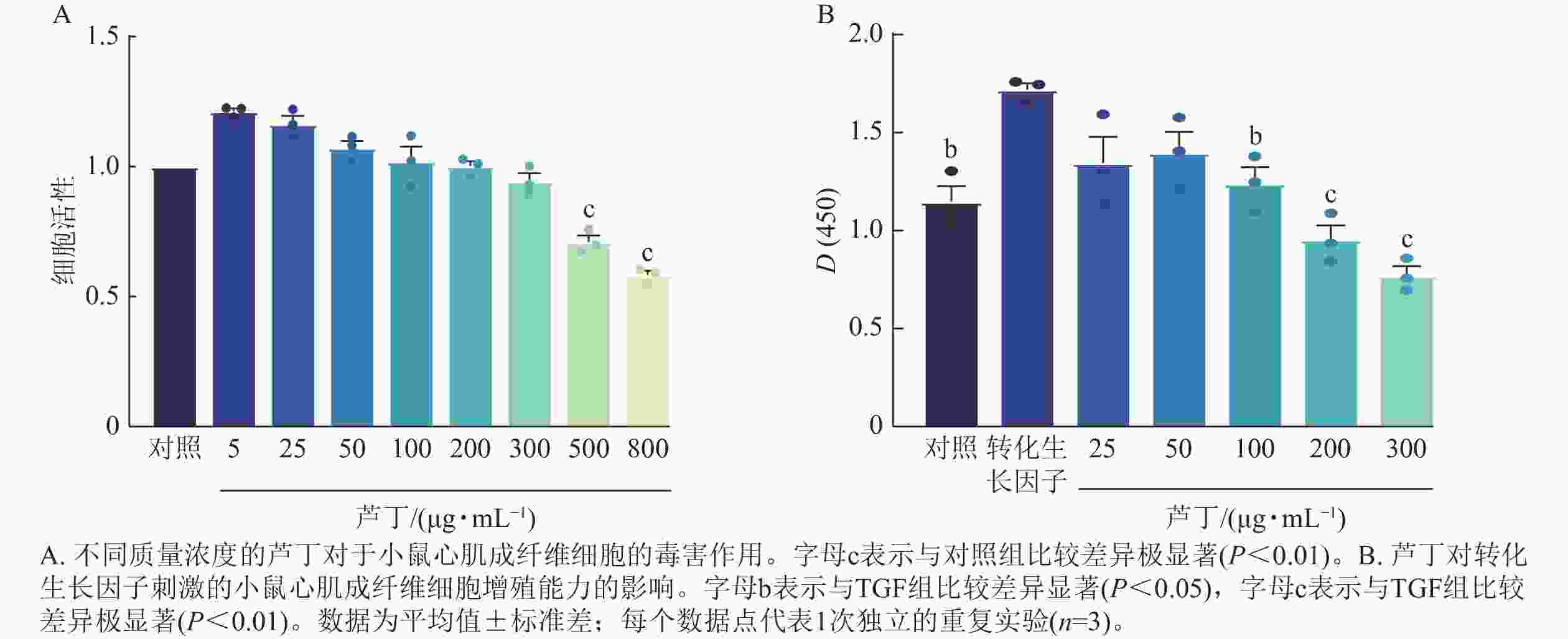
图5 A验证了不同质量浓度的芦丁对小鼠心肌成纤维细胞的细胞活性的影响。当芦丁质量浓度大于300 μg·mL−1时,对细胞产生一定程度的毒害作用。因此后续选用5~300 μg·mL−1考察无毒性剂量下芦丁对于纤维化的小鼠心肌成纤维细胞活性的影响。加入转化生长因子(10 ng·mL−1)刺激小鼠心肌成纤维细胞 48 h。如图5 B所示:与对照组比,转化生长因子刺激后小鼠心肌成纤维细胞活性显著增加(P<0.01),表明小鼠心肌成纤维细胞增殖增加,25~300 μg·mL−1芦丁处理后转化生长因子刺激的小鼠心肌成纤维细胞活性开始降低。当芦丁质量浓度为200 μg·mL−1时,10 ng·mL−1转化生长因子刺激后的小鼠心肌成纤维细胞活性显著降低(P<0.01)。因此,在后续实验中,采用的芦丁质量浓度为200 μg·mL−1。
-
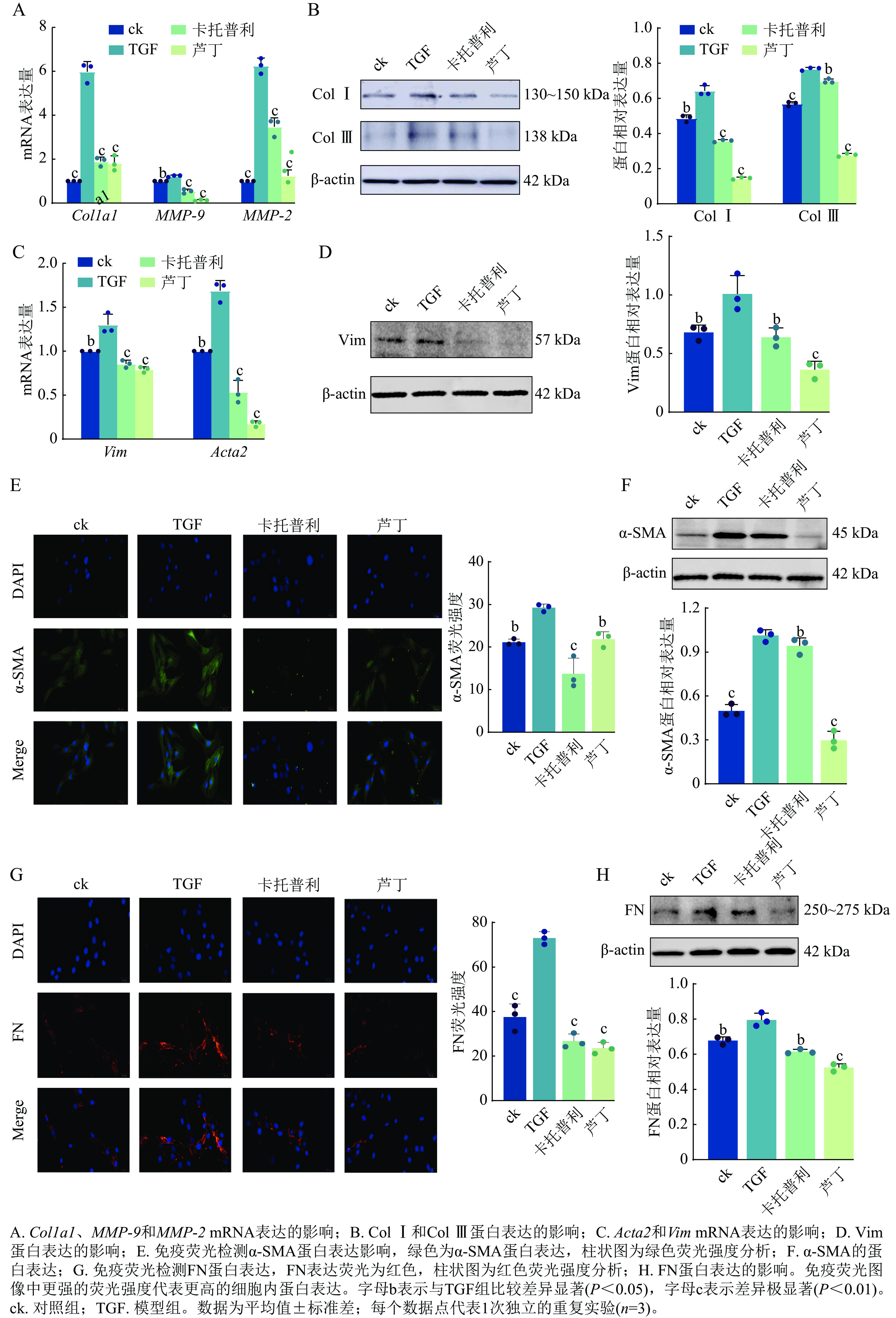
通过RT-qPCR检测发现:经过转化生长因子处理后,小鼠心肌成纤维细胞中Col1a1、MMP-9和MMP-2的mRNA表达增加,而卡托普利和芦丁处理后的小鼠心肌成纤维细胞中mRNA表达均下降(图6A)。同样,转化生长因子诱导后小鼠心肌成纤维细胞的Ⅰ型胶原(Col Ⅰ)和Ⅲ型胶原(Col Ⅲ)表达量较对照组升高,而芦丁和卡托普利处理后,表达量均下降(图6B)。此外,卡托普利和芦丁降低了由转化生长因子刺激的小鼠心肌成纤维细胞中Acta2和Vim mRNA的升高(图6C),也降低了Vim蛋白的表达(图6D)。免疫荧光与蛋白免疫印迹结果表明:经卡托普利和芦丁处理后,α-SMA的荧光强度(图6E)及蛋白表达水平(图6F)均有所降低,同时,也使FN的荧光强度(图6G)和蛋白表达量(图6H)下降。
-
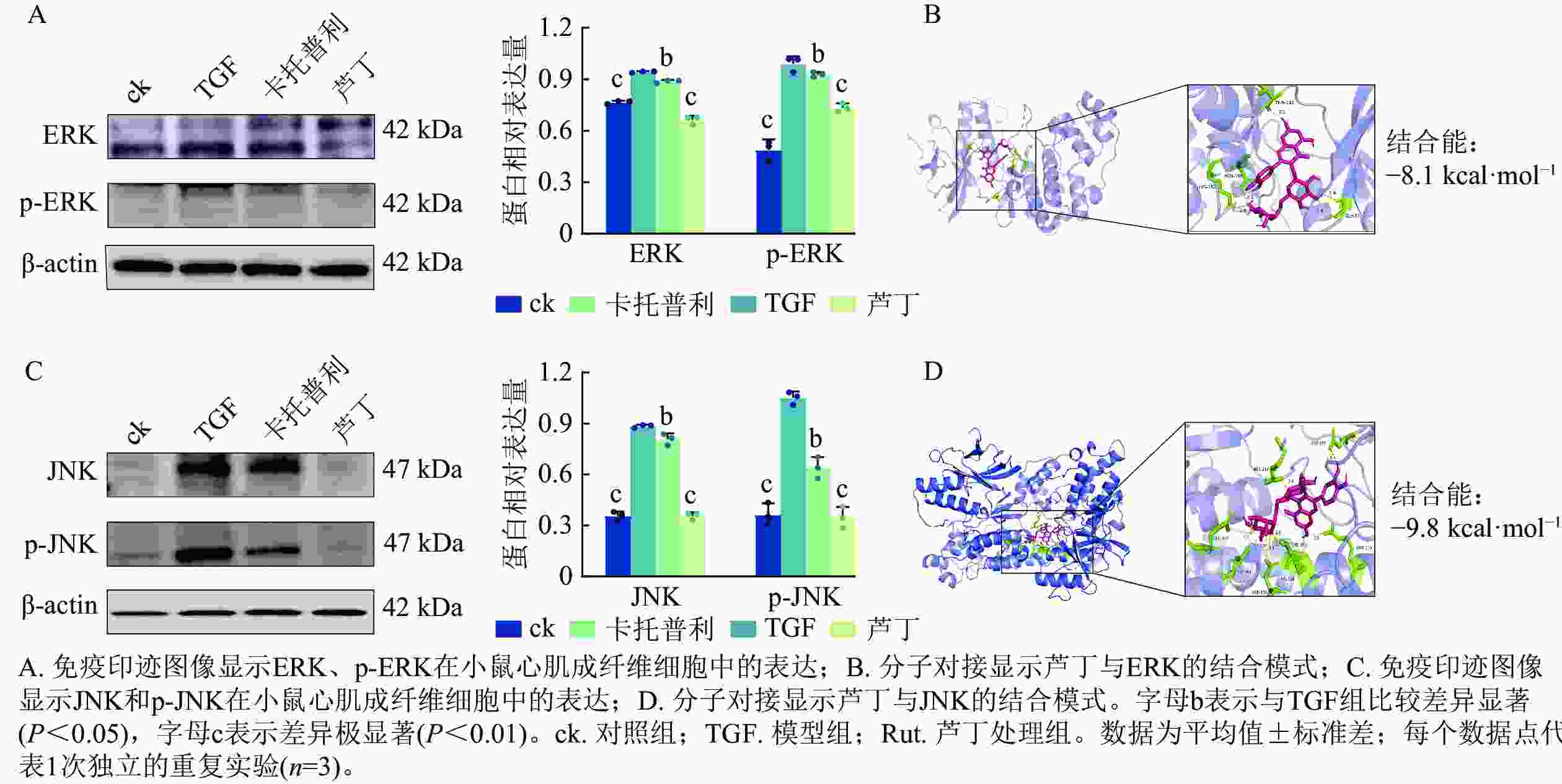
核心靶点基因及GO和KEGG富集分析提示:MAPK-ERK/JNK通路可能介导芦丁抗心肌纤维化作用。Western blot定量显示:与对照组相比,转化生长因子刺激显著上调小鼠心肌成纤维细胞中ERK和p-ERK水平,而卡托普利和芦丁处理抑制了ERK、p-ERK蛋白的表达水平(图7A)。分子对接结果显示:芦丁与ERK结合稳定(结合能:−8.1 kcal·mol−1),关键结合位点涉及THR112、ASN155、LYS152和GLY37残基(图B)。与此同时,转化生长因子诱导的小鼠心肌成纤维细胞中的JNK和p-JNK蛋白较对照组表达提高,经卡托普利和芦丁处理后能逆转这一趋势(图7C),芦丁与JNK结合能达 −9.8 kcal·mol−1(图7D)。这些数据共同表明:芦丁可能通过下调MAPK-ERK/JNK信号通路相关蛋白起到抗心肌纤维化作用。
-
心肌纤维化是多种心血管疾病的共同病理表现,通过破坏心肌细胞外机制稳态,显著损害心脏的正常功能。对心肌纤维化进行早期干预已成为心血管疾病防治的战略重点[12]。氧化应激在心肌纤维化的发生发展中起着关键作用[13]。芦丁作为一种天然的生物活性物质,近年来其抗器官纤维化的作用机制备受关注:芦丁具有极强的抗氧化活性,能够减轻氧化应激损伤[14],可以通过抑制氧化应激反应,减少心肌细胞的损伤和凋亡,从而减缓心肌纤维化的进程。此外在多种动物模型中,芦丁抗心肌纤维化作用已获得实验证据支持。建立大鼠心肌纤维化模型,给予芦丁灌胃后,大鼠的心肌纤维化程度明显减轻,胶原蛋白表达显著减少[15]。在糖尿病小鼠模型中,芦丁能够降低小鼠血清心肌酶含量,改善病变心肌细胞形态,降低纤维化程度,减轻心肌损伤[16]。尽管已有研究证实了芦丁在抗心肌纤维化中的作用,但尚未深入探讨芦丁抗心肌纤维化的具体作用机制。因此,本研究通过生物信息学手段,进一步挖掘芦丁抗心肌纤维化的分子机制,探索其核心靶点,并为后续的实验提供更有价值的指导方向。
中药活性成分的复杂性和多样性使得其作用机制和作用靶点尚不完全清楚,而网络药理学通过整合和分析大量的生物信息数据,揭示药物与靶点之间的相互作用,为药物研发提供了新的思路和方法[17]。该方法在抗器官纤维化研究中取得进展:丹参Salvia miltiorrhiza-黄芪Astragalus membranaceus配伍通过槲皮素、山奈酚等成分靶向NF-κB和VEGF通路抑制炎症及肾纤维化[18];当归Angelica sinensis-红芪Hedysarum polybotrys对经IL-17与TNF信号网络抑制心肌纤维化[19]。本研究整合网络药理学与分子对接技术系统解析芦丁抗心肌纤维化的多靶点调控机制。分析筛选出91个潜在作用靶点,其中IL-6是核心枢纽靶点。研究表明:IL-6通过激活转化生长因子-MMP2/MMP9轴促进肌成纤维细胞转分化[20],其在高盐诱导的高血压大鼠模型中表达显著增加,与心肌间质纤维化程度呈正相关[21]。而分子对接结果显示:芦丁与IL6、TNF等核心靶点结合能均 <−5 kcal·mol−1,符合稳定结合标准。
研究结果证实:芦丁在体外能有效逆转转化生长因子诱导的小鼠心肌成纤维细胞活化,其抗心肌纤维化主要通过干预细胞外基质的代谢和抑制MAPK信号通路来实现。在器官纤维化的过程中MMP-9蛋白和MMP-2蛋白过度活化会促进细胞外基质异常重塑[22];胶原(Col Ⅰ/Ⅲ)和FN的过度沉积可形成纤维化疤痕,限制心肌细胞的正常功能[23],α-SMA作为肌成纤维细胞标志物,其表达增加,会产生胶原和其他细胞外基质成分,导致器官组织的纤维化[24]。本研究观察到芦丁能同步下调包括Col Ⅰ/Ⅲ、FN在内的细胞外基质主要成分的合成和沉积,并同时抑制MMP-9、MMP-2的过度活化。这提示芦丁可以多靶点调控协同阻断心肌纤维化疤痕的形成,抑制心肌纤维化。更重要的是,本研究深入揭示了其抗心肌纤维化核心分子机制。分子对接结果表明:芦丁能够与MAPK信号通路中关键激酶ERK和JNK稳定结合。进一步Western blot验证发现:转化生长因子刺激使ERK、JNK、p-ERK和p-JNK的蛋白表达增高可被芦丁显著抑制。现有研究已经证实:MAPK信号通路可以通过调控炎症反应、胶原代谢及细胞凋亡等生物学过程参与器官纤维化[25],其中ERK磷酸化介导的细胞因子调控及JNK/P53介导的氧化应激-铁死亡级联已被证实是心肌纤维化进展的关键机制[26−28]。多种植物提取物,如龙胆草素[29]、氧化苦参碱[30]、肉桂提取物[31]等可通过该通路发挥心脏保护效应。本研究在此基础上进一步阐明,芦丁能够通过直接结合并抑制ERK/JNK的磷酸化活化,从而干预下游纤维化信号的转导抑制心肌纤维化,进一步验证了该通路作为心肌纤维化治疗靶点的重要性。
-
本研究阐明芦丁通过抑制MAPK-ERK/JNK信号通路,显著下调小鼠心肌成纤维细胞中MMP-2/9、α-SMA及Col Ⅰ/Ⅲ等纤维化标志物的表达,有效阻断心肌纤维化进程中异常细胞外基质重塑和肌成纤维细胞活化。该发现不仅系统揭示了黄酮类化合物多靶点抗纤维化的分子机制,更为重要的是,基于网络药理学-分子对接-体外实验研究,为开发靶向心肌基质稳态调节的新型抗纤维化药物提供了候选分子及作用靶标。但本研究结果仍存在一定局限性,主要为缺乏功能缺失实验的证据。为确立靶点与表型间的直接因果关系,后续研究将在细胞层面利用针对核心靶点的特异性siRNA进行敲低验证,并进一步构建基因敲除动物模型,以期在整体动物水平上确认药效并加速其临床转化进程。
Mechanism of rutin in inhibiting myocardial fibrosis
doi: 10.11833/j.issn.2095-0756.20250331
- Received Date: 2025-06-09
- Accepted Date: 2025-11-18
- Rev Recd Date: 2025-11-01
-
Key words:
- network pharmacology /
- myocardial fibrosis /
- rutin /
- MAPK signaling pathway /
- molecular docking
Abstract:
| Citation: | JING Ruixin, WANG Ruofen, NIU Pilian, et al. Mechanism of rutin in inhibiting myocardial fibrosis[J]. Journal of Zhejiang A&F University, 2025, 43(X): 1−11 doi: 10.11833/j.issn.2095-0756.20250331 |










 DownLoad:
DownLoad: