-
梅Prunus mume隶属于蔷薇科Rosaceae李属Prunus,原产中国南方,距今已有 3 000 多年的栽培历史[1]。目前,食用花卉的风潮日益兴起,花茶越来越受到欢迎,百合Lilium、菊花Chrysanthemum×morifolium、桂花Osmanthus fragrans等食用花卉已被应用于较多产业[2] ,梅花茶等相关制品具有巨大的开发前景和市场。梅花营养丰富,主要包括黄酮类、苯丙烷类、有机酸类、挥发性物质等化学成分,其中绿原酸、异槲皮苷、金丝桃苷质量分数较高[3]。以异槲皮苷、金丝桃苷为代表的黄酮类化合物具有抗炎、抗抑郁等药理作用,以绿原酸为代表的苯丙烷类化合物具有抗氧化、抑制黑色素形成等作用[4−5]。采摘后的梅花鲜花容易发生虫蛀、霉变,干燥加工能有效避免鲜花变质[6]。在干燥过程中,花茶的色、香、味和活性成分易受影响,干燥方式是梅花花茶品质最关键的影响因素。目前国内对梅花干燥制茶方面的研究相对缺乏,不同干燥方法对梅花花茶各方面品质的影响的研究报道甚少。
自然干燥、热风干燥、微波干燥等传统干燥方式[7]操作简单、成本低、耗时短,但存在品质差等缺陷。真空冷冻干燥是将物料降温冻结,在真空条件下使物料中的水分由冰直接升华为水蒸气被排除的技术[8]。它可使干制品最大限度地保持原有的色、香、味品质及营养成分,但设备投资大、能耗高、干燥时间长[9]。吴一超等[10]采用5种干燥方式对丹参Salvia miltiorrhiza茎叶干燥,得出真空冷冻干燥有利于保存丹参茎叶的酚酸及抗氧化活性成分,但成本高,仅适用于生产高品质的产品,40 ℃烘干法简便、高效、成本低,适合丹参茎叶的规模化加工。复合干燥是将多种干燥方式结合起来,优化干燥工艺,实现优势互补[11]。商涛等[12]采用微波热风联合干燥与热风干燥、微波干燥对比,结果表明:干燥时间、总色差值最小,黄芩苷质量分数和综合质量评分最高。WANG 等[13]采用不同温度热风干燥和微波结合热风干燥处理菊花,结果表明微波 30 s 与热风 75 ℃联合干燥后的菊花含有较高活性成分,整体构象变化小。由上述研究结果可知:真空冷冻干燥与复合干燥相较于其他干燥方式具有明显优势,但这2种方法的优劣以及对梅花进行干燥处理的效果未见报道。
本研究采用热风干燥法、微波干燥法、复合干燥法、真空冷冻干燥法对不同品种的梅花鲜花进行处理,测定了不同干燥处理后梅花的收缩率、花色表型等外在特征,以及花色成分、挥发性成分、抗氧化能力、绿原酸等指标。进一步使用熵权与变异系数组合赋权法计算耦合权重系数进行综合评分,并利用加权逼近理想解排序法(weighted approximation ideal solution ranking method,TOPSIS)验证评价模型[14],获得最优的干燥方式,为梅花花茶的制作提供理论依据。
-
在浙江农林大学梅花种质资源库选择‘东方朱砂’‘Dongfang Zhusha’、‘骨红朱砂’‘Guhong Zhusha’、‘晓红宫粉’‘Xiaohong Gongfen’、‘粉皮宫粉’‘Fenpi Gongfen’、‘粉台玉蝶’‘Fentai Yudie’、‘月光玉蝶’‘Yueguang Yudie’、‘久观绿萼’‘Jiuguang Lve’、‘素玉绿萼’‘Suyu Lve’等8个品种盛开期花朵作为试验材料。所有梅花花朵性状正常,花色鲜艳均匀,采摘时环境温度为0~15 ℃。
-
梅花干燥处理采用包括热风干燥法、微波干燥法、复合干燥法及真空冷冻干燥法。热风干燥法:将新鲜的花朵置于60 ℃热风烘箱中,烘干3 h。微波干燥法:将样品置于微波炉中,设置功率为300 W,干燥20 min。复合干燥法:首先将样品置于功率为300 W的微波炉中,干燥10 min,然后取出样品置于60 ℃热风烘箱中,时间1 h。真空冷冻干燥法:将真空冷冻干燥机设置温度为−66 ℃、气压为4 Pa,取鲜样置于其中干燥22 h。对照组(ck)为鲜样梅花样品。
-
使用英国皇家园艺协会比色卡(RHSCC)进行比对测定。用色差仪(COLOR READER CR-10 PLUS)测定梅花花瓣的色差参数,包括亮度(L*)、红度(a*)、黄度(b*)、彩度(C*)值和色调角(h)。根据滕彩玲等[15]的方法计算色差值,公式如下:$ \Delta E = \sqrt {{{\left( {L - {L_0}} \right)}^2} + {{\left( {a - {a_0}} \right)}^2} + {{\left( {b - {b_0}} \right)}^2}} $。其中:∆E表示总色差,L、a、b分别表示样品的亮度值、红绿值、黄蓝值,L0、a0、b0分别表示对照样品的亮度值、红绿值、黄蓝值。
-
根据刘盼盼等[16]的方法计算失水率。用游标卡尺测量梅花干燥前后最大直径,取平均值,6次生物学重复。收缩率计算公式为S=(dg−dt)/dg。其中:S为收缩率;dg和 dt分别为新鲜样品和干制样品的最大直径(cm)。
-
1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力根据TURKOGLU等[17]的方法测定。2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基清除能力根据THANA等[18]的方法测定并做调整。根据不同浓度与相应的清除率分别计算半数抑制质量浓度(IC50),比较抗氧化能力强弱。
-
每次取3 朵梅花花朵放入22 mL的采样瓶,密封瓶盖平衡10 min。将固相微萃取SPME纤维头插入采样瓶中,置于花朵上方2 cm,吸附30 min,重复3 次。色谱条件与质谱条件根据ZHANG等[19]和HAO等[20]的方法并做调整。
-
称取0.3 g花瓣并研磨成粉末,加入提取液(三氟乙酸∶甲醇∶甲酸∶水=1∶70∶2∶27,体积比)中,置于 4 ℃ 冰箱内提取24 h,使用超声波设备超声处理20 min,使用转速为4 000 r·min−1的离心机离心10 min,将上清液用0.22 μm 孔径的尼龙微孔滤器过滤后,用于花青素苷与类黄酮的定性及定量分析。采用UPLC-Triple-TOF/MS液质联用仪进行测定,色谱柱为waters HISS-SB C18 (100.0 mm×2.1 mm,1.7 μm),进样量为2 μL,柱温为25 ℃,流速为 0.4 mL·min−1。流动相组成为A:体积分数为0.1%甲酸水,B:体积分数为0.1%甲酸乙腈。洗脱梯度为0~11.0 min,0~95%B;11.0~12.0 min,95%B;12.0~12.1 min,95%~5%B;12.1~15.0 min,5%B。在 520、350 nm波长下获得色谱图。
-
可溶性蛋白质量分数采用考马斯亮蓝G-250法测定[21];新绿原酸、绿原酸、芦丁、异槲皮苷与金丝桃苷质量分数根据1.7成分分析方法测定。
-
使用熵权与变异系数组合赋权法计算耦合权重系数,进行综合评分,比主观权重更加可靠客观[22],可避免单一客观权重分配不合理的问题。选择失水率、收缩率、色差值、DPPH和ABTS自由基清除能力、总黄酮质量分数等作为评价指标,根据LIU等[23]的方法计算熵权法权重(wj1)。根据李叶贝等[24]的方法计算评价指标的变异系数法权重(wj2)。根据拉格朗日乘子法,得到优化后的耦合权重(wj)。为了避免评价的主观性[25],以原始数据和耦合权重的乘积作为评价数据,计算得到不同干燥方法与最优方案和最劣方案的距离C+和C−,以及待评价方案与正理想解的相对接近程度C,根据C的大小评价不同干燥方式的优劣。
-
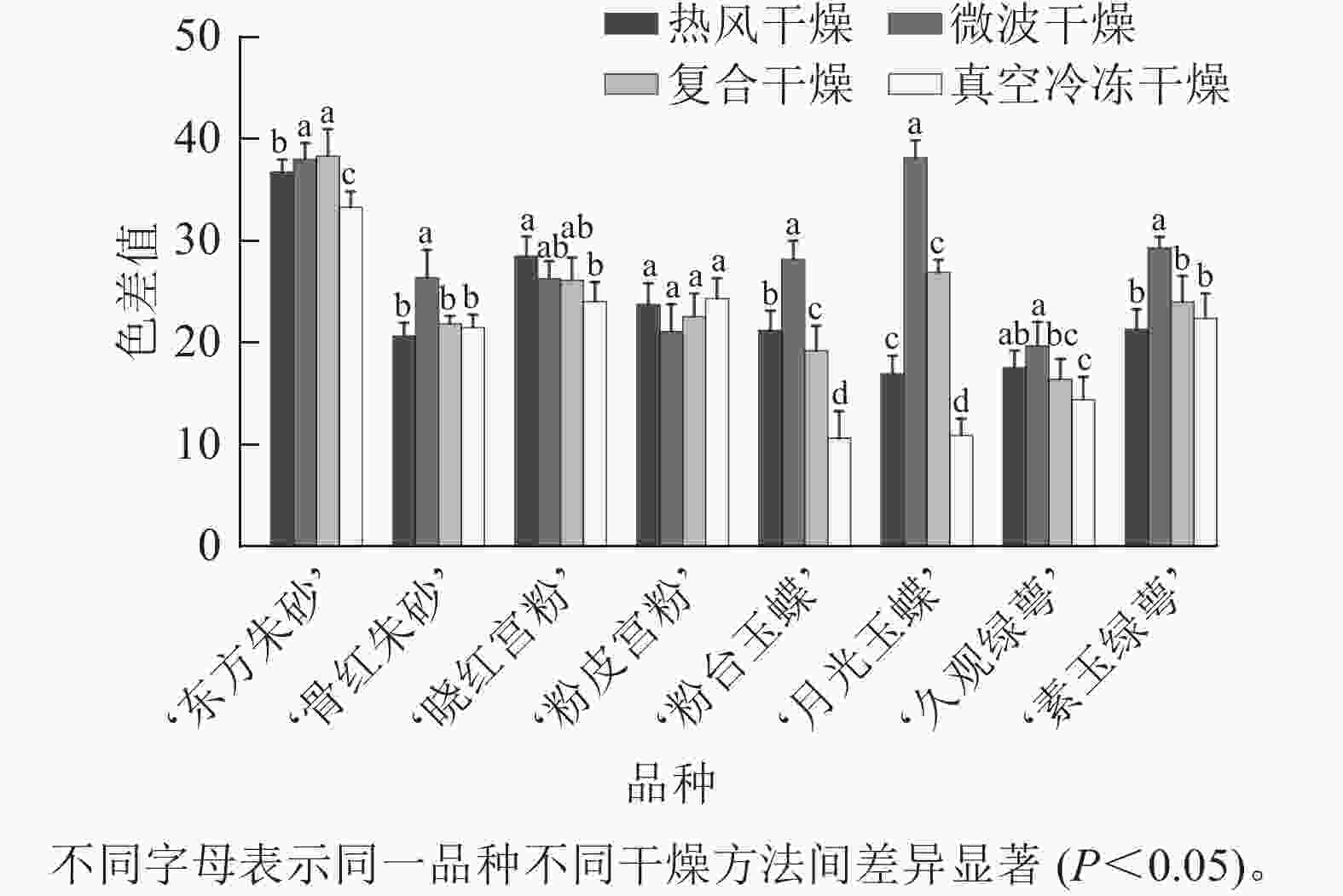
不同品种的梅花经不同方法干燥处理后,其外观特征如图1所示。比色卡测定结果(表1)表明:8个不同品种的梅花花色范围为 61B~155C,分为白色、粉红色、紫红色等3个色系。经干燥处理后,白色系品种梅花,转变为黄绿色系,花色范围为2D~N199D;粉红色和紫红色系品种梅花转变为紫红色系,花色范围为64A~84C。白色系‘粉台玉蝶’‘月光玉蝶’‘久观绿萼’‘素玉绿萼’,紫红色系‘骨红朱砂’的色差值测定结果(图2)表明:微波干燥后花色色差值最大,最大值为真空冷冻后的 3.49 倍;粉红色系‘晓红宫粉’‘粉皮宫粉’在热风干燥后花色色差值最大,色泽变化最大。对比其他3种干燥方法,真空冷冻干燥在‘东方朱砂’‘晓红宫粉’‘粉台玉蝶’‘月光玉蝶’‘久观绿萼’品种上保持色泽和形态上表现最佳,色差值显著低于其他3种干燥方法。
表 1 不同干燥方法处理后梅花花色变化
Table 1. Changes of flower color after different drying methods
品种 花色 对照 热风
干燥微波
干燥复合
干燥真空冷
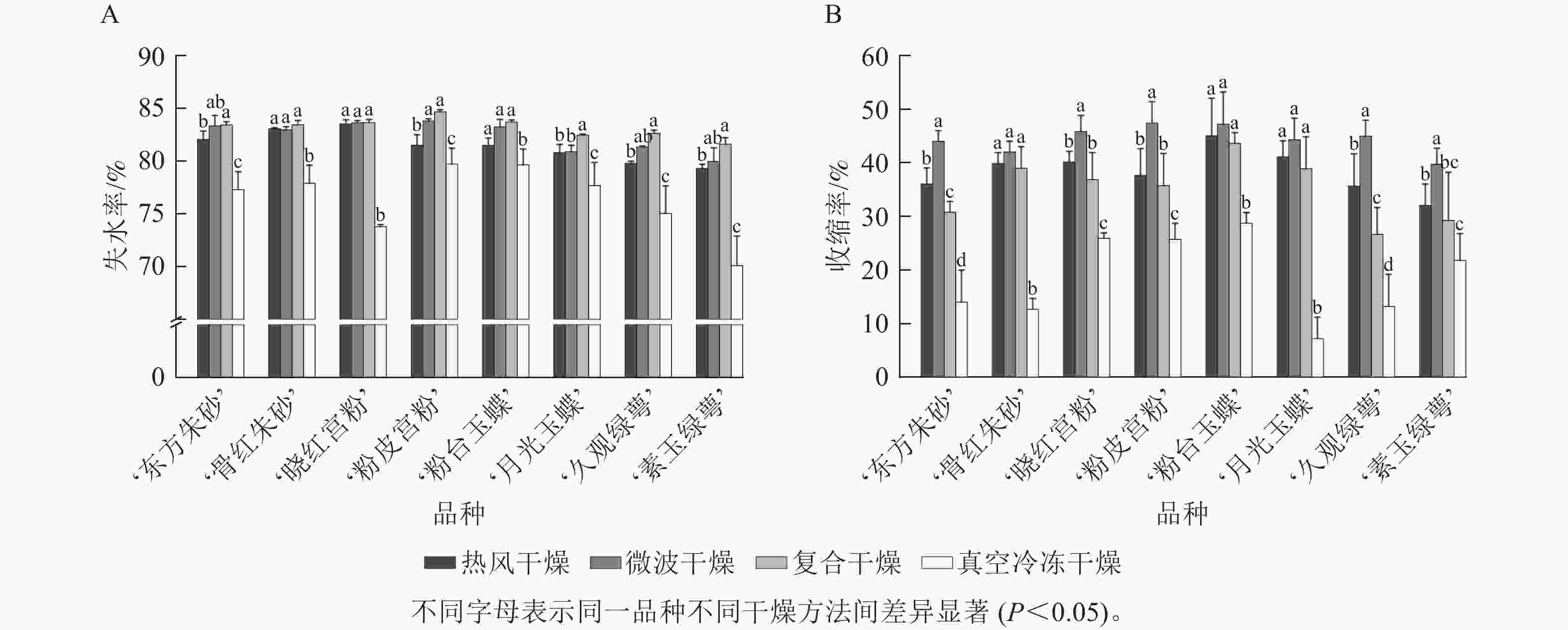
冻干燥‘东方朱砂’ 61B N79B N79A 79N N79B ‘骨红朱砂’ N66C 64A N79D 70B 64 ‘晓红宫粉’ 65A N75A 84C N80D N75B ‘粉皮宫粉’ 65C N74C 84C 77D 75A ‘粉台玉蝶’ NN155B 155A N199D 150D 155A ‘月光玉蝶’ NN155C N155C 157B N155D NN155B ‘久观绿萼’ 155C 4D 2D 155C 155A ‘素玉绿萼’ NN155B 155A 8D 4D 155A 由图3A可知:真空冷冻干燥后梅花的失水率为70.1%~79.7%,表明失水率较低且干燥效率低,其余3种干燥方法失水率均在79.3%以上,其中复合干燥后梅花的失水率显著高于其他3种干燥方法(P<0.05),最大失水率为84.7%。图3B 结果表明:真空冷冻干燥后梅花的收缩率显著小于其他3种干燥方式(P<0.05),为7.2%~28.7%,微波干燥后梅花的收缩率最大,为39.7%~47.4%。低温干燥特性能够更好地保持梅花的原有形态。
-
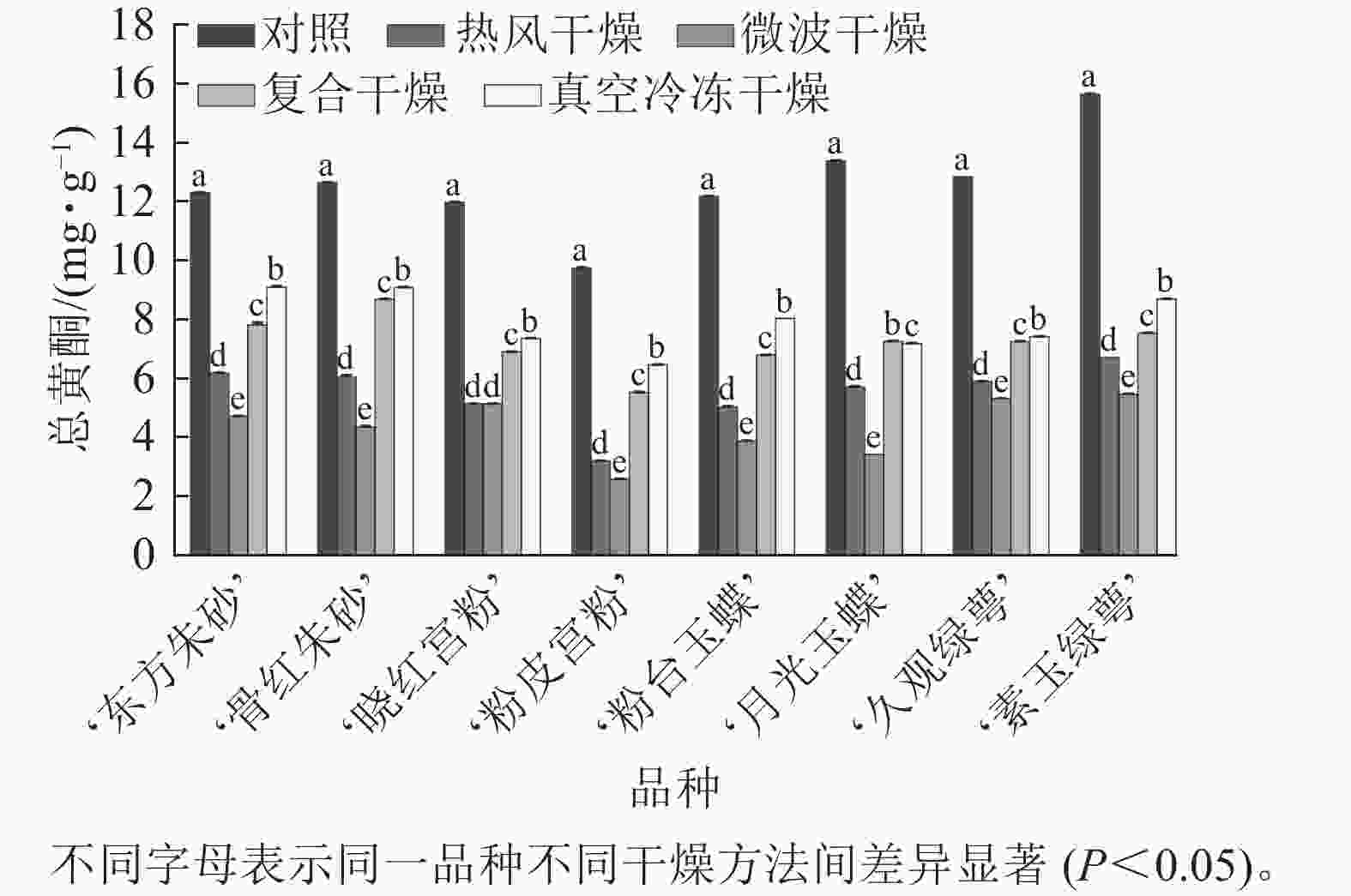
不同干燥方法处理后,梅花总黄酮质量分数出现了不同程度的损失(图4)。相较于其他干燥方法,真空冷冻干燥对黄酮的保留效果最好,其总黄酮质量分数为 6.46~9.10 mg·g−1,显著高于热风干燥与微波干燥(P<0.05),微波干燥后梅花总黄酮损失量达到74.5%。复合干燥的保留效果也较好。说明真空冷冻干燥对于保留梅花中的黄酮成分效果较好,并且相对于微波干燥,保留了更多的黄酮化合物,可能是高温对黄酮类化合物造成影响。
-
仅在‘东方朱砂’‘骨红朱砂’‘晓红宫粉’和‘粉皮宫粉’中共检测出了6种花青苷,包括矢车菊素-3-O-葡萄糖苷(Cy3G)、矢车菊素-3-O-芸香糖苷(Cy3Ru)、芍药花素-3-O-葡萄糖苷(Pn3G)、芍药花素-3-O-芸香糖苷(Pn3Ru)、飞燕草素-3-O-芸香糖鼠李糖苷(Dp3Ruh)、矮牵牛素-3-O-芸香糖-5-O-鼠李糖苷(Pt3Ru5h)。4个白色系品种中未检测到花青苷。由图5可知:梅花鲜样颜色越深花青苷总质量分数越高。梅花在不同干燥方法处理后花青苷总质量分数有显著差异(P<0.05)。‘东方朱砂’真空冷冻干燥后的花青苷质量分数最高,达到2.63 mg·g−1,这可能是由于低温干燥技术有效减少了花青苷的热降解。与之相比,热风干燥和微波干燥的花青苷损失较大。花青苷质量分数与总黄酮质量分数变化趋势一致,温度越高、干燥时间越长对类黄酮和花青苷质量分数的影响越明显。推测温度和干燥时间可能对梅花中类黄酮和花青苷质量分数变化具有较大的影响。
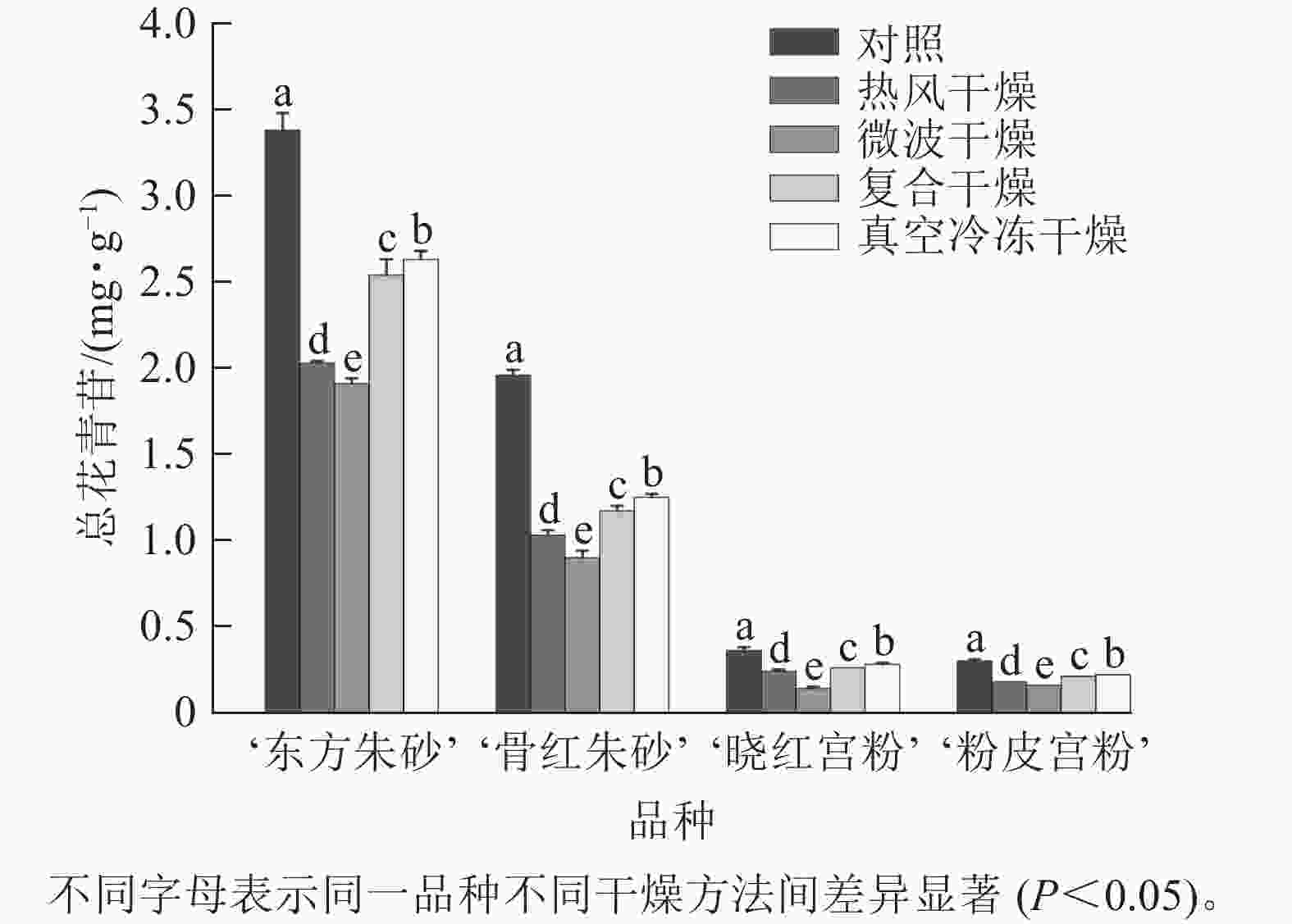
图 5 不同干燥方法处理前后梅花的总花青苷质量分数
Figure 5. Total anthocyanin content of P. mume flowers before and after different drying metheds
表2表明:‘东方朱砂’检测到 6 种花青苷,其余3个品种中,检测出除Pt3Ru5h外的 5种花青苷。紫红色系‘东方朱砂’所含的6种花青苷中,Cy3G、Cy3Ru、Pn3G占总花青苷比例较大,是主要的花青苷组成成分,其中,Cy3Ru质量分数最高,且在复合干燥后的梅花中质量分数显著高于其他干燥方法(P<0.05)。Cy3G和Pn3G质量分数分别在‘晓红宫粉’‘骨红朱砂’‘粉皮宫粉’中最高,均在真空冷冻干燥保留率最高。Pt3Ru5h只在‘东方朱砂’中被检测出,且在真空冷冻干燥后梅花中保留率最高。
表 2 不同干燥方法处理前后梅花花青苷组成及质量分数
Table 2. Composition and content of anthocyanin in P. mume flowers before and after different drying methods
品种 干燥方法 花青苷/(μg·g−1 ) Cy3G Cy3Ru Pn3G Pn3Ru Pn3Ru Pt3Ru5h ‘东方朱砂’ 对照 841.71±34.39 a 1 027.57±23.45 a 961.74±18.22 a 227.72±29.11 a 130.19±1.09 a 192.58±1.46 a 热风干燥 400.75±5.87 d 723.73±15.10 c 509.53±5.24 d 158.79±5.02 b 113.67±12.52 ab 127.39±5.79 c 微波干燥 464.20±15.80 c 617.52±7.30 d 508.77±15.26 d 100.32±10.42 c 92.19±20.83 b 126.93±6.97 c 复合干燥 571.18±14.74 b 840.66±16.28 b 692.89±44.69 c 145.47±5.46 b 126.78±0.93 a 160.19±17.22 b 真空冷冻干燥 575.79±5.60 b 827.60±9.85 b 775.04±13.32 b 157.75±21.72 b 117.91±15.1 a 174.76±1.24 b ‘骨红朱砂’ 对照 564.92±13.66 a 496.45±3.02 a 774.52±19.56 a 63.51±1.61 a 63.32±0.70 a - 热风干燥 424.35±15.82 c 357.86±29.59 c 493.59±15.76 c 47.37±2.21 c 51.91±1.49 c - 微波干燥 352.38±26.86 d 275.21±37.52 d 462.78±19.02 d 46.43±0.20 c 50.58±2.90 c - 复合干燥 452.85±6.76 b 428.39±12.83 b 555.72±14.56 b 51.09±2.53 b 56.97±2.22 b - 真空冷冻干燥 478.79±12.68 b 401.86±5.03 b 585.24±19.34 b 52.87±0.62 b 59.45±2.44 b - ‘晓红宫粉’ 对照 94.87±12.12 a 56.21±8.51 a 89.89±13.31 a 57.87±1.65 a 60.02±1.89 a - 热风干燥 57.85±2.58 c 35.28±2.90 b 68.27±1.29 b 33.03±1.68 c 42.12±0.85 d - 微波干燥 29.93±1.58 d 21.17±0.30 c 42.66±4.48 c 22.80±1.63 d 27.43±2.01 e - 复合干燥 69.90±2.39 b 37.63±4.39 b 64.46±3.00 b 37.62±1.74 b 47.27±1.58 c - 真空冷冻干燥 71.37±2.64 b 39.72±2.76 b 75.04±1.53 b 40.09±2.65 b 50.79±1.18 b - ‘粉皮宫粉’ 对照 77.44±6.27 a 38.79±1.36 a 88.49±3.42 a 39.86±0.70 a 51.80±1.71 a - 热风干燥 52.84±3.36 c 23.81±1.81 b 52.65±1.74 d 23.92±1.11 c 24.04±1.25 c - 微波干燥 47.59±1.50 c 19.84±1.56 c 48.16±1.92 e 21.87±1.27 d 22.96±0.32 c - 复合干燥 72.49±3.47 b 26.32±1.66 b 57.47±3.32 c 25.47±0.98 c 32.95±1.96 b - 真空冷冻干燥 68.73±3.34 b 25.92±1.69 b 64.74±0.33 b 28.90±0.57 b 35.09±2.47 b - 说明:同列不同字母表示同一品种不同干燥方法间差异显著(P<0.05)。Cy3G. 矢车菊素-3-O-葡萄糖苷; Cy3Ru. 矢车菊素-3-O-芸香糖苷; Pn3G. 芍药花素-3-O-葡萄糖苷;Pn3Ru. 芍药花素-3-O-芸香糖苷;Pn3Ru. 飞燕草素-3-O-芸香糖鼠李糖苷;Pt3Ru5h. 矮牵牛素-3-O-芸香糖-5-O-鼠李糖苷。-表示未检测到该成分。 -
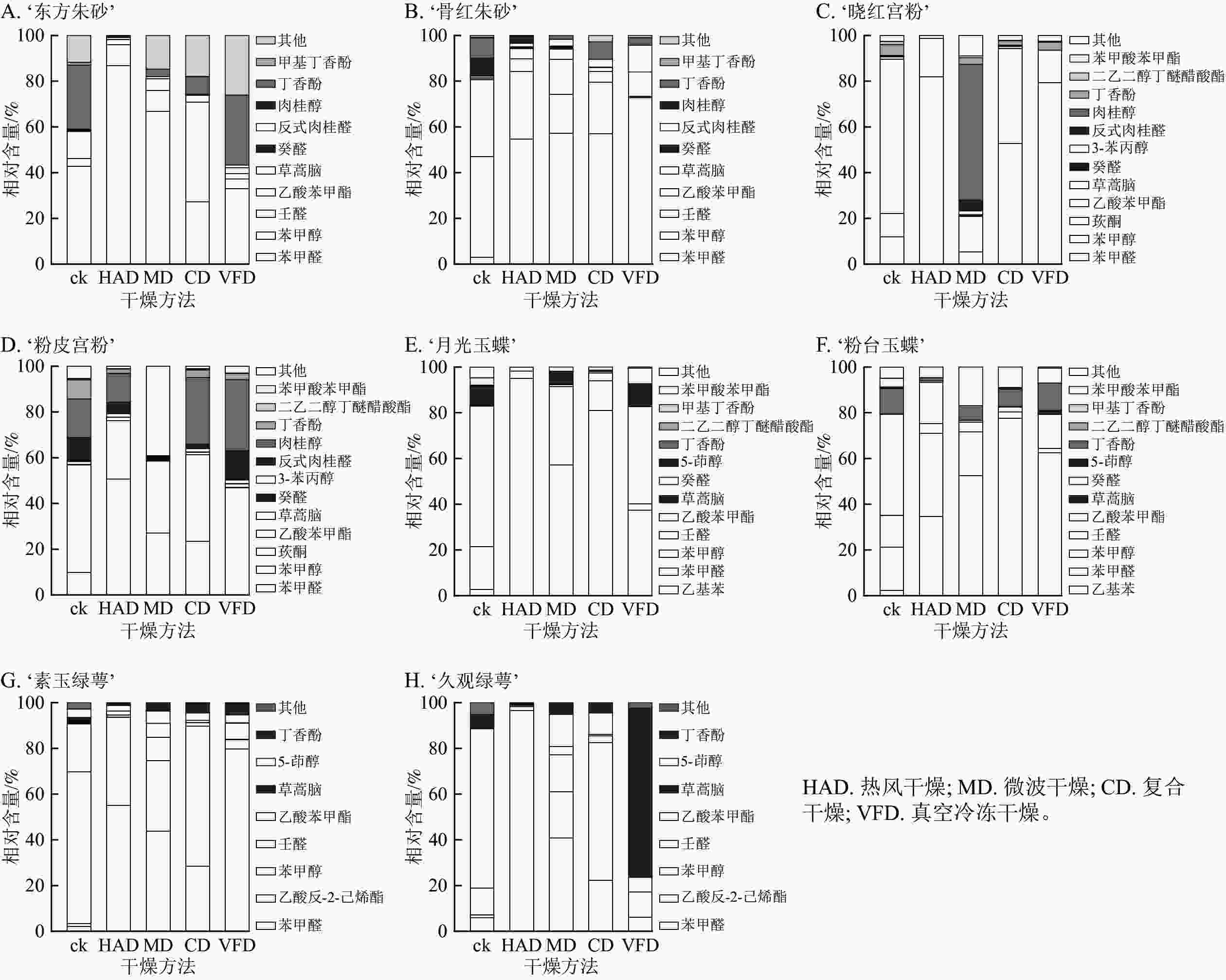
从8个梅花品种中鉴定出27种挥发物,这些挥发性成分主要包括醛类、酯类、有机酸、醇类和脂肪类化合物。酯类化合物在梅花花香成分中质量分数最高,苯甲醛、苯甲醇和乙酸苯甲酯等是梅花挥发物的主要成分[26]。由挥发性成分测定结果可知(图6):复合干燥和真空冷冻干燥在保留挥发性成分上具有明显优势,特别是在保留醛类和酯类这2类主要香气成分方面,这2种干燥方法表现出更佳的效果,复合干燥组的总保留率最高,达到50%以上。热风干燥组梅花的香气成分保留结果不稳定,部分梅花品种在热风干燥后挥发性成分保留少。8个梅花品种鲜样挥发性成分中除了‘粉皮宫粉’中检测到壬醛,其余品种只在干燥后检测到壬醛,说明在干燥处理后产生壬醛,梅花香气特征可能发生了改变。
-
表3和表4结果对比表明:干燥后梅花提取液对2种自由基清除能力一致。不同干燥方法处理后的梅花提取液清除DPPH和ABTS自由基的IC50均有所增加,并且存在显著差异(P<0.05),说明梅花提取液在干燥后对自由基的清除能力降低,并且不同干燥方法对自由基清除能力影响不同。
表 3 不同干燥方法处理前后梅花清除DPPH自由基的IC50
Table 3. IC50 values of DPPH free radical scavenging of P. mume flowers before and after different drying methods
品种 清除DPPH自由基的IC50/(mg·L−1) 对照 热风干燥 微波干燥 复合干燥 真空冷冻干燥 ‘东方朱砂’ 180.40±1.79 d 238.26±2.42 b 269.67±6.88 a 230.03±3.19 b 191.17±7.67 c ‘骨红朱砂’ 176.99±4.79 c 233.66±5.16 b 269.69±7.17 a 223.33±9.63 b 221.11±4.24 b ‘晓红宫粉’ 193.60±6.25 d 236.42±7.01 b 271.22±4.34 a 214.05±2.44 c 204.24±3.71 c ‘粉皮宫粉’ 186.91±7.98 d 242.91±7.63 b 292.69±3.39 a 222.02±1.34 c 197.54±6.29 d ‘月光玉蝶’ 171.70±2.90 d 241.20±7.81 b 273.73±9.35 a 229.67±1.03 b 208.39±6.02 c ‘粉台玉蝶’ 183.50±2.91 e 232.37±3.88 b 257.62±8.40 a 209.38±2.37 c 197.30±3.15 d ‘素玉绿萼’ 168.43±3.62 e 221.55±0.82 b 234.17±7.48 a 208.39±6.12 c 193.95±4.62 d ‘久观绿萼’ 155.31±5.20 d 229.09±6.76 b 249.32±12.28 a 190.41±4.72 c 189.24±1.65 c 说明:同行不同字母表示同一品种不同干燥方法间差异显著(P<0.05)。 表 4 不同干燥方法处理前后梅花清除ABST自由基的IC50
Table 4. IC50 value of ABST free radical scavenging of P. mume flowers before and after different drying methods
品种 清除ABST自由基的IC50/(mg·L−1) 对照 热风干燥 微波干燥 复合干燥 真空冷冻干燥 ‘东方朱砂’ 431.89±1.85 c 528.86±2.95 a 520.90±6.88 a 464.79±5.46 b 454.21±11.33 b ‘骨红朱砂’ 430.89±9.98 c 464.71±6.51 b 494.48±17.93 a 463.13±2.78 b 457.54±5.77 b ‘晓红宫粉’ 436.85±4.07 d 521.48±7.59 b 536.05±9.34 a 470.58±7.23 c 473.88±3.00 c ‘粉皮宫粉’ 423.26±3.85 d 470.38±7.51 b 519.48±5.67 a 463.42±4.80 bc 458.63±6.59 c ‘月光玉蝶’ 435.44±0.87 d 523.76±3.58 b 537.67±7.33 a 467.46±4.29 c 468.04±5.26 c ‘粉台玉蝶’ 434.56±1.98 d 471.71±1.28 c 520.86±5.47 a 469.50±4.63 c 478.67±3.32 b ‘素玉绿萼’ 428.30±5.57 d 490.43±7.95 b 510.52±18.91 a 454.54±5.22 c 452.54±7.60 c ‘久观绿萼’ 410.93±4.46 d 470.38±7.51 b 519.48±5.67 a 459.79±10.02 b 447.29±4.69 c 说明:同行不同字母表示同一品种不同干燥方式间差异显著(P<0.05)。 除‘骨红朱砂’外,与其他干燥方法相比,真空冷冻干燥后的梅花提取液清除DPPH、ABST自由基的IC50值显著低于热风干燥与微波干燥(P<0.05),与复合干燥差异小。真空冷冻干燥后的梅花提取液对DPPH自由基的清除能力是微波干燥后的1.2~1.5倍。复合干燥与真空冷冻干燥后梅花提取液清除ABTS自由基的IC50约为447.29~478.67 mg·L−1。真空冷冻干燥与复合干燥后的梅花提取液对DPPH、ABST自由基清除能力较强。可能由于真空冷冻干燥低温和缺氧的特点,有效减少了抗氧化物的降解,从而保持了更高的抗氧化活性。
-
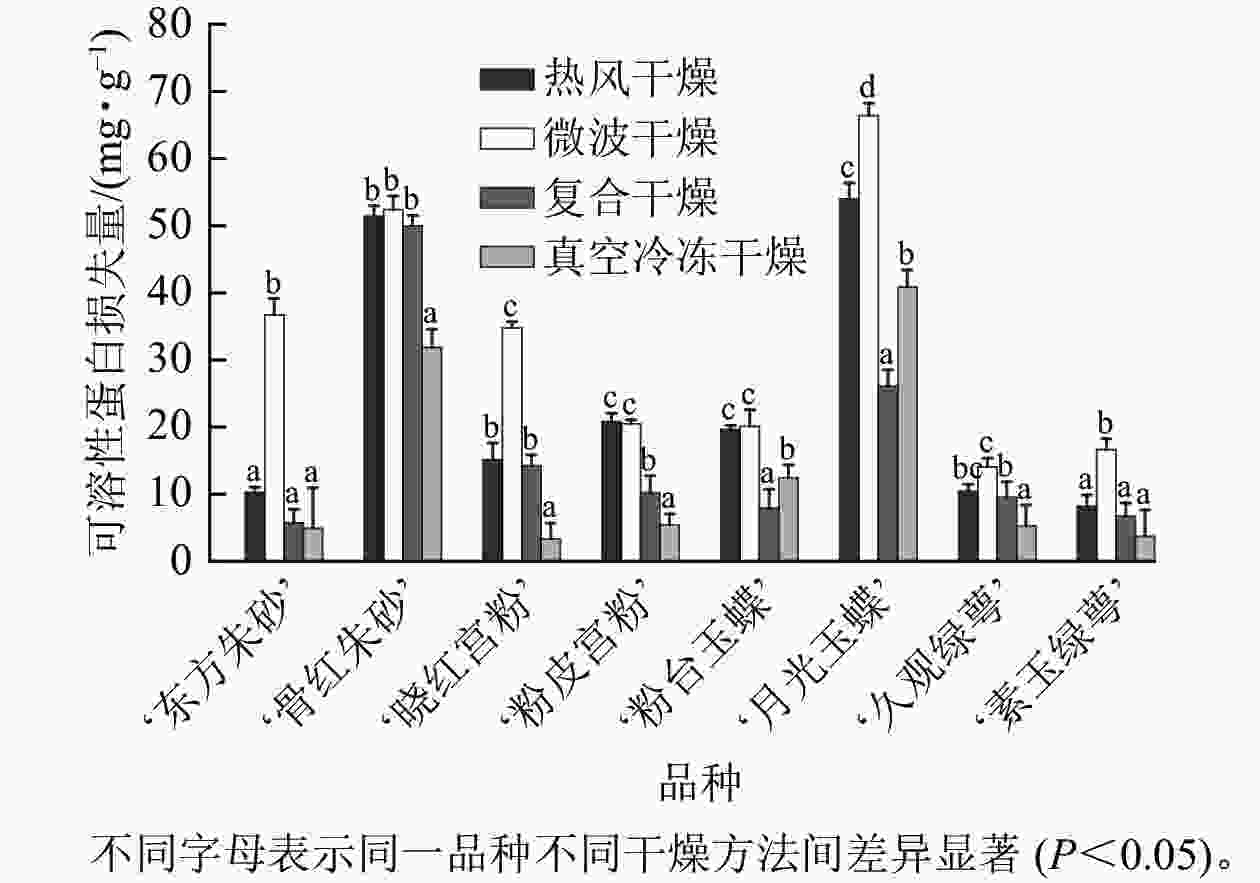
由图7可知:不同干燥方法处理对梅花可溶性蛋白的保留有显著影响。‘月光玉蝶’‘粉台玉蝶’中复合干燥组可溶性蛋白损失显著小于其他干燥方法(P<0.05),损失量分别为26.08、7.92 mg·g−1,‘东方朱砂’‘骨红朱砂’‘晓红宫粉’‘粉皮宫粉’‘久观绿萼’‘素玉绿萼’中,真空冷冻干燥组可溶性蛋白质量分数损失小于其他3种干燥方法,损失量分别为4.91、31.86、3.34、5.38、5.26、3.70 mg·g−1。
-
新绿原酸、绿原酸是梅花鲜花的主要酚类物质,其质量分数高于黄酮类化合物芦丁、异槲皮苷与金丝桃苷。由图8可知:真空冷冻干燥在所有干燥方法中保留效果最佳,尤其是大部分品种的绿原酸和异槲皮苷质量分数均显著高于除对照外的其他干燥方法(P<0.05)。复合干燥虽然保留效果略低于真空冷冻干燥,但显著高于热风干燥和微波干燥。
-
由上述分析可知:不同干燥方法处理对梅花品质指标的影响不同。熵权-变异系数综合评分和TOPSIS法计算结果如表5和表6所示:4种干燥方法的熵权-变异系数综合评分由高到低依次为真空冷冻干燥法、复合干燥法、热风干燥法和微波干燥法。通过TOPSIS排序法进行验证,结果与熵权-变异系数法分析结果基本一致,TOPSIS排序法中C越大排名越高,真空冷冻干燥法与复合干燥法品质优于热风干燥法和微波干燥法。综合来说真空冷冻干燥法干燥后梅花品质最优,复合干燥法干燥后次之。
表 5 不同干燥方法处理后熵权-变异系数法各梅花指标权重
Table 5. Weights of indexes of the P. mume flowers entropy weight-coefficient of variation method after different drying methods
品种 指标名称 wj1 wj2 wj 品种 指标名称 wj1 wj2 wj ‘东方朱砂’ 失水率 0.074 6 0.054 0 0.079 8 ‘骨红朱砂’ 失水率 0.072 3 0.054 0 0.079 5 收缩率 0.081 6 0.033 4 0.065 7 收缩率 0.100 3 0.022 4 0.060 3 色差值 0.094 2 0.026 8 0.063 2 色差值 0.072 5 0.050 3 0.076 8 DPPH 0.078 3 0.037 4 0.068 0 DPPH 0.072 7 0.051 2 0.077 6 ABST 0.086 1 0.038 5 0.072 4 ABST 0.072 5 0.050 4 0.076 9 总黄酮 0.078 5 0.040 0 0.070 5 总黄酮 0.076 2 0.043 2 0.073 0 总花青素 0.087 0 0.032 2 0.066 5 总花青素 0.080 9 0.036 9 0.069 5 挥发性分成保留率 0.080 5 0.039 2 0.070 6 挥发性分成保留率 0.094 7 0.028 5 0.066 1 新绿原酸 0.077 0 0.044 9 0.073 9 新绿原酸 0.073 1 0.045 9 0.073 7 绿原酸 0.079 8 0.041 8 0.072 6 绿原酸 0.072 9 0.046 8 0.074 3 芦丁 0.080 2 0.042 9 0.073 7 芦丁 0.075 8 0.042 0 0.071 8 金丝桃苷 0.082 2 0.033 0 0.065 5 金丝桃苷 0.082 9 0.035 8 0.069 3 异槲皮苷 0.075 9 0.050 0 0.077 4 异槲皮苷 0.078 2 0.039 5 0.070 7 可溶性蛋白 0.074 4 0.055 0 0.080 4 可溶性蛋白 0.101 8 0.022 2 0.060 5 ‘晓红宫粉’ 失水率 0.076 6 0.063 7 0.081 2 ‘粉皮宫粉’ 失水率 0.076 1 0.041 3 0.072 4 收缩率 0.083 6 0.037 0 0.064 6 收缩率 0.075 4 0.037 6 0.068 8 色差值 0.079 4 0.043 2 0.068 1 色差值 0.081 3 0.032 7 0.066 6 DPPH 0.078 4 0.050 6 0.073 2 DPPH 0.074 0 0.042 9 0.072 7 ABST 0.084 2 0.046 3 0.072 6 ABST 0.072 5 0.051 6 0.079 0 总黄酮 0.082 3 0.042 3 0.068 5 总黄酮 0.073 6 0.048 8 0.077 4 总花青素 0.077 2 0.054 3 0.075 2 总花青素 0.078 1 0.040 3 0.072 4 挥发性分成保留率 0.080 2 0.045 3 0.070 1 挥发性分成保留率 0.072 5 0.050 4 0.078 1 新绿原酸 0.080 4 0.043 7 0.068 9 新绿原酸 0.092 8 0.027 4 0.065 1 绿原酸 0.079 1 0.048 8 0.072 2 绿原酸 0.089 6 0.027 1 0.063 6 芦丁 0.093 8 0.030 4 0.062 0 芦丁 0.072 4 0.052 3 0.079 5 金丝桃苷 0.084 5 0.045 8 0.072 3 金丝桃苷 0.079 9 0.039 6 0.072 6 异槲皮苷 0.076 7 0.061 3 0.079 6 异槲皮苷 0.098 4 0.023 6 0.062 2 可溶性蛋白 0.077 9 0.048 6 0.071 5 可溶性蛋白 0.090 3 0.032 3 0.069 7 ‘月光玉蝶’ 失水率 0.081 1 0.046 8 0.081 0 ‘粉台玉蝶’ 失水率 0.080 1 0.047 6 0.079 2 收缩率 0.100 3 0.026 2 0.067 4 收缩率 0.106 4 0.025 4 0.066 7 色差值 0.082 8 0.038 1 0.073 9 色差值 0.082 2 0.045 0 0.078 0 DPPH 0.080 6 0.043 4 0.077 8 DPPH 0.082 1 0.045 5 0.078 5 ABST 0.087 6 0.043 7 0.081 4 ABST 0.079 1 0.057 0 0.086 2 总黄酮 0.088 7 0.038 3 0.076 6 总黄酮 0.102 1 0.036 9 0.078 8 含量花青素 0.063 8 0.000 1 0.002 7 总花青素 0.063 8 0.000 1 0.002 7 挥发性分成保留率 0.083 2 0.040 0 0.075 8 挥发性分成保留率 0.082 2 0.041 1 0.074 6 新绿原酸 0.080 6 0.046 1 0.080 1 新绿原酸 0.094 8 0.036 2 0.075 2 绿原酸 0.080 8 0.049 1 0.082 8 绿原酸 0.085 5 0.044 6 0.079 3 芦丁 0.092 0 0.040 4 0.080 1 芦丁 0.083 0 0.045 2 0.078 6 金丝桃苷 0.093 0 0.037 5 0.077 6 金丝桃苷 0.085 1 0.045 1 0.079 5 异槲皮苷 0.092 5 0.031 1 0.070 5 异槲皮苷 0.094 7 0.032 3 0.071 0 可溶性蛋白 0.097 6 0.033 2 0.074 9 可溶性蛋白 0.084 5 0.039 8 0.074 5 ‘素玉绿萼’ 失水率 0.083 7 0.061 3 0.082 2 ‘久观绿萼’ 失水率 0.083 6 0.055 6 0.080 1 收缩率 0.087 1 0.046 4 0.073 0 收缩率 0.089 1 0.042 4 0.072 2 色差值 0.084 2 0.058 4 0.080 5 色差值 0.086 5 0.045 9 0.074 0 DPPH 0.089 1 0.045 1 0.072 8 DPPH 0.088 0 0.052 5 0.079 8 ABST 0.088 6 0.053 3 0.078 9 ABST 0.083 3 0.056 8 0.080 8 总黄酮 0.090 3 0.050 6 0.077 6 总黄酮 0.086 7 0.046 0 0.074 2 总花青素 0.063 8 0.000 1 0.002 7 总花青素 0.063 8 0.000 1 0.002 7 挥发性分成保留率 0.088 6 0.046 2 0.073 4 挥发性分成保留率 0.106 5 0.045 3 0.081 6 新绿原酸 0.093 3 0.045 8 0.075 0 新绿原酸 0.084 4 0.054 7 0.079 8 绿原酸 0.086 9 0.050 0 0.075 7 绿原酸 0.087 3 0.052 8 0.079 8 芦丁 0.090 0 0.051 5 0.078 2 芦丁 0.089 6 0.039 7 0.070 0 金丝桃苷 0.088 0 0.050 1 0.076 3 金丝桃苷 0.089 8 0.050 4 0.079 0 异槲皮苷 0.095 7 0.047 4 0.077 3 异槲皮苷 0.086 6 0.048 9 0.076 4 可溶性蛋白 0.084 3 0.055 9 0.078 8 可溶性蛋白 0.087 0 0.043 8 0.072 5 表 6 不同干燥方法处理后梅花熵权-变异系数综合评分和TOPSIS排序结果
Table 6. Comprehensive score and TOPSIS ranking results of entropy-coefficient of variation of P. mume after different drying motheds
品种 干燥方法 熵权-变异系数
综合排名TOPSIS排名 品种 干燥方法 熵权-变异系数
综合排名TOPSIS排名 综合评分 排名 C 排名 综合评分 排名 C 排名 ‘东方朱砂’ 热风干燥法 783.50 3 0.501 0 3 ‘骨红朱砂’ 热风干燥法 952.51 3 0.367 5 4 微波干燥法 619.09 4 0.392 3 4 微波干燥法 735.31 4 0.416 1 3 复合干燥法 975.78 2 0.649 3 1 复合干燥法 1276.55 2 0.581 2 1 真空冷冻干燥法 1049.36 1 0.595 0 2 真空冷冻干燥法 1340.41 1 0.552 8 2 ‘晓红宫粉’ 热风干燥法 723.16 3 0.508 3 3 ‘粉皮宫粉’ 热风干燥法 783.50 3 0.378 6 3 微波干燥法 564.06 4 0.413 6 4 微波干燥法 619.09 4 0.417 8 4 复合干燥法 912.86 2 0.598 5 1 复合干燥法 975.78 2 0.565 1 2 真空冷冻干燥法 1045.04 1 0.582 4 2 真空冷冻干燥法 1049.36 1 0.626 6 1 ‘月光玉蝶’ 热风干燥法 590.06 3 0.393 3 4 ‘粉台玉蝶’ 热风干燥法 722.06 3 0.283 0 4 微波干燥法 501.93 4 0.450 8 3 微波干燥法 707.76 4 0.422 5 3 复合干燥法 852.84 2 0.620 7 1 复合干燥法 975.07 2 0.555 4 2 真空冷冻干燥法 953.14 1 0.550 9 2 真空冷冻干燥法 1016.84 1 0.586 4 1 ‘素玉绿萼’ 热风干燥法 812.27 3 0.432 2 3 ‘久观绿萼’ 热风干燥法 877.24 3 0.423 7 3 微波干燥法 713.61 4 0.435 2 4 微波干燥法 706.09 4 0.505 1 4 复合干燥法 1016.70 2 0.580 5 1 复合干燥法 1041.97 2 0.464 3 2 真空冷冻干燥法 1048.38 1 0.564 1 2 真空冷冻干燥法 1150.98 1 0.576 4 1 -
梅花具有多种香气成分和气味品质、独特的花色花形以及药用价值,这些特点赋予梅花极大的开发潜力[27]。本研究应用热风干燥、微波干燥、复合干燥和真空冷冻干燥4种不同干燥方法处理梅花,综合考虑了表型、花色、花香成分等因素,对比分析了不同干燥方法对梅花品质的影响。结果显示:干燥方法对梅花的理化属性产生较大的影响。与 ZHANG等[28]的研究一致。真空冷冻干燥的梅花在保持色泽和细胞结构上表现最佳,具较强的清除DHHP和ABST自由基能力,显示出强大的抗氧化能力。复合干燥法能保留梅花活性成分,提升抗氧化能力。这与SHI等[29]的研究结果相符。本研究中,复合干燥法在保留挥发性物质方面表现最佳,不仅提高了梅花的香气质量,还缩短了干燥时间,减少了有效成分的降解。此外,真空冷冻干燥法和复合干燥法处理后的梅花在保留总黄酮、总花青素、绿原酸等有效成分方面均表现出优势。在评估不同梅花品种的质量时,‘绿萼’品种表现出最强的抗氧化能力且各营养成分较高,而‘朱砂’品种在保留花色方面最为突出,并且其花青素质量分数较高。综合评分结果显示:‘骨红朱砂’‘久观绿萼’评分最高,因此,这2个梅花品种适用于梅花花茶的开发。
-
本研究选取8个梅花品种,采用4种不同干燥方法对梅花鲜花进行研究发现:真空冷冻干燥后的梅花品质最优,复合干燥次之。真空冷冻干燥在品质保持方面表现最佳,但较高的设备成本和长时间的干燥过程限制了其大规模应用。相比之下,复合干燥结合了不同干燥方法的优点,不仅保持了梅花的品质,还缩短了加工时间,为大批量生产提供了可能。可以进一步拓展梅花品种的选择范围,优化复合干燥条件,以提升梅花茶的整体品质。此外,本研究选用了色差值、抗氧化能力和总黄酮质量分数等指标进行综合评价,可以考虑引入更多与梅花品质相关的生化和生理指标,构建更为全面的梅花品质评价体系。
Impact and evaluation of different drying methods on the quality of Prunus mume flowers
-
摘要:
目的 探究不同干燥方法对梅Prunus mume干花品质的影响,并对其进行综合评价,为实际干燥加工中保持梅花的品质提供参考。 方法 采用热风干燥法、微波干燥法、复合干燥法和真空冷冻干燥法对8个梅花品种‘东方朱砂’‘Dongfang Zhusha’、‘骨红朱砂’‘Guhong Zhusha’、‘晓红宫粉’‘Xiaohong Gongfen’、‘粉皮宫粉’‘Fenpi Gongfen’、‘粉台玉蝶’‘Fentai Yudie’、‘月光玉蝶’‘Yueguang Yudie’、‘久观绿萼’‘Jiuguang Lve’、‘素玉绿萼’‘Suyu Lve’的鲜花进行干燥,以色差值、抗氧化能力、总黄酮质量分数等作为评价指标,比较不同干燥方法对梅花品质的影响,运用熵权-变异系数法组合赋权计算综合评分,并用加权逼近理想解排序法验证评价模型,得到最优的干燥方法。 结果 4种干燥方法中,真空冷冻干燥处理的梅花色差值与收缩率最小,分别小于33.09、28.7%,且样品总黄酮、花青素、总绿原酸质量分数最高。真空冷冻干燥法与复合干燥法处理材料的可溶性蛋白质质量分数最高,抗氧化能力最强。挥发性成分在复合干燥后保留率最高,大于50%。综合评分排名由高到低依次为真空冷冻干燥组、复合干燥组、热风干燥组、微波干燥组。 结论 4种干燥方法中真空冷冻干燥法后有效成分质量分数最高,其次为复合干燥法。真空冷冻干燥与复合干燥后梅花品质较佳,可用于梅花精品加工与干花批量生产。图8表6参29 Abstract:Objective The impact of different drying methods on the quality of dried Prunus mume flowers is to be studied and evaluated, so as to provide reference for maintaining the quality of dried P. mume flowers in drying process. Method 4 different drying methods (hot air drying, microwave drying, compound drying and vacuum freeze-drying) were used to treat 8 P. mume flower cultivars (‘Dongfang Zhusha’ ‘Guhong Zhusha’ ‘Xiaohong Gongfen’ ‘Fenpi Gongfen’ ‘Fentai Yudie’ ‘Yueguang Yudie’ ‘Jiuguang Lve’ and ‘Suyu Lv’). Color difference, antioxidant capacity, and total flavonoid content were used as evaluation indicators to compare the impact of different drying methods on the quality of P. mume flowers. The entropy weight-coefficient of variation method was used for combined weighting to calculate the comprehensive score. The evaluation model was verified by the weighted proximation ideal solution sorting method and the optimal drying method was obtained. Result The color difference and shrinkage rate treated with vacuum freeze-drying were the smallest, less than 33.09 and 28.7%, respectively, and the total flavonoids, anthocyanins, and total chlorogenic acid mass fractions of the samples were the highest. The soluble protein mass fraction and antioxidant capacity of the materials treated with vacuum freezing and composite drying methods were the highest. The retention rate of volatile substances was the highest after composite drying, exceeding 50%. The comprehensive scores ranking from high to low was vacuum freeze-drying group, composite drying group, hot air drying group, and microwave drying group. Conclusion The mass fraction of active ingredients is the highest after vacuum freeze-drying, followed by composite drying. The quality of P. mume flowers is the best after vacuum freeze-drying and composite drying, which can be used for high-quality processing and mass production. [Ch, 8 fig. 6 tab. 29 ref.] -
Key words:
- Prunus mume flower /
- drying method /
- flower color /
- floral scent /
- antioxidation
-
表 1 不同干燥方法处理后梅花花色变化
Table 1. Changes of flower color after different drying methods
品种 花色 对照 热风
干燥微波
干燥复合
干燥真空冷
冻干燥‘东方朱砂’ 61B N79B N79A 79N N79B ‘骨红朱砂’ N66C 64A N79D 70B 64 ‘晓红宫粉’ 65A N75A 84C N80D N75B ‘粉皮宫粉’ 65C N74C 84C 77D 75A ‘粉台玉蝶’ NN155B 155A N199D 150D 155A ‘月光玉蝶’ NN155C N155C 157B N155D NN155B ‘久观绿萼’ 155C 4D 2D 155C 155A ‘素玉绿萼’ NN155B 155A 8D 4D 155A 表 2 不同干燥方法处理前后梅花花青苷组成及质量分数
Table 2. Composition and content of anthocyanin in P. mume flowers before and after different drying methods
品种 干燥方法 花青苷/(μg·g−1 ) Cy3G Cy3Ru Pn3G Pn3Ru Pn3Ru Pt3Ru5h ‘东方朱砂’ 对照 841.71±34.39 a 1 027.57±23.45 a 961.74±18.22 a 227.72±29.11 a 130.19±1.09 a 192.58±1.46 a 热风干燥 400.75±5.87 d 723.73±15.10 c 509.53±5.24 d 158.79±5.02 b 113.67±12.52 ab 127.39±5.79 c 微波干燥 464.20±15.80 c 617.52±7.30 d 508.77±15.26 d 100.32±10.42 c 92.19±20.83 b 126.93±6.97 c 复合干燥 571.18±14.74 b 840.66±16.28 b 692.89±44.69 c 145.47±5.46 b 126.78±0.93 a 160.19±17.22 b 真空冷冻干燥 575.79±5.60 b 827.60±9.85 b 775.04±13.32 b 157.75±21.72 b 117.91±15.1 a 174.76±1.24 b ‘骨红朱砂’ 对照 564.92±13.66 a 496.45±3.02 a 774.52±19.56 a 63.51±1.61 a 63.32±0.70 a - 热风干燥 424.35±15.82 c 357.86±29.59 c 493.59±15.76 c 47.37±2.21 c 51.91±1.49 c - 微波干燥 352.38±26.86 d 275.21±37.52 d 462.78±19.02 d 46.43±0.20 c 50.58±2.90 c - 复合干燥 452.85±6.76 b 428.39±12.83 b 555.72±14.56 b 51.09±2.53 b 56.97±2.22 b - 真空冷冻干燥 478.79±12.68 b 401.86±5.03 b 585.24±19.34 b 52.87±0.62 b 59.45±2.44 b - ‘晓红宫粉’ 对照 94.87±12.12 a 56.21±8.51 a 89.89±13.31 a 57.87±1.65 a 60.02±1.89 a - 热风干燥 57.85±2.58 c 35.28±2.90 b 68.27±1.29 b 33.03±1.68 c 42.12±0.85 d - 微波干燥 29.93±1.58 d 21.17±0.30 c 42.66±4.48 c 22.80±1.63 d 27.43±2.01 e - 复合干燥 69.90±2.39 b 37.63±4.39 b 64.46±3.00 b 37.62±1.74 b 47.27±1.58 c - 真空冷冻干燥 71.37±2.64 b 39.72±2.76 b 75.04±1.53 b 40.09±2.65 b 50.79±1.18 b - ‘粉皮宫粉’ 对照 77.44±6.27 a 38.79±1.36 a 88.49±3.42 a 39.86±0.70 a 51.80±1.71 a - 热风干燥 52.84±3.36 c 23.81±1.81 b 52.65±1.74 d 23.92±1.11 c 24.04±1.25 c - 微波干燥 47.59±1.50 c 19.84±1.56 c 48.16±1.92 e 21.87±1.27 d 22.96±0.32 c - 复合干燥 72.49±3.47 b 26.32±1.66 b 57.47±3.32 c 25.47±0.98 c 32.95±1.96 b - 真空冷冻干燥 68.73±3.34 b 25.92±1.69 b 64.74±0.33 b 28.90±0.57 b 35.09±2.47 b - 说明:同列不同字母表示同一品种不同干燥方法间差异显著(P<0.05)。Cy3G. 矢车菊素-3-O-葡萄糖苷; Cy3Ru. 矢车菊素-3-O-芸香糖苷; Pn3G. 芍药花素-3-O-葡萄糖苷;Pn3Ru. 芍药花素-3-O-芸香糖苷;Pn3Ru. 飞燕草素-3-O-芸香糖鼠李糖苷;Pt3Ru5h. 矮牵牛素-3-O-芸香糖-5-O-鼠李糖苷。-表示未检测到该成分。 表 3 不同干燥方法处理前后梅花清除DPPH自由基的IC50
Table 3. IC50 values of DPPH free radical scavenging of P. mume flowers before and after different drying methods
品种 清除DPPH自由基的IC50/(mg·L−1) 对照 热风干燥 微波干燥 复合干燥 真空冷冻干燥 ‘东方朱砂’ 180.40±1.79 d 238.26±2.42 b 269.67±6.88 a 230.03±3.19 b 191.17±7.67 c ‘骨红朱砂’ 176.99±4.79 c 233.66±5.16 b 269.69±7.17 a 223.33±9.63 b 221.11±4.24 b ‘晓红宫粉’ 193.60±6.25 d 236.42±7.01 b 271.22±4.34 a 214.05±2.44 c 204.24±3.71 c ‘粉皮宫粉’ 186.91±7.98 d 242.91±7.63 b 292.69±3.39 a 222.02±1.34 c 197.54±6.29 d ‘月光玉蝶’ 171.70±2.90 d 241.20±7.81 b 273.73±9.35 a 229.67±1.03 b 208.39±6.02 c ‘粉台玉蝶’ 183.50±2.91 e 232.37±3.88 b 257.62±8.40 a 209.38±2.37 c 197.30±3.15 d ‘素玉绿萼’ 168.43±3.62 e 221.55±0.82 b 234.17±7.48 a 208.39±6.12 c 193.95±4.62 d ‘久观绿萼’ 155.31±5.20 d 229.09±6.76 b 249.32±12.28 a 190.41±4.72 c 189.24±1.65 c 说明:同行不同字母表示同一品种不同干燥方法间差异显著(P<0.05)。 表 4 不同干燥方法处理前后梅花清除ABST自由基的IC50
Table 4. IC50 value of ABST free radical scavenging of P. mume flowers before and after different drying methods
品种 清除ABST自由基的IC50/(mg·L−1) 对照 热风干燥 微波干燥 复合干燥 真空冷冻干燥 ‘东方朱砂’ 431.89±1.85 c 528.86±2.95 a 520.90±6.88 a 464.79±5.46 b 454.21±11.33 b ‘骨红朱砂’ 430.89±9.98 c 464.71±6.51 b 494.48±17.93 a 463.13±2.78 b 457.54±5.77 b ‘晓红宫粉’ 436.85±4.07 d 521.48±7.59 b 536.05±9.34 a 470.58±7.23 c 473.88±3.00 c ‘粉皮宫粉’ 423.26±3.85 d 470.38±7.51 b 519.48±5.67 a 463.42±4.80 bc 458.63±6.59 c ‘月光玉蝶’ 435.44±0.87 d 523.76±3.58 b 537.67±7.33 a 467.46±4.29 c 468.04±5.26 c ‘粉台玉蝶’ 434.56±1.98 d 471.71±1.28 c 520.86±5.47 a 469.50±4.63 c 478.67±3.32 b ‘素玉绿萼’ 428.30±5.57 d 490.43±7.95 b 510.52±18.91 a 454.54±5.22 c 452.54±7.60 c ‘久观绿萼’ 410.93±4.46 d 470.38±7.51 b 519.48±5.67 a 459.79±10.02 b 447.29±4.69 c 说明:同行不同字母表示同一品种不同干燥方式间差异显著(P<0.05)。 表 5 不同干燥方法处理后熵权-变异系数法各梅花指标权重
Table 5. Weights of indexes of the P. mume flowers entropy weight-coefficient of variation method after different drying methods
品种 指标名称 wj1 wj2 wj 品种 指标名称 wj1 wj2 wj ‘东方朱砂’ 失水率 0.074 6 0.054 0 0.079 8 ‘骨红朱砂’ 失水率 0.072 3 0.054 0 0.079 5 收缩率 0.081 6 0.033 4 0.065 7 收缩率 0.100 3 0.022 4 0.060 3 色差值 0.094 2 0.026 8 0.063 2 色差值 0.072 5 0.050 3 0.076 8 DPPH 0.078 3 0.037 4 0.068 0 DPPH 0.072 7 0.051 2 0.077 6 ABST 0.086 1 0.038 5 0.072 4 ABST 0.072 5 0.050 4 0.076 9 总黄酮 0.078 5 0.040 0 0.070 5 总黄酮 0.076 2 0.043 2 0.073 0 总花青素 0.087 0 0.032 2 0.066 5 总花青素 0.080 9 0.036 9 0.069 5 挥发性分成保留率 0.080 5 0.039 2 0.070 6 挥发性分成保留率 0.094 7 0.028 5 0.066 1 新绿原酸 0.077 0 0.044 9 0.073 9 新绿原酸 0.073 1 0.045 9 0.073 7 绿原酸 0.079 8 0.041 8 0.072 6 绿原酸 0.072 9 0.046 8 0.074 3 芦丁 0.080 2 0.042 9 0.073 7 芦丁 0.075 8 0.042 0 0.071 8 金丝桃苷 0.082 2 0.033 0 0.065 5 金丝桃苷 0.082 9 0.035 8 0.069 3 异槲皮苷 0.075 9 0.050 0 0.077 4 异槲皮苷 0.078 2 0.039 5 0.070 7 可溶性蛋白 0.074 4 0.055 0 0.080 4 可溶性蛋白 0.101 8 0.022 2 0.060 5 ‘晓红宫粉’ 失水率 0.076 6 0.063 7 0.081 2 ‘粉皮宫粉’ 失水率 0.076 1 0.041 3 0.072 4 收缩率 0.083 6 0.037 0 0.064 6 收缩率 0.075 4 0.037 6 0.068 8 色差值 0.079 4 0.043 2 0.068 1 色差值 0.081 3 0.032 7 0.066 6 DPPH 0.078 4 0.050 6 0.073 2 DPPH 0.074 0 0.042 9 0.072 7 ABST 0.084 2 0.046 3 0.072 6 ABST 0.072 5 0.051 6 0.079 0 总黄酮 0.082 3 0.042 3 0.068 5 总黄酮 0.073 6 0.048 8 0.077 4 总花青素 0.077 2 0.054 3 0.075 2 总花青素 0.078 1 0.040 3 0.072 4 挥发性分成保留率 0.080 2 0.045 3 0.070 1 挥发性分成保留率 0.072 5 0.050 4 0.078 1 新绿原酸 0.080 4 0.043 7 0.068 9 新绿原酸 0.092 8 0.027 4 0.065 1 绿原酸 0.079 1 0.048 8 0.072 2 绿原酸 0.089 6 0.027 1 0.063 6 芦丁 0.093 8 0.030 4 0.062 0 芦丁 0.072 4 0.052 3 0.079 5 金丝桃苷 0.084 5 0.045 8 0.072 3 金丝桃苷 0.079 9 0.039 6 0.072 6 异槲皮苷 0.076 7 0.061 3 0.079 6 异槲皮苷 0.098 4 0.023 6 0.062 2 可溶性蛋白 0.077 9 0.048 6 0.071 5 可溶性蛋白 0.090 3 0.032 3 0.069 7 ‘月光玉蝶’ 失水率 0.081 1 0.046 8 0.081 0 ‘粉台玉蝶’ 失水率 0.080 1 0.047 6 0.079 2 收缩率 0.100 3 0.026 2 0.067 4 收缩率 0.106 4 0.025 4 0.066 7 色差值 0.082 8 0.038 1 0.073 9 色差值 0.082 2 0.045 0 0.078 0 DPPH 0.080 6 0.043 4 0.077 8 DPPH 0.082 1 0.045 5 0.078 5 ABST 0.087 6 0.043 7 0.081 4 ABST 0.079 1 0.057 0 0.086 2 总黄酮 0.088 7 0.038 3 0.076 6 总黄酮 0.102 1 0.036 9 0.078 8 含量花青素 0.063 8 0.000 1 0.002 7 总花青素 0.063 8 0.000 1 0.002 7 挥发性分成保留率 0.083 2 0.040 0 0.075 8 挥发性分成保留率 0.082 2 0.041 1 0.074 6 新绿原酸 0.080 6 0.046 1 0.080 1 新绿原酸 0.094 8 0.036 2 0.075 2 绿原酸 0.080 8 0.049 1 0.082 8 绿原酸 0.085 5 0.044 6 0.079 3 芦丁 0.092 0 0.040 4 0.080 1 芦丁 0.083 0 0.045 2 0.078 6 金丝桃苷 0.093 0 0.037 5 0.077 6 金丝桃苷 0.085 1 0.045 1 0.079 5 异槲皮苷 0.092 5 0.031 1 0.070 5 异槲皮苷 0.094 7 0.032 3 0.071 0 可溶性蛋白 0.097 6 0.033 2 0.074 9 可溶性蛋白 0.084 5 0.039 8 0.074 5 ‘素玉绿萼’ 失水率 0.083 7 0.061 3 0.082 2 ‘久观绿萼’ 失水率 0.083 6 0.055 6 0.080 1 收缩率 0.087 1 0.046 4 0.073 0 收缩率 0.089 1 0.042 4 0.072 2 色差值 0.084 2 0.058 4 0.080 5 色差值 0.086 5 0.045 9 0.074 0 DPPH 0.089 1 0.045 1 0.072 8 DPPH 0.088 0 0.052 5 0.079 8 ABST 0.088 6 0.053 3 0.078 9 ABST 0.083 3 0.056 8 0.080 8 总黄酮 0.090 3 0.050 6 0.077 6 总黄酮 0.086 7 0.046 0 0.074 2 总花青素 0.063 8 0.000 1 0.002 7 总花青素 0.063 8 0.000 1 0.002 7 挥发性分成保留率 0.088 6 0.046 2 0.073 4 挥发性分成保留率 0.106 5 0.045 3 0.081 6 新绿原酸 0.093 3 0.045 8 0.075 0 新绿原酸 0.084 4 0.054 7 0.079 8 绿原酸 0.086 9 0.050 0 0.075 7 绿原酸 0.087 3 0.052 8 0.079 8 芦丁 0.090 0 0.051 5 0.078 2 芦丁 0.089 6 0.039 7 0.070 0 金丝桃苷 0.088 0 0.050 1 0.076 3 金丝桃苷 0.089 8 0.050 4 0.079 0 异槲皮苷 0.095 7 0.047 4 0.077 3 异槲皮苷 0.086 6 0.048 9 0.076 4 可溶性蛋白 0.084 3 0.055 9 0.078 8 可溶性蛋白 0.087 0 0.043 8 0.072 5 表 6 不同干燥方法处理后梅花熵权-变异系数综合评分和TOPSIS排序结果
Table 6. Comprehensive score and TOPSIS ranking results of entropy-coefficient of variation of P. mume after different drying motheds
品种 干燥方法 熵权-变异系数
综合排名TOPSIS排名 品种 干燥方法 熵权-变异系数
综合排名TOPSIS排名 综合评分 排名 C 排名 综合评分 排名 C 排名 ‘东方朱砂’ 热风干燥法 783.50 3 0.501 0 3 ‘骨红朱砂’ 热风干燥法 952.51 3 0.367 5 4 微波干燥法 619.09 4 0.392 3 4 微波干燥法 735.31 4 0.416 1 3 复合干燥法 975.78 2 0.649 3 1 复合干燥法 1276.55 2 0.581 2 1 真空冷冻干燥法 1049.36 1 0.595 0 2 真空冷冻干燥法 1340.41 1 0.552 8 2 ‘晓红宫粉’ 热风干燥法 723.16 3 0.508 3 3 ‘粉皮宫粉’ 热风干燥法 783.50 3 0.378 6 3 微波干燥法 564.06 4 0.413 6 4 微波干燥法 619.09 4 0.417 8 4 复合干燥法 912.86 2 0.598 5 1 复合干燥法 975.78 2 0.565 1 2 真空冷冻干燥法 1045.04 1 0.582 4 2 真空冷冻干燥法 1049.36 1 0.626 6 1 ‘月光玉蝶’ 热风干燥法 590.06 3 0.393 3 4 ‘粉台玉蝶’ 热风干燥法 722.06 3 0.283 0 4 微波干燥法 501.93 4 0.450 8 3 微波干燥法 707.76 4 0.422 5 3 复合干燥法 852.84 2 0.620 7 1 复合干燥法 975.07 2 0.555 4 2 真空冷冻干燥法 953.14 1 0.550 9 2 真空冷冻干燥法 1016.84 1 0.586 4 1 ‘素玉绿萼’ 热风干燥法 812.27 3 0.432 2 3 ‘久观绿萼’ 热风干燥法 877.24 3 0.423 7 3 微波干燥法 713.61 4 0.435 2 4 微波干燥法 706.09 4 0.505 1 4 复合干燥法 1016.70 2 0.580 5 1 复合干燥法 1041.97 2 0.464 3 2 真空冷冻干燥法 1048.38 1 0.564 1 2 真空冷冻干燥法 1150.98 1 0.576 4 1 -
[1] 陈俊愉. 中国梅花品种图志[M]. 北京: 中国林业出版社, 1989. CHEN Junyu. Illustrated Monograph of Chinese Prunus mume Cultivars [M]. Beijing: China Forestry Publishing House, 1989. [2] 陈安冉, 丁明君, 王保根. 梅花饮食文化探究[J]. 中国园林, 2020, 36(增刊1): 33 − 35. CHEN Anran, DING Mingjun, WANG Baogen. An exploration on mei flower dietary culture [J]. Chinese Landscape Architecture, 2020, 36(suppl 1): 33 − 35. [3] 张清华, 张玲, 尚立霞, 等. 白梅花的化学成分研究[J]. 中药材, 2008(11): 1666 − 1668. ZHANG Qinghua, ZHANG Ling, SHANG Lixia, et al. Studies on the chemical constituents of flowers of Prunus mume [J]. Journal of Chinese Medicinal Materials, 2008(11): 1666 − 1668. [4] 刘欣侗, 于现花, 刘军玲, 等. 绿梅花中 4 种成分双标多测法的建立[J]. 中国现代应用药学, 2023, 40(5): 613 − 618. LIU Xintong, YU Xianhua, LIU Junling, et al. Establishment of two reference substances for determination of multiple components for 4 components in armeniaca mume [J]. Chinese Journal of Modern Applied Pharmacy, 2023, 40(5): 613 − 618. [5] 李国卫, 吴文平, 何民友, 等. 一测多评法用于梅花多成分含量测定的适用性研究[J]. 中医药导报, 2020, 26(11): 42 − 45. LI Guowei, WU Wenping, HE Minyou, et al. Applicability study on quantitative analysis of multi-components by single marker (QAMS) for multi-component content determination of meihua (mume flower) [J]. Guiding Journal of Traditional Chinese Medicine, 2020, 26(11): 42 − 45. [6] 尚红梅, 郭玮, 陈诚, 等. 酶钝化处理对菊苣根 PPO活性和菊苣酸含量的影响[J]. 中国农业大学学报, 2014, 19(4): 108 − 114. SHANG Hongmei, GUO Wei, CHEN Cheng, et al. Influence of inactivating processing for enzyme on PPO activity and the cichoric acid content of chicory root [J]. Journal of China Agricultural University, 2014, 19(4): 108 − 114. [7] 刘光鹏, 王娟, 和法涛, 等. 不同干燥方式对枸杞微粉品质的影响[J]. 河南农业科学, 2016, 45(11): 130 − 134, 144. LIU Guangpeng, WANG Juan, HE Fatao, et al. Effects of different drying methods on the quality of micronized chinese wolfberry powder [J]. Journal of Henan Agricultural Sciences, 2016, 45(11): 130 − 134, 144. [8] BOSS E A, FILHO R M, de TOLEDO E C V. Freeze drying process: real time model and optimization [J]. Chemical Engineering Processing, 2004, 43(12): 1475 − 1485. [9] 王迪, 李大婧, 江宁, 等. 不同干燥方式对黄秋葵脆条品质及能耗的影响[J]. 食品工业科技, 2017, 38(1): 101 − 105. WANG Di, LI Dajing, JIANG Ning, et al. Effect of drying methods on quality and energy consumption of okra crisp bar [J]. Science and Technology of Food Industry, 2017, 38(1): 101 − 105. [10] 吴一超, 田七斤, 陈卫英. 不同干燥方式对丹参茎叶酚酸含量及抗氧化活性的影响[J/OL]. 分子植物育种, 2024-03-24[2024-04-18]. https://kns-cnki-net.webvpn.zafu.edu.cn/kcms/detail/46.1068.S.20230323.1426.011.html. WU Yichao, TIAN Qijin, CHEN Weiying. Effects of different drying methods on phenolic acids and antioxidant activity of Salvia miltiorrhiza Bge. stems and leaves [J/OL]. Molecular Plant Breeding, 2024-03-24[2024-04-18]. https://kns-cnki-net.webvpn.zafu.edu.cn/kcms/detail/46.1068.S.20230323.1426.011.html. [11] 蒋小雅, 郑炯. 竹笋干燥技术及其对竹笋品质的影响[J]. 食品与发酵工业, 2016, 42(6): 260 − 264. JIANG Xiaoya, ZHENG Jiong. Research advances in drying technology and its impact on the quality of bamboo shoots [J]. Food and Fermentation Industry, 2016, 42(6): 260 − 264. [12] 商涛, 袁越锦, 赵哲, 等. 黄芩微波热风联合干燥动力学及品质研究[J]. 中草药, 2023, 54(14): 4501 − 4510. SHANG Tao, YUAN Yuejin, ZHAO Zhe, et al. Drying kinetics and quality of Scutellaria baicalensis microwave-hot air combined with drying [J]. Chinese Traditional and Herbal Drugs, 2023, 54(14): 4501 − 4510. [13] WANG Ying, LI Xia, CHEN Xuetao, et al. Effects of hot air and microwave-assisted drying on drying kinetics, physicochemical properties, and energy consumption of chrysanthemum [J]. Chemical Engineering and Processing-Process Intensification, 2018, 129: 84 − 94. [14] ZANG Zepeng, HUANG Xiaopeng, ZHANG Qian, et al. Evaluation of the effect of ultrasonic pretreatment on vacuum far-infrared drying characteristics and quality of Angelica sinensis based on entropy weight-coefficient of variation method [J]. Journal of Food Science, 2023, 88(5): 1905 − 1923. [15] 滕彩玲, 杨晓洪, 邓超, 等. 英国皇家园艺学会比色卡颜色特征及其在盆栽香石竹花色测定上的应用[J]. 中国农业大学学报, 2022, 27(11): 93 − 103. TENG Cailing, YANG Xiaohong, DENG Chao, et al. Research on color traits of Royal Horticultural Society Color Chart and its application in flowercolor testing of potted carnation [J]. Journal of China Agricultural University, 2022, 27(11): 93 − 103. [16] 刘盼盼, 任广跃, 段续, 等. 基于变异系数法对不同干燥方式白萝卜品质及风味的评价[J]. 食品与发酵工业, 2022, 48(13): 218 − 226. LIU Panpan, REN Guangyue, DUAN Xu, et al. The evaluation of the quality and flavor of dried white radish by different drying methods based on coefficient of variation [J]. Food and Fermentation Industry, 2022, 48(13): 218 − 226. [17] TURKOGLU A, DURU M E, MERCAN N, et al. Antioxidant and antimicrobial activities of Laetiporus sulphureus (Bull. ) Murrill [J]. Food Chemistry, 2007, 101(1): 267 − 273. [18] THANA P, MACHMUDAH S, GOTO M, et al. Response surface methodology to supercritical carbon dioxide extraction of astaxanthin from Haematococcus pluvialis [J]. Bioresource Technology, 2008, 99(8): 3110 − 3115. [19] ZHANG Tengxun, BAO Fei, YANG Yongjuan, et al. A comparative analysis of floral scent compounds in intraspecific cultivars of Prunus mume with different corolla colours [J/OL]. Molecules, 2019, 25(1): 145[2024-02-24]. doi: 10.3390/molecules25010145. [20] HAO Ruejie, DU Dongliang, WANG Tao, et al. A comparative analysis of characteristic floral scent compounds in Prunus mume and related species [J]. Bioscience,Biotechnology,and Biochemistry, 2014, 78(10): 1640 − 1647. [21] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. LI Hesheng. Experiment Principle and Technology of Plant Physiology and Biochemistry [M]. Beijing: Higher Education Press, 2000. [22] 孙涵, 聂飞飞, 胡雪原. 基于熵权 TOPSIS 法的中国区域能源安全评价及差异分析[J]. 资源科学, 2018, 40(3): 477 − 485. SUN Han, NIE Feifei, HU Xueyuan. Evaluation and difference analysis of regional energy security in China based on entropy-weight TOPSIS modeling [J]. Resource Science, 2018, 40(3): 477 − 485. [23] LIU Sijia, DONG Fujia, HAO Jie, et al. Combination of hyperspectral imaging and entropy weight method for the comprehensive assessment of antioxidant enzyme activity in Tan mutton [J/OL]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2023, 291: 122342[2024-02-24]. doi: 10.1016/j.saa.2023.122342. [24] 李叶贝, 任广跃, 屈展平, 等. 基于变异系数法对不同干燥方法马铃薯全粉复合面条品质的评价[J]. 食品科学, 2020, 41(1): 48 − 54. LI Yebei, REN Guangyue, QU Zhanping, et al. Evaluating the quality of noodles incorporated with potato flour dried by different drying methods based on coefficient of variation [J]. Food Science, 2020, 41(1): 48 − 54. [25] 王琳, 赵红艳, 杜宪臣, 等. 基于熵权TOPSIS法综合评价三个玫瑰果用新品种果实质量[J]. 中药材, 2023, 46(8): 1858 − 1864. WANG Lin, ZHAO Hongyan, DU Xianchen, et al. Comprehensive evaluation of fruit quality of three new rose varieties based on entropy weight TOPSIS method [J]. Journal of Chinese Medicinal Materials, 2023, 46(8): 1858 − 1864. [26] 赵印泉, 周斯建, 彭培好, 等. 不同类型梅花品种及近缘种山桃挥发性成分分析[J]. 安徽农业科学, 2011, 39(26): 16164 − 16165. ZHAO Yinquan, ZHOU Sijian, PENG Peihao, et al. Analysis of volatile component in different species of plum varieties and its related species Prunus Plum [J]. Journal of Anhui Agricultural Science, 2011, 39(26): 16164 − 16165. [27] 杨钰, 王艺光, 董彬, 等. 不同梅花品种花香成分鉴定与分析[J]. 浙江农林大学学报, 2024, 41(2): 262 − 274. YANG Yu, WANG Yiguang, DONG Bin, et al. Identification and analysis of floral scent compounds of Prunus mume cultivars [J]. Journal of Zhejiang A&F University, 2024, 41(2): 262 − 274. [28] ZHANG Xinke, ZHANG Guoshuai, MIAO Yujiang, et al. Effects of different drying methods on physico-chemical properties, bioactive and taste substances of Cynomorium songaricum [J/OL]. LWT-Food Science and Technology, 2023, 185: 115159[2023-02-24]. doi: 10.1016/j.lwt.2023.115159. [29] SHI Linzuo, KIM E, YANG Leiyu, et al. Effect of a combined microwave-assisted drying and air drying on improving active nutraceutical compounds, flavor quality, and antioxidant properties of Camellia sinensis L. (cv. Longjing 43) flowers [J/OL]. Food Quality and Safety, 2021, 5: fyaa040[2024-02-24]. doi:10.1093/fqsafe/fyaa040. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20240256







 下载:
下载: